2015年中考化学模拟试题(八)


满分:100分 时间:100分钟
可能用到的相对原子质量:H—1 C—12O—16 Na—23 S—32 Ca—40 Cu—64
一、选择题(本题包括18个小题。每小题2分,共36分。每小题只有一个选项符合题意)
1.下列变化中,属于化学变化的是( )
A.酒精挥发 B.钢铁生锈
C.石蜡熔化D.干冰升华
2.下列厨房中常用物质加入水中,不能形成溶液的是( )
A.食盐B.蔗糖
C.味精D.芝麻油
3.下列图示实验操作中,错误的是( )
4.下列是某同学进行化学实验时记录的实验现象。其中,与事实相符的是( )
A.铁在氧气中燃烧火星四射生成红色固体
B.打开盛有浓盐酸的试剂瓶,看到有大量白烟
C.将二氧化碳通入紫色石蕊溶液中,溶液变成红色
D.在氢氧化钠溶液中加入硫酸铜溶液,有白色沉淀生成
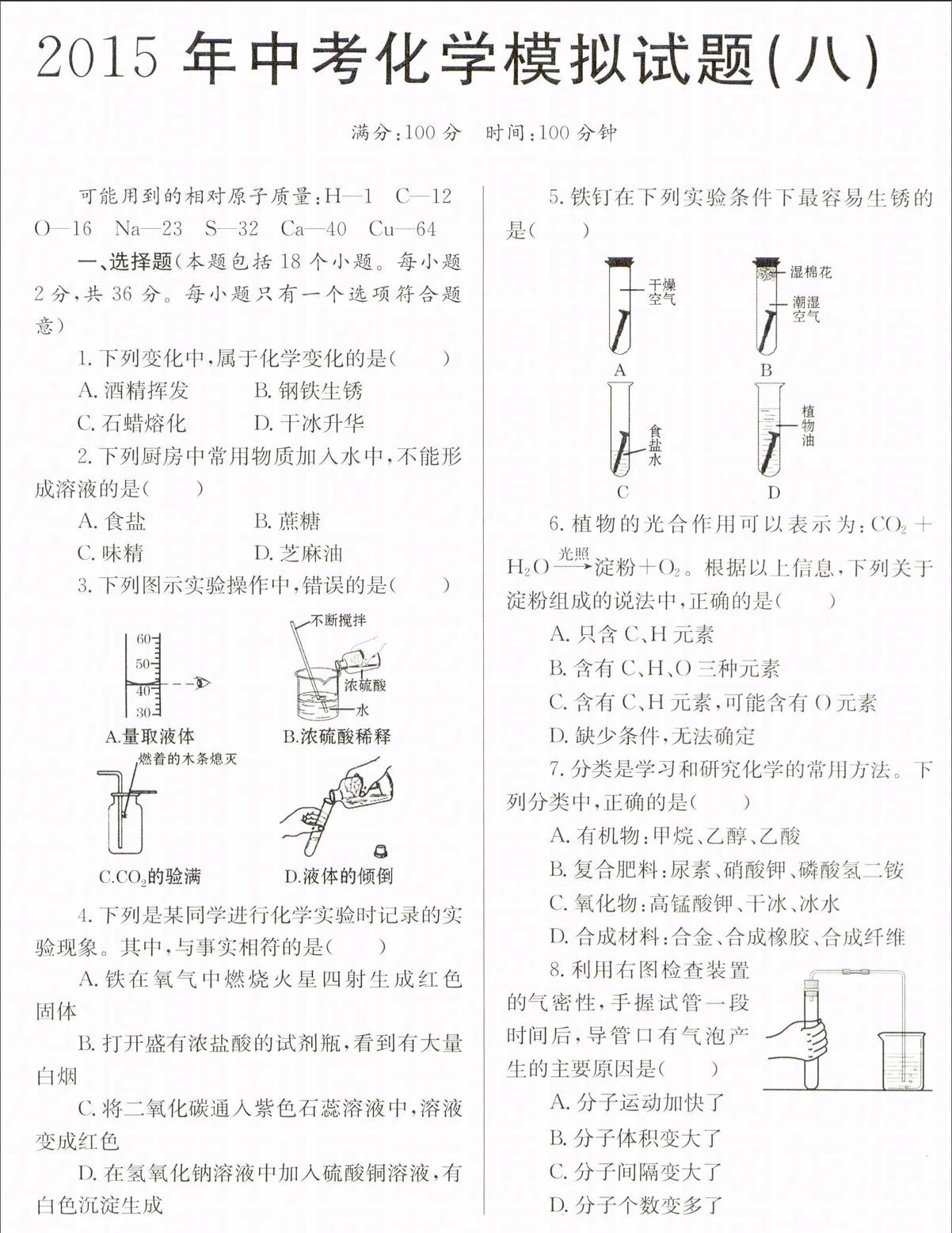
5.铁钉在下列实验条件下最容易生锈的是( )
6.植物的光合作用可以表示为:CO2+H2O光照淀粉+O2。根据以上信息,下列关于淀粉组成的说法中,正确的是( )
A.只含C、H元素
B.含有C、H、O三种元素
C.含有C、H元素,可能含有O元素
D.缺少条件,无法确定
7.分类是学习和研究化学的常用方法。下列分类中,正确的是( )
A.有机物:甲烷、乙醇、乙酸
B.复合肥料:尿素、硝酸钾、磷酸氢二铵
C.氧化物:高锰酸钾、干冰、冰水
D.合成材料:合金、合成橡胶、合成纤维
8.利用右图检查装置的气密性,手握试管一段时间后,导管口有气泡产生的主要原因是( )
A.分子运动加快了
B.分子体积变大了
C.分子间隔变大了
D.分子个数变多了
9.能源和环保是当今世界的重大问题。下列有关叙述正确的是( )
A.风能属于“绿色能源”
B.化石燃料的使用不会污染环境
C.使用农药和化肥不会污染水
D.大量使用天然气作燃料符合“低碳生活”理念
10.右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度明显上升。制造此加热杯可选用的固体碎块是( )
A.硝酸铵B.生石灰
C.蔗糖D.食盐
11.下列处理方法不正确的是( )
A.炒菜时油锅中的油不慎着火,可用锅盖盖灭
B.扑灭森林火灾的有效方法之一是将大火蔓延路线前的一片树木砍掉,形成隔离带
C.不慎碰倒酒精灯,酒精在桌面上燃烧起来,应立即用水浇灭
D.遇到火灾时,可用湿毛巾捂住口鼻,蹲下靠近地面或沿墙壁跑离着火区域
12.将一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下发生化学反应,一段时间后,测得各物质的质量数据如下:
物质甲乙丙丁
反应前各物质的质量/g3294
反应后各物质的质量/g52未知数6
下列说法正确的是( )
A.乙一定是该反应的催化剂
B.丙一定是化合物
C.该反应中甲和丙两物质变化的质量比为1∶1
D.该反应一定是化合反应
13.设计对比实验、控制变量是学习化学的一个重要方法。下列对比实验不能达到实验目的的是( )
编号AB
实验设计
实验目的探究人体呼出气体中CO2含量比空气中CO2含量高探究燃烧的条件
编号CD
实验设计
实验目的探究铁生锈的条件探究CO2与NaOH溶液确实能发生反应
14.在通常情况下,氧气是无色、无味的气体,但用氯酸钾与二氧化锰受热分解制得的氧气却有异常的气味。将这种有异味的氧气通入蒸馏水中,再滴加含硝酸的硝酸银溶液,产生了白色沉淀。根据上述事实作出下列结论:
(1)生成的气体不是纯净物而是混合物;(2)生成的气体中含有氯元素;(3)在氯酸钾与二氧化锰受热分解的过程中除生成氧气外,还生成了其他气体。
上述结论正确的是( )
A.只有(1)(2)B.只有(1)(3)
C.只有(2)(3)D.(1)(2)(3)
15.下表是小妮同学用多种方法来鉴别物质的情况,其中完全正确的是( )
需鉴别物质
分别取样后所加试剂或方法方法1方法2
A硝酸铵和氯化钾加水溶解加熟石灰研磨并闻气味
B鉴别厕所清洁剂和炉具清洁剂加入酚酞溶液,观察现象加入小苏打,观察现象
C木炭粉末和氧化铜粉末稀硫酸加水溶解
D黄铜和黄金互相刻画,比较硬度观察颜色
16.下列离子能在pH=11的溶液中大量共存的是( )
A.CO2-3、K+、Cl-、Ca2+
B.K+、NO-3、Na+、Cl-
C.H+、Ba2+、Cl-、SO2-4
D.K+、Cl-、SO2-4、Cu2+
17.在实验室用高锰酸钾制取氧气的过程中,下列图像能正确表示对应变化关系的是( )
18.以下归纳和总结完全正确的一组是( )
A.对化学资源的认识B.对安全的认识
①可用塑料来代替钢制造汽车零部件②石油是工业的血液③稀土是不可再生的重要战略资源,应合理利用和保护①点燃可燃性气体前一定要验纯②煤矿矿井要保持通风、严禁烟火③海鲜食品喷洒甲醛溶液防腐
C.对现象的认识D.对化学元素的认识
①气体压缩,气体分子之间的间隔变小②活性炭除去异味,活性炭具有吸附性③喝汽水打嗝,气体溶解度随温度升高而增大①缺铁,引起贫血②缺钙,引起骨质疏松③缺碘,引起坏血病
二、填空题(本题包括4个小题。每空1分,共15分)
19.填写化学符号。
(1)2个氮分子:。
(2)电解水中变化的最小粒子:。
(3)分析过氧化氢(H2O2)和过氧化钠(Na2O2)中氧元素的化合价,可写出过氧化钙的化学式为。
20.从化学的视角认识生活中的有关问题。
(1)从超市买来的“加锌酱油”、“加铁麦片”、“富硒茶”中的“锌”、“铁”、“硒”是指(填“单质”或“元素”)。
(2)硬水有很多危害,生活中常用方法降低水的硬度。
(3)家庭生活中经常产生的垃圾有:①易拉罐、②废报纸、③烂菜叶、④矿泉水瓶,其中属于可回收的垃圾有(填序号)。
(4)家长在给婴幼儿熬米粥时,常放入切成碎末的青菜叶,以增加营养。这种米粥为婴幼儿提供的营养素是。
21.下表是元素周期表的一部分,据此回答下列问题。
(1)表中13号元素的名称是,该元素的原子在化学反应中易(填“得到”或“失去”)电子形成离子,其离子符号是。
(2)右图是元素锶(Sr)的原子结构示意图,则x=,锶元素的氯化物的化学式为。通过上表分析可知,锶元素位于元素周期表第周期。
22.大理石是一种常用的建筑材料。下图是用切割机切割大理石的照片,切割大理石时飞速旋转的锯片是一种合金材料制成的。之所以选择该合金材料作锯片,是因为它具有下列性质:①;②。
三、简答(说明)题(本题包括3个小题。方程式每个2分,其余每空1分,共14分)
23.下图是A、B、C三种物质的溶解度曲线。
(1)t1℃时,溶解度最大的物质是(填字母)。
(2)把t2℃时150gA物质的饱和溶液降温到t1℃时,析出晶体的质量为g,此时所得溶液中溶质的质量分数为。
(3)用同一种方法可以使A、B、C三种物质的溶液都有晶体析出,该方法是。
24.下图是实验室制取气体的常用装置。
(1)检查装置B气密性的方法是。我能写出实验室中用B装置制取一种气体的化学方程式:。我制取该气体选用的收集装置是(填装置字母代号,下同)
(2)小明同学为了探究氨气(NH3)的某些性质,做了以下实验:
下图中从左向右依次是他做的实验及相应现象。
通过实验,小明同学可得出氨气的性质有(写两条即可):①;②。
25.我国高铁钢轨均使用无缝焊接。将两条钢轨之间的缝隙焊接的一种方法是:在特制漏斗中装入按一定质量比混合均匀的铝粉和氧化铁粉末,插上一根镁条,先点燃镁条,再引燃铝粉和氧化铁发生置换反应,生成的液态铁水从漏斗中流下来,将钢轨连接起来。
(1)写出镁条燃烧的化学方程式:。
(2)写出铝粉和氧化铁发生置换反应的化学方程式:。
四、简答(分析)题(本题包括2个小题。方程式每个2分,其余每空1分,共10分)
26.航天飞行器座舱内空气更新过程如图所示:
(1)装置Ⅰ的作用是。
(2)装置Ⅱ是CO2和H2的反应装置,该反应的化学方程式为(可不写反应条件)。
(3)装置Ⅲ发生的化学反应为。
27.A~H为初中化学中常见物质。已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、H均为只含有一种溶质的溶液,甲为锌粉和铁粉的混合物。“→”表示物质间存在着相应的转化关系(部分生成物未标出),它们之间的关系如下图所示。
请回答下列问题。
(1)A的化学式是。
(2)写出B与H反应的化学方程式:。
(3)将溶液G与甲充分反应后过滤,向滤渣E中加入稀硫酸,有无色气体放出,则滤渣E中一定含有,滤液F中可能含有的金属阳离子是。
五、简答(探究)题(本题包括2个小题。方程式每个2分,其余每空1分,共16分)
28.小梅、小军和小虎组成的化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取10mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到的现象为,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为。
实验二:对实验一反应后溶液中的溶质进行探究。
【提出猜想】小梅:只有NaCl;
小虎:有NaCl和NaOH;
小军:有NaCl和HCl。
【合理质疑】小梅认为小虎的猜想不合理,其理由是。
【设计实验】
实验操作实验现象实验结论
取反应后的溶液于试管中,加入小军猜想成立
29.物质除杂是化学实验中经常遇到的问题。
【方法探究】为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案
方案A
方案B
方案C
上述方案中有两个是合理的,写出合理方案中任意一个反应的化学方程式:。
【方法提炼】上述两种合理方案体现了物质除杂的不同思路:
思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
【方法运用】
运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。
运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。
步骤①中反应的化学方程式是,滤液B中一定含有的溶质是;步骤②中反应的化学方程式是,滤液C中一定含有的阴离子是;步骤③中乙溶液是(填化学式)溶液。
六、计算题(本题包括1个小题。共9分)
30.有一包Na2SO4和Na2CO3的固体混合物,为测定Na2SO4的质量分数,称取样品10g放入45g水中使其完全溶解,再逐滴加入溶质质量分数为9.8%的稀硫酸,边加边振荡,至不再放出气泡为止,刚好消耗50g稀硫酸。试计算:(结果保留一位小数)
(1)所用稀硫酸中溶质H2SO4的质量。
(2)样品中Na2SO4的质量分数。
(3)反应后所得溶液中溶质的质量分数。
【拟题人:刘四方】

