海州常山花粉低温贮藏及其生理生化特征研究
杨秀莲,林燕青,王良桂
(南京林业大学 风景园林学院,南京210037)
海州常山(Clerodendrum trichotomum Thumb)为马鞭草科(Verbenaceae)大青属(Clerodendrum L.)小乔木或灌木[1],是既可观花,又可冬季观果的优良花木[2]。海州常山具有多种抗逆性,如较强的抗旱、耐瘠薄、耐盐碱能力,可用于城市盐碱地及矿区绿化美化、废弃地恢复等,是一种很有应用潜力的植物树种[1]。此外,海州常山的茎叶均含有一些重要的药用成分[3],又是一种极具经济价值的野生植物,具有较大开发潜力。
花粉是植物重要的种质材料,其活力直接影响到植物遗传、育种、进化、生殖等的效率[4-6]。花粉的低温贮藏对人工授粉和杂交育种,以及解决花期不遇现象有重要的意义,花粉的生活力及低温贮藏过程中其生理生化反应特征的研究是育种过程的基础性工作。目前,对果树、药用植物、农作物、园林植物花粉低温保存的研究已经逐步展开,并取得一定的成果,如日本在取得桃花粉及美国山核桃花粉保存10年仍具有活力,葡萄品种花粉保存5年活力仍然保持不变的显著成果[6]。唐菖蒲花粉于-80 ℃超低温保存下可保持1年的生活力[7-8]等。不同品种的海州常山花期差异较大,其杂交育种普遍存在花期不遇现象,但目前还没有海州常山花粉相关的研究报道。因此,本试验研究了贮藏方式、贮藏温度及时间对海州常山花粉低温贮藏效果的影响,测定并记录了4℃及-80℃低温贮藏过程中海州常山花粉生理生化特征变化,旨在为海州常山新品种培育、花粉库建立及其杂交育种中花期不遇问题的解决提供参考。
1 材料和方法
1.1 试验材料
试验用花粉材料来自江苏盐城海州常山基地,采集时间为2014年8月中下旬。选择晴朗的天气,使用铁镊子采集盛花期且生长健壮植株的花药,收集于聚乙烯离心管中,迅速带回室内,铺于硫酸纸上阴干1~2d后带回南京林业大学生理生化实验室,于25 ℃下干燥9h,将花粉以散粉和花药的形式分别收集于聚乙烯离心管中并贴标签,分别贮藏于4℃、-18 ℃、-80 ℃恒温箱中。基地地处中国东部沿海,江苏省中北部,长江三角洲北翼,年平均气温为13.7~14.5℃,极端最高气温为37.2℃,一年当中以7~9月份为最高,12、1、2月份为最低,年降水总量为785.2~1 309.5mm,无霜期长,土壤肥沃。
1.2 试验处理
将采集的花粉样品先进行干燥,再进行不同温度预冻、解冻,以及不同贮藏方式、温度处理,最后测试萌发率。本试验中,花粉萌发条件及干燥条件(25℃下干燥9h)为海州常山花粉前期萌发试验所测得的最佳条件。
1.2.1 干燥脱水花粉预冻处理 将花粉干燥(25℃下干燥9h)后,分别进行4种方式的预冻处理:4℃预冷12h后投入-80 ℃;-18 ℃预冷12h后投入-80 ℃;4 ℃预冷12h,再经-18 ℃预冷12h后投入-80 ℃;直接投入-80 ℃。每处理3次重复,处理结束后测定花粉的萌发率。
1.2.2 低温贮藏花粉解冻处理 以-18 ℃及-80 ℃下贮藏的花粉为试验材料,分别进行4种解冻 试验[7]:37 ℃水 浴 快 速 解 冻、4 ℃缓 慢 解 冻、流 动自来水(约17 ℃)解冻、25 ℃室温自然解冻,3次重复,处理结束后测定花粉萌发率。
1.2.3 不同贮藏方式、时间及温度处理 将干燥后(25 ℃下干燥9h)的实验材料分别采取花药贮藏及散粉贮藏两种方式,分别置于室温(25 ℃,CK)、4℃、-18 ℃、-80 ℃环境下贮藏,然后分别于3、5、7、11、15、30、60、90d后将取出的花粉进行低温解冻(37 ℃水浴解冻)。试验3次重复,最后测定花粉的萌发率。
1.3 测定指标和方法
1.3.1 花粉萌发率 用移液枪分装0.1 mL 液体培养基(150 mg/L 氯化钙+150g/L 蔗糖+200 mg/L硼酸)于每个双孔凹玻片孔内,使用牙签将待试花粉均匀点入培养液中,使其充分混合,将凹玻片放入铺有湿润滤纸的培养皿中,室温(25 ℃)有光条件下培养8h。在40×电镜下观察统计花粉萌发率,每处理统计3个视野,每个视野花粉粒数不少于50粒,每试验3次重复,花粉萌发以花粉管长度大于花粉粒直径为标准。
花粉萌发率(%)=萌发的花粉粒数/花粉粒总数×100%
1.3.2 低温贮藏花粉的生理生化指标 由于可采集的花粉量有限,本试验选取4 ℃、-84 ℃低温下保存的花粉进行了花粉生理生化指标的测定,-18℃低温下保存的花粉生理生化特征变化仍有待于进一步研究。将采集的新鲜花粉于-4 ℃和-80 ℃两个温度进行贮藏,分别测定贮藏0、15、30、60、90d后花粉的超氧化物歧化酶(SOD)、过氧化物酶(POD)活性以及丙二醛(MDA)、可溶性糖、可溶性蛋白含量相关生理生化指标的变化。测定方法参考李合生[9]的实验方法,采用氮蓝四唑光还原法测定SOD 活性,采用愈创木酚法测定POD 活性,采用硫代巴比妥酸法测定MDA 含量,采用蒽酮法测定可溶性糖含量,采用考马斯亮蓝G250法测定可溶性蛋白质含量[7-8],每个指标测定3次重复。
1.4 数据处理
对试验所测定、记录的数据,运用SPSS19.0软件进行方差分析和多重比较,采用非参数检验方法进行正态分布检验,并验证方差是否具有齐性,若数据方差具有齐性即采用Duncan方差分析法进行处理,若数据方差不具有齐性则采用Dun nets’sT3非参数检验法进行方差分析[10],使用Excel软件绘制折线图。
2 结果与分析
2.1 贮藏方式、时间及温度对海州常山花粉生活力的影响
如表1所示,就散粉低温贮藏方式而言,室温贮藏(CK)花粉的萌发率在11d 后接近0;在4 ℃、-18 ℃和-80 ℃低温条件下,花粉萌发率在贮藏5~90d 后 分 别 比 贮 藏3d 下 降 了 约6.86%~94.64%、12.55%~91.87%、6.96%~81.02%,并且在贮藏7d或者11d后下降即达到显著水平,但其在贮藏90d时仍分别有1.58%、2.09%和5.94%的萌发率。同时,与以上散粉低温贮藏相比,以花药方式贮藏的花粉萌发率更高。其中,室温贮藏(CK)花粉的萌发率在15d后接近0;在4 ℃、-18 ℃和-80 ℃低温条件下,花粉萌发率在贮藏5~90d后分别比贮藏3d下降了约1.49%~88.23%、8.23%~84.53%、1.37%~75.12%,并分别在贮藏7、11和15d后下降即达到显著水平,但其在贮藏90d时仍分别有2.85%、4.23%和7.99%的萌发率。可见,花药贮藏与散粉贮藏效果无显著差异;海州常山花粉活力随着贮藏时间的延长而逐渐降低,且下降率逐渐升高;-80 ℃低温比-18 ℃及4 ℃低温能更有效地延缓花粉活力的丧失,且海州常山花粉适宜在-80 ℃进行长期低温贮藏。
2.2 预冻和解冻方式对海州常山花粉生活力影响
预冻处理旨在减轻低温对花粉细胞原生质的损害,植物种类不同,预冻的效果也会有较大差异[11]。如图1所示,4种不同预冻处理方式对海州常山花粉萌发率的提高效果差异并不显著,即程序性预冻对海州常山花粉的活力无显著影响。相对而言,4 ℃预冷12h后投入-80 ℃处理(Ⅰ)下的花粉萌发率较高(24.82%),表明经过4 ℃预冷12h后,花粉细胞进行了保护性脱水,从而避免了低温贮藏过程中结冰造成的伤害[21]。可见,海州常山花粉于-80 ℃低温贮藏时较宜采用4 ℃预冷12h的预冻方式。

表1 不同贮藏条件花粉萌发率Table 1 The pollen germination in the different conditions storage/%
同时,花粉的解冻方式对其活力也有重要影响,而植物的种类及花粉的含水量决定花粉解冻方式的选择[11]。图2显示,-80 ℃低温贮藏条件下,37 ℃水浴快速解冻(Ⅰ)后的花粉萌发率最高,并极显著高于25℃室温自然解冻(Ⅳ)后的花粉萌发率,其余解冻方式处理间无显著性差异;在-18 ℃低温贮藏条件下,4种解冻方式间花粉萌发率差异均不显著,但仍以解冻方式Ⅰ最高,方式Ⅳ最低。可见,在两种花粉低温贮藏条件下,37 ℃水浴解冻效果均相对最佳,室温解冻效果相对最差,其余两种解冻效果差异不明显,即37 ℃水浴解冻能更有效地保持花粉活力,海州常山花粉低温保存的解冻方式较宜选用37 ℃水浴快速解冻。

图1 不同预冷方式下花粉萌发率的变化Ⅰ.4 ℃预冷12h后投入-80 ℃;Ⅱ.-18 ℃预冷12h后投入-80 ℃;Ⅲ.4 ℃预冷12h,再经-18 ℃预冷12h后投入-80 ℃;Ⅳ.直接投入-80 ℃Fig.1 The effects of different precooling on pollen germination rateⅠ.Precooling at 4 ℃for 12hthen put into-80 ℃;Ⅱ.Precooling at-18 ℃for 12hthen put into-80 ℃;Ⅲ.Precooling at 4 ℃for 12h,and precooling at-18 ℃for 12hthen put into-80 ℃;Ⅳ.No precooling put into-80 ℃
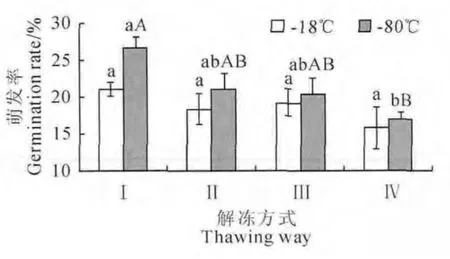
图2 不同解冻方式下花粉萌发率的变化Ⅰ.37 ℃水浴解冻;Ⅱ.4 ℃解冻;Ⅲ.自来水解冻;Ⅳ.室温解冻Fig.2 The pollen germination rate under different thawing waysⅠ.Thaw at 37 ℃water bath;Ⅱ.Thaw at 4 ℃;Ⅲ.Thaw at tap water;Ⅳ.Thaw at room temperature
2.3 低温贮藏对海州常山花粉抗逆性生理生化指标的影响
2.3.1 SOD 和POD 活性 SOD 具有特殊的生理活性,对生物体内自由基的清除具有极其重要的意义,通过测定SOD 活性水平高低可检测生物体衰老与死亡状态特征[12-13]。如图3,A 所示,-80 ℃及4℃低温保存过程中,海州常山花粉SOD 活性均呈现先升后降的趋势。其中,在-80 ℃低温条件下,贮藏15d后花粉SOD 活性上升幅度较大,与新鲜花粉相比显著上升了10.89%;之后SOD 活性开始下降,且下降幅度逐渐加剧;贮藏90d后花粉SOD 活性相比新鲜花粉显著下降了44.09%。在4 ℃低温条件下,贮藏15d后花粉SOD 活性略有上升,其活性相比新鲜花粉仅上升了0.95%;之后SOD 活性下降幅度以缓慢-急剧-缓慢的趋势波动;贮藏90d后SOD 活性下降了89.91% 。因此,海州常山花粉在低温保存初期能通过自身协调SOD 活性清除体内的自由基以适应低温环境,但随着低温长时间胁迫,花粉受到了一定程度的冻害,SOD 合成受到了抑制,其活性不断下降;-80 ℃低温下保存的花粉SOD 活性始终明显高于4 ℃下低温保存的花粉。
POD 对各种不良环境十分敏感,在受低温刺激时活性发生改变,可以作为花粉受伤害程度及其抗性大小的指标[14-15]。图3,B显示,-80 ℃低温条件下,海州常山花粉POD 活性呈现急剧上升后又急剧下降趋势,并于保存30d时达到峰值,此时其活性比新鲜花粉上升了274.39%,但在贮藏90d后其活性比新鲜花粉下降了27.27%。在4 ℃低温条件下,花粉POD 活性先缓慢上升,并于60d时达到峰值,之后又急剧下降;在保存60d后其活性比新鲜花粉上升了105.72%,贮藏90d后相比新鲜花粉下降了60.61%。可见,海州常山花粉POD 活性在-80 ℃保存条件下始终显著高于4 ℃下保存,-80℃比4℃能更有效地刺激了花粉POD 活性的提高,更有利于花粉细胞产生胁迫反应。

图3 低温保存下花粉SOD和POD活性变化Fig.3 Changes of SOD and POD activities of pollen under low temperature

图4 低温保存下花粉可溶性糖和可溶性蛋白含量的变化Fig.4 Changes of soluble sugar and soluble protein contents of pollen under low temperature
2.3.2 可溶性糖和可溶性蛋白含量 如图4,A 所示,4℃和-80℃低温条件下,海州常山花粉可溶性糖含量均呈现出先升后降的趋势,且-80 ℃贮藏花粉始终低于4 ℃花粉含量。其中,在-80 ℃低温条件下,贮藏30d后花粉可溶性糖含量达到最大值,且比新鲜花粉增加了24.55%。在4 ℃低温条件下,贮藏15d后花粉可溶性糖含量达到最大值,比新鲜花粉增加了42.17%。这表明花粉在低温贮藏初期能通过积累可溶性糖含量来提高自身抗寒性,但随着时间的延续,持续低温对花粉细胞造成了一定程度的伤害,可溶性糖含量逐渐降低,但-80 ℃比4 ℃低温贮藏花粉的可溶性糖含量更高;-80 ℃低温可以更有效、更长时间地刺激可溶性糖含量的积累,使花粉细胞对低温胁迫产生更有效的适应性反应。
可溶性蛋白具有较强的亲水性,其在低温胁迫下能得到不断积累,从而提高花粉细胞保水性及抗寒性。图4,B 显示,-80 ℃低温条件下,花粉可溶性蛋白含量呈现先升后降的趋势,并于贮藏30d后达到最大值,此时其含量比新鲜花粉增加了14.54%,而贮藏90d后的花粉可溶性蛋白含量比新鲜花粉下降了59.11%。4℃低温条件下,花粉可溶性蛋白含量呈现逐渐下降的趋势,贮藏90d后其含量比新鲜花粉下降了68.19%。同时,-80 ℃下贮藏的花粉可溶性蛋白含量在贮藏过程中明显高于4 ℃下保存的花粉。以上结果表明,花粉于-80 ℃低温贮藏初期能通过不断积累自身可溶性蛋白含量来提高细胞抗寒性,以避免细胞受到不可恢复的伤害,但贮藏30d后可溶性糖含量不断下降,花粉细胞受到了较严重伤害;在4℃低温贮藏过程中,花粉的可溶性糖含量不断降低,花粉细胞在4 ℃低温下受到的伤害逐渐加重且不可逆。
3 讨 论
一般来讲,低温贮藏可以有效地降低花粉呼吸强度和酶活性,以延续花粉的衰老进程,且温度越低,花 粉 保 存 效 果 越 好[7,16-18]。随 着 贮 藏 时 间 的 推移,花粉生活力会不断降低,研究花粉低温贮藏的相关技术及机理特性对花粉种质资源保存、杂交育种等具有重要意义。
花粉细胞在低温状态下,其体内新陈代谢基本停止[11],赵婵璞等[19]研究发现-80 ℃低温可使有斑百合花粉保持2年的活力。本试验中,-80 ℃低温比室温(25 ℃)、4 ℃、-18 ℃能更有效刺激花粉细胞对低温胁迫的应激反应,有效降低花粉呼吸作用,延续了花粉寿命,总体而言,-80 ℃可实现海州常山花粉较长时间的贮藏。有研究[20]发现花药在低温条件下可有效地降低花粉的失水率,本试验结果发现海州常山花粉进行低温贮藏时,选用花药贮藏效果与散粉贮藏效果差异不显著,仍有待于进一步研究确定。
本试验中4种预冻处理效果差异并不显著,经过变温预冻的花粉贮藏效果均略优于直接投入-80 ℃低温下花粉贮藏效果。赵婵璞等[19]发现有斑百合花粉采用液氮预冻再投入-80 ℃中贮藏,且采用35 ℃水浴解冻可有效的提高花粉萌发率。本试验中,在-18 ℃低温贮藏条件下,不同的解冻方式对花粉萌发率的影响并不显著;而在-80 ℃低温贮藏条件下,不同的预冻方式对花粉萌发率的影响并不显著,37 ℃水浴快速解冻效果极显著高于室温自然解冻的效果,采用37 ℃水浴解冻效果相对较佳,可有效避免次生结冰对细胞的致死性破坏[21-22]。
低温贮藏过程中,花粉细胞会发生一些生理生化反应,参与呼吸作用等生理过程的脂、糖、蛋白质等生物大分子与酶活性均会发生一系列的变化。有学者研究表明,低温贮藏时切花寒菊小花花粉SOD活性[17]随着温度的降低而持续上升,而福建山樱花[18,23]、唐菖蒲花粉[8]及卷荚相思[24-25]花粉 的SOD和POD 活性则呈现先升后降的趋势,可能是由于切花寒菊小花对于低温胁迫的适应性较强,更适宜于在低温条件下长期贮藏。本试验测得海州常山花粉在4 ℃和-80 ℃低温贮藏过程中,其SOD 和POD活性均呈现先升后降的趋势,且-80 ℃低温保存下的花粉SOD和POD活性上升幅度较高,比4 ℃低温更有利于刺激花粉细胞产生较大幅度的胁迫反应。
另外,海州常山花粉在-80 ℃及4 ℃低温贮藏过程中,其可溶性糖含量均呈现先增后降的趋势,贮藏初期可溶性糖含量显著增加,之后逐渐下降,可见在短期低温胁迫下海州常山花粉通过可溶性糖含量的积累增加了自身的抗寒能力,维持了自身活力,但持续低温对其造成了伤害,影响了海州常山花粉的代 谢活动。福建 山 樱 花[18,23]及 唐 菖 蒲 花 粉[7-9]的 低温贮藏研究证实了花粉可溶性糖含量与其抗寒性的正相关性,本试验也证实了这一结论。另外,詹福建等[26]的研究曾表明植物体内的可溶性蛋白的增加能够平衡细胞质与液泡间的渗透势,降低细胞伤害程度,增强其抗寒性。切花寒菊小花[17]、唐菖蒲[7-8]、福建 山 樱 花[18,23]等 花 粉 在 低 温 贮 藏 过 程 中的可溶性蛋白含量呈现先增后减的趋势。本试验中,-80 ℃低温贮藏的海州常山花粉可溶性蛋白含量呈现先上升后下降的趋势,表明低温贮藏过程中其体内的渗透调节作用较活跃,更好地适应了低温条件,但随着低温胁迫时间的延续,细胞原生质结冰加剧,对细胞造成了不可逆的伤害,可溶性蛋白质含量不断降低。4 ℃低温保存条件下,海州常山花粉可溶性蛋白质含量呈现不断下降的趋势,说明4 ℃低温胁迫不足以刺激其启动自身的应激机制,没有促进一些新蛋白的合成。
综上所述,海州常山进行杂交育种时,出现花期不遇现象时,可将海州常山的花粉贮藏于-80 ℃低温下,可在短期内(约3个月)保持一定的活力。试验中海州常山花粉萌发率总体偏低,贮藏时间较短,可能与花粉品种、材质相关,或是因长距离携带使花粉活力降低,还需进一步研究。
[1] HU F Q(胡凤琴),YANG W J(杨文杰),XU G M(徐贵明),et al.Influence of light intensity and soil water content on morphologic and growth traits of Clerodendrum trichotomumseedling[J].Journal of Nanjing Forestry University(Natural Science Edition)(南京林业大学学报·自然科学版),2009,33(5):27-31(in Chinese).
[2] DENG SH Y(邓绍勇),ZHU P L(朱培 林),HE Y CH(贺义昌),et al.Study on growth laws of 1-year-old Clerodendrum trichotomum seedlings and breeding technology[J].South China Forestry Science(南方林业科学),2013,(3):14-15(in Chinese).
[3] LIU J(刘 军),ZENG D J(曾德静),W CH(王 铖),et al.Effect of different growth regulators on hardwood cutting rooting of Clerodendrum trichotomum [J].Journal of Northeast Forestry University(东北林业大学学报),2012,40(8):10-12,46(in Chinese).
[4] CHEN M(陈 默),ZHENG Y H(郑玉红),LU B(陆 波),et al.Studies on the vitality of the pollen of Lycoris chinensis[J].Chinese Agricultural Science Bulletin中国农学通报20132934122-126in Chinese.
[5] GU Y D(顾亚东),ZHANG H L(张华丽),ZHANG X X(张西西).Study on pollen germination and vitality of Impatiens wallerana[J].Northern Horticulture(北方园艺),2011,(6):65-67(in Chinese).
[6] ZHAG Y L(张亚利),SHANG X Q(尚晓倩),LIU Y(刘 燕).Advances in research of pollen cryopreservation[J].Journalof Beijing Forestry University(北京林业大学学报),2006,28(4):139-144(in Chinese).
[7] GENG X M(耿兴敏),HUANG B L(黄蓓丽),LUO F X(罗凤霞),et al.A study on cryopreservation of Gladiolus pollens[J].Journal of Nanjing Forestry University (Natural Science Edition)(南京林业大学学报·自然科学版),2011,35(4):7-12(in Chinese).
[8] GENG X M(耿兴敏),HUANG B L(黄蓓丽),LUO F X(罗凤霞),et al.Physio-biochemical characteristics of Gladiolus pollen during cold storage[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2011,31(7):1 417-1 421(in Chinese).
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003.
[10] ZHANG CH Y(张超仪),GENG X M(耿兴敏).Comparative study on methods for testing pollen viability of the six species from genus Rhododendron[J].Plant Science Journal(植物科学学报),2012,30(1):92-99(in Chinese).
[11] CHEN H M(陈和明),YIN G T(尹光天),HU ZH S(胡哲森),et al.Germination and low-temperature storage of Daemonorops margaritae pollens[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2006,26(7):1 395-1 400(in Chinese).
[12] NAN X Y(南旭阳),DAI L P(戴灵鹏).Effect of copper stress on lethal rate,Cu enrichment,CAT and SOD activities of Bellamya aeruginosa[J].Journal of Ecology and Rural Environment(生态与农村环境学报),2011,27(5):67-71(in Chinese).
[13] LENG CH L(冷春龙),YU Y CH(俞元春),WU D M(吴电明),et al.Effect of transgenic pest-resistant cotton on the growth,reproduction and SOD activity of Eisenia foetida[J].Chinese Journal of Eco-Agriculture(中国生态农业学报),2012,20(7):927-931(in Chinese).
[14] MU J(穆 静),LIU X J(刘小京),et al.Effects of nitrogen on sweet sorghum seed germination,seedling growth and physiological traits under NaCl stress[J].Chinese Journal of Eco-Agriculture(中国生态农业学报),2012,20(10):1 303-1 309(in Chinese).
[15] 庞士铨.植物逆境生理学基础[M].哈尔滨:东北林业大学出版社,1990.
[16] ZHANG B C(张保才),LI X D(李晓丹),CUI H W(崔鸿 文),et al.Effects of different storage condition on vitality and pollination of pepper pollens[J].Acta Agriculturae Boreali-Occidentalis Sinica(西北农业学报),2013,22(7):132-137(in Chinese).
[17] LI N(李 娜),FANG W M(房伟民),et al.Physiological indexes in florets of two winter cut chrysanthemum cultivars under low temperature and their cold tolerance[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2010,30(4):645-651(in Chinese).
[18] ZHANG Y H(张迎辉),LI SH P(李书平),et al.Change of Prunus campanulata Maxim.and Prunus yedoensis Matsum.endogenous hormone under low temperature[J].J.of Fujian Forestry Sci and Tech(福建林业科技),2013,40(3):62-67(in Chinese).
[19] ZHAO CH P(赵婵璞),ZHANG Q W(张泉卫),SHI B SH(史宝胜),et al.Studies on cryopreservation of Liliumion concolor var.pulchellum[J].Journal of Agriculture University of Hebei(河北农业大学学报),2014,37(1):54-58(in Chinese).
[20] GUO L(郭 磊),ZHANG B B(张斌斌),MA R J(马瑞娟),et al.Effects of temperature on the pollen dissemination and germination of peach[J].Plant Physiology Journal(植物生理学报),2014,50(3):269-274(in Chinese).
[21] ZHANG Y L(张亚利),SHANG X Q(尚晓倩),et al.Advances in research of pollen cryopreservation[J].Journal of Beijing Forestry University(北京林业大学学报),2006,28(4):140-144(in Chinese).
[22] ZHAO J W(赵纪伟),LI L(李 莉),PENG J Y(彭建营),et al.Pollination characteristics and pollen viability test of different pear cultivars[J].Journal of Plant Genetic Resources(植物遗传资源学报),2012,13(1):152-156,162(in Chinese).
[23] ZHANG Y H(张迎辉),RONG J D(荣俊冬),LI SH P(李书平),et al.Effect of low temperature on biochemical characteristics of Prunus campanulata Maxim[J].Journal of Fujian College of Forestry(福建林学院学报),2013,33(4):326-329(in Chinese).
[24] LI T(李 婷),LIANG J(梁 机),XIE L(谢 乐),et al.Effects of low temperature stress on physiological and biochemical properties of different families of Acacia crassicarpa[J].Journal of Northeast Forestry University(东北林业大学学报),2013,41(2):6-9(in Chinese).
[25] 王瑞雪.低温对卷荚相思无性系耐寒生理特征的影响及综合评价[D].福州:福建农林大学,2014.
[26] ZHAN F J(詹福建),WU G H(巫光宏),HUANG ZH L(黄卓烈),et al.Study on the resistance of Acacia mangiumto low temperature stress[J].Cientia Silvae Sinicae(林业科学),2003,39(1):56-61(in Chinese).

