异子蓬PEPC 基因原核表达及其重组菌在非生物胁迫下的耐受力解析
程 刚,兰海燕
(新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,乌鲁木齐830046)
磷酸烯醇式丙酮酸羧化酶(PEPC)是C4光合途径中重要的光合调控酶,催化磷酸烯醇式丙酮酸(PEP)的β-羧化并以四碳酸形式固定CO2,充当CO2泵 的 作 用[1-3]。PEPC 存 在 于 所 有 植 物、绿 藻、光合细菌、古细菌及非光合细菌中,主要参与C4及景天酸光合代谢途径[4-5]。PEPC 在植物中主要以C4型、C3型、CAM 型 以 及 细 菌 型4 种 同 工 酶 形 式存 在[6-7]。除 了调控光 合 作 用,PEPC 还 参 与 三 羧 酸循环(TCA)中各种生物合成及氮同化过程所消耗的中间产物的回补反应,在植物、藻类及细菌中起到重要的非光合协调作用[8-10]。除此之外,PEPC在植物应对逆境胁迫中也发挥重要作用,如非生物胁迫中的盐[11]、干旱[12]、低温[13]、臭氧胁迫[14]等均能诱导PEPC 基因上调表达,参与植物抗逆反应。特别是通过转基因方法将C4植物PEPC 基因导入C3经济作物中,以提高其光合速率及胁迫耐受性,从而增加作物产量和适应性的研究已被广泛报道。研究发现,转玉米PPDK 和PEPC 基因的拟南芥和水稻较对照具有更高的光合速率[15-16],干旱胁迫下,过表达PEPC 水稻较对照具有更高光耐受性[17]。在生物胁迫中,一些植物病毒能够诱导PEPC 基因的高表达,间接帮助植物抵御病毒侵害[18]。
近年来发现的几种单细胞C4植物光合碳同化模式[19],为人类进一步认识光合碳同化途径及其进化关系提供了新证据。异子蓬(Suaeda aralocaspica)作为藜科异子蓬属一年生盐生植物,在中国仅分布于新疆,生长于重度盐化荒漠,整个生活史均具极强的抗逆性[20]。异子蓬特有的单细胞C4光合途径,能够在单个叶肉细胞内经极性区隔化分布的两种异型叶绿体进行高效光合作用[21]。因此,探索单细胞C4植物异子蓬中PEPC 的相关功能对揭示该物种高光效机制及逆境胁迫响应机制具有重要意义。前期研究中发现异子蓬中至少有2 种植物型PEPC(根据文献命名为PEPC-1型和PEPC-2型),目前 获 得 了PEPC-1 型PEPC 基 因 的cDNA 全长[22]。本 研 究 通 过 原 核 表 达 异 子 蓬PEPC-1 型PEPC 基因,分析了PEPC 在原核表达系统中的酶学特性,并检测了PEPC 重组菌在非生物胁迫下的耐受性能。本研究为后续深入分析PEPC的功能及利用其改良作物光合特性和抗逆性提供参考依据。
1 材料和方法
1.1 实验材料
异子蓬(Suaeda aralocaspica)种植于新疆大学新疆生物资源基因工程重点实验室阳台。本研究所用的菌株、质粒和PCR 扩增用引物序列见表1。
1.2 方 法
1.2.1 cDNA 全长序列的克隆 取发育2 个月的异子蓬幼苗嫩叶0.15g,于液氮中磨碎至均匀粉末状,用RNAprep Pure植物总RNA 提取试剂盒(天根)提取异子蓬总RNA,置-80 ℃备用。
取 上 述 总RNA 1 μg,用 M-MLV 试 剂 盒(TaKaRa)反转录合成cDNA 第一链,以此作为模板,根据已报道异子蓬PEPC 基因的部分序列(DQ538353),以及近源种中相似性较高的PEPC保守编码序列(DQ538352、AY950667)设计简并引物(表1),获得部分序列(缺失5′端)。PCR 反应程序为94 ℃预变性5min;94 ℃变性30s,58.8 ℃复性30s,72 ℃延伸3min,30个循环后,72℃延伸7 min。随后,利用SMARTerTMRACE cDNA Amplification Kit(Clontech,TaKaRa)及引物GSP1和NGSP1扩增获得PEPC 基因5′端序列。获得的PEPC 全长cDNA 由上海Sangon公司测序。
1.2.2 PEPC生物信息学分析 用http://blast.ncbi.nlm.nih.gov程序进行序列比对,并用Clustal X 进 行 多 序 列 比 对 分 析[23]。用http://web.expasy.org/translate/在线软件进行蛋白翻译分析;利 用Protparam(http://web.expasy.org/protparam/)对蛋白质基本理化性质进行预测;Motif Scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)对蛋白质功能位点进行预测分析;http://cello.life.nctu.edu.tw 在线软件进行亚细胞定位预测;SignalP4.0(http://cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽序列;http://expasy.org/tools/protscale.html分析蛋白亲疏水性;Predict-Protein(https://www.predictprotein.org)及Swiss-Model(http://swissmodel.expasy.org/)预测蛋白质二级及三级结构。

表1 菌株、质粒和PCR 扩增所用引物Table 1 Strains,plasmids and PCR amplification primers used in this study
1.2.3 基因诱导表达及免疫印迹分析 将E.coli Transetta::pGEX-4T-1-PEPC 重 组 菌 和E.coli Transetta::pGEX-4T-1对照菌,接种于含100μg/mL氨苄青霉素的LB液体培养基,于37 ℃、220r/min 培 养 至OD6000.4~0.6,加 入0.8 mmol/L IPTG 诱导4h。离心收集5mL 菌液,用PBS(pH 7.4)缓冲液洗涤菌体2次,加入1mL PBS缓冲液,超声波破碎菌体(功率200 W,超声3s,间隔10s,重复10次),随后4 ℃、12 000g离心10min,取上清及1 mL PBS 缓冲液重悬沉淀进行SDS-PAGE检测。SDS-PAGE结束后,90V 历时50 min将蛋白转印至PVDF 膜。先用1∶10 000 稀释GST Tag鼠源单克隆抗体与膜反应2h,再用1∶10 000羊抗小鼠IgG 二抗孵育2h,洗膜后加入DAB显色液室温避光孵育5~10 min,至出现目的条带后终止显色反应,观察结果。
1.2.4 重组菌表达蛋白的酶活分析 用索莱宝磷酸烯醇式丙酮酸羧化酶试剂盒(北京)和朗顿植物磷酸烯醇式丙酮酸羧化酶酶联免疫检测试剂盒(上海),检测E.coli Transetta::pGEX-4T-1-PEPC 重组菌的PEPC 酶活性和蛋白含量,以空载菌株E.coli Transetta::pGEX-4T-1 作 为 对 照。样 品 前 处理步骤为:离心收集10mL 菌液,用PBS(pH 7.4)缓冲液洗涤菌体2 次,加入1 mL 提取液(含100 mmol/L PMSF的PBS 缓 冲 液),超 声 波 破 碎 菌 体(功率200 W,超声3s,间隔10s,共5min),随后4℃、8 000g离心10min,取上清,置冰上待测。按照Deng等[24]的方法,在340nm 处检测样品吸光度,通过监测NADH 的减少量来评价PEPC 酶活,每mg组织蛋白在反应体系中每分钟消耗1nmol NADH 定义为一个酶活力单位。用生物素双抗体夹心酶联免疫吸附法(ELISA)评价菌体中PEPC的含量变化水平。
1.2.5 重组菌的生长和胁迫耐受性测定 重组菌生长情况测定按照Narayan等的方法[25],并做适当修改。菌体在0.8mmol/L IPTG 诱导表达4h,调节重组菌E.coli Transetta::pGEX-4T-1-PEPC 和对照 菌 株E.coli Transetta::pGEX-4T-1 的 初 始OD 值相等,按1%(v/v)的接种量2 次 转接至含100μg/mL氨苄青霉素的新鲜LB培养基中,每隔2 h取样,在600nm 处测定菌液OD 值。
重组菌E.coli Transetta::pGEX-4T-1-PEPC和对照菌株E.coli Transetta::pGEX-4T-1的非生物胁迫耐受性检测按照Singh等方法[5],并做适当修改。将0.8mmol/L IPTG 诱导表达4h后的重组菌和对照菌株调节OD 值一致,按1%(v/v)的接种量,接种在添加有200 ~800 mmol/L NaCl、5%~20%PEG 6 000、50~400μmol/L甲基紫精以及pH 3.0~11.0的LB 液体培养基,于37 ℃、220r/min振荡培养。温度胁迫实验是将诱导后培养物添加到LB(pH 7.0),于25℃~52℃,220r/min振荡培养。所有非生物胁迫实验每2h取样1次,在600 nm 处 检 测 菌 液OD 值。
1.3 数据分析
实验数据统计分析及作图采用GraphPad Prism 5.01软件进行。
2 结果与分析
2.1 PEPC 基因克隆及原核表达
以异子蓬总RNA 反转录获得的cDNA 为模板,通过5′-RACE和同源克隆技术,对目的片段进行扩增,得到3 000bp左右条带(图1,A),与预期片段大小一致。
测序结果表明,PEPC 基因cDNA 全长为2 901 bp。在线蛋白翻译分析(http://web.expasy.org/translate/)发现,该序列具有完整读码框,可进行后续蛋白表达。后将PEPC 基因重组子转化E.coli Transetta(DE3),得到重组菌E.coli Transetta::pGEX-4T-1-PEPC(图1,B)。
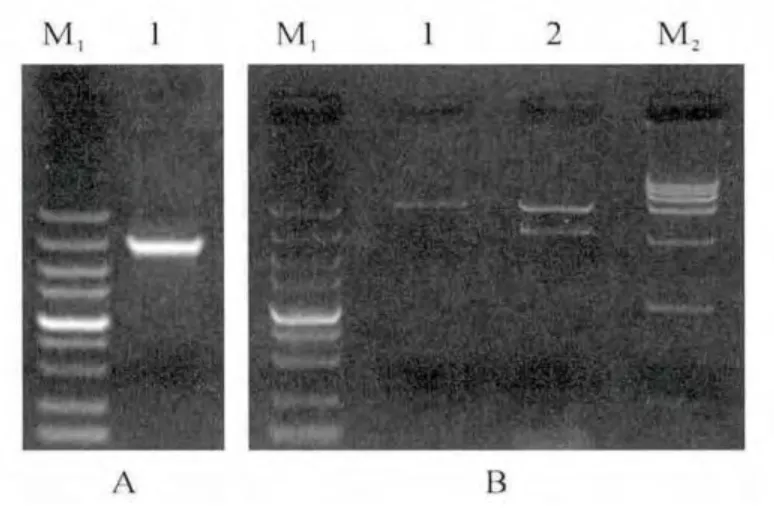
图1 异子蓬PEPC 基因cDNA 扩增(A)及重组原核表达载体pGEX-4T-1-PEPC 双酶切鉴定(B)M1.DL 5 000;M2.DL 15 000;A.1.PEPC 基因PCR 扩增产物;B.1.EcoRⅠ和NotⅠ消化的pGEX-4T-1;2.EcoRⅠ和NotⅠ消化的pGEX-4T-1-PEPC 重组质粒。Fig.1 PCR results of PEPCcDNA of S.aralocaspica(A)and restriction digestion of pGEX-4T-1-PEPCvector(B)M1.DL 5 000;M2.DL 15 000;A.1.PEPCgene fragment by PCR;B.1.pGEX-4T-1digested by EcoRⅠand NotⅠ;2.Recombinant plasmid pGEX-4T-1-PEPCdigested by EcoRⅠand NotⅠ.
2.2 异子蓬PEPC生物信息学分析
本研究通过生物信息学平台系统分析了异子蓬PEPC的蛋白信息。ProtParam 分析发现,异子蓬PEPC 基因编码966 个氨基酸,理论分子量为110.2kD,等电点为6.10。该蛋白质的主要氨基酸构成为Leu(12.2%)、Glu(8.5%)、Arg(7.3%)、Ala(6.8%)、Asp(6.1%),推测的分子式为C4903H7801N1361O1450S37。理论不稳定系数为38.65,属于稳定型蛋白。亲水性及疏水性分析发现,该蛋白多肽链中亲水性氨基酸多于疏水性氨基酸且均匀分布,因此推测异子蓬PEPC属于亲水蛋白。
前人研究发现,植物中C4型PEPC 的C 末端第774位或附近的1 个氨基酸残基为保守丝氨酸(Ser),而C3型PEPC 的 相 应 位 置 则 为 丙 氨 酸(Ala)[21-22]。本研究克隆的异子蓬PEPC 在C 末端第775位氨基酸是丙氨酸(图2),推测可能属于C3型PEPC,并将其命名为PEPC-1型PEPC。
异子蓬PEPC 蛋白功能位点与功能域预测发现,163~966位氨基酸之间存在一个典型PEPC 结构域。氨基酸序列分析表明,异子蓬PEPC 含有植物型PEPC所有基本模体、保守残基、催化位点及磷酸化和泛素化位点[26](图2)。其中,位于N 端的11SIDAQLR17模体,在C4、CAM 及部分C3植物中参与调控植物酶活性的昼夜变化,该模体中的丝氨酸残基为专一磷酸化位点[27]。位于C 端的963QNTG966模 体 决 定 了PEPC 最 大 催 化 活 性[28]。640GRGGTVGRGG649模体中R647残基直接参与该酶的羧化反应[29]。根据PROSITE 数据库分析,异子蓬PEPC氨基酸序列含有2 个大的PEPC 活性位点,分别位于169~180 氨基酸位点(PS00781,Vl-TAHPTQsiRR)和 592 ~604 氨 基 酸 位 点(PS00393,VMIGYSDSgKDAG)之间。
PEPC亚细胞定位和结构预测结果显示,异子蓬PEPC位于线粒体基质空间、线粒体内膜、线粒体间隙和叶绿体类囊体膜的可能性系数分别为0.527、0.255、0.255 和0.280。PEPC 蛋白跨膜结构域和信号肽分析发现,该蛋白不含信号肽,属于非分泌型蛋白。
利用PredictProtein程序预测异子蓬PEPC 二级结构(图3)分析发现,α-螺旋、无规则卷曲和延伸链含量分别为65.73%、30.43%和3.83%,α-螺旋和无规则卷曲大量分布,而延伸链稀疏地散布在其中。利用Swiss-Model程序提供的同源建模法,对异子蓬PEPC蛋白质进行同源建模,获得的三级结构如图3所示。

图2 异子蓬PEPC氨基酸序列的分析方框标示酶催化反应中重要的结构域;灰色背景标示保守残基;黑色背景标示功能位点;下划线标示模体Fig.2 Analysis of amino acid sequence of PEPC fromS.aralocaspica Boxes indicate the important catalytic domains;Gray and black indicate the conserved residues and functional sites,respectively;Underline sequences mean motifs

图3 异子蓬PEPC三级结构预测Fig.3 The predicted tertiary structure of PEPC protein
2.3 异子蓬PEPC蛋白诱导表达及免疫印迹分析
SDS-PAGE结果显示,重组菌E.coli Transetta::pGEX-4T-1-PEPC 样品在130kD 处有差异表达条带(PEPC 110kD+GST 26kD),表明构建原核表达载体正确(图4,A)。取超声处理后菌体上清及沉淀进行蛋白可溶性检测(图4,B)。结果表明目的蛋白主要以包涵体形式存在于沉淀中。
Western印迹结果发现,重组菌和对照菌E.coli Transetta::pGEX-4T-1 经IPTG 诱导后分 别检测到GST 融合蛋白(130kD)和GST 标签(26 kD),且重组菌未诱导情况下也检测到较弱条带,说明PEPC存在本底表达(图4,C)。
2.4 重组蛋白的酶活分析

图4 PEPC重组蛋白的SDS-PAGE及Western blot分析A 和B.SDS-PAGE分析:M1.蛋白质分子量对照;1.重组菌诱导前;2.重组菌诱导后;3.重组菌诱导前总蛋白;4.重组菌诱导前上清;5.重组菌诱导前上清;6.重组菌诱导后总蛋白;7.重组菌诱导后沉淀;8.重组菌诱导后上清;C.Western blot分析:M2.预染蛋白质分子量对照;9.对照菌诱导后;10.重组菌诱导后。箭头所示为PEPC重组蛋白条带。Fig.4 Analysis of the recombinant PEPC protein by SDS-PAGE and Western blot A and B.SDS-PAGE analysis of recombinant PEPC protein.M1.Protein molecular weight marker;1.Un-induced recombinant E.coli Transetta::pGEX-4T-1-PEPC;2.Induced recombinant E.coli Transetta::pGEX-4T-1-PEPC;3.Total crude extract of un-induced recombinant strains;4.Insoluble fraction of un-induced recombinant strains;5.Soluble fraction of un-induced recombinant strains;6.Total crude extract of induced recombinant strains;7.Insoluble fraction of induced recombinant strains;8.Soluble fraction of induced recombinant strains;C.Western blot analysis of recombinant PEPC protein.M2.Prestained protein molecular weight marker;9.Induced control E.coli Transetta::pGEX-4T-1;10.Induced recombinant E.coli Transetta::pGEX-4T-1-PEPC.The arrow indicates the target recombinant PEPC protein.
本研究采用酶联免疫吸附技术和分光光度法,对E.coli Transetta::pGEX-4T-1-PEPC 重 组 菌PEPC蛋白含量及活性进行了测定。结果表明,重组 菌经0.8mmol/L IPTG诱导4h,PEPC含量达0.19ng/mL,分别是非诱导组和对照组的2.01和29.69倍(图5)。PEPC活性为176.13U/mg,分别是非诱导组和对照组的2.35和5.38倍。该结果表明通过IPTG 诱导,重组菌表达了目的蛋白PEPC且具有活性。非诱导重组菌中PEPC 基因有少量泄漏表达,因此与对照菌相比检测到一定的PEPC含量及活性。
2.5 重组菌胁迫耐受性测定
为 了 验 证PEPC 重 组 菌E.coli Transetta::pGEX-4T-1-PEPC 在不同非生物胁迫下的耐受性,本研究检测了200~800mmol/L NaCl、5%~20%PEG6000、25 ℃~52 ℃、50~400μmol/L甲基紫精和pH 3.0~11.0等不同条件下的菌体生长(图6,A~E)。结果显示,在400mmol/L NaCl处理12h时,重组菌液OD600值是对照的1.58 倍。在10%PEG 6 000、25 ℃、75μmol/L 甲基紫精和pH 9.0胁迫下,重组菌分别是对照的1.25、2.73、1.92和1.82倍。并且,随着胁迫增强,重组菌的生长呈现优于对照菌的趋势。以上结果表明,过量表达PEPC能够赋予宿主菌更好的耐受非生物胁迫的能力。

图5 异子蓬PEPC蛋白含量和活性测定1.对照菌非诱导;2.重组菌非诱导;3.重组菌诱导后;图中数据为平均值±SD(n=3);下同。Fig.5 The protein content and enzyme activity of PEPC fromS.aralocaspica 1.Un-induced control E.coli Transetta::pGEX-4T-1;2.Un-induced recombinant E.coli Transetta::pGEX-4T-1-PEPC;3.Induced recombinant E.coli Transetta::pGEX-4T-1-PEPC;Bar represents mean±SD of three replicates;The same as below.
本研究进一步探讨了400 mmol/L NaCl、10%PEG 6 000、25 ℃、75μmol/L 甲基紫精、pH 9.0等单一非生物胁迫条件下菌体生长情况(图7,B~F)。结果显示,在正常条件下(37℃、pH 7.0),重组菌和对照菌生长没有差异,10h 后基本达到平稳期(图7,A)。在胁迫条件下,除10%PEG 6 000以外,12 h两者菌体生长量均有显著差异,并且对照菌的生长受到明显胁迫抑制。以上结果表明,PEPC 基因的表达促进了菌体在非生物胁迫下的生长。
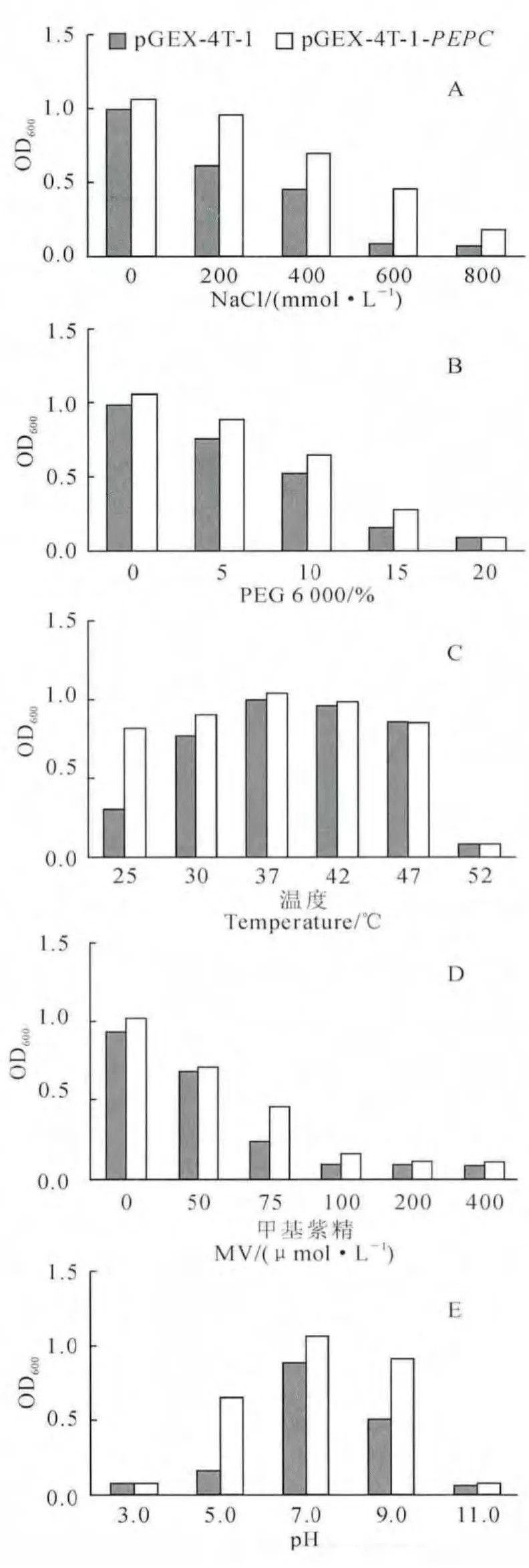
图6 非生物胁迫下的菌体生长检测Fig.6 Strains growth under various abiotic stresses
3 讨 论

图7 E.coli Transetta::pGEX-4T-1-PEPC 重组菌在不同非生物胁迫下的生长检测Fig.7 Growth of the recombinant E.coli Transetta::pGEX-4T-1-PEPC under different abiotic stresses
尽管PEPC 基因在C3或具花环结构的C4植物中已被广泛研究,但在单细胞C4植物中的研究鲜见报道。本研究克隆了单细胞C4植物异子蓬PEPC 基 因cDNA全 长 序 列,包 含2 9 0 1bp个 核 苷酸,编码966个氨基酸,序列中含有多个PEPC已知模体、保守残基、酶催化位点、磷酸化和泛素化位点及两个大的PEPC 活性位点[22]。氨基酸序列多重比对发现,异子蓬PEPC 序列与甜菜(Beta vulgaris)、五色苋(Alternanthera ficoidea)及莲子草(Alternanthera sessilis)的同源性最高,均达90%以上[22]。通过生物信息学方法对异子蓬PEPC 蛋白质理化性质、结构及功能位点等预测分析发现,异子蓬PEPC同其他种属植物型PEPC类似[30-31]。该蛋白主要分布于线粒体基质,属于无跨膜结构域和信号肽的非分泌蛋白。对其三级空间结构分析显示,异子蓬PEPC主要以α-螺旋为主,其酶催化反应结构域位于蛋白中心位置,符合酶活性中心局限于大分子一定区域的规律[32]。
经免疫印迹检测原核表达的130 kD 重组GST-PEPC蛋白主要以包涵体形式存在,在菌体裂解后上清及未诱导情况下也有少量表达。本实验克隆的异子蓬PEPC 属PEPC-1型,其体外重组酶活性检测显示,底物PEP能够在PEPC及苹果酸脱氢酶催化下,通过消耗NADH 最终生成苹果酸,该结果与Park等研究结果一致 。众所周知,PEPC作为重要的光合关键酶在植物中被广泛研究。C4型PEPC在C4光合途径中催化PEP 结合大气中CO2形成四碳酸,后经脱羧作用释放CO2,并将其供给C3循 环 使 用,起 到 了CO2浓 缩 作 用[5,9,22]。C3型(和/或根型)PEPC 在C3及C4植物中则可能在三羧酸循环的中间物质的回补反应中行使重要功能,包括草酰乙酸(OAA)、苹果酸等[5]。
已有大量报道集中在PEPC 抗逆功能的研究。在转基因植物中过量表达C4植物PEPC,能不同程度地增强植物抵御和适应外界胁迫的能力。除了增强植物耐旱[34-35]、耐盐[11]、耐高 温[17]等能力 外,Beguma等[36]发现,转PEPC 基因水稻具有耐受重金属毒害的能力。此外,在E.coli中过量表达PEPC基因有利于细胞抵御逆境胁迫[5,33]。本研究也发现原核表达的PEPC蛋白在NaCl、PEG 6 000、甲基紫精(MV)、pH 3.0~11.0 的胁迫下能促进菌体生长,由此推测PEPC 在非生物胁迫下参与了E.coli耐受非生物胁迫的胁迫生理过程,该结果与Singh等研究结果相符[5]。推测PEPC参与胁迫应答可能存在两种机制,一是PEPC能够催化PEP生成OAA 和/或随后的苹果酸,OAA 在TCA 循环中起重要的回补反应[37-38];二是菌体内积累大量的苹果酸能够作为渗透调节物质帮助抵御胁迫产生的细胞损伤[39-40]。因此,PEPC作为一种重要的酶,能够促进菌体积极应对逆境胁迫。这进一步佐证了PEPC抗逆性能研究在生物逆境生理研究领域的重要性。
本研究原核表达了异子蓬PEPC-1 型PEPC基因,该基因的异源表达提高了E.coli耐受非生物逆境胁迫的能力。因此,本研究将为PEPC 逆境生理和逆境生物的工程改造提供了信息。
[1] UHRIG R G,O'LEARY B,SPANG H E,et al.Coimmunopurification of phosphorylated bacterial-and plant-type phosphoenolpyruvate carboxylases with the plastidial pyruvate dehydrogenase complex from developing castor oil seeds[J].Plant Physiology,2008,146(3):1 346-1 357.
[2] IZUI K,MATSUMURA H,FURUMOTO T,KAI Y.Phosphoenolpyruvate carboxylase:a new era of structural biology[J].Annual Review of Plant Biology,2004,55:69-84.
[3] NIMMO H.Control of the phosphorylation of phosphoenolpyruvate carboxylase in higher plants[J].Archives of Biochemistry and Biophysics,2003,414(2):189-196.
[4] MASUMOTO C,MIYAZAWA S,OHKAWA H,et al.Phosphoenolpyruvate carboxylase intrinsically located in the chloroplast of rice plays a crucial role in ammonium assimilation[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(11):5 226-5 231.
[5] SINGH J,REDDY G M,AGARWAL A,et al.Molecular and structural analysis of C4-specific PEPC isoform from Pennisetum glaucum plays a role in stress adaptation[J].Gene,2012,500(2):224-231.
[6] TING I P,BURK J H.Aspects of carbon metabolism in Welwitschia[J].Plant Science Letters,1983,32(3):279-285.
[7] GENNIDAKIS S,RAO S,GREENHAM K,et al.Bacterial-and plant-type phosphoenolpyruvate carboxylase polypeptides interact in the hetero-oligomeric Class-2PEPC complex of developing castor oil seeds[J].The Plant Journal,2007,52(5):839-849.
[8] CHOLLET R,VIDAL J,O'LEARY M H.Phosphoenolpyruvate carboxylase:a ubiquitous highly regulated enzyme in plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1996,47:273-298.
[9] O'LEARY B,PARK J,PLAXTON W C.The remarkable diversity of plant phosphoenolpyruvate carboxylase(PEPC):recent insights into the physiological functions and post-translational controls of non-photosynthetic PEPCs[J].Biochemical Journal,2011,436(1):15-34.
[10] VIDAL J,CHOLLET R.Regulatory phosphorylation of C4PEP carboxylase[J].Trends Plant Science,1997,2(6):230-237.
[11] SANCHEZ R,FLORES A,CEJUDO F J.Arabidopsis phosphoenolpyruvate carboxylase genes encode immunologically unrelated polypeptides and are differentially expressed in response to drought and salt stress[J].Planta,2006,223(5):901-909.
[12] CARMO-SILVA A E,BERNARDES DA SILVA A,KEYS A J,et al.The activities of PEP carboxylase and the C4acid decarboxylases are little changed by drought stress in three C4grasses of different subtypes[J].Photosynthesis Research,2008,97(3):223-233.
[13] GONZALEZ M C,SANCHEZ R,CEJUDO F J.Abiotic stresses affecting water balance induce phosphoenolpyruvate carboxylase expression in roots of wheat seedlings[J].Planta,2003,216(6):985-992.
[14] DIZENGREMEL P,LE THIEC D,HASENFRATZ-SAUDER M P,et al.Metabolic-dependent changes in plant cell redox power after ozone exposure[J].Plant Biology,2009,11(1):35-42.
[15] WANG Y M,XU W G,HU L,et al.Expression of maize gene encoding C4-Pyruvate Orthophosphate Dikinase(PPDK)and C4-Phos-phoenolpyruvate CarboxylasePEPCin transgenic ArabidopsisJ.Plant Molecular Biology Reporter2012301 367-1 374.
[16] BANDYOPADHYAY A,DATTA K,ZHANG J,et al.Enhanced photosynthesis rate in genetically engineered indica rice expressing pepc gene cloned from maize[J].Plant Science.2007,172(6):1 204-1 209.
[17] DING Z S,ZHOU B Y,SUN X F,et al.High light tolerance is enhanced by overexpressed PEPC in rice under drought stress[J].Acta Agronomica Sinica,2012,38(2):285-292.
[18] MÜLLER K,DOUBNEROVÀV,SYNKOVÀH,et al.Regulation of phosphoenolpyruvate carboxylase in PVY(NTN)-infected tobacco plants[J].Biological Chemistry,2009,390(3):245-251.
[19] VOZNESENSKAYA E V,FRANCESCHI V R,KIIRATS O,et al.Kranz anatomy is not essential for terrestrial C4plant photosynthesis[J].Nature,2001,414:543-546.
[20] EDWARDS G E,FRANCESCHI V R,VOZNESENSKAYA E V.Single-cell C4photosynthesis versus the dual-cell(Kranz)paradigm[J].Annual Review of Plant Biology,2004,55:173-196.
[21] LARA M V,CHUONG S D,AKHANI H,et al.Species having C4single-cell-type photosynthesis in the chenopodiaceae family evolved a photosynthetic phosphoenolpyruvate carboxylase like that of kranz-type C4species[J].Plant Physiology,2006,142(2):673-684.
[22] ROSNOW J J,EDWARDS G E,ROALSON EH.Positive selection of Kranz and non-Kranz C4phosphoenolpyruvate carboxylase amino acids in Suaedoideae(Chenopodiaceae)[J].Journal of Experimental Botany,2014,65(13):3595-3607.
[23] THOMPSON J D,GIBSON T J,PLEWNI F,et al.The Clustal X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,24(4):876-488.
[24] DENG X,CAI J,LI Y,et al.Expression and knockdown of the PEPC1gene affect carbon flux in the biosynthesis of triacylglycerols by the green algaChlamydomonas reinhardtii[J].Biotechnology Letters,2014,36(11):2 199-2 208.
[25] NARAYAN O P,KUMARI N,RAI L C.Heterologous expression of Anabaena PCC 7120 all 3940(a Dps family gene)protects Escherichia coli from nutrient limitation and abiotic stresses[J].Biochemical and Biophysical Research Communications,2010,394(1):163-169.
[26] RUIZ-BALLESTA I,FERIA A B,NI H,et al.In vivo monoubiquitination of anaplerotic phosphoenolpyruvate carboxylase occurs at Lys624in germinating sorghum seeds[J].Journal of Experimental Botany,2014,65(2):443-451.
[27] LEPINIEC L,VIDALA J,CHOLLETB R,et al.Phosphoenolpyruvate carboxylase:structure,regulation and evolution[J].Plant Science,1994,99(2):111-124.
[28] DONG L,PATIL S,CONDON S A,et al.The conserved C-terminal tetrapeptide of sorghum C4phosphoenolpyruvate carboxylase is indispensable for maximal catalytic activity,but not for homotetramer formation[J].Archives of Biochemistry and Biophysics,1999,371(1):124-128.
[29] MATSUMURA H,XIE Y,SHIRAKATA S,et al.Crystal structures of C4form maize and quaternary complex of E.coli phosphoenolpyruvate carboxylases[J].Structure,2002,10(12):1 721-1 730.
[30] ZHANG G F(张桂芳),ZHAO M(赵 明),DING Z S(丁在松),et al.Cloning and characterization of phosphoenolpyruvate carboxylase gene fromEchinochloa crusgalli[J].Acta Agronomica Sinica(作物学报),2005,31(10):1 365-1 369(in Chinese).
[31] CHEN M N(陈明娜),YANG Q L(杨庆利),YU SH L(禹山林),et al.Cloning and analysis of phosphoenolpyruvate carboxylase gene fromSuaeda glauca[J].Marine Sciences(海洋科学),2009,33(6):67-72(in Chinese).
[32] 王镜岩.生物化学[M].北京:高等教育出版杜,2002:384-385.
[33] PARK S,PACK S P,LEE J.Expression of codon-optimized phosphoenolpyruvate carboxylase gene from Glaciecola sp.HTCC2999in Escherichia coli and its application for C4chemical production[J].Applied Biochemistry and Biotechnology,2012,167(7):1 845-1 853.
[34] DU X H(杜西河),XU W G(许为钢),HU L(胡 琳),et al.Response of maize C4-type PEPCand PPDKtransgenic Arabidopsis plants to drought-stress[J].Molecular Plant Breeding(分子植物育种),2013,11(4):477-484(in Chinese).
[35] ZHOU B Y,DING Z S,ZHAO M.Alleviation of drought stress inhibition on photosynthesis by overexpression of pepc gene in rice[J].Acta Agronomica Sinica,2011,37(1):112-118.
[36] BEGUMA H H,OSAKIA M,WATANABEA T,et al.Mechanisms of aluminum tolerance in phosphoenolpyruvate carboxylase transgenic rice[J].Journal of Plant Nutrition,2009,3(1):84-96.
[37] PLAXTON W C,PODESTA F E.The functional organization and control of plant respiration[J].PlantS ciences,2006,25(2):159-198.
[38] MILLARD C S,CHAO Y P,LIAO J C,eta l.Enhanced production of succinic acid by overexpression of phosphoenolpyruvate carboxylase in Escherichia coli[J].Applied and Environmental Microbiology,1996,62(5):1 808-1 810.
[39] RZEPKA A,RUT G,KRUPA J.Effect of abiotic stress factors on fluctuations in contents of malate and citrate and on malic enzyme activity in moss gametophores[J].Photosynthetica,2009,47(1):141-145.
[40] BROADBENT J R,LARSEN R L,DEIBEL V,et al.Physiological and transcriptional response of Lactobacillus casei ATCC 334to acid stress[J].Journal of Bacteriology,2010,192(9):2 445-2 458.

