水杨酸对西瓜幼苗耐低温性的影响
孔新宇 王雯雯 张松影 戴祖云


摘 要: 为了探讨低温下水杨酸(salicylic acid,SA)对西瓜幼苗生长的调控作用,以‘天使无籽1号西瓜幼苗为试材,通过不同浓度的SA叶面喷施处理,系统地研究了低温下无籽西瓜幼苗叶片细胞膜透性、丙二醛(MDA)含量、脯氨酸(Pro)含量和超氧化物歧化酶(SOD)活性的变化。结果表明:低温胁迫下,当SA浓度为0~1.5 mmol·L-1时,西瓜叶片细胞膜透性和MDA的含量明显下降,Pro含量与SOD活性呈上升趋势;当SA浓度达到2.5 mmol·L-1时,SA所诱导的保护性应激反应已达到极限,逐渐失去应激保护作用。
关键词: 西瓜幼苗; 水杨酸; 低温胁迫; 应激反应
Abstract: In order to elucidate the regulation function of salicylic acid(SA) on the seedlings of watermelon under cold stress,the seedlings of ‘Tianshi Wuzi No.1 were sprayed with different levels of SA concentrations under cold stress,and the cell membrane relative permeability,malondialdehyde(MDA) content,proline(Pro) content and superoxide dismutase enzyme(SOD) activity were measured. The results showed that the cell membrane relative permeability and MDA content in leaves were obviously decreased while SOD activity and Pro content increased under cold stress under the SA concentrations of 0-1.5 mmol·L-1. When SA concentration reaching 2.5 mmol·L-1,the protective stress response induced by SA had reached its limitation,and lost the protective effect under stress gradually.
Key words: Watermelon seedlings; Salicylic acid; Low temperature stress; Stress response
西瓜是喜溫作物,不耐寒,生长发育的最适温度18~24 ℃。北方地区早春栽培或冬季大棚栽培常因温度过低而出现发芽率低、出苗不齐的现象,所以研究低温伤害机理,探讨减轻低温危害的途径和方法,在理论和实践上都有重要意义。西瓜在受到低温胁迫时,细胞膜会发生一系列生理变化,当达到一定阈值,会引起膜收缩,膜内物质如丙二醛(MDA)、脯氨酸(Pro)等向膜外渗透,从而使酶系统活性降低[1]。水杨酸(salicylic acid,SA)是普遍存在于植物体内的内源生长调节物质,不仅参与调节植物的许多生理过程,如产热、植物开花、性别分化、种子发芽、气孔关闭、离子吸收等,还是一种重要的胞内信号分子[2-3],与植物的抗病、耐盐和抗寒密切相关[4-5]。
目前,关于SA生理作用的报道多是与植物抗病性相关的研究[6],而在低温胁迫下对植物,尤其是对瓜类作物影响的研究较少。耿广东等[7]证实经SA处理的番茄幼苗在低温胁迫下通过降低体内MDA含量和提高SOD活性来维持自身的生长;梁瑞等[8]以番茄为试材,利用SA处理-5 ℃开花期番茄,结果显示,番茄幼苗的耐低温性与相对电导率成反比,与Pro含量呈正比。这些研究结果表明,低温胁迫下,SA能提高番茄幼苗的抗氧化能力。但是有关SA对提高瓜类作物的抗寒性的系统研究还未见报道。本试验以无籽西瓜品种——‘天使无籽1号为试验材料,探讨了SA叶面喷施对西瓜幼苗生理生化特性的影响,为进一步研究SA提高西瓜幼苗的抗寒性机制提供参考。
1 材料与方法
1.1 试验材料
试验西瓜品种为‘天使无籽1号,由安徽江淮园艺种业股份有限公司提供。该品种瓤质紧脆,果皮坚硬,耐低温弱光,适合我国西北地区种植。
1.2 处理方法
选取饱满、整齐一致的西瓜种子,用(55±1)℃的蒸馏水浸种15 min,期间不断搅拌,自然冷却4 h,再用蒸馏水将种子冲洗2次,放在铺有滤纸的瓷盘上萌发,并于种子露白后播种。播种时选取直径为8 cm的营养钵210个,每个营养钵中平放3粒种子,用沙壤土覆盖,浇透水后于室温下正常管理。设置SA浓度梯度分别为0、0.5、1.5、2.5、3.5 mmol·L-1,将西瓜幼苗平均分为5组,每组42盆。待子叶展平时,开始对叶面上下喷洒SA,直至叶面滴水为止,每3 h喷施1次,共计4次。待西瓜幼苗长至1叶1心后,将幼苗按SA梯度处理分成2等份,1份移入人工气候培养箱[温度(18±2)℃,光周期16/8 h,相对湿度60%~80%,光强度8 000~10 000 Lx]培养;1份移入低温恒温槽(THD-3010),设置温度为18 ℃,每2 h下降1 ℃,最终温度为4 ℃(共计7 h)。在低温(4 ℃)处理12 h,常温(18 ℃)处理19 h后,称取西瓜叶片1 g,测定各生理指标。
1.3 测定方法
MDA含量测定以常规硫代巴比妥酸(TBA)比色法进行[9];用电导法测定细胞膜的相对透性[10];用磺基SA提取比色法测定Pro含量[9],SOD活性的测定采用氮蓝四唑(NBT)还原法[11]。
1.4 数据处理
利用Excel进行数据初步统计分析,数据的平均值、标准差及SNK多重比较分析采用SPSS 19.0软件进行。
2 结果与分析
2.1 SA对低温胁迫下的西瓜幼苗叶片细胞膜透性的影响
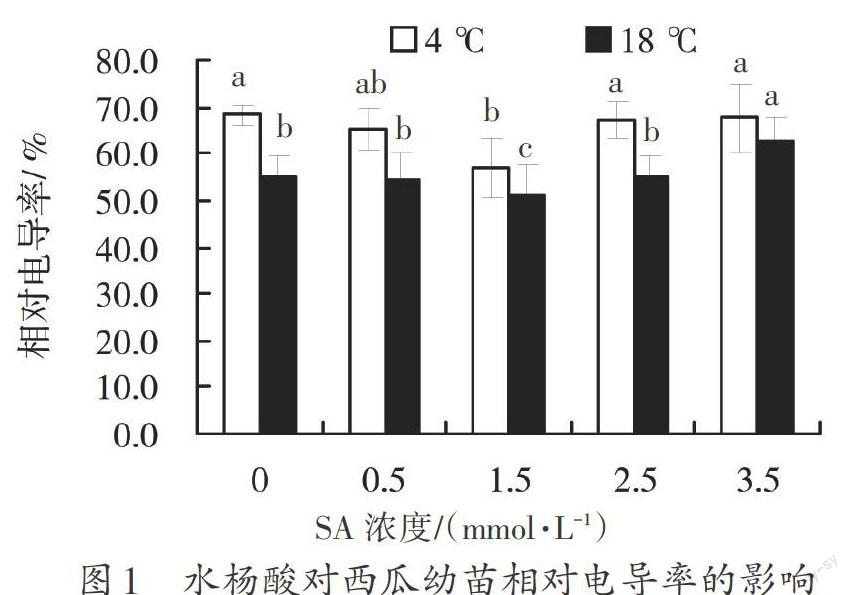
从图1可以看出,在同一SA浓度下,西瓜幼苗在低温胁迫下的相对电导率要显著高于常温下的电导率,这表明低温胁迫下膜内物质透过细胞膜流入胞外。常温下,SA对西瓜幼苗相对电导率影响不大,当SA浓度达到3.5 mmol·L-1时,电导率显著上升,说明SA对植物造成损伤;在低温胁迫下,经0.5和1.5 mmol·L-1的SA处理后,叶片内相对电导率呈下降趋势,其中在1.5 mmol·L-1达到最小值,对低温胁迫处理效果最佳。
2.2 SA对低温胁迫下西瓜幼苗MDA含量的影响
丙二醛(MDA)是膜脂过氧化作用的最终产物,其含量是胞内膜脂过氧化程度的重要指标。由图2可以看出,常温下西瓜幼苗叶片内MDA含量极少。在相同SA浓度下,低温胁迫下的MDA含量与常温相比有所增加。此外,在低温胁迫下,当SA浓度为0~1.5 mmol·L-1的较低浓度时,可以降低叶片中MDA的含量,以减轻植物损害程度,保持叶片细胞的渗透压和活力;当处理浓度大于1.5 mmol·L-1时,MDA的含量呈上升趋势。
2.3 SA对低温胁迫下西瓜幼苗中SOD活性的影响
在低温胁迫下,细胞内活性氧代谢的平衡被破坏,容易形成活性氧的积累。活性氧过剩的毒害之一是引发或加剧膜质过氧化的作用,造成细胞膜系统的损害。低温处理24 h后,由于进入低温胁迫,西瓜幼苗内部的保护酶SOD对O2- 有一个适应过程,胁迫使得SOD活性有所降低,随着SA浓度的增加,SOD活性开始上升,在1.5 mmol·L-1 SA处理时达到最高值,之后由于O2- 含量下降,SOD活性快速下降。除2.5 mmol·L-1 SA 及3.5 mmol·L-1 SA处理后的SOD活性下降外,其余浓度均不同程度的提高了SOD活性(图3)。
2.4 SA对低温胁迫下西瓜幼苗中Pro含量的影响
在逆境的条件下,植物体内的脯氨酸(Pro)含量明显增加,因而Pro常被用来作为植物抗逆性的指标,通常情况下,其含量越高越有利于植物抵御低温。从图4可以看出:在低温胁迫下,不同浓度SA处理后西瓜幼苗Pro的含量与常温下的Pro含量相比,均有增加。低浓度SA(0~1.5 mmol·L-1)处理的叶片Pro含量增加缓慢,当SA浓度达到3.5 mmol·L-1时,Pro含量显著上升。由此表明,当SA浓度在低浓度范围内时,可诱导西瓜幼苗在抵御低温胁迫时产生保护性应激反应,增加Pro含量,以保持细胞通透性和活性,提高植株的抗寒能力。在常温下,Pro含量随着SA含量的增加而缓慢增加,这表明在非胁迫环境下,施加高浓度的SA本身会对植物体造成胁迫,并带来伤害。
幼苗Pro含量的影响
3 讨论与结论
植物在遭受低温、干旱等逆境胁迫时,自身发生一系列的应激生理反应,诱导体内相应的酶系统和代谢过程发生变化,如Pro含量增加、SOD活性增强等,以维持植物细胞正常的MDA含量、电解质含量和其他生理功能,保护细胞膜的通透性和细胞稳定性。外源SA能够有效诱导以上生理反应,增强植物在逆境中的抗性。从本试验结果看,在低温胁迫下,适当浓度的SA可以显著提高西瓜幼苗的细胞膜透性和游离脯氨酸(Pro)含量,同时降低MDA含量和电解质含量,帮助植物抵御低温逆境,保证植物的正常生长,本研究结果与前人研究一致[12-13]。
SA可通过调节植物体内的生理代谢过程提高植物抗性。大量证据表明,植物体内SOD含量的增加是适应逆境的表现,是植物获得抗性的信号[2,13-14]。MDA含量和细胞膜透性反映细胞膜过氧化程度,是衡量细胞稳定性的指标,MDA含量过高以及细胞膜透性过大都将对植物细胞造成不可恢复的伤害[15]。Pro常被作为植物抗逆性的指标,体现细胞的稳定性和活力,含量越高越有利于植物抵御逆境[16]。
此外,高浓度的SA处理能显著提高Pro的含量,但是西瓜幼苗中相对电导率大幅增加、MDA含量迅速积累,这表明,SA所诱导的保护性应激发应已达到极限,更大浓度的SA将逐渐失去应激保护作用,本研究表明1.5 mmol·L-1的SA处理效果最为明显。这与前人研究有一定差异[7],可能由于作物种类的差异造成[17]。本研究提出防御西瓜幼苗低温危害的最适SA浓度,对我国北方地区早春大棚栽培西瓜所面临的低温危害具有一定指导意义。
参考文献
[1] 王 静,魏晓红,龙瑞军. 植物抗寒机制的研究方法与进展[J].甘肃科技纵横,2004,33(6): 72-73.
[2] 李兆亮,原永兵,刘连成,等. 黄瓜细胞中水杨酸的信号传递研究[J].植物学报,1998,40(5): 430-436.
[3] Daniel F Klessig,Jocelyn Malamy. The salicylic acid signal in plant[J].Plant Molecular Biology,1994,26(5): 1439-1458.
[4] 原永兵,曹宗巽. 水杨酸在植物体内的作用[J]. 植物学通报,1994,11(3): 1-9.
[5] Kang H M,Saltveit M E.Chilling tolerance of maize,cucumber and rice seedling leaves and roots are differentially affected by salicylic acid[J]. Physiol Plant,2002,1l5(4): 57l-576.
[6] 李兆亮,原永兵,刘成连,等. SA对叶片抗氧化剂酶系的调节作用[J]. 植物学报,1998,40(4): 356-361.
[7] 耿广东,程智慧,李建设,等. 水杨酸对茄子幼苗抗寒性的影响[J]. 西北农林科技大学学报(自然科学版),2002,30(6): 101-103.
[8] 梁 瑞,张喜春. 生长调节剂处理对番茄开花期耐寒性的影响[J].中国农学通报,2010,26(17): 223-228.
[9] 西北农业大学植物生理生化研究组. 植物生理学实验指导[M].西安:陕西科学技术出版社,1987.
[10] 刘鸿先,曾韶西,王以柔,等. 低温对不同耐寒力的黄瓜幼苗子叶细胞器的超氧物歧化酶的影响[J].植物生理学报,1985,11(1): 48-57.
[11] 刘永军,郭守华,杨晓玲. 植物生理生化实验[M]. 北京:中国农业科技出版社,2002.
[12] 石玉兰,陈 宣,岳 君,等. 水杨酸通过提高抗氧化酶系统活力增强拟南芥悬浮细胞的耐寒性[J]. 冰川冻土,2010,32(6): 1175-1179.
[13] 张 蕊,高志明,吕 俊,等.外源水杨酸对水稻幼苗耐寒性的影响[J].江苏农业科学,2012,40(6): 62-65.
[14] 庞金安,马德华,霍振荣,等. 水杨酸预处理对提高黄瓜幼苗耐低温能力的影响[J].华北农学报,2000,15(1): 112-115.
[15] 蔡 漢,李卫东,熊作明,等. 低温胁迫下水杨酸预处理对茉莉幼苗活性氧及保护酶的影响[J].中国农学通报,2007,23(7): 290-294.
[16] 种培芳,杨江山. 水杨酸对水分胁迫下甜瓜幼苗生理特性的影响[J].甘肃农业大学学报,2006,41(3): 44-47.
[17] 余丽玲. 西洋杜鹃四个品种抗寒性对比研究[D]. 福州:福建农林大学,2014.

