橄榄果实发育成熟过程中糖积累与相关酶活性的关系
李泽坤,陈清西
(福建农林大学 园艺学院,福州350002)
糖含量是评价果实品质的主要因子之一,而蔗糖代谢是糖积累过程的关键环节[1-2]。橄榄果实糖积累主要以蔗糖为主,还有葡萄糖、果糖以及少量的棉籽糖[3]。因此蔗糖代谢是影响橄榄品质形成的主要因素。研究发现蔗糖代谢过程以蔗糖转化酶(Ivr)、蔗糖合成酶(SuSy)、蔗糖磷酸合成酶(SPS)为主[4]。其中蔗糖转化酶可分为酸性转化酶(AI)、中性转化酶(NI),催化蔗糖分解为葡萄糖、果糖;蔗糖合成酶催化可逆反应,在一定条件下促进蔗糖的分解或合成。目前蔗糖代谢的相关研究主要集中在苹 果[5-6]、枇 杷[7]、柑 橘[8-9]、荔 枝[10]、玉 米[11]、甘蔗[12]等作物中,橄榄果实发育中蔗糖代谢变化的研究甚少。橄榄原产于福建、广东,具有生津治咽、开胃止泻等多种药用功效[13-14],但因其入口苦涩而后甘甜的口感造成消费群体小,市场潜力挖掘受到限制。本试验选用不同含糖量的‘马坑22’、‘檀头23’橄榄品种为试验材料(前者含糖量高,后者含糖量低[15]),研究橄榄果实蔗糖代谢变化过程,旨在探讨不同含糖量品种橄榄果实糖积累差异的生理基础,为进一步在代谢与分子水平探讨橄榄果实糖积累机制提供试验依据。
1 材料与方法
1.1 材 料
2个供试材料采自福建闽侯县白沙镇上岐橄榄园,树龄7年,均为丘陵山地露天栽培,盛花期为5月中旬,成熟期为11月中上旬。盛花期后60d开始采果,每隔14d采集1次。选择树体东西南北四个方位各3~5个大小相近、无病虫害的橄榄果实为试材。采样后洗果、去核、冻干、粉碎,过40目筛,置-40 ℃冰箱中作为可溶性糖含量测定材料。另取一部分果实去核,液氮速冻后置于-40 ℃冰箱中用于蔗糖代谢相关酶活性测定。
1.2 测定指标及方法
1.2.1 可溶性总糖含量 可溶性总糖含量的提取、测定参照王学奎[16]蒽酮法进行测定。
1.2.2 糖组分含量 (1)样品制备 取0.20g橄榄干样置于离心管中,加入10mL纯水,100 ℃水浴1 h,冷却后10 000×g离心10min。取上清液加热浓缩后用1mL纯水溶解,过0.45μm 水系膜后待测。(2)标准溶液制备 取葡萄糖、果糖、蔗糖标准品配置成质量浓度为2、6、10、14、18mg/mL的糖混合标准溶液,过0.45μm 水系膜待测。(3)高效液相色谱(HPLC)条件 色谱柱选用NH2柱及保护柱,柱温38 ℃,流动相为乙腈∶水=80∶20,流速1 mL·min-1。检测器为示差检测器,检测池温度为38℃,进样量10μL。
1.2.3 蔗糖代谢相关酶活性 酶的提取过程均在0~4 ℃中完成。称取橄榄样品,液氮中研磨5~10 min,加 入200 mmol·L-1磷酸钾缓冲液(含有0.1%β-巯基乙醇,5 mmol·L-1MgCl2,0.05%BSA,0.05% Triton X-100,2% PVPP,pH 7.5)研磨至匀浆,20 000×g离心30 min。取上清液逐渐加 入(NH4)2SO4至80%饱和度,4 ℃冰箱中静置30min,20 000×g离心20min,去除上清液,加入脱盐缓冲液(20mmol·L-1K3PO4缓冲液,0.01%β-巯基乙醇,0.25 mmol·L-1MgCl2,0.05% BSA,pH 7.5)重新溶解沉淀,装入透析袋,脱盐缓冲液中透析16h,即得酸性转化酶(AI)、中性转化酶(NI)。
SPS、SuSy的提取步骤与AI、NI相似,其中提取缓冲液为200 mmol·L-1Hepes-NaOH(含有0.1%β-巯基乙醇,5 mmol·L-1MgCl2,0.05%BSA,0.05% Triton X-100,2% PVPP,1 mmol·L-1EDTA,1mmol·L-1EGTA,10mmol·L-1抗坏血酸钠,10mmol·L-1半胱氨酸-盐酸,2%甘油,pH 7.5),脱盐缓冲液为20 mmol·L-1Hepes-NaOH(0.25 mmol·L-1MgCl2,0.01%β-巯基乙醇,0.05% BSA,1 mmol·L-1EDTA,1 mmol·L-1EGTA,2%甘油,pH 7.5)。
酶的活性测定参照赵智中[17]方法略做改动,其中AI、NI活性测定反应体系由490μL 改为700 μL。AI、NI、SuSy(分解方向)活性测定采用3,5-二硝基水杨酸法测定还原糖生成量来表示酶活性大小,SPS、SuSy(合成方向)活性测定采用蒽酮法测定蔗糖生成量来表示酶活性大小。
1.3 数据处理
试验每组重复3 次,试验结果通过SPSS19.0和Excel 2003进行数据统计,采用LSD 法进行显著性差异分析,Spearman法进行相关性分析。
2 结果与分析
2.1 橄榄果实发育成熟过程中可溶性糖含量变化
如图1所示,‘马坑22’橄榄果实内蔗糖含量在花后60~102d变化不大,果糖与葡萄糖含量在花后102d出现最低值,这可能与果核硬化过程有关;在花后102d直至成熟期间,果实内蔗糖含量快速积累,可溶性总糖含量也迅速提高,其己糖与蔗糖含量比在果实成熟时为0.668。‘檀头23’果实内蔗糖含量在花后60~130d变化不大,果糖、葡萄糖含量的最低值同样出现在花后102d;但‘檀头23’果实内蔗糖快速积累期出现在花后130~186d,较‘马坑22’迟14d且增长幅度较小;成熟时‘檀头23’果实内葡萄糖、果糖含量与‘马坑22’相近,蔗糖含量低于‘马坑22’,己糖与蔗糖含量比为0.904。因此,不难发现蔗糖积累是橄榄果实内可溶性糖含量提高的重要原因。
2.2 橄榄果实发育成熟过程中转化酶活性的变化
图2显示,橄榄品种‘马坑22’果实内AI活性随果实发育成熟总体呈现波动下降的变化趋势,从花后144d开始随着果实成熟逐渐降低,并在成熟时达到最低值(1.424 mg·g-1·h-1)。橄榄品种‘檀头23’果实内AI活性总体变化趋势与‘马坑22’相同,但在成熟时AI活性高于‘马坑22’,且最低值出现在花后102d。在橄榄果实发育成熟过程前后,其AI活性在‘檀头23’中有所增强,而在‘马坑22’AI内有所减弱。另外,在橄榄果实发育成熟过程中,2个品种果实内NI活性变化趋势也大致相同,但‘马坑22’中的NI活性始终高于‘檀头23’,尤其是在花后172和186d2个品种的差值更大,‘马坑22’的NI活性分别比‘檀头23’提高125.24%和112.69%。可见‘马坑22’与‘檀头23’AI活性主要差异表现在果实发育成熟的后阶段,‘马坑22’果实内较低的AI活性有利于减缓蔗糖分解。而由于NI主要位于细胞质中,因此‘马坑22’较高的NI活性有利于提高果实库强间接促进蔗糖的进入。
2.3 橄榄果实发育成熟中蔗糖磷酸合成酶活性的动态变化
如图3所示,橄榄品种‘马坑22’果实中SPS活性随生育期呈现先升后降再升的变化趋势,在花后130d达到最低值(0.408μg·g-1·h-1),并分别在花后102d和172d分别达到峰值。品种‘檀头23’果实中SPS活性随生育期变化趋势与‘马坑22’相同,但其在花后88d即达到第一峰值,且峰值明显低于‘马坑22’;同时‘檀头23’SPS活性在果实成熟期(花后172~186d)显著低于‘马坑22’(P<0.05)。可见,‘马坑22’与‘檀头23’在果实发育成熟过程中SPS 活性变化差异不大且2 个品种的SPS活性均明显低于其他蔗糖代谢相关酶。
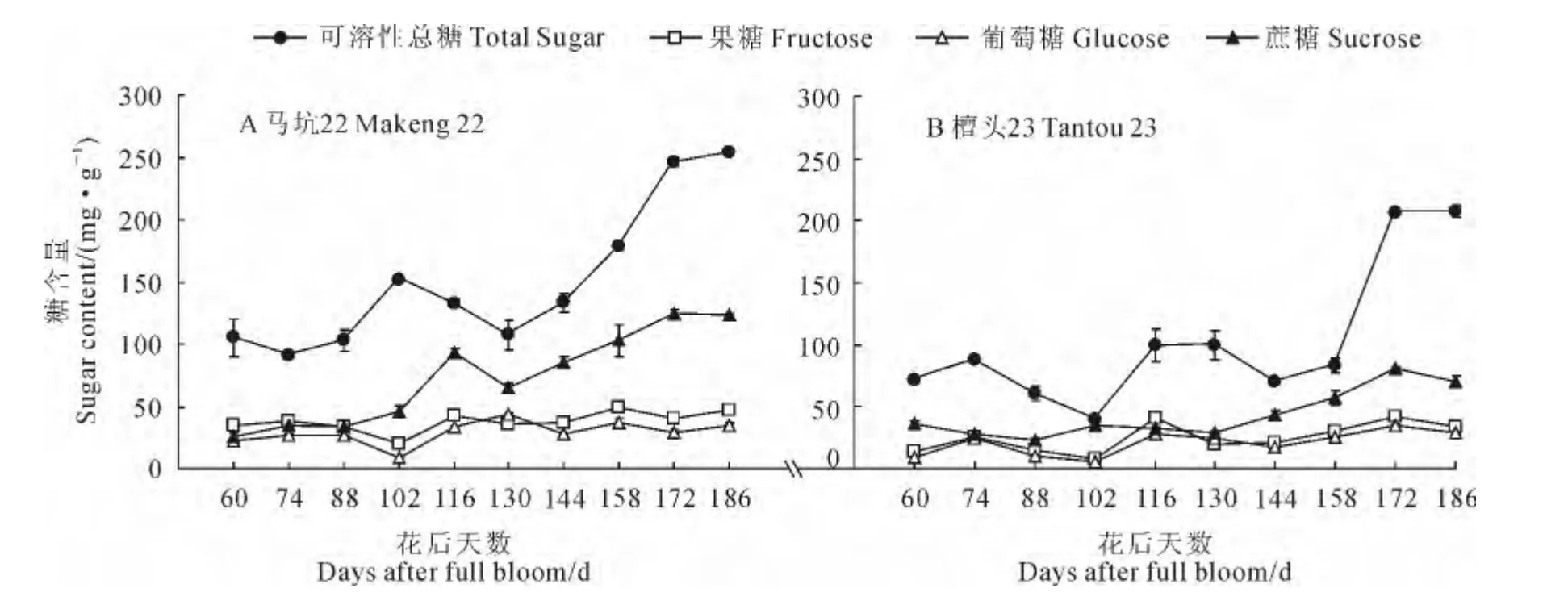
图1 橄榄果实发育成熟过程中可溶性糖含量变化Fig.1 Soluble sugar content changes during the development and ripening of Chinese olive fruit

图2 橄榄果实发育成熟过程AI和NI活性变化Fig.2 Changes of AI and NI activities during the development and ripening of Chinese olive fruit

图3 橄榄果实发育成熟中SPS活性变化Fig.3 Changes of SPS activity during the development and ripening of Chinese olive fruit
2.4 橄榄果实发育成熟中蔗糖合成酶活性的变化
橄榄品种‘马坑22’果实内SuSy(合成方向)活性在花后60~144d 与‘檀头23’变化趋势大致相同,但其在花后144~186d快速提高,增长幅度为140.70%,而同期‘檀头23’SuSy(合成方向)活性增长幅度明显小于‘马坑22’(图4,A)。同时,在橄榄果实发育成熟过程中,品种‘马坑22’和‘檀头23’果实中SuSy(分解方向)活性变化趋势大致相同,分别在7.344~14.533 mg·g-1·h-1和8.565~16.622mg·g-1·h-1范围内波动变化,但‘檀头23’SuSy(分解方向)活性在大部分时期上高于‘马坑22’(图4,B)。以上结果说明在橄榄果实发育成熟过程中SuSy活性以分解方向为主且2个品种间的分解方向活性变化差异不大。但在合成方向上,‘马坑22’与‘檀头23’SuSy活性在花后144~186d表现明显差异,‘马坑22’SuSy(合成方向)活性的显著提高促进了果实内蔗糖的快速积累。
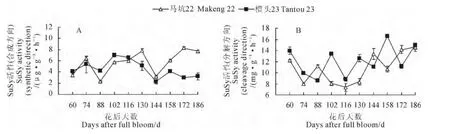
图4 橄榄果实发育成熟中SuSy活性在合成方向(A)和分解方向(B)的变化Fig.4 Changes of SuSy activity at synthetic direction(A)and cleavagedirection(B)during the development and ripening of Chinese olive fruit

表1 橄榄果实可溶性糖含量及其代谢相关酶活性的相关性分析Table1 Correlation analysis among souble sugar contents and the activities of sucrose-metabolizing enzymes in the Chinese olive fruits
2.5 橄榄果实可溶性糖含量及其代谢相关酶活性的关系
如表1所示,在橄榄果实发育成熟过程中,‘马坑22’橄榄果实中可溶性总糖与蔗糖含量极显著正相关(r=0.855),其蔗糖含量与AI活性显著负相关(r=-0.661),与SPS、SuSy(合成方向)活性显著正相关(r=0.624)。而‘檀头23’橄榄果实中可溶性总糖含量与果糖、葡萄糖含量极显著正相关(r分别为0.867和0.770),其蔗糖含量与SuSy(合成方向)活性显著负相关(r=-0.673),与SuSy(分解方向)活性显著正相关(r=0.636)。以上结果说明,‘檀头23’果实内较低的蔗糖含量促使果糖和葡萄糖成为影响该品种橄榄果实可溶性总糖含量的主要影响因子;SuSy(合成方向)在2个品种果实的糖积累过程中发挥着截然不同的作用。
3 讨 论
本研究结果表明蔗糖含量是橄榄果实可溶性糖含量提高的重要原因。在橄榄果实糖积累过程中,无论是‘马坑22’还是‘檀头23’均存在蔗糖快速积累期,且直接影响到果实成熟时可溶性糖含量的高低。在蔗糖积累型的网纹甜瓜糖代谢研究中也同样发现在果实成熟前期出现蔗糖快速积累过程[18]。前人研究认为果实内蔗糖的积累通常经韧皮部运输直接进入或者转化为六碳糖进入果实,其进入速率主要依赖于源与库间的浓度梯度[17,19-20]。蔗糖的水解通常被认为是蔗糖进入果实的限速步骤[21]。在甜菜[22]、柑橘[23]等研究上表明果实成熟过程中AI活性降低是蔗糖积累的前提。本研究中,在果实蔗糖快速积累期内‘马坑22’AI活性低于‘檀头23’,从而为‘马坑22’果实内蔗糖的快速积累创造了前提条件,而其位于细胞质中的NI活性高于‘檀头23’又有利于增强果实库强。在蔗糖合成方面,两个品种的SPS活性变化大致相似,‘马坑22’仅在成熟期时(花后172~186d)略高于‘檀头23’,且SPS在橄榄果实中的活性较低,因此SPS不是两个品种蔗糖积累差异的关键。在蔗糖快速积累期内,两个品种在SuSy(合成方向)活性变化上差异显著,‘马坑22’SuSy(合成方向)活性在花后144~186d增速高于‘檀头23’。在 桃[24-25]、日本梨[26-27]、甜橙[28]等研究中均认为SuSy是蔗糖积累的关键酶。此外,王惠聪研究认为SPS、SuSy(合成方向)参与了库组织的糖组分调节,较高的活性有利于荔枝假种皮的蔗糖积累,在本研究中也有相似的发现[29]。
在本研究中由于蔗糖净合成速率(蔗糖净合成速率=SPS+SuSy 合成方向-AI-NI-SuSy 分解方向)始终为负值,因此蔗糖直接进入橄榄果实是蔗糖积累的另一重要途径。有研究认为SuSy是调节蔗糖直接进入柑橘果实速度的关键酶,其机理主要是由于汁胞外SuSy催化蔗糖分解为UDPG 和果糖,经三羧酸循环生成ATP,间接促使H+外运,同时胞外蔗糖被运入胞内[30]。在本试验的‘檀头23’橄榄果实中也有同样的发现,相关性分析显示SuSy(分解方向)活性的提高促进了果实内蔗糖的积累,表明SuSy(分解方向)间接地促进了蔗糖直接进入果实的速率加快。以上的这种变化关系在‘马坑22’上并不明显,但本研究中‘马坑22’SuSy(分解方向)活性在大部分时期低于‘檀头23’且2个品种的变化趋势相似。研究表明在大多数植物中存在至少2种以上的SuSy同工酶[31]。因此可以推断Su-Sy(分解方向)活性虽然在2个橄榄品种上变化趋势相同,但在SuSy(分解方向)的功能结构上可能存在差异。
[1] LIANG J(梁 俊),GUAN Y(郭 燕),LIU Y L(刘玉莲),etal.Analysis of contents and constituents of sugar and organic acid in different apple cultivars[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.)(西北农林科技大学学报·自然科学版),2011,39(10):163-170(in Chinese).
[2] WANG D F(王德孚),YANG ZH J(杨志军),SUN J M(孙江妹),etal.Difference in soluble sugar accumulation and related enzyme activity of fruits among different pear cultivars[J].JournalofFruitScience(果树学报),2014,31(1):30-38(in Chinese).
[3] HE ZH Y(何志勇).Analysis of nutrient content in the fruit flesh ofCanariumalbum[J].ScienceandTechnologyofFoodIndustry(食品工业科技),2009,(12):224-226(in Chinese).
[4] CHEN J W(陈俊伟),ZHANG SH L(张上隆),ZHANG L CH(张良诚).Fruit sugar transport,metabolism and accumulation and its regulation[J].JournalofPlantPhysiologyandMolecularBiology(植物生理与分子生物学学报),2004,30(1):1-10(in Chinese).
[5] LI M,FENG F,CHENG L.Expression patterns of genes involved in sugar metabolism and accumulation during apple fruit development[J].PLoSOne,2012,7(3):e33055.
[6] ZHU Z,LIU R,LI B,etal.Characterisation of genes encoding key enzymes involved in sugar metabolism of apple fruit in controlled atmosphere storage[J].FoodChemistry,2013,141(4):3 323-3 328.
[7] CAO S,YANG Z,ZHENG Y.Sugar metabolism in relation to chilling tolerance of loquat fruit[J].FoodChemistry,2013,136(1):139-143.
[8] CHEN M,JIANG Q,YIN X-R,etal.Effect of hot air treatment on organic acid-and sugar-metabolism in Ponkan(Citrusreticulata)fruit[J].ScientiaHorticulturae,2012,147:118-125.
[9] JIANG N,JIN L-F,DA SILVA J A T,etal.Activities of enzymes directly related with sucrose and citric acid metabolism in citrus fruit in response to soil plastic film mulch[J].ScientiaHorticulturae,2014,168:73-80.
[10] YANG Z,WANG T,WANG H,etal.Patterns of enzyme activities and gene expressions in sucrose metabolism in relation to sugar accumulation and composition in the aril ofLitchichinensisSonn[J].JournalofPlantPhysiology,2013,170(8):731-740.
[11] REN X,ZHANG J.Research progresses on the key enzymes involved in sucrose metabolism in maize[J].CarbohydrateResearch,2013,368:29-34.
[12] LOBO A K M,DE OLIVEIRA MARTINS M,NETO M C L,etal.Exogenous sucrose supply changes sugar metabolism and reduces photosynthesis of sugarcane through the down-regulation of Rubisco abundance and activity[J].JournalofPlantPhysiology,2015,179:113-121.
[13] WANG Y P(王燕平),CHEN Q(陈 勤),ZHOU ZH Q(周志钦),etal.Optimization of AFLP reaction system inCanariumalbum[J].JournalofFruitScience(果树学报),2012,3:39(in Chinese).
[14] ZHOU J,ZHONG G,LIN Z,etal.The effects of bagging on fresh fruit quality ofCanariumalbum[J].JournalofFood,Agriculture&Environment,2012,10(1):505-508.
[15] 林玉芳.福建橄榄[Canariumalbum(Lour)Raeusch]若干功能成分和品质相关指标的研究[D].福州:福建农林大学,2012.
[16] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:202-204.
[17] ZHAO ZH ZH(赵智中),ZHANG SH L(张上隆),XU CH J(徐昌杰),etal.Roles of sucrose-metabolizing enzymes in accumulation of sugars in satsuma mandarin fruit[J].ActaHorticulturaeSinica(园艺学报),2001,28(2):112-118(in Chinese).
[18] QIAO Y X(乔永旭),LIU Q T(刘栓桃),ZHAO ZH ZH(赵智中),etal.Study on the correlation of sugar accumulation and sucrose-metabolizing enzymes during the developing period of muskmelon(Cucumismelon)[J].JournalofFruitScience(果树学报),2004,21(5):447-450(in Chinese).
[19] SUO B H(索滨华),CHEN G(陈 光),WANG D H(王德辉),etal.Sugar accumulation in Net-Melon[J].ActaAgricultuaeNucleatae Sinica(核农学报),1997,11(3):190-192(in Chinese).
[20] VIZZOTTO G,PINTON R,VARANINI Z,etal.Sucrose accumulation in developing peach fruit[J].PhysiologiaPlantarum,1996,96(2):225-230.
[21] WALKER A,HO L,BAKER D.Carbon translocation in the tomato:pathways of carbon metabolism in the fruit[J].AnnalsofBotany,1978,42(4):901-909.
[22] GIAQUINTA R T.Sucrose translocation and storage in the sugar beet[J].PlantPhysiology,1979,63(5):828-832.
[23] KATO T,KUBOTA S.Properties of invertases in sugar storage tissues of citrus fruit and changes in their activities during maturation[J].PhysiologiaPlantarum,1978,42(1):67-72.
[24] MORIGUCHI T,YAMAKI S.Purification and characterization of sucrose synthase from peach(Prunuspersica)fruit[J].Plantandcell physiology,1988,29(8):1 361-1 366.
[25] MORIGUCHI T,SANADA T,YAMAKI S.Seasonal fluctuations of some enzymes relating to sucrose and sorbitol metabolism in peach fruit[J].JournaloftheAmericanSocietyforHorticulturalScience,1990,115(2):278-281.
[26] WANG D F(王德孚),YANG ZH J(杨志军),SUN J M(孙江妹),etal.Difference in soluble sugar accumulation and related enzyme activity of fruits among different pear cultivars[J].JournalofFruitScience(果树学报),2014,31(1):30-38(in Chinese).
[27] MORIGUCHI T,ABE K,SANADA T,etal.Levels and role of sucrose synthase,sucrose-phosphate synthase,and acid invertase in sucrose accumulation in fruit of Asian pear[J].JournaloftheAmericanSocietyforHorticulturalScience,1992,117(2):274-278.
[28] ECHEVERRIA E.Developmental transition from enzymatic to acid hydrolysis of sucrose in acid limes(Citrusaurantifolia)[J].Plant Physiology,1990,92(1):168-171.
[29] WANG H C(王惠聪),HUANG H B(黄辉白),HUANG X M(黄旭明).Sugar accumulation and related enzyme activities in the litchi fruit of‘Nuomici’and‘Feizixiao’[J].ActaHorticulturaeSinica(园艺学报),2003,30(1):1-5(in Chinese).
[30] GONG R G(龚荣高),ZHANG G L(张光伦).Advances in research on sugar metabolism inCitrusfruit[J].JournalofSichuanAgricultralUniversity(四川农业大学学报),2004,21(4):343-346(in Chinese).
[31] LU H Q(卢合全),SHEN F F(沈法富),LIU L X(刘凌霄),etal.Recent advances in study on plant sucrose synthase[J].ChieseAgriculturalScienceBulletin(中国农学通报),2005,21(7):34-37(in Chinese).

