香蒲对不同浓度Pb2+胁迫的生理应答及其细胞超微结构变化
徐义昆,徐小颖,池 源,金银根
(扬州大学 生物科学与技术学院,江苏扬州225000)
水体重金属污染是当前社会环境中较为难以根治的问题之一,对农业生产的持续稳定增长及人类的健康产生了极大的威胁[1],其中铅(Pb2+)是水体污染中最常见也是环境中毒性最强的重金属元素之一。其来源广泛,如采矿、冶炼、化工、电镀、电子、制革等行业,以及民用固体废弃物的不合理填埋和堆放等,都导致土壤和水体中铅的含量增高。重金属在环境中既不能自然降解也不能生物降解,往往富集在水体或沉积在淤泥里,被水生植物吸收,并通过食物链最终损害人类的健康[2-3]。在重金属污染修复技术中,植物修复技术以其治理效果良好、成本低廉且能带来一定的环境效益等优势而备受青睐,而植物修复技术的基础是超富集植物,所以寻找有潜力的超富集植物将也是今后发展的趋势[4]。
香蒲为多年生落叶、宿根性挺水型的单子叶植物,在中国分布广泛,适应性强,生长迅速,生物量大,在净化水体污染方面取得了良好的成效。叶志鸿等[5]以宽叶香蒲(Typhalatifolia)净化塘系统来处理铅/锌矿废水,经5年多的监测结果表明,pH从8.03下降到7.74,总悬浮物去除率达99%,Pb去除率达90%,Zn和Cd去除率为84%,其他金属也有不同程度的降低,水质明显改善。近年来已有香蒲对重金属超富集的研究[6],但其在铅胁迫下的生理应答和细胞超微结构变化尚少见报道。因此,本研究以东方香蒲(TyphaorientalisPresl)为实验材料,通过营养液培养试验,分析了其在不同Pb2+浓度胁迫下Pb的富集量、光合色素含量、膜脂过氧化程度、抗氧化酶活性和细胞超微结构的变化,旨在从不同角度揭示香蒲对Pb2+的响应机理,丰富高等水生植物对重金属胁迫的抗性生理机制资料,并为深入探讨香蒲在重金属污染修复中的应用提供依据。
1 材料与方法
1.1 材料培养
将收集的东方香蒲(TyphaorientalisPresl)种子(取自扬州大学文汇路校区小果园,N32°23′24″、E119°25′4″)于实验室培养箱内进行萌发与培养,昼夜温度25 ℃/20 ℃,光照周期14h/10h,湿度70%,光照度17 600Lx。待植株长至5~7片真叶,将其转入50% Hoagland营养液中继续培养,选取生长状态一致(株高为40cm 左右)的香蒲作Pb2+胁迫处理。
1.2 Pb2+胁迫处理
实验分为5个组,将香蒲分别置于含0、0.25、0.50、1.00 和2.00 mmol·L-1Pb2+的Hoagland营养液中进行急性毒害处理,并同样置于光照培养箱中培养,培养条件同上。处理10d后,用自来水洗净根和叶片后,放入20 mmol·L-1EDTA-Na2交换15min,然后用去离子水洗净,吸水纸吸干,选取相同部位的根和叶用于生理指标的测定。
1.3 生理指标测定和超微结构观察
1.3.1 叶绿素含量 采用分光光度法测定[7]。称取叶片0.2g,放入研钵中,加少量石英砂和95%乙醇,研成匀浆,用95%乙醇定容至8mL,10 000×g离心20min。取上清液测定665、649和470nm 的光密度,分别计算叶绿素a、b含量。
1.3.2 丙二醛的含量 采用硫代巴比妥酸比色法测定[8]。取植物组织0.5g,加入4 mL 20% TCA研磨后10 000×g下离心15min。取1.5mL 上清液与2.5mL 0.5%TBA(溶于20%TCA 中)混合,煮沸30 min,然后迅速冷却,1 800×g 下离心15 min。测定反应液在450、532 和600nm 处的吸光值,计算MDA 含量。
1.3.3 抗氧化酶活性 取0.5g新鲜的香蒲植物组织,加入5 mL 50 mmol·L-1磷酸缓冲液(pH 7.8)进行研磨,匀浆液4 ℃下10 000×g 离心20 min,上清液用于测定抗氧化酶活性。SOD 活性测定采用NBT 光化还原法[9],反应液共3 mL,包括50mmol·L-1磷酸缓冲液(pH 7.8)、130 mmol·L-1甲硫氨酸、750μmol·L-1NBT、20μmol·L-1核黄素、0.1 mmol·L-1EDTA-Na2和酶提取液。光照启动反应,其活性单位定义为:每克鲜重材料中SOD 抑制率达50%时所对应的SOD 量为一个单位(U);POD 活性测定采用愈创木酚方法[10],反应液共3 mL,包括100 mmol·L-1磷酸缓冲液(pH 6.0)、1%愈创木酚、0.4% H2O2和酶提取液。酶液一加入,迅速启动愈创木酚的氧化反应,每隔10s读取反应液在470nm 下的吸光值,连续读数3 min,每分钟吸光值的变化定义为一个酶活性单位(U);CAT 活性测定采用钼酸盐方法测定[11],反应体系为60mmol·L-1磷酸缓冲液(pH 7.4)、32.4 mmol·L-1钼酸铵、65μmol·L-1H2O2、酶液。其活力单位(U)定义为:每克植物材料每秒钟分解1 μmol H2O2的CAT 量。
1.3.4 Pb含量 采用湿消化法测定。精确称取0.2g植物干样于50 mL 烧杯中,加入5 mL 浓硝酸,摇匀后置于电热板(120 ℃)上,渐渐有红棕色气体冒出,待大量红棕色气体消失时再加入1 mL 高氯酸,摇匀,此时调制电热板至150 ℃,待冒白烟结束,若发现烧杯底部有未消解完的样品,重复上述过程至止样品完全消解,消解后溶液澄清,冷却至室温,定溶于50mL的容量瓶。用电感耦合等离子体发 射 光 谱 仪(Optima 7 3 0 0DV,美 国PerkinElmer公司)测定溶液Pb含量。实验均进行3次重复。
1.3.5 超微结构观察 Pb2+处理10d后,从各浓度梯度实验组中取香蒲相同部位的叶片和根,洗净,切成1mm3大小的样块,迅速用2.5%戊二醛固定,丙酮系列脱水,Epon812包埋,超薄切片机切片,切片后用醋酸双氧铀-柠檬酸铅染色,于透射电子显微镜(CM100,荷兰Philips公司)下观察并拍照。
1.4 数据统计分析
实验结果为3次实验的平均值±标准差,数据分析和制图采用Excel和Statistica 6.0统计软件完成。将各生理指标与处理浓度作相关性分析,同时进行数据间的差异显著性检测。
2 结果与分析
2.1 Pb在香蒲叶和根中的积累
由图1可知,当外源施用不同浓度的Pb2+胁迫时,Pb在香蒲根和叶中的积累量均显著高于对照,但叶和根中的积累量和变化幅度、趋势有明显差异。其中,各Pb2+处理组根中的Pb含量与外源Pb2+浓度间呈显著正相关(r=0.896,P<0.05);当外源Pb2+浓度为2.00mmol·L-1时,根中Pb含量高达对照组的332 倍。而相同处理下,叶中的Pb 含量极显著低于根部,并当外源Pb2+浓度为0.50mmol·L-1时达到最大值,此时约是对照的5倍;后随外源Pb2+浓度升高叶片中Pb含量略有下降,但仍显著高于对照组。可见,Pb 主要在香蒲根中大量积累,且积累量与外界环境中Pb2+浓度密切相关。
2.2 Pb2+胁迫对香蒲叶片叶绿素含量的影响
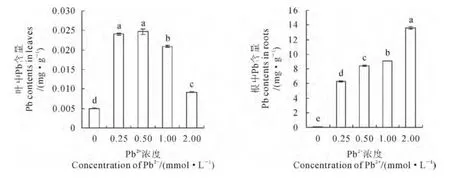
图1 Pb2+胁迫下香蒲叶和根中Pb含量Fig.1 Pb contents in leaves and roots of Typha orientalis Presl under Pb2+stress
图2显示,随外源Pb2+浓度的升高,香蒲叶片中的叶绿素a和叶绿素b含量均呈现先升后降的趋势。其中,在外源Pb2+浓度为0.50mmol·L-1时,叶绿素a和叶绿素b含量均达到其峰值,分别是相应对照的1.11和1.26倍;此后两者均显著下降,当Pb2+浓度增至2.00mmol·L-1时,叶绿素a和叶绿素b含量分别降至对照组76.4%和63.8%,并达到其最低值。各Pb2+处理组间及其与对照间的叶绿素a和叶绿素b含量均差异显著(P<0.05)。
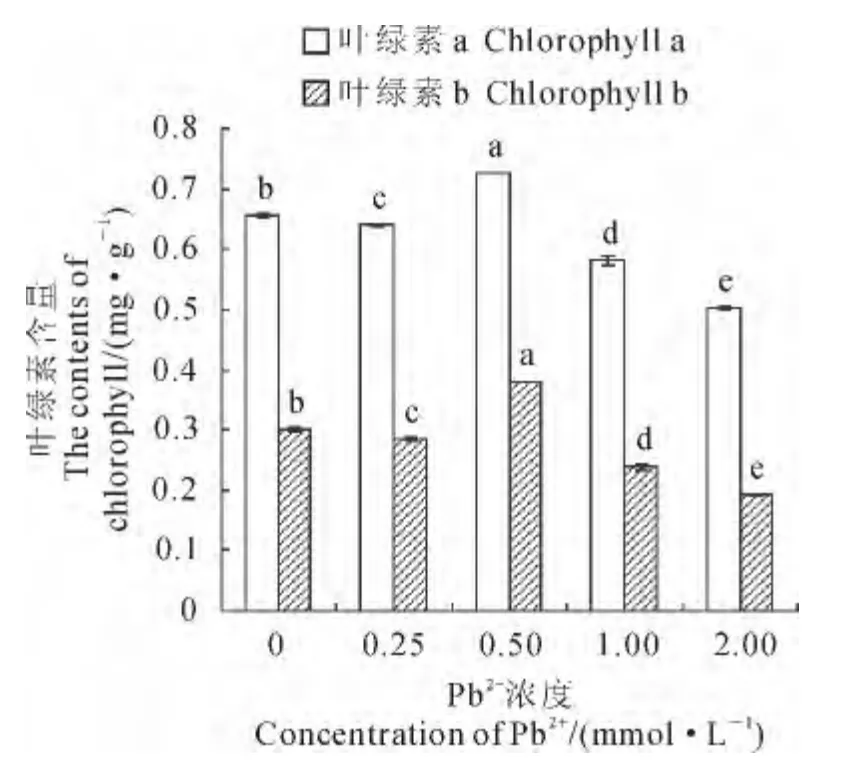
图2 Pb2+胁迫下香蒲叶绿素含量Fig.2 The contents of chlorophyll in T.orientalis Presl under Pb2+stress
2.3 Pb2+胁迫对香蒲抗氧化酶活性和MDA 含量的影响
如图3,A 所示,香蒲叶片中SOD 活性随着外源Pb2+浓度的升高呈现先升后降的变化趋势;当外源Pb2+浓度低于2.00mmol·L-1时,SOD 活性随着外源Pb2+浓度的升高而显著提高,且各Pb2+处理组间的SOD 活性差异显著;在外源Pb2+浓度为1.00mmol·L-1时,SOD 活性升至对照组的4.59倍,并达到其峰值;当外源Pb2+浓度升至2.00 mmol·L-1时,SOD 活性快速大幅下降,但仍略高于对照组。根中SOD 活性随外源Pb2+浓度表现出降-升-降的趋势,且除1.00mmol·L-1Pb2+处理组外均显著低于对照组;当外源Pb2+浓度为0.50 mmol·L-1时,SOD 活性降至其最低值,比对照显著下降了40.9%。
同时,图3,B、C 显示,在香蒲叶片中,各Pb2+处理组的CAT 和POD 活性均随Pb2+胁迫浓度的升高表现出先降低后升高的趋势,且均显著低于对照组;两种酶活性分别在外源Pb2+浓度为0.25和0.50mmol·L-1时降至其最低值,分别比相应对照组显著降低19.2%和50.4%。而在根中,各Pb2+处理组CAT和POD活性随Pb2+胁迫浓度的增大呈现先升高后降低的趋势,并分别在外源Pb2+浓度为0.25和0.50mmol·L-1时达到其峰值,此时分别比对照组显著提高58.0%和66.0%;根中CAT活性除峰值外均低于对照,而其POD 活性均高于对照。在各处理浓度下,叶片中CAT 活性均远高于根中,而其POD 活性却均远低于根中。
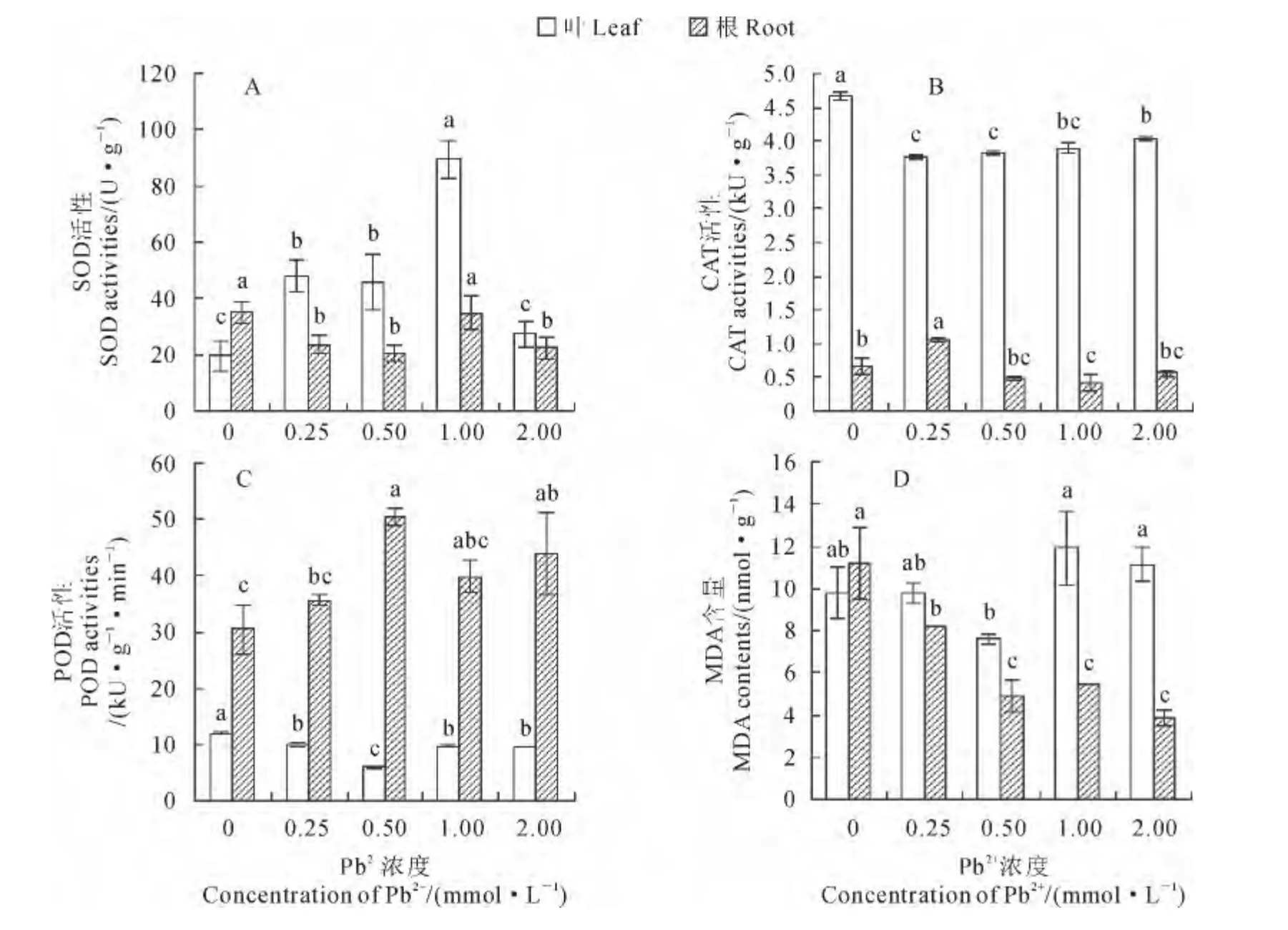
图3 Pb2+胁迫下香蒲叶和根抗氧化酶活性及MDA 含量的变化Fig.3 The antioxidase activities and MDA content in T.orientalis Presl leaves and roots under Pb2+stress
另外,由图3,D 可以看出,随着外源Pb2+胁迫浓度的增大,各Pb2+处理组叶片中的MDA 含量有先降后升的趋势,但与对照比变化均不显著;而根中MDA 含量随着外源Pb2+浓度的增高而呈下降趋势,且各Pb2+处理组均显著低于对照,如当Pb2+浓度增至2.00mmol·L-1时,其MDA 含量比对照显著降低65.5%,并降至其最低值。
以上结果说明,香蒲叶和根中的抗氧化酶对Pb2+胁迫的响应不同,由于抗氧化酶阈值的限制,3种主要的抗氧化酶(SOD、CAT 和POD)最大程度地消灭了部分活性氧,但是过剩的活性氧(ROS)仍然导致细胞膜膜脂过氧化。而且,香蒲根对Pb2+胁迫的敏感程度远远大于叶片。
2.4 Pb2+胁迫对香蒲叶和根细胞超微结构的影响
由电镜观察发现,随着Pb2+处理浓度的增加,香蒲叶和根细胞超微结构的损伤程度逐渐加重。在叶片细胞中,对照组叶绿体呈规则的长椭圆形,类囊体和被膜结构清晰,基质片层排列整齐;线粒体脊突呈管状,间质浓密(图版Ⅰ,1)。当外源施用0.50 mmol·L-1Pb2+处理时,叶细胞中的线粒体被膜出现破裂,脊突排列无序,内部出现空泡化现象;叶绿体基粒类囊体开始膨胀,基质片层发生扭曲,被膜结构模糊(图版Ⅰ,2、3);当Pb2+浓度高达2.00mmol·L-1时,叶细胞中的叶绿体双层膜局部出现破损,基粒类囊体膨胀程度加剧,内部结构趋于瓦解(图版Ⅰ,4);核膜局部破裂,核仁消失,核内容物成无序状态(图版Ⅰ,5)。
在根细胞中,对照组的核膜完整,核仁清晰,染色质分布均匀;线粒体结构完整规则(图版Ⅰ,6)。当外源施用0.50mmol·L-1Pb2+处理时,线粒体被膜破裂,出现轻度的空泡化现象(图版Ⅰ,7)。当外源Pb2+浓度升至1.00mmol·L-1时,核膜出现破裂,核仁已消失,染色质凝集(图版Ⅰ,8)。当外源Pb2+浓度高达2.00mmol·L-1时,核膜已消失不见,染色质高度凝集;线粒体空泡化程度加剧(图版Ⅰ,9)。
3 讨 论
Baker等[12]研究多种植物不同组织的重金属含量时发现,不同植物对各种重金属的吸收、迁移和积累存在差异。Pb2+主要滞留在根部,向地上部分迁移的速率较慢[13]。在本实验中,随着外源Pb2+浓度的升高,Pb主要在香蒲根部大量积累,而同一浓度处理下,叶片中Pb含量显著低于根部,这与上述研究结论一致。
导致Pb在香蒲体内大量积累的原因可能与细胞膜的损伤有关。丙二醛(MDA)是膜脂过氧化的最终产物之一,常被作为膜损伤的指示指标[14]。正常情况下,植物体内活性氧的产生与清除处于动态平衡,并不会对植物产生伤害,但当植物遭受重金属胁迫时,其体内过剩的活性氧(ROS)会攻击质膜上的多聚不饱和脂肪酸,引起膜脂过氧化,导致产生大量MDA。目前,大多数研究结果表明,植物体在Pb、Cu和Cd等重金属胁迫下,MDA 含量均会有不同程度的增加[15-17]。而本实验表明,Pb2+胁迫后根中MDA 含量表现为随着Pb2+浓度的升高而呈下降趋势。推测这是由于Pb2+在根部大量积累,引发氧化胁迫,致使根细胞膜上的多聚不饱和脂肪酸发生过氧化损伤而含量明显降低[18-19],从而导致根部的MDA 含量随Pb2+浓度的升高而降低。Dhir等[20]对金鱼藻(Ceratophyllumdemersum)、无根萍(Wolffiaarrhiza)和黑藻(Hydrillaverticillata)进行Cd处理,以及Xu 等[21]对水花生(Alternantheraphiloxeroides)愈伤组织进行Cu处理后也发现MDA 含量下降。
为了抵御重金属胁迫引起的氧化胁迫,植物体通过提高抗氧化酶的活性来维持植物体内ROS产生和清除的动态平衡,植物体中常见的抗氧化酶有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT),它们组成了一个有效的ROS 清除系统[22-23]。SOD 将O-·2歧化成H2O2,再由CAT 和POD 将H2O2分解成H2O 和O2,从而阻止O-·2和H2O2的积累[24]。在本实验中,香蒲叶片中的SOD活性随Pb2+胁迫浓度的升高逐渐提高,这是植物的应激保护机制;当Pb2+胁迫浓度高达2.00mmol·L-1时,由于SOD 阈值的限制,其活性略有下降,但仍高于对照组。这与Cd2+胁迫下玉豆(Phaseolus vulgarisL.)[25]SOD 活 性 变 化 趋 势 一 致。Pb2+胁迫下香蒲叶片中CAT 和POD 活性较对照均显著下降,这可能是由于在Pb2+胁迫下叶片中CAT 和POD 阈值较低,且细胞器结构已损伤所致。在香蒲根组织中,Pb2+胁迫下的SOD 活性较对照均下降,CAT 和POD 活性均呈现先上升后下降的趋势,这与叶片中的酶活性变化不同,推测原因可能是Pb在根和叶片中的积累量不同引起的,叶片中清除H2O2的关键酶是CAT,而根组织中则是POD。
重金属胁迫下,植物叶片失绿是一种普遍现象,而失绿主要是细胞叶绿素含量下降的表现,因此叶绿素含量的变化在一定程度上能够反映植物受毒害的程度[26]。本研究中,香蒲叶绿素含量随着Pb2+浓度的升高呈现先上升后下降的趋势。这表明,在较低浓度Pb2+胁迫下,香蒲叶中的叶绿素含量应激性地升高,表现出一定的Hormesis效应[27];高浓度Pb2+胁迫导致叶绿素含量下降,其主要原因可能是Pb2+积累抑制叶绿素合成过程所必需的原叶绿素还原酶(protochlorophyllide reductase)活性,并减少氨基酮戊二酸(aminolaevulinic acid)的合成[28],或是Pb2+能直接破坏叶绿体结构和干扰植物对矿质元素的吸收和转移[29]。Kupper等[30]研究表明,Pb2+可以直接取代叶绿素分子中的Mg2+,破坏叶绿素分子结构,从而抑制其生理功能。叶绿体结构的破坏可以从本实验的电镜照片中证实,在较低浓度(0.50 mmol·L-1)的Pb2+胁迫下,叶绿体结构已出现损伤,表现为叶绿体膨胀,被膜出现破损;当胁迫浓度升高至2.00mmol·L-1时,叶绿体的损伤加剧,其内部的基质和基粒已变得模糊不清,叶绿体膨胀程度和被膜的破损程度加剧。因此,叶绿素含量的下降与叶绿体结构遭到破坏有直接关系[31]。
细胞是生物结构和功能的基本单位。植物在长期的演化过程中形成了与环境相适应的精细超微结构,作为其进行正常生理代谢的基础。在逆境下,细胞结构的改变是植物一系列生理活动综合反应的细胞学基础[32]。通过对Pb2+胁迫下的香蒲细胞超微结构的观察发现,随着Pb2+胁迫浓度的升高,香蒲根和叶细胞的膜系统损伤逐渐加重,低浓度(0.50 mmol·L-1Pb2+)胁迫时,最初表现为叶绿体开始膨胀,线粒体内腔出现轻度空泡化,叶绿体和线粒体被膜局部破裂;高浓度(1.00 和2.00 mmol·L-1Pb2+)胁迫时,叶绿体膨胀加剧,类囊体已解体,线粒体内腔高度空泡化,且细胞核膜出现破裂,核仁消失,染色质出现凝集。Pb2+胁迫对香蒲细胞中叶绿体、线粒体和细胞核的结构造成不可逆的损伤[33],影响了正常的代谢过程中的各种酶活性,破坏了各项正常生命活动的有序进行。
综上所述,不同浓度的外源Pb2+处理引起Pb在香蒲叶和根中大量积累(主要富集在根部),Pb本身磁催化的特殊功效[34]引起的氧化胁迫导致膜系统的损伤,叶片光合色素含量下降,抗氧化酶系统(SOD、CAT、POD)紊乱,细胞超微结构破坏,致使香蒲生理代谢失衡并导致其最终衰亡。在本研究的基础上,今后的工作应结合分子生物学技术,通过高通量转录组学测序分析,从基因与蛋白水平筛选香蒲抵抗Pb2+胁迫的抗性基因,并通过Pb2+对代谢途径的影响,研究Pb2+胁迫的作用机理,为深入探讨香蒲在重金属污染修复中的应用提供理论依据。
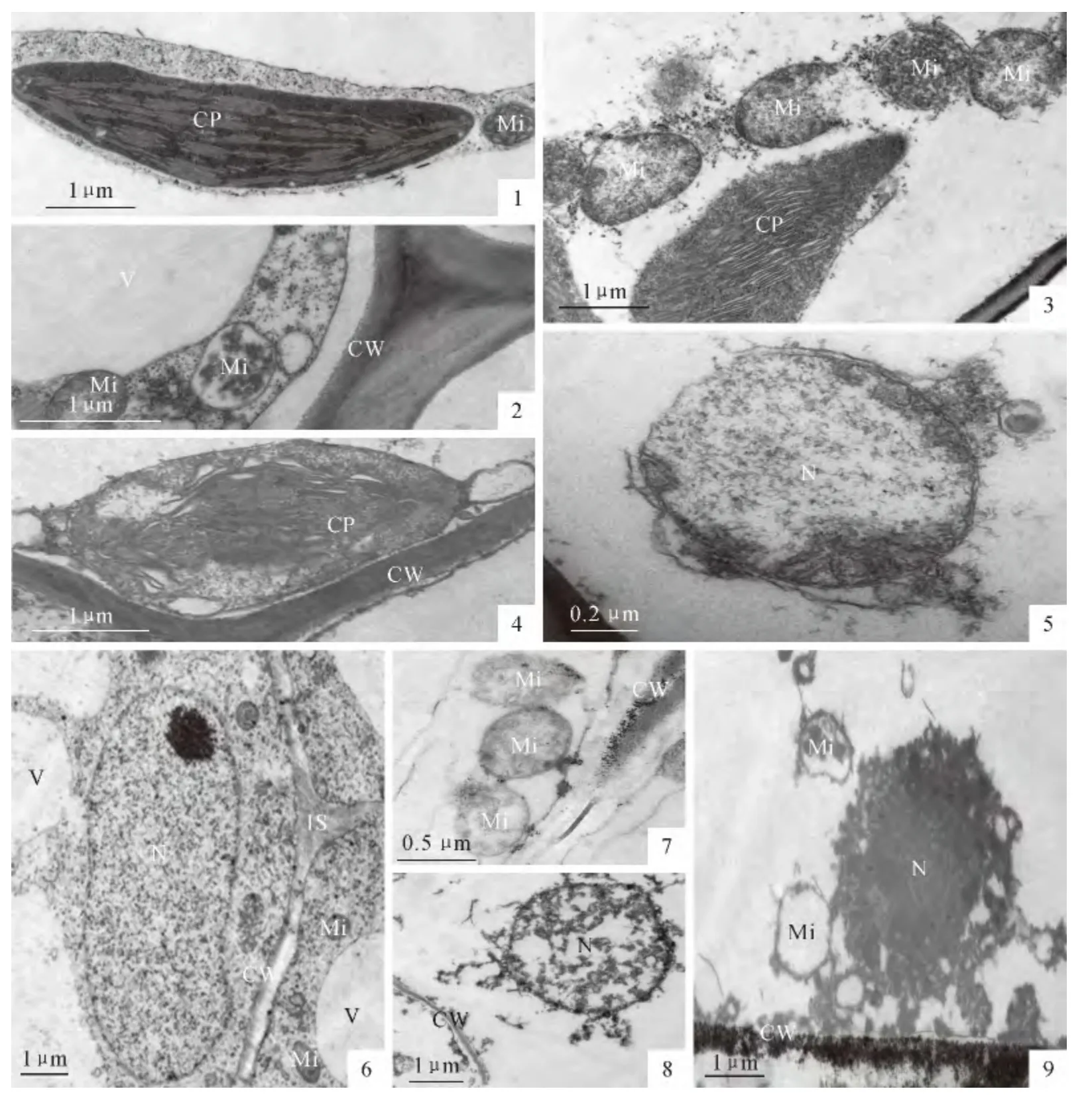
图版Ⅰ Pb2+胁迫下香蒲叶片和根部细胞亚显微结构的变化PlateⅠ Submicroscopic structure of leaf and root cells of Typha orientalis Presl under Pb2+stress
[1] PENCE N S,LARSEN P B,EBBS S D,etal.The molecular physiology of heavy metal transport in the Zn/Cd hyperaccumulatorThlaspi caerulescens[J].NationalAcadSciences,2000,97(9):4 956-4 960.
[2] HUANG H G(黄化刚),LI T X(李廷轩),YANG X E(杨肖娥),etal.Research advances in plant lead tolerance and detoxification mechanism[J].Chin.J.Appl.Ecol.(应用生态学报),2009,20(3):696-704(in Chinese).
[3] 孙铁珩,周启星,李培军.污染生态学[M].北京:科学出版社,2001.
[4] HAN Y L(韩玉林).Effects of Pb and NaCl on the growth and physiological response ofIrishalophila[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2008,28(8):1 649-1 653(in Chinese).
[5] YE ZH H(叶志鸿),CHEN G ZH(陈桂珠),LAN CH Y(蓝崇钰),etal.Effect of treating Pb/Zn mine wastewater withTyphalatifoliapurification pond system[J].Chin.J.Appl.Ecol.(应用生态学报),1992,3(2):190-194(in Chinese).
[6] LI Y L,LIU Y G,LIU J L,etal.Effects of EDTA on Lead uptake byTyphaorientalisPresl:a new lead-accumulating species in Southern China[J].BEnvironContamTox,2008,81(1):36-41.
[7] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[8] HEATH R L,PACKER L.Photoperoxidation in isolated chloroplasts:I.kinetics and stoichiometry of fatty acid peroxidation[J].Arch Biochem.Biophys.,1968,125(1):189-198.
[9] STEWART R R C,BEWLEY J D.Lipid peroxidation associated with accelerated aging of soybean axes[J].PlantPhysiol.,1980,65(2):245-248.
[10] MAEHIY A C.Plant peroxidase[J].MethodEnzymol,1955,2:801-813.
[11] KARSTEN U,FRANKLIN L A,LUNING K,etal.Natural ultraviolet radiation and photosynthetically active radiation induce formation of mycosporine-like amino acids in the marine macroalgaChondruscrispus(Rhodophyta)[J].Planta,1998,205(2):257-262.
[12] BAKER A J M,WALKER P L.Ecophysiology of Metal Uptake by Tolerant Pants[M]//in:SHAW A J(Ed.),Heavy Metal Tolerance in Plants.Evolutionary Aspects.Boca Raton FL:CRC Press,1989:155-177.
[13] GUPTA D K,NICOLOSO F T,SCHETINGER M R C,etal.Antioxidant defense mechanism in hydroponically grownZeamaysseedlings under moderate lead stress[J].J.HazardMater.,2009,172(1):479-484.
[14] 段文芳.镉胁迫下红树植物桐花树和红海榄生理生化特性的研究[D].桂林:广西师范大学,2008.
[15] MALAR S,VIKRAM S S,FAVAS P J C,etal.Lead heavy metal toxicity induced changes on growth and antioxidative enzymes level in water hyacinths[Eichhorniacrassipes(Mart.)][J].Bot.Stud.,2014,55:54.
[16] SUN Y B,ZHOU Q X,Wang L,etal.Cadmium tolerance and accumulation characteristics ofBidenspilosaL.as a potential Cd-hyperaccumulator[J].J.HazardMater,2009,161(2-3):808-814.
[17] YAN Z Z,LI X Z,CHEN J,etal.Combined toxicity of cadmium and copper inAvicenniamarinaseedlings and the regulation of exogenous jasmonic acid[J].EcotoxEnvironSafe,2015,113:124-132.
[18] JONES G J,NICHOLS P D,JOHNS R B,etal.The effect of mercury and cadmium on the fatty acid and sterol composition of the marine diatomAsterionellaglacialis[J].Phytochemistry,1987,26(5):1 343-1 348.
[19] GUPTA M,SINHA S,CHANDRA P.Copper-induced toxicity in aquatic macrophyte,Hydrillaverticillata:effect of pH [J].Ecotoxicology,1996,5(1):23-33.
[20] DHIR B,SHARMILA P,SARADHI P P.Hydrophytes lack potential to exhibit cadmium stress induced enhancement in lipid peroxidation and accumulation of proline[J].Aquat.Toxicol.,2004,66(2):141-147.
[21] XU X Y,SHI G X,WANG J,etal.Copper-induced oxidative stress in alternantheraphiloxeroides callus[J].PlantCellTiss.Org.,2011,106(2):243-251.
[22] CHRIS B,MARC V H,DIRK I.Superoxide dismutase and stress tolerance[J].Ann.Rev.PlantPhysiol.PlantMol.Biol.,1992,42(1):83-116.
[23] GUSMAN G S,OLIVEIRA J A,FARNESE F S,etal.Mineral nutrition and enzymatic adaptation induced by arsenate and arsenite exposure in lettuce plants[J].PlantPhysiol.Bioch.,2013,71:307-314.
[24] FECHT-CHRISTOFFERS M M,HORST W J.Does apoplastic ascorbic acid enhance manganese tolerance ofVignaunguiculataandPhaseolusvulgaris?[J].JPlantNutrSoilSc,2005,168(4):590-599.
[25] LI D Q(李冬琴),CHEN G K(陈桂葵)ZHENG H(郑 海),etal.Effects of cadmium on growth and antioxidant enzyme activities of two kidney bean(PhaseolusvulgarisL.)cultivars[J].J.Agro-EnvironSci.(农业环境科学学报),2015,34(2):221-226(in Chinese).
[26] LI ZH ZH(李铮铮),WU J(伍 钧),TANG Y(唐 亚),etal.Effect of Pb,Zn and their interactions on the chlorophyll content and antioxidant enzyme systems ofHouttuyniacordataThunb[J].ActaEcologicaSinica(生态 学 报),2007,27(12):5 441-5 446(in Chinese).
[27] LIU ZH L(刘周莉),HE X Y(何兴元),CHEN W(陈 玮).LonicerajaponicaThunb.——a newly discovered Cd hyper-accumulator[J].EcologyandEnvironmentalSciences(生态环境学报),2013,22(4):666-670(in Chinese).
[28] PRASAD D D K,PRASAD A R K.Effect of lead and mercury on chlorophyll synthesis in mung bean seedlings[J].Phytochemistry,1987,26(4):881-883.
[29] 王焕校.污染生态学基础[M].昆明:云南大学出版社,1990:71-148.
[30] KUPPER H,KUPPER F,SPILLER M.Environmental relevance of heavy metal-substituted chlorophylls using the example of water plants[J].J.Exp.Bot.,1996,47(2):259-266.
[31] ZHANG L L(张乐乐),SHI G X(施国新),WANG J(王 娟),etal.Toxic of chromium(Cr6+)on the callus ofAlternantheraphiloxeroides[J].Guihaia(广西植物),2011,31(3):377-382(in Chinese).
[32] LI D H(李大辉).Effects of lead polluted water on activities of superoxide dismutase,peroxidase and ultrastructure in leaves ofTrapabicornisseedlings[J].ChinaEnvironmentalScience(中国环境科学),2009,29(2):136-141(in Chinese).
[33] DING CH X(丁春霞),SHI G X(施国新),XU Q S(徐勤松),etal.Physiological and structural responses ofHyhrocharisdubialeaves to different concentrations of Pb2+stress[J].Guihaia(广西植物),2009,29(6):768-773(in Chinese).
[34] 王 梦.铅胁迫下茶树根细胞壁多糖的响应机制初探[D].杭州:浙江大学,2014.

