《弱电解质的电离》导学案
马俊瑞

摘 要:本节课主要在教师的引导下以学生活动为主,体现新课改中以教师为主导,学生为主体的教学理念。课堂以演示实验为基础,对实验现象采取合作探究的学习方式,引导学生发现和解决问题,体会化学知识的建构过程,认识知识的本质。整个教学设计力求既要符合学生的实际情况,又要符合新课改的教学理念。
关键词:弱电解质;电离
中图分类号:G632 文献标识码:B 文章编号:1002-7661(2015)09-278-02
一、教学目标
1、知识与技能
(1)通过“小灯泡实验”和同浓度下盐酸、醋酸pH值的测定,理解强、弱电解质在水溶液中电离程度的差异及原因。
(2)在化学平衡概念的基础上理解电离平衡概念,自我总结电离平衡的特征,画出电离平衡的v-t图像。
(3)以CH3COONa对CH3COOH电离平衡影响的实验为基础,学会运用电离平衡原理解释弱电解质在水溶液中的电离情况。
(4)通过对强、弱电解质的认识,分析同浓度、同体积的盐酸、醋酸分别与过量的Mg反应;同pH值、同体积的盐酸、醋酸分别与过量的Mg反应的差异与原因。
2、过程与方法
(1)通过强、弱电解质概念的学习,掌握学习概念性知识的常用方法:归纳法和演绎法。
(2)通过合作学习、活动与探究,学习科学探究的一般方法,培养提出问题、探究问题和解决问题的能力。
情感、态度和价值观:认识电离理论对实践的指导作用。
二、重、难点
【重点】弱电解质的电离平衡
【难点】弱电解质电离平衡的影响因素
三、教學活动
活动一:回忆温故
活动三:迁移应用
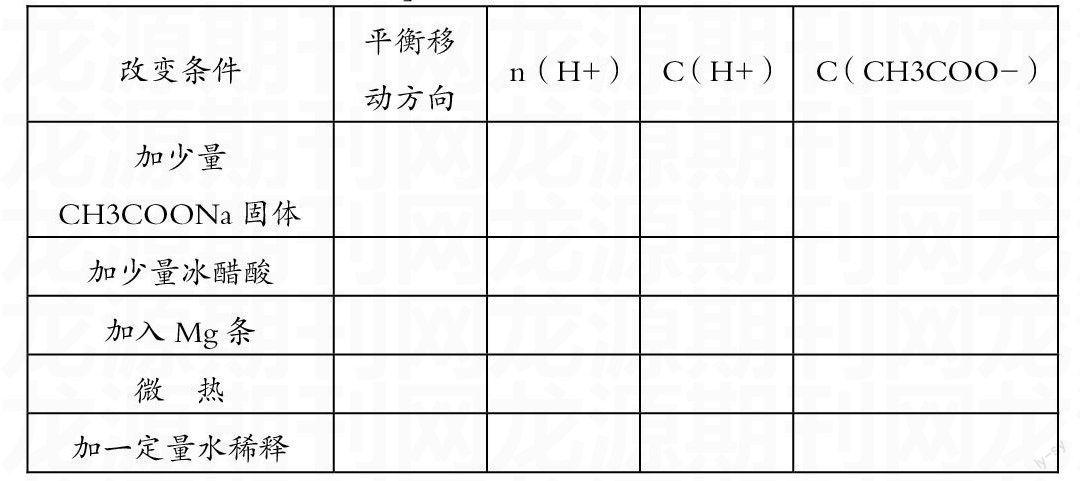
实验三:取实验一中HCl 、CH3COOH溶液,向HCl 中加入0.5gNaCl固体,向CH3COOH中加入0.5gCH3COONa固体,充分搅拌,溶解后,再测其pH值,观察数值的变化。
现象:____________________________
【问题1】两次测量pH值,说明什么问题?
【问题2】将100ml蒸馏水与1ml冰醋酸混合,配成溶液,请思考:
(1)开始时分子电离成离子的速率(V电离)、离子结合成分子的速率(V结合)如何变化?
(2)当V电离=V结合时,达到一种什么样的状态?[该状态属于化学平衡状态的一种
(3)请根据化学平衡的知识,用自己的语言描述电离平衡的定义、特征,并画出v-t图像。
2、在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
3、下列叙述中正确的是( )
A、物质的溶解过程,实质上就是其电离过程
B、二氧化硫的水溶液能导电,所以二氧化硫是电解质
C、1 L、0.1 mol·L-1的H2SO4溶液中含有0.2 mol的H+
D、1 L 、0.2 mol·L-1的H2S溶液中含有0.4 mol的H+
4、已知0.1 mol·L-1的醋酸溶液中存在电离平衡: CH3COOH CH3COO-+H+,要使溶液中C(H+)/C(CH3COOH)的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A、①② B、①③ C、②④ D、③④
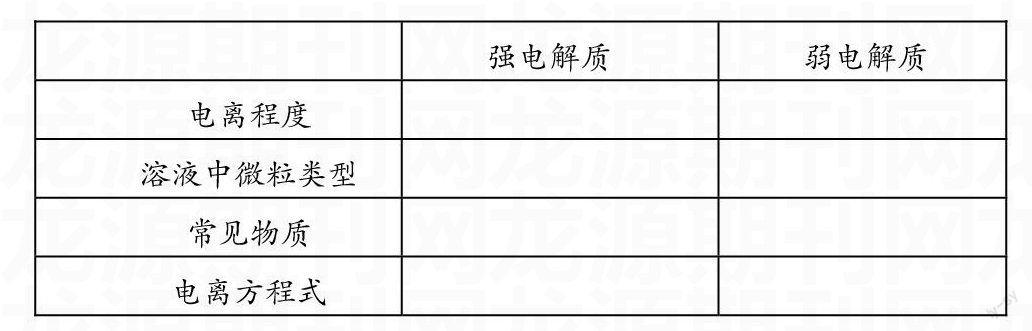
课堂小结:本节课我们通过对几个实验现象以及由实验现象引发的问题进行探讨学习,体验了强电解质、弱电解质与弱电解质的电离平衡概念的形成过程,了解了弱电解质电离平衡的建立、特征、V—t图像,掌握了外界条件对弱电解质电离平衡的影响。
设计思路:整个课堂教学分为以下几个教学环节:1、温习回顾电解质、非电解质的分类,唤醒学生沉睡的思维细胞。2、用导电计测量同浓度、同体积不同溶液的导电性强弱,吸引学生的注意力,紧接着用该溶液进行“小灯泡”实验,进一步证明溶液导电性的差异,引导学生从中分析原因,提出问题:为什么同浓度、同体积的溶液导电性会有差异。如此设计既能让学生感受化学实验的魅力,又能调动学生的积极性,为随后的学习创建良好的课堂气氛。3、测量溶液的pH值,认识pH计的方便、快捷,解决问题:因溶液中自由移动离子浓度的大小不同,所以导电性不同。同时又提出新的问题:为什么同浓度、同体积的盐酸与醋酸中C(H+)不同。很自然的引入本节课的重点,不会让学生产生心理负担。4、由学生合作完成实验3的内容,解决实验2中的疑问,建立强、弱电解质的概念。如此,既完成了新课标的要求,又可以避免学生产生厌学的心理情绪,活跃课堂气氛,同时也为解决本节课的难点打下伏笔。5、学生针对实验3的现象进行合作探究学习,解决难点:外界条件对弱电解质电离平衡的影响。鼓舞学生的信心。6、通过知识拓展,拔高学生的水平、开拓思路。

