山羊腰椎间盘退变微创动物模型研究
谢林,顾军,唐田,陈舰舰
(江苏省中西医结合医院骨科,江苏 南京 210028)
实验研究
山羊腰椎间盘退变微创动物模型研究
谢林,顾军,唐田,陈舰舰
(江苏省中西医结合医院骨科,江苏 南京 210028)
目的 腰椎间盘退变动物模型是研究人体椎间盘退变的机制及治疗方法中不可或缺的部分,目前腰椎间盘退变模型研究以小型动物为主,其椎间盘解剖结构与人体差异明显。山羊腰椎间盘解剖结构与人体相似,本研究用微创手术方法建立山羊腰椎间盘损伤退变模型,探索一种新的大型动物腰椎间盘退变造模方法。方法 20只成年波尔多山羊随机分为腰椎微创造模组(A组)、腰椎假手术组(B组)。术前A、B组使用MRI测量腰椎间盘原始数值,腰椎微创造模组(A组)使用全内窥镜腰椎微创手术方法制造腰椎间盘退变模型,腰椎假手术组使用相同操作而不损伤腰椎间盘。术后2个月复查腰椎MRI,动物空气栓塞处死后获取腰椎间盘标本,并进行组织固定、切片、染色。术前及术后按Videman椎间盘退变等级、Zhang Y的山羊动物椎间盘组织退变分级标准比较两组之间腰椎MRI影像学及细胞组织形态学评分,并用反转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,rt-PCR)法检测腰椎间盘髓核组织中缺氧诱导因子(hypoxia inducible factor-1,HIF-1)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)、核因子-κB(nuclear factor-κB,NF-κB)、白介素-1(interleukin-1,IL-1)基因表达差异。结果 腰椎微创造模组(A组)、腰椎假手术组(B组)经比较,MRI影像学评分差异明显,差异具有统计学意义(P<0.05);细胞组织形态评分差异明显,差异具有统计学意义(P<0.05)。HIF-1基因表达在两组之间差异显著,差异具有统计学意义(P<0.01);TNF-a、TGF-β、IL-1基因表达差异具有统计学意义(P<0.05);NF-κB表达在两组之间差异无统计学意义(P>0.05)。结论 腰椎微创造模组(A组)、腰椎假手术组(B组)腰椎间盘MRI及组织形态学差异显著,从影像学及组织学上说明全内窥镜微创造模法成功建立波尔多山羊腰椎间盘退变动物模型。两组山羊HIF-1、TNF-a、TGF-β、IL-1基因表达差异从分子角度证明山羊腰椎间盘退变微创动物模型造模成功。
腰椎间盘退变;山羊动物模型;微创手术
腰椎间盘退变引起的相关病症影响着人们的生活,而腰椎间盘退变动物模型是研究人体椎间盘退变的机制及治疗方法中不可或缺的部分。目前,关于腰椎间盘退变动物模型的文献报道较多,备选动物种类及动物模型制作方法繁多,但以鼠、兔居多,其椎间盘解剖结构与人体结构差异明显,并且其椎间盘体积较小,不利于椎间盘组织工程修复、椎间盘细胞再生等研究,而山羊腰椎间盘解剖结构与人体较为相似。本研究用腰椎微创手术方法建立腰椎间盘退变模型,探索一种新的大型腰椎间盘退变动物造模方法。
1 资料与方法
1.1 实验器材与动物造模 选用20只健康雌性成年波尔多山羊(江苏省农科院羊养殖基地提供),体重36~41 kg,平均为38.5 kg,采用随机数列分为2组,每组10只,分别为腰椎微创造模组(A组)、腰椎假手术组(B组)。
实验器材:德国 Richard Wolf全内窥镜操作系统(25°视角,长度165 mm,直径6.9 mm×5.6 mm,工作通道直径4.1 mm)、常规骨科手术器械、德国Richard Wolf胸腰椎全内窥镜脊柱手术器械(抓钳、篮钳、探针)、美国KARL STORZ视频影像系统、德国Richard Wolf手术冲洗泵系统、西门子公司C型移动式X线机、Ellman美国双频射频机(4 MHz)、美国Thermo Scientific公司702型超低温冰箱、日本Sanyo公司MPR-1410恒温保存箱、日本Sanyo公司MLS-3780高压蒸汽灭菌锅、Eppendorf 5415D小型台式高速离心机、美GE核磁共振成像仪、3L袋装生理盐水(每袋盐水中加入庆大霉素16万单位)。美国Milli-Q Biocel超纯水器-2.5 mm克氏针数枚。术前常规骨科器械采用高温消毒,全内窥镜脊柱手术器械采用低温消毒。
实验药品及试剂:速眠新Ⅱ(10*1.5 mL,吉林省华牧动物保健品有限公司生产)、鹿醒宁(10*1.5 mL,吉林省华牧动物保健品有限公司生产)、盐酸利多卡因(5 mL︰100 mg,山东华鲁制药有限公司提供)、注射用青霉素纳(160万单位,山东鲁抗医药股份有限公司生产)、10%中性甲醛(江苏省中医药研究院病理科配制)、反转录试剂盒(Thermo公司生产)、氯仿(西陇化工股份有限公司生产)、异丙醇(西陇化工股份有限公司生产)、Trizol(Invitrogen公司生产)、75%酒精(西陇化工股份有限公司生产)、SBYR Green预混试剂(Thermo公司)。
实验动物手术前一天开始禁食,术前肌注陆眠宁Ⅱ(0.2 mL/kg)(长春军需大学研究所提供)行全身麻醉。麻醉成功后,进行MRI术前检查,记录实验动物腰椎基础信号。腰椎手术区域备皮,造模组取左侧卧位,常规手术消毒、铺巾,C型臂机下定位L3~4及L4~5椎间隙,连接双频射频机、全内窥镜、视频监测系统、及手术冲洗泵系统。自L3~4,L4~5椎体前外侧用皮刀切开约0.6 cm切口,垂直插入开路锥,经C型臂机透视正侧位确定位置后,逐渐向椎间盘垂直插入套筒,C型臂机透视再次确认位置后放置全内窥镜工作系统,在视频监视下用射频探头止血并烧灼阻碍视野的脂肪组织,显露椎间盘,以探针探入,证实是椎间盘后将2.5 mm克氏针插入,用榔头缓慢敲入1 cm,拔除克氏针,彻底止血,拔除套筒,缝合切口,敷料覆盖,术毕。腰椎微创造模组(A)实验动物术中出血少,手术过程顺利。腰椎假手术组(B组)手术过程无克氏针损伤椎间盘步骤,其余与造模组相同。
各组实验羊苏醒后均能自行行走,生命体征稳定,四肢活动正常,术后6 h后予正常饮食,肌注青霉素80万U,连续3 d。术后密切观察切口渗血渗液、饮食、四肢活动及大小便情况,切口处红霉素软膏预防感染。
1.2 标本处理与检测方法
1.2.1 标本采集及制备 两组60 d后,在全麻下再次对实验羊的腰椎摄MRI,与术前的MRI进行比较,取耳缘静脉予空气栓塞处死,取出完整腰椎,剔除椎体周围肌肉、韧带,保留L1~L6椎体。截取包括腰椎间盘及其两侧1/3椎体,祛除两侧椎弓根、椎板及周围软组织,取部分椎间盘标本以10%中性甲醛浸泡,固定1 周后,然后用10%稀硝酸常温下脱钙,脱钙至针尖能扎进终板为准。脱钙后酒精梯度脱水,二甲苯透明,石蜡块包埋,切片机切片,切片后行HE染色。剩余椎间盘标本30 min内放入-80℃冰箱内保存以备聚合酶链式反应(Polymerase chain reaction,PCR)用。
1.2.2 MRI评估 由两位不参与手术的骨科医生和两位放射科医生进行腰椎间盘退变程度MRI检测,通过对实验动物羊术前、术后2个月腰椎矢状位、冠状位、水平位MRI检测对比,并计算Kappa值。根据Videman椎间盘退变等级对腰椎间盘的退变程度进行评估(见表1)。

表1 Videman椎间盘退变等级
1.2.3 组织学评估 根据Zhang Y的山羊动物椎间盘退变分级标准(见表2)从四方面评估椎间盘退变程度:a)纤维环与髓核交界处结构;b)纤维环组织结构;c)髓核组织外基质形态;d)髓核细胞结构及形态。分数为0-2分,正常组织为0分,轻微退变为1分,重度退变为2分。观察切片的显微镜为Olympus BX-60。

表2 Zhang Y的山羊动物椎间盘退变分级标准
1.2.4 基因表达检测
1.2.4.1 RNA的提取 所有实验用品经双蒸馏水清洗,高温蒸汽消毒,烘箱烘烤24 h处理。迅速剪碎取出的新鲜髓核组织标本,在研磨皿中加入适量液氮,待液氮挥发后,用研磨棒将髓核组织剪碎。加入TRIzol试剂1 mL(组织块总体积未超过TRIzol试剂体积的10%),用移液枪头充分吹打该髓核组织样品,移入1.5 mL EP管中,将上述EP放置室温下5 min,等待核糖核酸和蛋白分离充分,再向每1 mLTRIzol试剂用量的匀浆液中加入0.2 mL氯仿,盖紧管盖,后手动剧烈摇晃15 s,溶液呈乳粉红色状,无分层现象。最后室温静置2~3 min,放入4℃离心机,于 10 000 rpm离心10 min;取出EP管,见样品分为三层:无色清水相的上层、乳白色的中间层及粉红色的有机相下层。只吸取上层水相(无色)加入到新EP管中,吸入约200 μL;不必过多吸取上清液,防止吸入DNA和蛋白杂质(中间层,白色);上清液加入200 μL的异丙醇,盖紧管盖,轻轻摇匀;于室温下静置10 min,待RNA充分沉淀(为减少RNA降解,此步骤可省略)再次将混合溶液放入4℃离心机,于 10 000 rpm离心10 min;离心后,本次将上清弃除(注意不丢弃沉淀),每管加入1 mL 75%乙醇润洗,盖紧管盖,轻轻晃动试管,以去除残留的异丙醇和盐份,于4℃离心机下7 500 rpm离心5 min;将上清弃除(注意不丢弃沉淀),打开管盖,将RNA沉淀干燥(室温挥发),未让RNA沉淀不可完全干燥,否则难以溶解;将RNA沉淀溶解于50 μL的无酶(RNase)水中,待完全溶解后取少量进行电泳和OD值检测,后于-80℃保存。
1.2.4.2 引物设计 通过查阅NCBI数据库资料,获得肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、缺氧诱导因子(hypoxia inducible factor-1,HIF-1)、核因子-κB(nuclear factor-κB,NF-κB)、B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)、基质金属蛋白酶-1(matrix metalloproteinase,MMP-1)五个基因的序列,设计quantitative real time PCR引物。引物设计软件:Primer5。引物设计如下:
NF-kB
Goat-NF-KB-F:5-GACACAGCCAGTTACATGTGC-3′
Goat-NF-KB-R:5-TGGCCCGGATGAATACTTGG-3′
TNF-α
Goat-TNF-α-F:5-CAGACATCCCATTCAGGAGGC-3′
Goat-TNF-α-R:5-GTGTTTTGCACTTTTGTCCTGC-3′
Bcl-2
Goat-Bcl-2-F 5-GTCTGAAGCGCATCGGAGAT-3′
Goat-Bcl-2-R 5-CCTTGAGCACCAGTTTGCTG-3′
HIF-1
Goat-HIF-1-F 5-TCCATTTTCCACTCAGGACACT-3′
Goat-HIF-1-R 5-GCGGTGGCTATAGGAGGTTC-3′
MMP-1
Goat-MMP-1-F 5-TGGGCGAGTATGCCACATTT-3′
Goat-MMP-1-R 5-TCCTGAGCTCCTCGTTGAAA-3′
GAPDH
Goat-GAPDH-F 5-CATGTTTGTGATGGGCGTGA-3′
Goat-GAPDH-R 5-GTGGTCATAAGTCCCTCCACG-3′
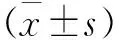
2 结 果
2.1 腰椎间盘退变影像学结果 造模前后MRI腰椎间盘纤维环形态见图1~2。腰椎微创造模组与腰椎假手术组在术后2个月腰椎间盘的MRI结果相比,差异有统计学意义(P<0.05,见表3)。
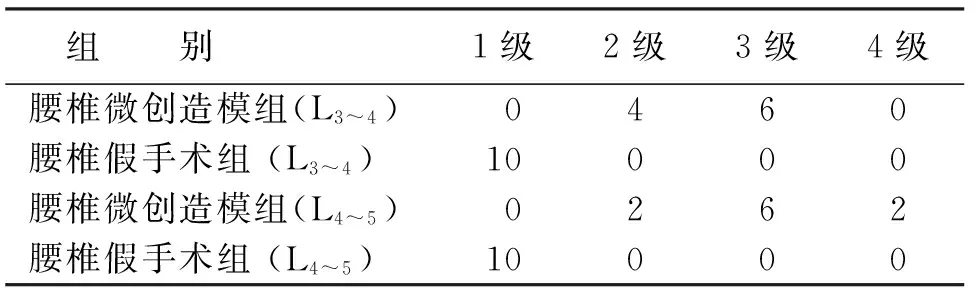
表3 各组实验羊L3~4、L4~5腰椎间盘影像学评分测量结果比较(例)

图1 造模前MRI示右侧纤维结构完整
2.2 腰椎间盘退变组织学结果 两组髓核组织形态(400倍光镜下观察)见图3~4。两组实验羊L3~4、L4~5腰椎间盘组织学评分测量,腰椎微创造模组(10 例)组织学评分(1.50±0.40)分,腰椎假手术组(10 例)组织学评分(0.10±0.05)分,两组比较差异具有统计学意义(P<0.05)。
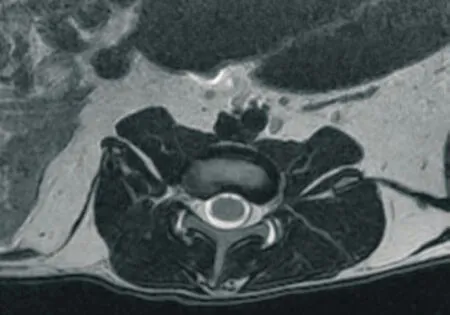
图2 造模后MRI示右侧纤维结构紊乱

图3 腰椎假手术组髓核细胞丰富,胞浆均匀,胞核形态正常(×400)
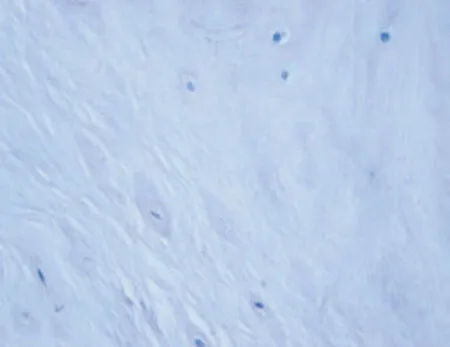
图4 腰椎微创造模组髓核细胞减少,髓核细胞形态异常,胞浆减少,胞核浓缩(×400)
2.3 腰椎间盘退变TNF-α、Bcl-2、HIF-1等基因表达检测结果 经统计分析,HIF-1基因表达在两组之间,差异具有统计学意义(P<0.01),TNF-a、TGF-β、IL-1基因表达差异具有统计学意义(P<0.05),NF-κB表达在两组之间差异无统计学意义(P>0.05,见表4)。
3 讨 论
腰椎间盘退变继发的椎间盘源性腰痛、腰椎间盘突出症及相关运动功能障碍普遍存在。70%的人一生中会因为腰椎间盘退变引起的疾病就诊[1]。20世纪60年代起国内外学者开始对腰椎间盘退变的病因、病理进行研究,其确切的退变机理仍不清楚。众多国内外学者认为腰椎间盘退变是多种因素共同作用的结果,包括氧化应激、炎症因子、细胞衰老、细胞凋亡、酶活性水平的改变、营养通路等因素,在退变过程中腰椎间盘的生物力学、生物化学和超微结构均发生了相应的变化,最终导致腰椎间盘细胞分解代谢增加,合成代谢减少,导致腰椎间盘退变。
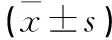
表4 各组实验羊腰椎间盘组织基因表达测量结果
3.1 建立动物模型的意义 动物模型是研究人体腰椎间盘退变的机制及治疗方法中不可或缺的部分。鉴于目前研究方法与治疗手段的多样性,为探索腰椎间盘退变的发病机制及药物的治疗机制,需要获得与人体椎间盘结构及退变机制相似的动物模型,并且这种模型需要满足经济性、低周期性、易获得性、可重复性等特点。但目前研究动物使用种类繁杂,模型制作的方式多种多样,没有固定的造模标准,也没有统一的评估体系。因此,建立经济、安全、可靠的腰椎间盘退变动物模型,用于研究腰椎间盘退变的发生、发展以及探索其有效治疗手段以及制定防治策略具有重要意义。目前,腰椎间盘退变动物模型主要有自发退变模型[2-4]、损伤动物模型[5-7]、诱导退变模型等[8-10],它们都有各自的优缺点,而微创腰椎间盘退变造模是目前研究的热点。
3.2 构建动物模型的方法选择 动物模型是研究人体椎间盘退变的机制及治疗方法中不可或缺的部分。但是选择动物模型模拟人体的腰椎间盘退变过程时,要考虑到动物的种类、自然寿命、年龄、行走方式等,同时也要考虑到人体的生理构成,考虑到人体椎间盘在正常生理状态下所承受着垂直方向的重力及水平方向的剪切力特征。出于上述考虑,类人猿如恒河猴是最理想的动物模型之一,但由于经济成本、实验动物获取等因素,此类动物模型不能成为主要的实验对象。
小动物,诸如啮齿类大鼠、兔是目前常用的备选动物。此类动物容易获得、造模周期短、经济实用,所以被广泛用于椎间盘退变研究。但是此类动物椎间盘较小,普通的注射穿刺即可引起退变,所以只适用于前期基础实验,不利于药物注射、细胞移植、基因转染的椎间盘再生、修复的研究。大型动物的椎间盘结构与人体结构较为相似,其中包括犬类、猪、牛、羊等大型动物。O′Connell等[11]使用几何方法研究实验动物椎间盘厚度、高度、前后径等与人体椎间盘结构相似度发现,大型动物山羊的椎间盘结构与人体结构较为相似。
在选择以何种方式构建动物退变模型时,自然退变模型、椎间盘损伤模型、诱导模型是目前主要的备选方案。自然退变的动物模型与人体腰椎间盘退变过程相似,但模型获取周期较长,啮齿类动物如大鼠就需要8到9个月时间,大型动物需要的时间更长,此类动物模型实验周期长是其缺点。目前纤维环损伤模型应用较广,大量报道显示损伤后的椎间盘组织退变较快,模型容易获得,但其缺点主要是在手术方法上的不足,因为开放手术对腰椎间盘周围组织损伤较大,安全性低、死亡率高,增加了造模风险与不必要的干扰因素。诱导模型主要研究单一致病因素或者生存环境对实验动物的椎间盘退变影响,不利于广泛的机制及治疗方法的研究。所以,能够重复、安全、创伤小、经济、能够模拟的大型动物模型是目前腰椎间盘退变研究所缺少的。
我们使用与人体椎间盘结构相似的山羊作为备选动物,通过腰椎间盘微创技术制备山羊腰椎间盘退变模型,在充分使用大型动物结构特点同时,减少造模过程所带来的损伤因素、结构破坏的干扰因素,为腰椎间盘退变提供可重复且简单易行的动物模型方法,为日后腰椎间盘修复及再生准备理想的动物模型。
3.3 动物模型制备的要求 腰椎间盘退变模型的选择要考虑多方面因素,获得理想腰椎间盘退变模型要综合以下因素:a)实验动物经济实用、获取方便、有利于广泛开展研究;b)腰椎间盘退变模型可重复性好,安全可靠;c)选择造模动物的腰椎间盘结构与人体椎间盘结构相似,有利于开展进一步的修复与再生研究;d)造模动物的退变过程应与人体的损伤及自然退变过程相似;e)造模动物损伤可控与精确化,减少不必要的手术损伤与退变的干扰因素;f)构建腰椎间盘退变客观、统一的量化标准,减少人为的主观因素对腰椎间盘退变的干扰。
所以采用大型动物作为备选动物模型,借助腰椎微创技术实现腰椎间盘结构损伤的可控性、精确性,是以后腰椎间盘退变模型构建的研究方向,但目前客观的评价标准尚未统一,需进一步量化微创动物模型的观察及测量指标。
[1]Andersson GB.Epidemiological features of chronic low-back pain.Lancet[J].The Lancet,1999,354(9178): 581-585.
[2]Bergknut N,Rutges JP,Kranenburg HJ,etal.The dog as an animal model for intervertebral disc degeneration?[J].Spine (Phila Pa 1976),2012,37(5):351-358.
[3]Cho H,Park SH,Lee S,etal.Snapshot of degenerative aging of porcine intervertebral disc:a model to unravel the molecular mechanisms[J].Exp Mol Med,2011,43(6):334-340.
[4]Zhang Y,Sun Z,Liu J,etal.Features of intervertebral disc degeneration in rat′s aging process[J].J Zhejiang Univ Sci B,2009,10(7):522-527.
[5]Xi Y,Kong J,Liu Y,etal.Minimally invasive induction of an early lumbar disc degeneration model in rhesus monkeys[J].Spine (Phila Pa 1976),2013,38(10):E579-586.
[6]Michalek AJ,Iatridis JC.Height and torsional stiffness are most sensitive to annular injury in large animal intervertebraldiscs[J].Spine J,2012,12(5):425-432.
[7]Zhang W,Li T,Gong Q,etal.A comparative study on establishing rabbit intervertebral disc degeneration models by three methods[J].Zhongguo Xiufu Chongjian Waike Zazhi,2010,24(1):41-45.
[8]Wang D,Nasto LA,Roughley P,etal.Spine degeneration in a murine model of chronic human tobacco smokers[J].Osteoarthritis Cartilage,2012,20(8):896-905.
[9]Liang QQ,Zhou Q,Zhang M,Prolonged upright posture induces degenerative changes in intervertebral discs in rat lumbar spine[J].Spine (Phila Pa 1976),2008,33(19):2052-2058.
[10]朱伟红,朱海波,马南,等.山羊腰椎间盘退变模型硬膜外胶原酶的注射[J].中国组织工程研究与临床康复,2011,15(26):4751-4754.
[11]O′Connell GD,Vresilovic EJ,Elliott DM.Comparison of animals used in disc research to human lumbar disc geometry[J].Spine,2007,32(3):328-333.
An Animal Goat Model of Lumbar Intervertebral Disc Degeneration Using Minimally Invasive Surgery
Xie Lin,Gu Jun,Tang Tian,etal
(Jiangsu Provincial Hospital of TCM and Western Medicine,Nanjing 210028,China)
Objective To make goat model of lumbar intervertebral disc degeneration to explorer a new method to create large animal model.Methods Twenty Bordeaux goats were divided to two groups.Group A underwent full-endoscopic technique of minimally invasive surgery,the group B is sham-operation group.Original dates of all lumbar intervertebral disc were detected by MRI before operation.Full-endoscopic technique of minimally invasive surgery was used to make animal model of lumbar intervertebral disc degeneration.Sham-operation group accape the same technique but the structure of lumbar intervertebral disc was not injured.Two months later,MRI test was taken again and lumbar intervertebral discs were harvested after animals sacrificed.Comparation of MRI scores,histology scores and gene expression including HIF-1、TNF-a、TGF-β、NFκB、IL-1in nucleus pulposus tissue were taken in these two groups.Results There were statistically significant differences in MRI scores and histology scores of these two groups(P<0.05).TNF-a、TGF-β、IL-1 gene expression also had a significant difference in these two groups,further more the gene expression of HIF-1 had a statistically significant difference(P<0.01).The gene expression of TNF-a between group A and group B had no statistically difference.(P>0.05)Conclusion The statistically significant differences in MRI scores and histology scores illustrate that full-endoscopic technique of minimally invasive surgery successfully estabilish a goat model of lumbar intervertebral disc degeneration.Also the significant different gene expression of HIF-1、TNF-a、TGF-β、IL-1in nucleus pulposus tissue of the two groups further prove this conclusion with molecule evidence.
lumbar intervertebral disc degeneration;goat animal model;minimally invasive surgery
江苏省卫生国际交流支撑计划及江苏省中医药局领军人才项目资助(BZ2008071);江苏省生命健康科技专项(BL2012069)
1008-5572(2015)08-0709-05
R332
A
2014-12-10
谢林(1965- ),男,主任医师,江苏省中西医结合医院骨科,210028。

