地表水中微囊藻毒素的检测分析方法
赵起越,赵红帅,刘保献,徐蘇士
(北京市环境保护监测中心,北京 100048)
地表水中微囊藻毒素的检测分析方法
赵起越,赵红帅,刘保献,徐蘇士
(北京市环境保护监测中心,北京 100048)
蓝藻水华会向地表水中排放大量的微囊藻毒素,对水生动、植物及人类构成很大威胁。综述了国内外分析微囊藻毒素的方法,包括生物检测法、生物化学检测法、化学仪器检测法等,指出了地表水中微囊藻毒素检测分析方法的发展趋势。
地表水;微囊藻毒素;分析
随着经济的发展及人口的增加,地表水体富营养化日益严重,污染水体中的藻类快速生长繁殖,引发藻类水华。蓝藻水华爆发频率较高,向水体释放出大量的藻毒素,严重影响水体生态环境,威胁水生动、植物的生长及人体健康[1-2]。其中最常见的毒素为微囊藻毒素(microcystin,MCs)。MCs是一种具有生物活性的环状缩氨酸,基本结构为环(D-Aka-L-X-D-Masp-L-YAdda-D-Glu-Mdha),L、D为左、右旋,D-Aka为D-丙氨酸,D-Masp为D-赤-甲基-β-D-异天冬氨酸,Adda为3-氨基-9-甲氧基-2,6,8-三甲基-10-苯基-4,6-二烯酸,DGlu为D-异谷氨酸,Mdha为N-甲基脱氢丙氨酸。X和Y为两种可变的氨基酸。
MCs有近90种异构体,其中研究较多的有MCLR、MC-RR及MC-YR等。MCs具有肝毒性,是一种强肿瘤促进剂,不仅损害饮用及接触污染水体的生物健康,还会通过食物链富集,对人类健康构成威胁。微囊藻毒素溶于水,有较强的耐热性及酸碱稳定性。普通自来水处理工艺难以将其有效去除[3]。世界卫生组织(WHO)设定饮用水中MC-LR的浓度指导限值不得大于1μg·L-1[4],我国《地表水环境质量标准》及《生活饮用水卫生标准》均采用了WHO的浓度限值[5-6]。
微囊藻毒素浓度与蓝藻水华的程度息息相关。研发准确、快速的测定方法对控制蓝藻水华、保护地表水环境安全具有重大意义。由于微囊藻毒素种类繁多、结构相似、浓度很低,加之地表水中存在许多干扰物质,准确而快速地定量测定MCs具有一定难度。MCs的分析方法种类繁多,作者在此主要介绍生物检测法、生物化学检测法及化学仪器检测法等MCs检测方法。
1 生物检测法
生物法检测MCs是通过动、植物体外摄入MCs,观察个体或组织器官的反应变化。研究常通过灌喂或腹腔注射小白鼠鉴定MCs的毒性,周期较长。Torokne等[7]使用甲壳纲无甲目丰年虫进行了水中MCs亚致死点1 h Rapidtoxkit实验及死亡率24 h实验,两种实验结果相关性好,因此可以用1 h实验代替24 h实验,快速、经济地检测MCs。目前,使用细菌测定MCs毒性的报道较多,如费舍尔弧菌或明亮发光杆菌等,最多能检测5种MCs[8-9]。2008年,南非第一次出现了使用鲇鱼肝细胞进行动物实验的报道,细胞暴露后,进行抽样、抑制及引发等实验,结果与酶联免疫法相符,与小白鼠动物实验完全一致,该方法可能在不远的将来替代动物活体实验[10]。此外,还有使用植物检测水中MCs的报道[11]。
生物法操作简单,结果直观,但成本较高,特异性不好,无法区别不同的MCs异构体,也不能对毒素进行准确定量。
2 生物化学检测法
2.1 蛋白磷酸酶抑制分析法(protein phosphatase inhibition analysis,PPIA)
MCs能阻断抑制真核蛋白磷酸酶PP1及PP2A的活性,因此通过测定放射性同位素32P标记底物或对硝基苯基磷酸酶类底物,获取蛋白磷酸酶PP1及PP2A的抑制情况,可以得到MCs的浓度。Rivasseau等开发了一种免疫与比色实验相结合的蛋白磷酸酶抑制方法,样品经免疫萃取后进行磷酸酶抑制检测,可对MCs水华毒性进行快速的在线监测。Covaci等[12]研究了3种蛋白磷酸酶被MCs抑制的情况,使用其中2种、依据人工神经网络对MC-LR及MC-YR进行了定量检测。这种检测方法成本低,可用于常规环境样品的筛选,但特异性不好,干扰较大。
2.2 酶联免疫法(enzyme-linked immunosorbent assays,ELISA)
ELISA根据抗体对MCs的识别进行检测,ELISA又分为抗原抗体复合物酶联免疫法(anti-immune complex ELISA,IC ELISA)、间接竞争酶联免疫法(indirect cELISA)和直接竞争酶联免疫法(direct cELISA)3种。雷腊梅等[13]采用水样、藻样和水产品对上述方法进行了系统比较,证明IC ELISA灵敏度高、稳定性好、特异性强,而且不需要预处理样品,检测限符合国内外相关法规要求。ELISA实验多数使用免疫诊断试剂盒进行,如Gurbuz等[14]使用自制的多克隆抗体试剂盒及一种市售的试剂盒对水体中的MCs进行了分析,同时使用液相色谱对结果进行了确证。结果表明:多克隆抗体法比单克隆抗体法重复性好,制备也比较方便、快速,虽然检测限比单克隆法高,但可以满足水中MCs的测定要求。
一般的ELISA不能对不同MCs异构体区别检测,对MCs及其它有类似结构的物质也不能加以区分,因此测量结果有时会产生偏差。
目前,免疫传感器的研制工作非常活跃。将免疫测定法与传感技术相结合,产生了一类新型生物传感器——免疫传感器。此类传感器利用抗原与抗体的特异性吸附反应对目标化合物进行测定。MCs免疫传感器应用分直接测定(非标记型)及间接测定(标记型)两种[15-16]。张金果等[17]研制出基于Fe3O4@Au磁性纳米粒子修饰丝网印刷电极的免疫传感器,并进行水中MC-LR测定,其响应峰电流值与化合物浓度在0.79~12.9μg·L-1范围内呈良好的线性关系,检测限为0.38μg·L-1。杜华丽等[18]使用基于石墨和金纳米笼修饰的无标记型微囊藻毒素免疫传感器进行污染物的测定,考察了抗原培育时间及抗体浓度等条件对传感器响应性能的影响,操作简单,稳定性很好。Shi等[19]建立了新型在线自动光度生物传感系统,使用间接竞争检测模式对饮用水中的MC-LR实现了快速、自动、在线、实时检测,MC-LR的定量范围为0.2~4.0μg·L-1,检测限可达0.09μg·L-1。Morais等[20]应用间接竞争微免疫反应研制出微传感器,实现了现场、原位、快速、高通量的分析,对水中MCLR的检测限可达1.04μg·L-1,线性范围0.12~200 μg·L-1,37 min内可同时分析42个样品。
免疫传感器特异性强、灵敏度高、准确性好,纳米材料的引入,使它的诸多性能有很大提升。但多数传感器仅能测定MC-LR,且非标记传感器分析MCs等小分子化合物时的灵敏度不够高。此外,多数传感器不能胜任大量环境样品长时间连续分析的任务,在使用寿命、再生性、有效性及稳定性等方面也需要进一步完善[21]。
2.3 分子技术检测法
聚合酶链反应(polymerase chain reaction,PCR)是一种体外核酸扩增技术,因为特异多肽合成基因仅存在于产毒微囊藻藻株中,通过检测藻类基因组DNA中是否含有该基因簇,判断被检藻株的产毒能力,此为全细胞PCR分析法。Saker等[22]使用该法研究葡萄牙水体中MCs,检测结果与使用基体辅助激光消解-飞行时间质谱检测结果一致。Calvo等[23]使用五巢式PCR在西班牙Aragón不同水体中同时检测了5种单细胞生物,对其中主要病原体进行了识别。实时荧光定量PCR技术是指在PCR指数扩增期间通过连续监测荧光信号强弱的变化实时测定特异性产物的量,并据此推断目的基因的初始量。它操作简单、快速高效,灵敏度和特异性均很高,可以通过不同的引物设计在同一反应体系中同时对多个靶基因分子进行扩增。如Juliana等[24]设计了mcyD特异片段引物,采用PCR评估了水中蓝藻数量。而Kyoung-Hee等[25]以mcyA基因为研究对象,使用PCR估算了铜绿微囊藻在蓝藻种群中的比例,进行了蓝藻水华风险的评估。基因核苷酸探针DNA芯片技术大大提升了实时PCR的分析通量,对蓝藻水华测定的灵敏度可达1 000 cell· mL-1[26]。PCR技术的缺陷是,随着放大产物长度的增加,放大效率逐渐降低,优化工作难度加大,检测时间延长[27]。
3 化学仪器检测法
3.1 前处理方法
3.1.1 固相萃取法(solid phase extraction,SPE)
大多数分析方法均要使用固相萃取技术从水中提取MCs。萃取柱活化后将水样注入,再使用溶剂依次洗脱杂质及MCs,含有MCs的洗脱液经浓缩换相,使用仪器进行分析。这部分研究主要集中在萃取柱的填料、孔径、杂质及目标化合物洗脱条件的选择和比较上[28]。Sep-Pak C18、Supelco LC-Si及HLB等SPE柱的研究较多,一般认为HLB的萃取效果较好,因为其填料是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,具有较高的吸附容量[28-29]。
水中MCs使用固相微萃取(solid phase microextraction,SPME)技术的报道不多,主要因为该技术萃取平衡时间较长(>20 h),实用性不强[30]。自动固相萃取是将SPE自动化,使用机械泵自动抽取分析水样及洗脱溶液。节约了人工,但仪器造价较高,系统维护费用及工作量较大。1999年,Lee等[31]使用一种在线富集装置,将水样过滤后,直接上机富集,富集柱为Zorbax腈基柱,流速0.3 mL·min-1。该研究使用液相色谱分析了水中MC-LR、MC-YR及MC-RR。单芯片SPE技术使用芯片作固定相,可以在低压下达到较高的流速,分析速度快,灵敏度高。芯片可以反复使用,经济实惠。Ammerman等[32]开发了一种流动注射(flow injection,FI)结合单芯片SPE萃取分析地表水中痕量MCs的方法,该方法比传统SPE目标化合物的半峰宽减少近20%,灵敏度提高近10倍。
3.1.2 直接进样法
直接进样法指水样不经过萃取,通过滤膜后直接进入仪器(通常为液相色谱)进行分析。近年来,随着液相色谱-质谱及多级质谱的出现,仪器检测的灵敏度有了很大提高,抗干扰能力也大大增强,直接进样法的报道也越来越多[33-35]。该方法的研究集中在过滤膜材质的选择和进样量、色谱条件的筛选上。杨立新等[33]使用直接进样液相色谱-串联质谱测定了自来水、地下水及地表水中的8种有机物,包括2种MCs,通过色谱及质谱条件的优化,8种有机物于6 min内分析完毕,2种MCs的线性范围较宽,相关系数达0.99以上。姜雷等[34]使用同种方法测定了水中9种藻毒素,用脑啡肽作内标,定量限为0.012~0.360μg· L-1。茅海琼等[35]使用直接进样法分析了环境水质样品中MC-LR,采用超高效液相色谱-串联质谱,回收率为91.5%~110.3%,检测限为0.08μg·L-1,符合《地表水环境质量标准》及《生活饮用水卫生标准》的要求。
3.2 仪器分析
3.2.1 气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)
以过碘化钠及高锰酸钾氧化MCs得到2-甲基-3-甲氧基-4-苯基丁基酸,使用气相色谱-火焰离子化检测器或GC-MS进行定量,间接求得MCs总量[36]。Patricia等[37]使用上述方法,酯化衍生配合SPME,提高了回收率及灵敏度,可以分析水中及鱼的不同组织内积累的MCs。气相色谱-化学电离源-质谱方法使用红-2-甲基-3-(甲氧基-d3)-4-甲基丁基酸作内标,对水体中MCs测定更加灵敏[38]。GC-MS方法灵敏、快速、准确,但样品处理复杂,且只能测定MCs的总量,不能鉴别不同的异构体。
3.2.2 高效液相色谱(high performance liquid chromatography,HPLC)
LC适于分析MCs这种挥发性不强、热稳定性高、沸点较高的物质,WHO及我国权威机构推荐的方法均为HPLC方法。MCs的LC分析通常使用反相硅胶柱,由于流动相中添加小比例的酸可以提高MCs测定的灵敏度,因此色谱柱需要有一定的耐酸性。Xterra、Symmetry、Luna、Atlantis等色谱柱的使用均有报道。流动相甲醇及乙腈均有使用,流动相流速及组成比例依据分析的目标化合物及进样方式不同而异。LC分析MCs可以使用紫外(UV)、二极管阵列(diode array detector,DAD)及质谱(MS)等检测器。
3.2.2.1 紫外及二极管阵列检测器
因为MCs含有Adda官能团,最大吸收波长为238 nm,因此LC与DAD或UV联用技术成为检测MCs的最广泛使用的手段。Mankiewicz-Boczek等[39]使用LC-DAD测定了波兰3个湖泊夏季水中的MCs,并与PCR方法进行了比较,含P阿氏藻的水样最大浓度可达11.13μg·L-1,而含M阿氏藻的为4.67μg·L-1。Shen等[40]使用LC-UV测定了太湖发生水华时梅梁湾的湖水,发现MC-LR是主要的有毒组分,其中MCs的含量与湖水温度及富营养状况有关。LC-UV法灵敏度不高,对化合物的定性定量要依据标准物质,另外,有些化合物在200~300 nm之间有紫外吸收,会干扰测定。
3.2.2.2 质谱检测器
LC-MS分析水中MCs分析灵敏度高,通量大,对目标化合物采用保留时间及核质比双重定性,准确度更高。质谱通常采用熔接快原子轰击技术、电喷雾电离技术(electron spray ionization,ESI)及大气压化学电离技术(atmospheric pressure chemical ionization,APCI)等几种电离技术获得分子离子,其中ESI使用最多[41]。Jurcza等使用LC-ESI-MS分析了波兰1996年至2001年8个水体中的MCs,发现主要污染物为MCRR、MC-LR及MC-YR,还发现了几种去甲基MCs[42]。Hoeger等[43]使用LC-MS分析了前-阿尔卑斯湖泊中的藻类,发现了2种MC-RR的变异体,并应用多级质谱加以确认。
LC与多级MS联用使用母离子和子离子共同定性定量,对MCs的测定更加准确[44],这方面的报道很多,如Ortea等[45]使用LC-MS-MS分析了爱尔兰被MCs污染的湖水,检出了MC-LR和MC-LA。MC-LR的分析重现性好,线性及变异系数均达到要求。邓力等[46]使用LC-MS-MS分析了重庆长寿湖中3种MCs,分析仅用6 min,检测限达到ng·L-1级,回收率为85.6%~107.9%。Kaloudis等[47]使用LC-ESI-MS-MS分析了马拉松湖水中的MCs及神经毒素,发现了MC-LA一种新的断裂机理,神经毒素的回收率为70%~114%,检测限达到2 ng·L-1。
应用LC-MS-MS方法时因不同目标化合物的离子化程度不同,有时会产生误差,使用同位素内标可以消除[48]。有时还可以添加替代物,进一步修正前处理产生的误差[49]。除此以外,应用这一技术还可以确证未知MCs,如可以根据Adda侧链m/z135证明分析物是MCs[50]。因此,LC-MS-MS逐渐成为分析MCs的有力工具。
MS一般为四级杆质谱,如果使用飞行时间质谱(time of flight MS,TOFMS),检测灵敏度还会提高。Ortelli等[51]使用超高效液相色谱与TOFMS联用定量测定水中MCs,检测限可达0.1μg·L-1。
3.2.3 基体辅助激光解析离子化(matrix-assisted laser desorption ionization,MALDI)-飞行时间质谱(MALDI-TOFMS)及表面加强激光解析电离(surface-enhanced laser desorption ionization,SELDI)-飞行时间质谱(SELDI-TOFMS)
MALDI-TOFMS及SELDI-TOFMS是新发展起来的软电离生物质谱。分析快速、灵敏度高、选择性好、样品用量少、对无机盐及缓冲液有一定耐受性,该仪器的高通量、多路复用性能适于分析MCs及其异构体[52]。Via-Ordorika等[53]使用MALDI-TOFMS对欧洲9个国家的MCs菌落进行了分析,共检出8个不同MCs异构体。有人使用疏水芯片萃取水中MCs,使用SELDITOFMS测定,每2μL样品中可检出MC-LR 2.5 pg,但方法基体效应很大,很难监测到MCs的m/z135的特征离子碎片[54]。
3.2.4 其它分析方法
其它MCs的分析方法包括毛细管电泳、薄层色谱和二维核磁共振等,各方法比较见表1。
4 发展趋势
随着经济的发展及人口的增加,地表水体富营养化程度不断加剧,水中MCs的分析非常活跃,呈现出以下发展特点:
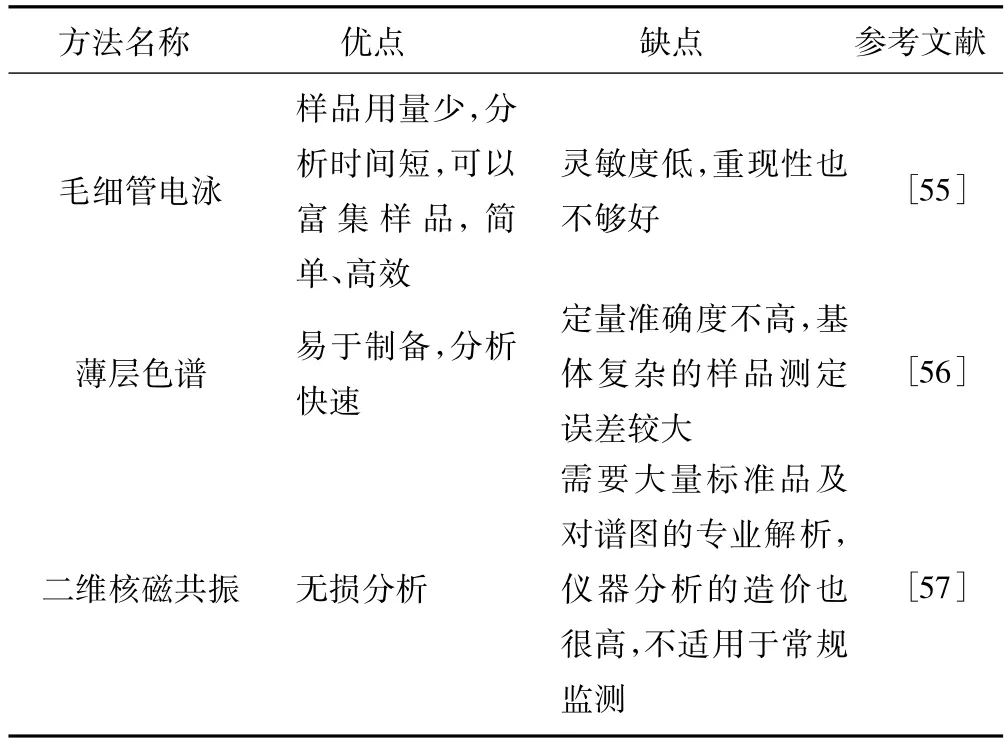
表1 其它MCs分析方法比较Tab.1 Com parison of other analyticalmethods of MCs
4.1 分析的MCs种类逐渐增多
可分析的水中MCs已从过去的一、两种(MC-LR及MC-RR)增加至近十种,而且还增加了神经毒素、柱状藻毒素、节球藻毒素等易于伴生的毒素,并与微囊藻毒素一起进行同步分析。
4.2 前处理方法逐渐简化
从起始的离线固相萃取到自动固相萃取、在线固相萃取,现在已发展至直接进样。水样只要用滤膜过滤后便可上机分析。在生化分析方面,生物试剂盒已普遍使用,分析快速,便于大量样品的筛查。
4.3 分析仪器越来越先进,检测精度越来越高
虽然现在水中MCs的常规检测还是使用LC-UV,但MS方法已经被广泛采用,甚至多级MS的使用也愈来愈多,TOFMS的使用也有少量报道。MS的引入使MCs的仪器测量精度有很大提高,在不远的将来必定成为MCs仪器分析的主流。
4.4 高通量、现场、原位、实时测定
目前,世界上还没有较为成熟的防止蓝藻水华发生的有效办法,因此对水中MCs必须进行密切监控。生物试剂盒、免疫传感器等技术的发展应用使地表水中MCs的实时、原位、在线检测成为可能。纳米材料的引入大大提高了传感器灵敏度、稳定性和抗体分子吸附量。生物传感器对MCs的现场、实时、原位分析将与经典分析方法同时存在、共同发展、互为补充。
5 结语
地表水中MCs的检测分析方法发展迅速,且日趋多元化。更多的异构体、变异体分析、更少的前处理步骤及更精确、快速、高通量及经济的分析方法成为发展的方向,实时、原位的现场分析方法也方兴未艾。结合我国国情,在扩展分析目标化合物种类的同时,须逐步开展不同方法之间的比对、同一方法不同设备之间的比对研究,尤其是新建方法与国标方法的比对工作,以确认方法的有效性。此外,要加强我国地表水中微囊藻毒素标准评价体系的构建工作,综合动物实验、流行病学研究及国内外文献,建立符合我国国情的地表水中微囊藻毒素的标准评价体系,并在此框架下配套进行方法学研究。
[1]TENGW,WU Z X,FENG D,et al.Rapid and efficient removal ofmicrocystins by ordered mesoporous silica[J].Environ Sci Technol,2013,47(15):8633-8641.
[2]PARGADHI S,GONG Z Y,BALASUBRAMANIAN R.Toxicological implications ofmicrocystins for zebrafish embryos in the presence of other environmental pollutants[J].Environmental To-xicology and Chemistry,2013,32(7):1574-1581.
[3]FERRANTI P,FABBROCINO S,CHIARAVALLE E,et al.Profiling microcystin contamination in awater reservoir by MALDI-TOF and liquid chromatography coupled to Q/TOF tandem mass spectrometry[J].Food Research International,2013,54(1):1321-1330.
[4]WHO.Cyanobacterialtoxins:Microcystin-LR.WHO guidelines for drinkingwater quality[R].Geneva:World Health Organization,1998.
[5]GB/T 3838—2002,地表水环境质量标准[S].
[6]GB/T 5750—2006,生活饮用水卫生标准[S].
[7]TOROKNE A,VASDINNYEI R,ASZTALOS B M.A rapid microbiotest for the detection of cyanobacyrtial toxins[J].Environmental Toxicology,2007,22(1):64-68.
[8]FLADMARK K E,SERRESM H,LARSEN N L,et al.Sensitive detection of apoptogenic toxins in suspension cultures of rat and salmon hepatocytes[J].Toxicon,1998,36(8):1101-1114.
[9]唐承佳,陈振楼,王东启.太湖贡湖湾水源地水质青海弧菌Q67急性毒性测试[J].安徽农业科学,2011,39(27):16739-16742,16784.
[10]MASANGO M,MYBURGH J,BOTHA C,et al.A comparison of in vivo and in vitro assays to assess the toxicity of algal blooms[J].Water Research,2008,42(13):3241-3248.
[11]BOUAQCHA N,RIVASSEAU C,HENNION M C,et al.The use of lepidiumsaitvaum in a plant bioassay system for the detection ofmicrocystin-LR[J].Toxicon,2003,41(7):871-876.
[12]COVACIO I,SASSOLAS A,ALONSO G A,et al.Highly sensitive detection and discrimination of LR and YR microcystins based on protein phosphatases and an artificial neural network[J].Anal Bioanal Chem,2012,404(3):711-720.
[13]雷腊梅,甘南琴,张小明,等.三种检测微囊藻毒素的ELISA方法比较研究[J].高技术通讯,2004,14(7):89-92.
[14]GURBUZF,MMTCALF JS,CODDGA,etal.Evaluation of enzymelinked immunosorbent assays(ELISAs)for the determination ofmicrocystins in cyanobacteria[J].Environmental Forensics,2012,13 (2):105-109.
[15]张新爱,申建忠,张帆,等.碳纳米管/纳米金复合膜电化学免疫传感器用于微囊藻毒素的检测研究[J].分析化学,2014,42 (9):1301-1306.
[16]宋保栋,盛建武,廖志民,等.微囊藻毒素-LR的全内反射荧光免疫传感器研究[J].环境污染与防治,2014,36(9):50-54.
[17]张金果,康天放,薛瑞,等.基于Fe3O4@Au磁性纳米粒子修饰丝网印刷电极的免疫传感器研究[J].分析化学,2013,41(9): 1353-1358.
[18]杜华丽,符雪文,温永平,等.基于石墨烯和金纳米笼修饰的无标记型微囊藻毒素免疫传感器的研制[J].分析化学,2014,42 (5):660-665.
[19]SHIH C,SONG B D,LONG F,et al.Automated online optical biosensing system for continuous real-time determination ofmicrocystin-LR with high sensitivity and specificity:Early warning for cyanotoxin risk in drinking water sources[J].Environ Sci Technol,2013,47 (9):4434-4441.
[20]MORAIS S,TAMARIT-LOPEZ J,PUCHADES R,et al.Determination ofmicrocystins in river waters usingmicrosensor arrays on disk[J].Environ Sci Technol,2010,44(23):9024-9029.
[21]鲁丁强,庞广昌.电化学纳米免疫传感器在食品安全检测中的应用展望[J].食品科学,2014,35(8):6-10.
[22]SAKER M L,VALEM,KRAMER D,et al.Molecular techniques for the early warning of toxic cyanobacteria blooms in freshwater lakes and rivers[J].Appl Microbiol Biotechnol,2007,75(2):441-449.
[23]CALVO L,GRGEGORIO I,GARCIA A,et al.A new pentaples-nested PCR to detect five pathogenic bacteria in free living amoebae[J].Water Research,2013,47(2):493-502.
[24]JULIANA SM P,ALESSANDRA G.Estimating toxic cyanobacteria in a Brazilian reservoir by quantitative real-time PCR based on themicrocystinsynthetase D gene[J].Journal of Applied Phycology,2013,25(5):1545-1554.
[25]KYOUNG-HEEO,DONG-HWAN J,YOUNG-CHEOL C.Qu-antification of toxigenicmicrocystins spp.in freshwaters by quantitative realtime PCR based on themicrocystinsynthetase A gene[J].Journal of Microbiology,2013,51(1):18-24.
[26]HA JH,HIDAKA T,TSUNO H.Quantification of toxic microcystins and evaluation of its dominance ratio in blooms using real-time PCR[J].Environ Sci Technol,2009,43(3):812-818.
[27]SRIVASTAVA A,SINGH S,AHN C Y,et al.Monitoring approaches for a toxic cyanobacterial bloom[J].Environ Sci Technol,2013,47 (16):8999-9013.
[28]KOHOUTEK J,BABICA P,BLAHA L,et al.A novel approach for monitoring of cyanobacterial toxins:Development and evaluation of the passive sampler formicrosystems[J].Anal Bioanal Chem,2008,390(4):1167-1172.
[29]李彦文,黄献培,吴小莲,等.固相萃取-高效液相色谱串联质谱法同时测定土壤中3种微囊藻毒素[J].分析化学,2013,41 (1):88-92.
[30]GOU Y N,EISERT R,PAWLISZYN J.Automated in-tube solid phase microextraction-high-performance liquid chromatography for carbamate pesticide analysis[J].Journal of Chromatogr A,2000,873 (1):137-147.
[31]LEE H S,JEONG C K,LEE H M,et al.On-line trace enrichment for the simultaneous determination ofmicrocystins in aqueous samples using high-performance liquid chromatography with diode-array detection[J].Journal of Chromatography A,1999,848(1-2):179-184.
[32]AMMERMAN J L,ALDSTADT J.Monolithic solid-phase extraction for the rapid on-line monitoring of microcystins in surface waters[J].Microchim Acta,2009,164(1-2):185-196.
[33]杨立新,张剑波,路阳,等.超高效液相色谱-串联质谱法直接进样测定水样中8种有机污染物[J].岩矿测试,2014,33(2):275-281.
[34]姜雷,张东.高效液相色谱-串联质谱法同时分析水中9种典型藻毒素[J].给水排水,2013,39(6):37-41.
[35]茅海琼,翁燕波,傅晓钦,等.超高效液相色谱-电喷雾串联四级杆质谱法快速分析水中微囊藻毒素LR[J].中国环境监测,2009,25(6):19-22.
[36]SANO T,NOHARA K,SHIRAISHIF,et al.A method formicro-determination of totalmicrocystin content in water blooms of cyanobacteria(Blue-Green Algae)[J].Intern JEnviron Anal Chem,1992,49 (3):163-170.
[37]PATRICIA S,JOHN B.Detection of totalmicrocystin in fish tissues based on lemieux oxidation and recovery of 2-methl-3-methoxy-4-phenylbutanoic acid(MMPB)by solid-phase microextraction gas chromatography-mass spectrometry(SPME-GC/MS)[J].Intern J Environ Anal Chem,2012,92(12):1443-1456.
[38]KAYA K,SANO T.Totalmicrocystin determination using ert-hro-2-methyl-3-(methoxy-d3)-4-phenylbutyric acid(MMPB-d3)as the internal standard[J].Anal Chim Acta,1999,386(1-2):107-112.
[39]MANKIEWICZ-BOCZEK J,IZYDORCZYK K,ROMANOWSKA-DUDA Z,etal.Detection andmonitoring toxigenicity of cyanobacteria by application of molecular methods[J].Environmental Toxicology,2006,21(4):380-387.
[40]SHEN PP,SHIQ,HUA Z C,et al.Analysis ofmicrocystins in cyanobacteria blooms and surface water samples from Meiliang Bay,Taihu Lake,China[J].Environment International,2003,29(5): 641-647.
[41]CONG L,HUANG B,CHEN Q,et al.Determination of trace amount ofmicrocystins in water samples using liquid chromatography coupled with triple quadruplemass spectrometry[J].Anal Chim Acta,2006,569(1-2):157-168.
[42]EDWARDSC,LAWTON L A,BEATTIE K A,et al.Analysis ofmicrocystins from cyanobacteria by liquid chromatography with mass spectrometry using atmospheric-pressure ionization[J].Rapid Commun Mass Spectro,1993,7(8):714-721.
[43]HOEGER S J,SCHMIND D,BLOM JF,et al.Analytical and fu-nctional characterization of microcystins[Asp3]MC-RR and[Asp3,Dhb7]MC-RR:Consequences for risk assessment?[J].Environ Sci Technol,2007,41(7):2609-2616.
[44]NEFFLING M R,LANCE E,MERILUOTO J.Detection of free and covalently bound microcystins in animal tissues by liquid chromatography-tandem mass spectrometry[J].Environmental Pollution,2010,158(3):942-952.
[45]ORTEA P M,ALLISO,HEALY B M,et al.Determination of toxic cyclic heptapeptides by liquid chromatography with detection using ultra-violet,protein phosphatase assay and tandem mass spectrometry[J].Chemosphere,2004,55(10):1395-1402.
[46]邓力,余轶松,孙静,等.水中微囊藻毒素的超高效液相色谱-串联质谱法[J].中国环境监测,2011,27(Z1):3-6.
[47]KALOUDIS T,ZERVOU S K,TSIMELI K,et al.Determination of microcystins and nodularin(cyanobacterial toxins)in water by LCMS/MS.Monitoring of Lake Marathonas,awater reservoir of Athens,Greece[J].Journal of Hazardous Materials,2013,263:105-115.
[48]SPOOF L,VESTERKVISTP,LINDHOLM T,etal.Screening for cyanobacterial hepatotoxins,microcystinsand nodularin in environmental water samples by reversed-phase liquid chromatography-electrospray ionization mass spectrometry[J].Journal of Chromatography A,2003,1020(1):105-119.
[49]YENH K,LIN TF,LIAOPC.Simultaneous detection of nine cyanotoxins in drinking water using dual solid-phase extraction and liquid chromatography-mass spectrometry[J].Toxicon,2011,58(2):209-218.
[50]MEIHINEY J,LAWTON L A.Detection of the cyanobacterialhepatotoxinsmicrocystins[J].Toxicol Appl Pharmacol,2005,203(3):219-230.
[51]ORTELLID,EDDER P,COGNARD E,et al.Fast screening and quantitation of microcystins in microalgae dietary supplement products and water by liquid chromatography couple to time of flightmass spectrometry[J].Anal Chim Acta,2008,617(1-2):230-237.
[52]WELKER M,FASTNER J,ERHARDM,et al.Applications of MALDI-TOFMS analysis in cyanotoxin research[J].Environ Toxicol,2002,17(4):367-374.
[53]VIA-ORDORIKA L,FASTNER J,KURMAYER R,et al.Distribution ofmicrocystin-producing and non-microcystin-producingmicrocystins sp.in european freshwater bodies:Detection ofmicrocystins and microcystin genes in individual colonies[J].Syst ApplMicrobol,2004,27(5):592-602.
[54]YUAN M,CARMICHAEL W W.Detection and analysis of the cyanobacterial peptide hepatotoxinsmicrocystin and nodularin using SELDI-TOFmass spectrometry[J].Toxicon,2004,44(5):561-570.
[55]GAGO-MARTINEZ A,LEAO JM,PINEIRO N,et al.An application of capillary electrophoresis for the analysis of algal toxins from the aquatic environment[J].Intern JEnviron Anal Chem,2003,83(6): 443-456.
[56]崔萌萌,马康,何雅娟,等.微囊藻毒素检测方法研究进展[J].化学分析计量,2012,21(6):95-99.
[57]HARADA K I,MURATA H,QIANG Z,et al.Mass spectrometric screening method for microcystins in cyanobacteria[J].Toxicon,1996,34(6):701-710.
Detection and Analytical M ethods of M icrocystins in Surface W ater
ZHAO Qi-yue,ZHAO Hong-shuai,LIU Bao-xian,XU Su-shi
(Beijing Municipal Environmental Monitoring Center,Beijing 100048,China)
Microcystins(MCs)in surface water discharged during cyanobacterial blooms is a big threat to water plants,animals and human.Analyticalmethods of MCs from home and abroad are reviewed,including biologicalmethod,biochemicalmethod,chemical instrument analyticalmethod,etc.Developing trend of detection and analyticalmethods of MCs in surface water is pointed out too.
surface water;microcystins;analysis
O 657
A
1672-5425(2015)07-0009-06
10.3969/j.issn.1672-5425.2015.07.003
2015-03-07
赵起越(1968-),女,北京人,教授级高级工程师,研究方向:环境有机污染物分析,E-mail:qiyuezhao@126.com。

