超声波辅助乙醇法提取茶皂素工艺优化
杜志欣,张崇坚,万端极
(湖北工业大学资源与环境工程学院,湖北武汉 430068)
超声波辅助乙醇法提取茶皂素工艺优化
杜志欣,张崇坚,万端极
(湖北工业大学资源与环境工程学院,湖北武汉 430068)
以脱脂后的茶籽饼粕为原料,采用超声波辅助乙醇法提取茶皂素,并用香草醛-浓硫酸显色法测定茶皂素提取率。以茶皂素提取率为考核指标,通过单因素实验和正交实验确定最佳的提取工艺条件为:乙醇体积分数80%、超声波功率400W、超声波作用时间40min、温度50℃、液料比8∶1(mL∶g),在此条件下,茶皂素提取率达到13.27%。
茶皂素;乙醇;超声波辅助提取;香草醛-浓硫酸显色法
茶皂素是从茶籽饼粕中提取得到的一种五环三萜类糖苷化合物[1],由三部分组成,分别为糖体部分、有机酸部分和皂苷元部分[2]。其分子结构中有亲水性的糖体和疏水性的苷元与有机酸,亲水基和疏水基通过醚键连接。因此,茶皂素具有多种表面活性,如:分散、润湿、乳化、去污、稳泡等[3-4],被广泛应用于日化、农药、纺织、建材等行业,具有可观的经济效益[5]。
茶皂素主要通过水和有机溶剂进行提取,但存在提取率低、能耗高、周期长等缺陷。为降低能耗、提高提取率、缩短提取时间,作者在此采用超声波辅助乙醇法提取茶皂素,并通过单因素实验和正交实验优化提取工艺条件,拟为茶籽饼粕中茶皂素的提取提供参考。
1 实验
1.1 材料、试剂与仪器
茶籽饼粕产自湖北恩施。
茶皂素标准品,阿拉丁生物技术有限公司;去离子水;石油醚、氢氧化钠、浓硫酸、香草醛、无水乙醇,均为国产分析纯。
UV-2550型紫外可见分光光度计,日本岛津公司;HDM1000型调温恒温电热套,常州国华电器有限公司;超声波清洗机,深圳洁康洗净电器有限公司。
1.2 方法
1.2.1 茶皂素的提取工艺流程
茶皂素的提取工艺流程如下:茶籽饼粕→粉碎→过60目筛→脱脂→抽滤→超声波辅助提取→离心→干燥。
1.2.2 提取工艺优化
首先分别考察乙醇体积分数、超声波功率、超声波作用时间、温度、液料比(mL∶g,下同)对茶皂素提取率的影响;然后根据单因素实验结果,选择乙醇体积分数、超声波作用时间、温度、液料比为考察因素,以茶皂素提取率为考核指标,进行L9(34)正交实验优化提取工艺。
1.2.3 茶皂素提取率的测定[6]
香草醛上的醛基可与茶皂素C3和C12上的羟基发生反应形成缩醛,成为新的共轭体系而显色[7]。因此,采用香草醛-浓硫酸显色法测定茶皂素的含量:
1)溶液配制
8%香草醛溶液:香草醛0.8g溶于10mL无水乙醇中;77%硫酸溶液:浓硫酸(质量分数95%)77mL加到23mL去离子水中。
标准溶液:精密称取经80℃干燥至恒质量的茶皂素标准品23.5mg,置于50mL容量瓶中,加80%(体积分数,下同)乙醇溶液适量使之溶解,稀释到刻度,摇匀,即得。
供试溶液:精密称取茶皂素样品65.6mg,置于10 mL容量瓶中,加去离子水适量使之溶解,然后加去离子水稀释到刻度,摇匀,即得。
2)标准曲线的绘制[7]
取0.5mL标准溶液,准确加入0.5mL的8%香草醛溶液,在冰水浴中加入4mL的77%硫酸溶液,摇匀,放入60℃水浴锅中加热15min,再放入冰水浴中冷却10min,取出,以试剂为空白组,在紫外可见分光光度计上扫描,确定最大吸收波长。
分别取标准溶液0.1mL、0.2mL、0.3mL、0.4 mL、0.5mL、0.6mL,置于带塞试管中,按上述方法加试剂反应后,在最大吸收波长下测定吸光度,并绘制标准曲线,建立回归方程。
3)提取率的测定
取供试溶液0.5mL,置于带塞试管中,按上述方法加试剂反应后,加水定容至10mL容量瓶中,在最大吸收波长下测定吸光度。计算茶皂素的质量浓度,按下式计算茶皂素提取率:
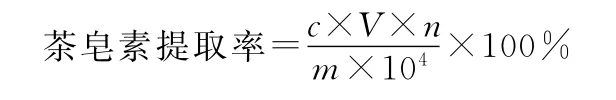
式中:c为茶皂素质量浓度,μg·mL-1;V为茶皂素水提液的总体积,mL;n为茶皂素水提液的稀释倍数;m为茶籽饼的质量,mg。
2 结果与讨论
2.1 最大吸收波长的确定(图1)
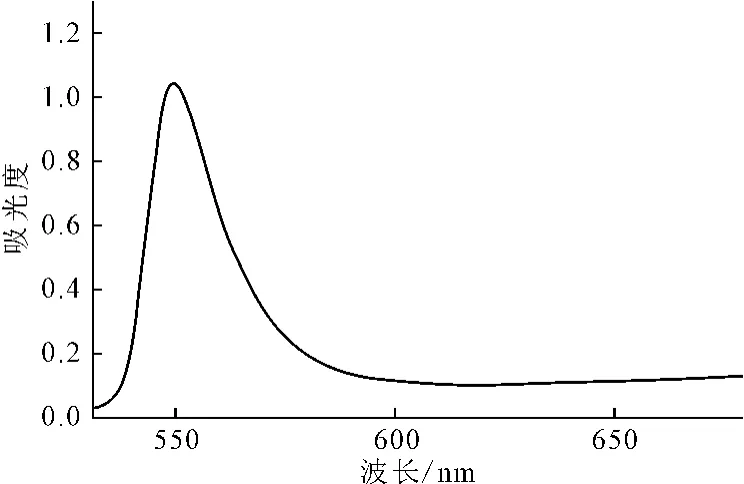
图1 茶皂素标准品的紫外可见吸收光谱Fig.1 UV-Vis Absorption spectrum of tea saponin standard
由图1可看出,茶皂素标准品的紫外可见吸收光谱在550nm处有最大吸收峰。因此,确定最大吸收波长为550nm。
2.2 茶皂素的标准曲线
在550nm处测定不同浓度标准溶液的吸光度,以吸光度(x)为横坐标、茶皂素质量浓度(y)为纵坐标绘制标准曲线(图2),拟合得回归方程为y=32.733x+1.6642,R2=0.9911。
2.3 单因素实验结果
2.3.1 乙醇体积分数对茶皂素提取率的影响
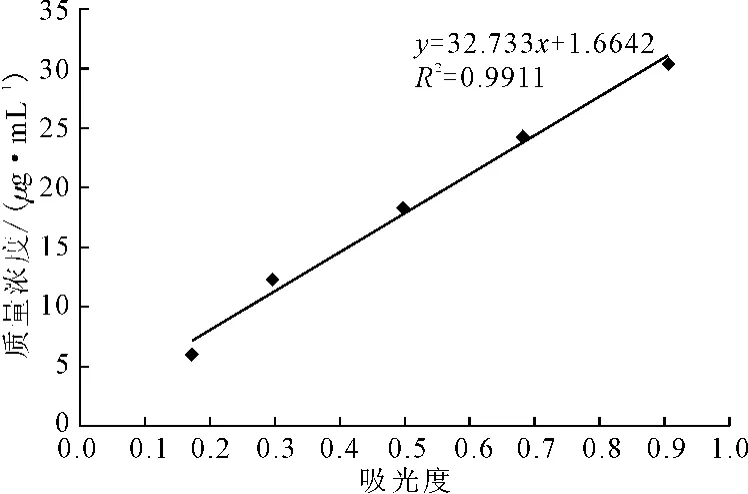
图2 茶皂素的标准曲线Fig.2 Standard curve of tea saponin
在超声波功率为400W、超声波作用时间为30 min、温度为50℃、液料比为8∶1的条件下,考察乙醇体积分数对茶皂素提取率的影响,结果见图3。
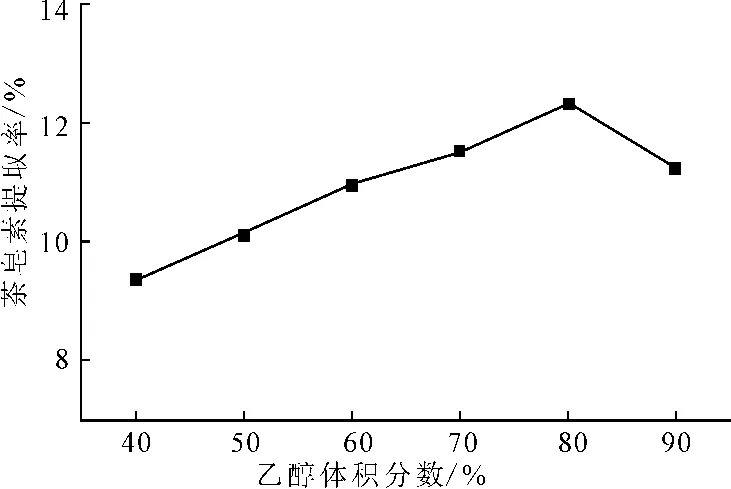
图3 乙醇体积分数对茶皂素提取率的影响Fig.3 Effect of ethanol volume fraction on extraction rate of tea saponin
由图3可知,随着乙醇体积分数的增大,茶皂素提取率先升高后降低,在乙醇体积分数为80%时提取率达到最高。这是因为,增大乙醇体积分数,可以减少蛋白、胶体等杂质溶出,有利于茶皂素的溶出;但是茶皂素不溶于纯的无水乙醇,乙醇体积分数过大提取率反而降低[8]。因此,乙醇体积分数以80%为宜。
2.3.2 超声波功率对茶皂素提取率的影响
在乙醇体积分数为70%、超声波作用时间为30 min、温度为50℃、液料比为8∶1的条件下,考察超声波功率对茶皂素提取率的影响,结果见图4。

图4 超声波功率对茶皂素提取率的影响Fig.4 Effect of ultrasonic power on extraction rate of tea saponin
由图4可知,随着超声波功率的增大,提取率逐渐上升,但在400W之后提取率几乎不再上升。这是因为,超声波产生的空化作用有利于茶皂素从细胞壁中出来;但当超声波功率过大时,可能会破坏茶皂素的性质[9]。因此,从降低能耗和得到高品质茶皂素的角度考虑,超声波功率以400W为宜。
2.3.3 超声波作用时间对茶皂素提取率的影响
在超声波功率为400W、乙醇体积分数为70%、温度为50℃、液料比为8∶1的条件下,考察超声波作用时间对茶皂素提取率的影响,结果见图5。
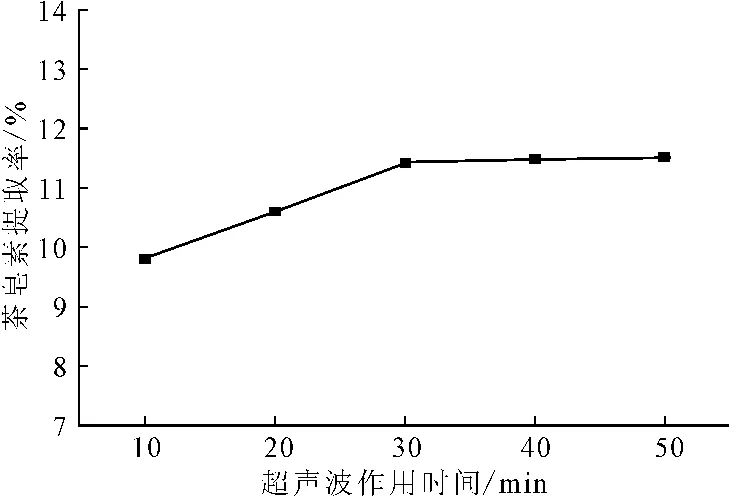
图5 超声波作用时间对茶皂素提取率的影响Fig.5 Effect of ultrasonic time on extraction rate of tea saponin
由图5可知,随着超声波作用时间的延长,茶皂素提取率逐渐升高;当超声波作用时间达到30min后,茶皂素提取率几乎达到平衡,继续延长超声波作用时间,提取率几乎不变。综合考虑能耗、提取周期等因素,超声波作用时间以30min为宜。
2.3.4 温度对茶皂素提取率的影响
在乙醇体积分数为70%、超声波功率为400W、超声波作用时间为30min、液料比为8∶1的条件下,考察温度对茶皂素提取率的影响,结果见图6。

图6 温度对茶皂素提取率的影响Fig.6 Effect of temperature on extraction rate of tea saponin
由图6可知,随着温度的升高,茶皂素提取率先升高后降低,在温度为50℃时茶皂素提取率达到最高。这是因为,温度升高,溶剂挥发较严重,溶液浓度几乎达到平衡,可能导致部分茶皂素分解,果胶、蛋白质等杂质凝固加快,从而阻止了茶皂素析出[10]。因此,温度以50℃为宜。
2.3.5 液料比对茶皂素提取率的影响
在乙醇体积分数为70%、温度为50℃、超声波功率为400W、超声波作用时间为30min的条件下,考察液料比对茶皂素提取率的影响,结果见图7。

图7 液料比对茶皂素提取率的影响Fig.7 Effect of liquid-solid ratio on extraction rate of tea saponin
由图7可知,随着液料比的不断增大(即溶剂量的不断增加),提取率逐渐升高;在液料比达到8∶1后,提取率基本保持不变。这是因为,增加溶剂量,溶质浓度越低,传质推动力越大,提取速度就越快,茶皂素提取率就相应升高。因此,液料比以8∶1为宜。
2.4 正交实验结果
根据单因素实验结果,从节约能源和得到高品质茶皂素的角度考虑,选用400W为正交实验最适超声波功率,以茶皂素提取率为考核指标,以乙醇体积分数、超声波作用时间、温度、液料比为考察因素,进行L9(34)正交实验优化提取工艺条件。正交实验的因素与水平见表1,结果与分析见表2。
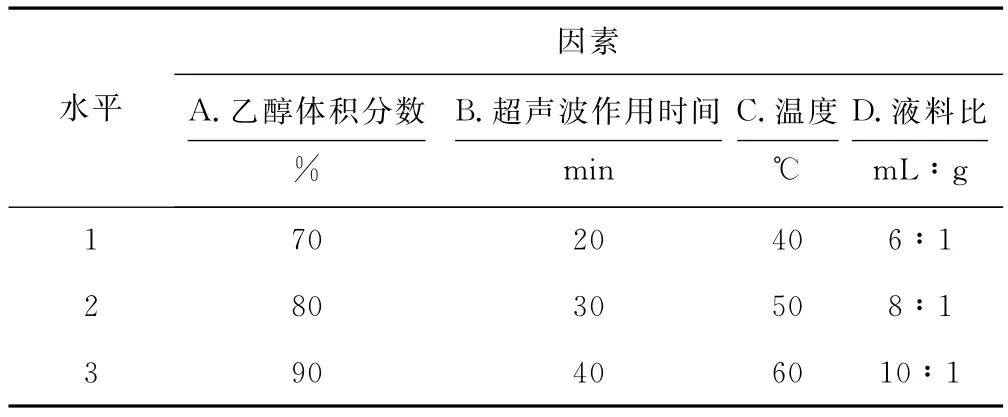
表1 正交实验的因素与水平Tab.1 Factors and levels of orthogonal experiment
由表2可知,各因素对茶皂素提取率的影响大小顺序为:液料比>乙醇体积分数>超声波作用时间>温度,最佳提取工艺条件为A2B3C2D2,即乙醇体积分数80%、超声波作用时间40min、温度50℃、液料比8∶1。在此最佳条件下进行验证实验,茶皂素提取率为13.27%,比正交实验的最高提取率略高,表明本实验确定的优化条件是可行的。
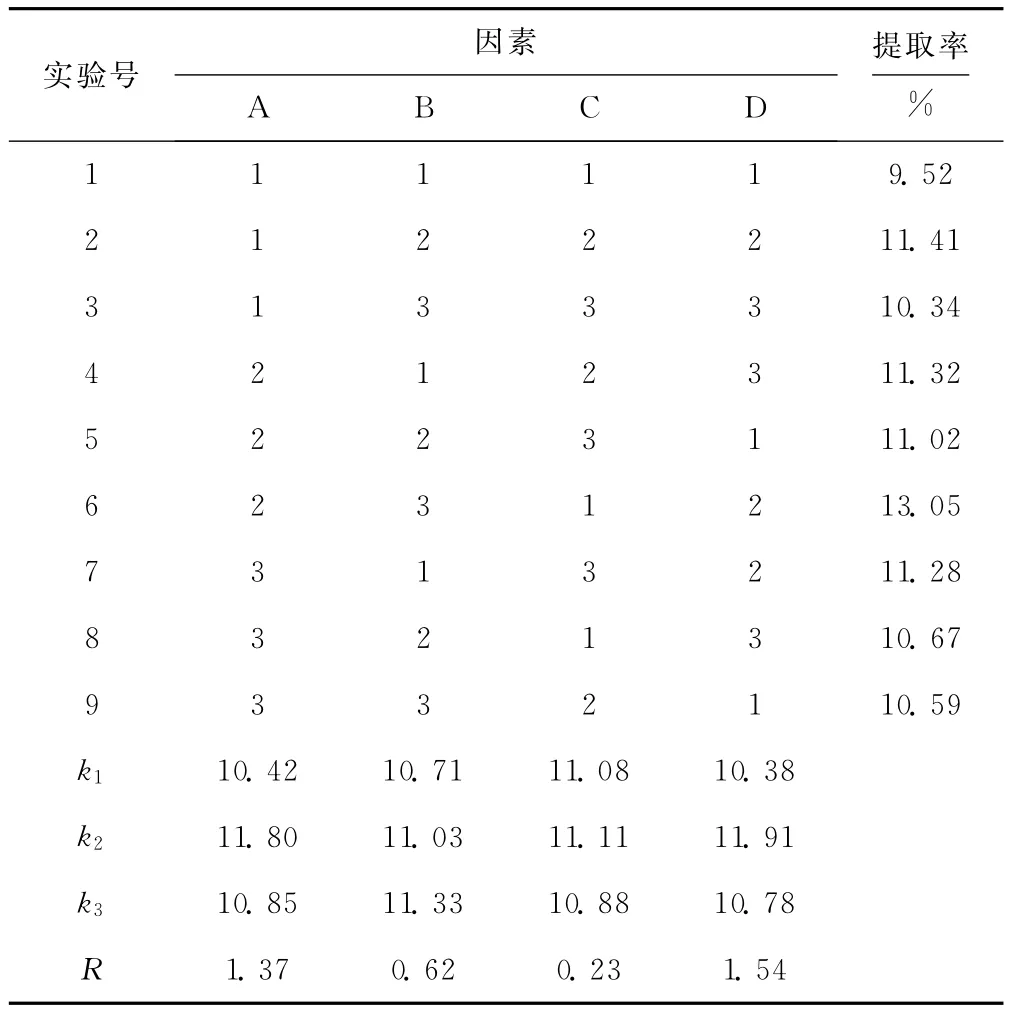
表2 正交实验结果与分析Tab.2 Results and analysis of orthogonal experiment
3 结论
通过单因素实验和正交实验确定超声波辅助乙醇法提取茶皂素的最佳工艺条件为:乙醇体积分数80%、超声波功率400W、超声波作用时间40min、温度50℃、液料比8∶1,在此条件下,茶皂素提取率达到13.27%。该法耗时短、提取率高,为茶皂素的工业化生产奠定了基础。
[1]王廷吉,魏俊峰,李天顺.茶皂甙纯化及其初步鉴定[J].华东地质学院学报,1991,14(1):88-92.
[2]周昊,王成章,陈虹霞,等.油茶中茶皂素的化学结构及提取分离工艺研究进展[J].林产化学与工业,2009,29(B10):233-237.
[3]叶雪良.茶皂素的开发与利用[J].化工生产与技术,2002,9(2):6-8.
[4]彭游,郎少杰,邓泽元,等.茶皂素光波干法提取与产品开发[J].天然产物研究与开发,2009,21(6):1023-1027.
[5]LI X,MA J Z,XIA J,et al.A study on the extraction and purification technology of tea sapogenin[J].Afr J Biotechnol,2010,9(18):2691-2696.
[6]傅春玲,洪奇华,阮晖,等.茶皂素定量测定方法的研究[J].杭州大学学报(自然科学版),1997,24(3):239-242.
[7]陈莹,刘松柏,何良兴,等.油茶籽粕和茶皂素中皂苷的定量检测方法研究[J].中国粮油学报,2012,27(2):105-111.
[8]蒋丽.茶皂素超声提取-纯化新工艺及产物抗菌活性研究[D].重庆:重庆理工大学,2011.
[9]郭树琴,吴胜举,牛春玲,等.超声提取绿茶茶多酚研究[J].陕西师范大学学报(自然科学版),2009,37(1):36-38.
[10]胡婕伦,聂少平,龚毅,等.响应曲面法优化茶皂素提取工艺的研究[J].食品科学,2009,30(18):106-109.
Optimization of Extraction Process of Tea Saponin by Ultrasonic-Assisted Ethanol Method
DU Zhi-xin,ZHANG Chong-jian,WAN Duan-ji
(College of Resource and Environmental Engineering,Hubei University of Technology,
Wuhan 430068,China)
Tea saponin was extracted by ultrasonic-assisted ethanol method with camellia seed cake as raw material.Extraction rate of tea saponin was detected by vanillin-sulfuric acid colorimetry.Using extraction rate of tea saponin as index,the extraction conditions were optimized by single factor experiment and orthogonal experiment.The optimal extraction conditions were obtained as follows:ethanol volumn fraction 80%,ultrasonic power 400W,ultrasonic time 40min,temperature 50℃,and liquid-solid ratio 8∶1(mL∶g).Under the optimal conditions,extraction rate of tea saponin was 13.27%.
tea saponin;ethanol;ultrasonic-assisted extraction;vanillin-sulfuric acid colorimetry
TQ 914.3 TS 229
A
1672-5425(2015)03-0056-04
10.3969/j.issn.1672-5425.2015.03.014
2014-11-04
杜志欣(1988-),女,山西运城人,硕士研究生,研究方向:天然产物提取,E-mail:duzhixin1989@163.com;通讯作者:万端极,教授。

