持续应用吸入型糖皮质激素对哮喘儿童生长发育的影响
颜卫红,李英,郭华,任善香,陈彤,李世芳,郑华
(1东营市人民医院市立儿童医院,山东东营257091;2胜利油田胜东社区锦苑卫生院)
持续应用吸入型糖皮质激素对哮喘儿童生长发育的影响
颜卫红1,李英2,郭华1,任善香1,陈彤1,李世芳1,郑华1
(1东营市人民医院市立儿童医院,山东东营257091;2胜利油田胜东社区锦苑卫生院)
目的 探讨长期应用吸入型糖皮质激素(ICS)对哮喘儿童生长发育的影响。方法 选择30例哮喘儿童为观察组,30例年龄与之匹配的健康儿童为对照组。观察组予丙酸氟替卡松吸入治疗2年。比较两组随访起点(观察组治疗前)及随访终点(观察组治疗满2年)身高、体质量。观察组用药前及用药6、12、24个月时分别抽取两组空腹静脉血,分离血清,采用ELISA法检测血清IGF-1、IGFBP-3水平,采用放射免疫法检测血清LEP、BGP水平。结果 两组随访起点及终点身高、体质量,血清IGF-1、IGFBP-3、LEP、BGP水平均无统计学差异。结论 长期应用ICS对哮喘儿童生长发育无明显影响。
吸入型糖皮质激素;哮喘;儿童;身高;体质量
哮喘是儿童最常见的慢性气道疾病, 患病率在全球呈上升趋势。吸入型糖皮质激素(ICS)已被公认为控制哮喘急性发作和预防复发最为有效的药物[1]。糖皮质激素存在许多不良反应,儿童处于生长发育的关键时期,目前国内有关长期应用ICS对儿童身高的影响、对下丘脑—垂体—肾上腺轴的抑制及对骨骼、脂肪代谢的影响的系统研究极少。我们观察了30例长期(2年)应用ICS的哮喘儿童和30例年龄与之匹配的健康儿童生长发育相关指标的变化,探讨长期应用ICS对儿童生长发育的影响。
1 资料与方法
1.1 临床资料 2005年1月~2013年12月在东营市人民医院门诊随诊的30例哮喘儿童为观察组,其中男19例, 女11例;年龄4~12岁, 平均8岁;均符合中华医学会制定的诊断标准[2], 病程1~7年,确诊后依据全球哮喘防治会议(GINA)方案的相关标准判断发作程度并确定治疗原则。均吸入ICS丙酸氟替卡松气雾剂(辅舒酮,125 μg×60喷)治疗,急性期每次125~250 μg,2次/d, 3岁或以上患儿采用储雾罐吸入,3岁以下患儿采用有活瓣的面罩储雾罐吸入。根据年龄及发作程度按GINA阶梯方案减量, 哮喘已控制达3个月以上者用最低维持剂量(125 μg)维持治疗24个月以上。近3个月内均未应用ICS。对照组为30例体检健康的儿童,其中男20例, 女10例;年龄4~10岁, 平均6岁。两组性别、年龄比较无统计学差异。
1.2 相关指标观察 两组随访时间均为2年。观察项目:①身高、体质量。记录两组随访起点(观察组治疗前)及随访终点(观察组治疗满2年)身高、体质量。②血清胰岛素样生长因子-1(IGF-1)、胰岛素样生长因子结合蛋白-3(IGFBP-3)、骨钙素(BGP)、瘦素(LEP)水平。观察组用药前及用药6、12、24 个月时分别抽取两组空腹静脉血,分离血清,采用ELISA法检测血清IGF-1、IGFBP-3水平,采用放射免疫法检测血清LEP、BGP水平。按试剂盒说明书操作。
2 结果
2.1 身高、体质量 两组随访起点、随访终点身高、体质量比较均无统计学差异,见表1。对两组儿童身高进行比较时已经考虑生长速率,两组儿童生长速率无明显差异。
2.2 血清IGF-1、IGFBP-3、LEP、BGP水平 观察组治疗前及治疗6、12、24 个月血清IGF-1、IGFBP-3、LEP及BGP与对照组相同时间点比较均无统计学差异,见表2。
3 讨论
哮喘是一种进行性的慢性非特异性炎症疾病[ 3],GINA 哮喘防治方案的主要内容是吸入药物(包括长期预防药物和快速缓解药物)及规范化管理。ICS可以较高浓度迅速到达病变部位,可最有效地控制气道过敏性炎症、降低气道高反应性。但长期应用ICS 的疗效及安全性一直是儿科医生关心的问题。国外Turktas 等[4]对应用ICS治疗的哮喘儿童进行了短期安全性观察,结果显示治疗组身高增长明显低于对照组(正常儿童)。Norjavaara 等[5]认为哮喘的严重程度是患儿最终身高的主要影响因素,但长期应用ICS对哮喘患儿身高没有明显影响。查胜年[6]报道,长期低剂量应用ICS对患儿的生长发育无明显影响,但其研究中患儿应用ICS时间较短,仅为1年。

表1 两组随访起点及随访终点身高、体质量比较±s)
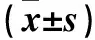
表2 两组血清IGF-1、IGFBP- 3、LEP及BGP变化
儿童的生长发育主要受生长激素、胰岛素样生长因子和胰岛素样生长因子结合蛋白系统及BGP、LEP等内分泌激素的共同调控。血清IGF-1水平主要受生长激素调节,其水平可反映生长激素状态。IGF-1和IGFBP-3是反映GH-IGF轴变化的主要指标[7]。BGP 是由成骨细胞分泌的非胶原蛋白,具有维持及调节骨钙的作用,血清BGP 水平能直接反映成骨细胞活性,比定期测身高的方法更敏感和精确,能在短期内预测促生长或抑制生长药物治疗的反应[8]。血清LEP水平是反映机体脂肪代谢紊乱程度的重要指标[9]。本研究结果显示,两组儿童随访起点及终点身高、体质量无统计学差异,各时点血清IGF-1、IGFBP-3、LEP、BGP的水平比较亦无统计学意义,说明长期应用ICS对儿童生长发育无明显影响,与文献结论一致[10~13]。提示对儿童哮喘长期应用ICS 维持量治疗较为安全。
[1] 杨锡强.小儿哮喘的免疫学发病机制及其对策[J].中国当代儿科杂志, 2001,3(5):490-492.
[2] 中华医学会儿科学分会呼吸学组.儿童支气管哮喘防治常规(试行)[J].中华儿科杂志,2004,42(2):100-106.
[3] Djukanovic J, Roche WR, Wilson JW, et al.Mucosalin flammation inasthma[J].Am Rev Respir Dis, 1990,14(2):434-457.
[4] Turktas I, Ozkaya O, Bostanci I, et al. Safety of inhaled corticosteroid therapy in young children with asthma[J]. Ann Allergy Immunol, 2001,86(6):649-654.
[5] Norjavaara E, Verdier GM, Lindmark B.Reduced height in Swedish men with asthma at the age of conscription for military service[J]. J Pediatr, 2000,137(1):25-29.
[6] 查胜年.低剂量糖皮质激素吸入治疗的持续时间对哮喘患儿预后的影响[J].海南医学,2013,24(7):983-984.
[7] 魏虹,梁雁,土慕逖.矮小儿童的生长激素—胰岛素样生长因子轴功能的检查[J].中华儿科杂志,2005,43(2):99-103.
[8] 黄江渝,胡演竹.血清骨钙素水平检测的临床应用现状[J].现代预防医学,2007,34(9):1674-1675.
[9] 彭惠,毕玫荣,潘峰.瘦素抵抗与肥胖的研究[J].中国优生与遗传杂志,2007,15(9):1-3.
[10] Peter SP. Safety of inhaled corticosteroid s in the treatment of persistent asthma[J]. J Natl Med Assoc, 2006,98 (6): 851-861.
[11] Anthracopoulos MB, Papadimitriou A, Panagiotakos DB,et al.Growth deceleration of children on inhaled corticosteroids is compensated for after the first 12 months of treatment[J]. Pediatr Pulmonol, 2007,42(5):465-470.
[12] Acun C, Tomac N, Ermis B, et al. Effects of inhaled corticosteroids on growth in asthmatic children: a comparison of fluticasone propionate with budesonide[J]. Allergy Asthma Proc, 2005,26(3):204-206.
[13] Altintas DU, Karakoc GB, Can S, et al. The effects of long term use of inhaled corticosteroids on linear growth,adrenal function and bone mineral density in children[J].Allergol Immunopathol(Madr), 2005,33(4):204-209.
颜卫红
10.3969/j.issn.1002-266X.2015.06.023
R563
B
1002-266X(2015)06-0061-02
2014-11-17)

