土茯苓切面不同颜色总多糖的提取工艺优选
杜洪志,农 亨,董立莎,何席呈,李家丽,张 静
(贵阳中医学院,贵州 贵阳550002)
土茯苓为百合科植物光叶菝葜(SmilaxglabraRoxb.)的干燥根茎。具除湿,解毒,通利关节之功,临床上广泛用于湿热,带下,疥癣,梅毒及汞中毒等疾病[1]。市售土茯苓切面均为白色[2],而产于贵州的土茯苓切面却为红色,贵州苗族称之为薄丈达,是具有贵州地域特点的苗族常用大宗传统药材,蕴藏量大并有资源优势。由此导致该药材在应用上的多元化和复杂化。同时,2种不同切面颜色土茯苓在相关化学成分及药效上存在着较大差异[3-4]。
近年研究发现,多糖具有增强机体免疫力、抗肿瘤及抗衰老的良好活性,毒副作用较小,故在医药学领域已成为国内外专家学者研究的热点[5-6]。多糖为土茯苓中主要大类成分之一,具有显著的抗肿瘤及抗氧化活性[7],但有关对比研究贵州产(切面红色)土茯苓与市售品(切面白色)土茯苓中总多糖的最佳提取工艺,迄今未见报道。为比较土茯苓不同切面颜色中总多糖的最佳提取工艺,笔者采用紫外-可见分光光度法及蒽酮-硫酸比色法测定总多糖含量,以期获得较高含量的土茯苓多糖。同时,对2010年版《中国药典》总多糖的显色条件进行优化,旨在筛选出简单高效、稳定可行的土茯苓总多糖检测方法,为土茯苓不同切面颜色筛选关键有效部位的药效学试验提供最佳给药组,也为该药材资源的合理利用及质量控制奠定一定基础。
1 材料与方法
1.1 材料、仪器与试剂
药材:切面为红色的土茯苓于2014年8月采自贵州省贵阳市乌当区水田镇,切面为白色的购自北京同仁堂(批号:130102),样品由贵阳中医学院生药教研室董立莎教授鉴定。
仪器:紫外-可见分光光度计(UV-2501PC 型,日本岛津公司),超声提取器(KQ5200型,昆山市超声仪器有限公司),万分之一分析天平(AB104-N型,梅特勒上海有限公司),十万分之一电子天平(XS205型,瑞士梅特公司),电热恒温鼓风干燥箱(GZX-GF101-Z-S-II,上 海 贺 德 实 验 设 备 有 限 公司),恒温水浴锅(HH-S4,常州普天仪器制造有限公司)。
试剂:无水葡萄糖对照品(批号:110833-200904,中国药品生物制品检定所),蒽酮(批号:20140421,国药集团化学试剂有限公司),蒸馏水为实验室自制,其余试剂均为分析纯。
1.2 对照品溶液的制备
取无水葡萄糖0.076 9 g,精密称定,置于25mL的棕色量瓶中,加蒸馏水溶解并定容至刻度,摇匀,即得3.076mg/mL葡萄糖对照品溶液,4℃保存备用。
1.3 总多糖提取样品的前处理
称取土茯苓不同切面颜色(二号筛)约50g,加入10倍量95%的乙醇,回流提取3次,每次1h,过滤,残渣用95%的热乙醇洗涤数次后55℃挥尽乙醇,烘干,即得总多糖提取样品,干燥器中保存备用。
1.4 供试品溶液的制备
分别称取经前处理的切面红色和切面白色样品约0.5g,精密称定,按单因素试验及正交试验因素水平表提取总多糖,冷却,补重,摇匀,离心10 min(转速为4 000r/min),取上清液置于50mL的棕色量瓶中,4℃保存备用。
1.5 显色条件的优化
显色条件的优化包括硫酸浓度的考察、蒽酮用量的考察、显色剂用量比的考察、热浴时间的考察、热浴温度的考察、冷却时间的考察。
1)硫酸浓度。取同一样品溶液于10mL 的具塞试管中,精密加入0.15%的蒽酮-硫酸溶液4mL,摇匀,90℃热浴显色15min,冰水混合物冷却15min。硫酸浓度设为50%、60%、70%、80%、90%和98%,其他显色因素均为定值,以蒸馏水为空白,在波长为630nm 处测定吸光度(下同)。
2)蒽酮用量。以80%的硫酸溶液作为溶剂,取同一样品溶液于10mL的具塞试管中,分别精密加入浓度为0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%和0.40%的蒽酮-硫酸溶液4mL,摇匀,90℃热浴显色15min,冰水混合物冷却15min。
3)显色剂用量比。取同一样品溶液于10 mL的具塞试管中,精密加入不同体积的0.15%的蒽酮-硫酸溶液,使显色剂与样品溶液的用量比分别为1∶1,1∶2,1∶4,1∶6,1∶8,1∶10,1∶12,1∶14,1∶16,1∶18,1∶20,摇匀,90℃热浴显色15 min,冰水混合物冷却15min。
4)热浴时间。取同一样品溶液于10mL 的具塞试管中,精密加入0.15%的蒽酮-硫酸溶液4mL,摇匀,分别于90℃热浴显色0min,5 min,10 min,15min,20 min,25 min,30 min,35 min,40 min,45min,50min,55min和60min,冰水混合物冷却15min。
5)热浴温度。取同一样品溶液于10mL 的具塞试管中,精密加入0.15%的蒽酮-硫酸溶液4mL,摇匀,分别于60℃、70℃、80℃、90℃和95℃热浴显色15min,冰水混合物冷却15min。
6)冷却时间。取同一样品溶液于10mL 的具塞试管中,精密加入0.15%的蒽酮-硫酸溶液4mL,摇匀,90℃热浴显色15 min,分别于冰水混合物中冷却0min、5min、10min、15min、20min、25min、30min,35min、40min和45min。
1.6 总多糖含量测定的方法学考察
1.6.1 线性关系的考察 精密量取对照品溶液0.1mL,0.4 mL,0.8 mL,1.2 mL,1.6 mL,2.0mL,分别置于25mL 的棕色量瓶中,加蒸馏水定容至刻度,分别取不同浓度的对照品溶液0.5mL于10mL的具塞试管中,精密加入0.15%的蒽酮-硫酸溶液4mL,摇匀,90℃热浴显色15min,冰水混合物冷却15min,以蒸馏水为空白,在最佳波长处测定吸光度,以吸光度为纵坐标,含量为横坐标,绘制标准曲线。
1.6.2 检测波长的选择 取葡萄糖对照品及样品溶液,按1.6.1项下方法显色,在200~800nm 进行全波长扫描,记录试验结果。
1.6.3 精密度试验 精密量取葡萄糖对照品溶液,按1.6.1项下方法连续测定6 次,记录试验结果。
1.6.4 重复性试验 取同一批号土茯苓样品6份,按1.4项方法制备供试品溶液,按1.6.1项下方法进行含量测定,记录试验结果。
1.6.5 稳定性试验 精密量取同一供试品溶液,按1.6.1项下方法分别在0 min,40 min,80 min,100min,120min,140min,180min进行吸光度测定,记录试验结果。
1.6.6 加样回收率试验 精密称取土茯苓粉末(二号筛)6份,每份0.25g,根据样品减半称样后总多糖的含量,加入等量的无水葡萄糖对照品,按1.4项制备供试品溶液,按1.6.1项下方法进行含量测定,计算回收率。
1.7 总多糖提取的不同因素考察
1.7.1 提取方法 在提取时间1 h、料液比1∶20(g/mL)、提取次数1次的条件下,分别采用回流提取,超声提取,测定总多糖含量(下同)。
1.7.2 提取温度 在提取时间1 h、料液比1∶20(g/mL)、提 取 次 数1 次 的 条 件 下,分 别 在60℃、70℃、80℃、90℃、95℃进行回流提取。
1.7.3 提取时间 在提取温度90℃、料液比1∶20(g/mL)、提取次数1 次的条件下,分别回流提取0.5h,1.0h,1.5h,2.0h。
1.7.4 提取次数 在提取温度90℃、料液比1∶20(g/mL)、提取时间1h的条件下,分别回流提取1次、2次、3次。
1.7.5 料液比 在提取温度90℃、提取次数1次、提取时间1h的条件下,分别采用料液比为1∶10(g/mL)、1∶20(g/mL)、1∶30(g/mL)、1∶40(g/mL)、1∶50(g/mL)进行回流提取。
1.8 总多糖提取的正交试验
以总多糖为指标,根据单因素试验结果,进行正交优化试验,以提取温度(A),提取时间(B),提取次数(C),料液比(D)为主要影响因素,设计L9(34)正交优化试验,每个样品平行制备3份样,按照1.6.1项下方法进行总多糖的含量测定。土茯苓不同切面颜色的正交试验因素水平见表1。

表1 土茯苓切面红色和白色正交试验设计因素水平表Table 1 The levers and factors of the orthogonal test of S.glabra with red and white transverse sections
2 结果与分析
2.1 检测波长
根据对照品与样品溶液的紫外吸收光谱,两者在630nm 处均有最大吸收,故确定最佳的测定波长为630nm。
2.2 显色条件的优化
1)硫酸浓度为50%、60%、70%、80%、90%和98%的 平 均 吸 光 度 分 别 为0.073 4、0.092 5、0.634 6、0.815 7、0.576 2和0.352 7。硫酸浓度为80%时吸光度值最大。
2)蒽酮用量的百分比为0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%和0.40%的平均吸光度分别为0.452 4、0.536 9、0.597 9、0.553 8、0.529 8、0.536 4、0.528 7和0.533 6。蒽酮用量的百分比为0.15%时吸光度值最大。
3)显色剂用量比为1∶1、1∶2、1∶4、1∶6、1∶8、1∶10、1∶12、1∶14、1∶16、1∶18和1∶20的平均吸光度分别为0.200 4、0.2356、0.782 5、0.678 2、0.601 3、0.554 2、0.512 9、0.401 2、0.335 7、0.234 5 和0.197 9。显色剂的用量比为1∶4时吸光度值最大。
4)热浴温度为60℃、70℃、80℃、90℃和95℃的平均吸光度分别为0.234 8、0.325 0、0.484 3、0.524 2和0.472 7,热浴温度为90℃时吸光度值最大。
5)热浴时间为0 min、5 min、10 min、15 min、20min、25 min、30 min、35 min、40 min、45 min、50min、55 min 和60 min 的 平 均 吸 光 度 分 别 为0.216 1、0.314 5、0.343 8、0.461 5、0.345 6、0.330 4、0.305 3、0.278 3、0.262 3、0.261 0、0.252 4、0.230 3 和0.212 1。热浴时间为15 min时吸光度值最大。
6)冷却时间为0 min、5 min、10 min、15 min、20min、25min、30min、35min、40min和45min的平均吸光度分别为0.265 7、0.275 4、0.285 6、0.309 8、0.291 7、0.285 4、0.274 3、0.273 1、0.262 4和0.264 9。冷却时间为15 min时吸光度值最大。
最佳显色条件为称取一定量的蒽酮,以80%的浓硫酸为溶剂,配制成0.15%蒽酮-硫酸溶液,摇匀,备用。精密吸取一定量的样品溶液,加入4倍量的显色剂,摇匀,于90℃的水浴中热浴15min,放入冰水混合物中冷却15min后取出,于最大吸收波长处测定吸光度,根据吸光度值计算总多糖的含量。
2.3 方法学考察
2.3.1 线性关系考察 根据1.6.1项下方法进行试 验,得 回 归 方 程y=6.290 5x+0.156 8,R2=0.999 5,结果表明葡萄糖在0.006 152~0.123 040mg具有良好的线性关系。
2.3.2 精密度试验 根据1.6.3项下方法进行试验,结果RSD为1.06%(n=6),表明仪器精密度良好。
2.3.3 重复性试验 根据1.6.4项下方法进行试验,结果RSD为2.34%,表明方法重复性良好。
2.3.4 稳定性试验 根据1.6.5项下方法进行试验,结果RSD为2.85%,表明样品显色后在3h内稳定性良好。
2.3.5 加样回收率试验 由表2 可知,土茯苓切面红色的平均回收率为94.60%,RSD=1.35%(n=6);切面白色的平均回收率为100.66%,RSD=1.96%(n=6),均符合要求。
2.4 不同因素对土茯苓不同切面颜色总多糖含量的影响
2.4.1 提取方法 土茯苓切面红色回流提取和超声提取的总多糖平均含量分别为10.98% 和1.412%;切面白色回流提取和超声提取的总多糖平均百分含量分别为34.94%和8.851%。结果表明,不同提取方法对土茯苓中总多糖的含量有较大影响,采用回流提取时,总多糖的含量较高,故选择回流提取进行试验。

表2 土茯苓不同切面颜色样品总多糖的加样回收率Table 2 Recovery rate of total polysaccharides in S.glabra with red and white transverse sections
2.4.2 提取温度 在提取温度为60℃、70℃、80℃、90℃和95℃时,土茯苓切面红色的总多糖平均含量分别为2.383%、3.133%、3.886%、8.909%和8.676%,切面白色的总多糖平均含量分别为1.211%、9.877%、20.316%、34.77%和32.89%。结果表明,不同提取温度对土茯苓总多糖的含量有较大影响,随着提取温度的升高,总多糖的溶出速率逐渐增大,当温度为90℃时,总多糖的含量达最大值;当温度为95℃时,总多糖的含量下降,表明较高温度不利于总多糖的溶出。
2.4.3 提取时间 在提取时间为0.5h、1.0h、1.5h和2.0h时,土茯苓切面红色的总多糖平均含量分别为9.039%、9.540%、10.82%和10.58%,切面白色的总多糖平均含量分别为33.04%、35.75%、37.46%和40.62%。结果表明,不同提取时间对土茯苓总多糖的含量有一定的影响,随着提取时间的延长,总多糖的溶出速率逐渐增大,当提取时间为1.5h,切面红色土茯苓的总多糖含量为最大值;当提取时间为2.0h,切面白色土茯苓的总多糖含量为最大值,这可能与切面白色土茯苓中总多糖含量较高有关,所需时间较长才能提取完全。
2.4.4 提取次数 在提取次数为1次、2次和3次时,土茯苓切面红色的总多糖平均含量分别为8.338%、9.045%和5.521%,切面白色的总多糖平均含量分别为28.17%、32.45%和27.31%。结果表明,不同提取次数对土茯苓总多糖的含量有一定的影响,提取1次未能将多糖提取完全,当提取2次时,总多糖的含量为最大值。
2.4.5 料液比 在料液比为1∶10(g/mL)、1∶20(g/mL)、1∶30(g/mL)、1∶40(g/mL)和1∶50(g/mL)时,土茯苓切面红色的总多糖平均含量分别为14.55%、9.850%、6.691%、6.331%和5.991%;切面白色的多糖平均含量分别为32.99%、37.93%、30.49%、26.73%和17.95%。结果表明,不同料液比对土茯苓总多糖的含量具有一定的影响,土茯苓切面红色的料液比为1∶10(g/mL)时,总多糖含量较高;土茯苓切面白色的料液比为1∶20(g/mL)时,总多糖含量较高,这可能与切面白色土茯苓中总多糖含量较高有关,所需溶剂用量较大才能提取完全。
2.5 土茯苓不同切面颜色正交试验各处理的总多糖含量
由表3可知土茯苓切面红色和白色正交试验各处理的总多糖含量。通过极差分析(表4)可知:切面红色为A>B>C>D,影响总多糖含量的因素依次为提取时间>提取次数>提取温度>料液比,最佳提取方案:A3B3C1D1,即用蒸馏水85℃回流提取1.5h,提取3次,料液比为1∶10(g/mL)。切面白色为B>A>D>C,影响总多糖含量的因素依次为提取次数>提取时间>料液比>提取温度,最佳提取方案:A3B1C3D3,即用蒸馏水95℃回流提取2h,提取1次,料液比为1∶30(g/mL)。
将试验结果进行方差分析,切面红色的料液比离均差平方和与极差值分别为2.144和1.187,为4个因素中的最小值,故将其列为误差项进行方差分析,用以检验其他因素作用的显著性[8],其中提取时间、提取次数、提取温度的P值均大于0.05,表明各因素对试验结果均无显著性影响。然切面红色土茯苓中提取时间与提取次数的P值均接近于0.05。通过LSD多重比较分析,提取2 次与3 次的P值小于0.05,两者之间具有显著性差异;而提取时间中,提取0.5h与1.0h、1.0h与1.5h之间的P值均小于0.05,表明2个总体均数之间具有显著性差异;而提取0.5h与1.5h的P值大于0.05,两者之间不具有显著性差异。表明,长时间提取并非能达到有效提高其提取率的效果。
切面白色的提取温度离均差平方和与极差值分别为29.545和4.420,为4 个因素中的最小值,故将其列为误差项进行方差分析,用以检验其他因素作用的显著性[8],其中提取时间、提取次数、料液比的P值均大于0.05,表明各因素对试验结果无显著性影响。
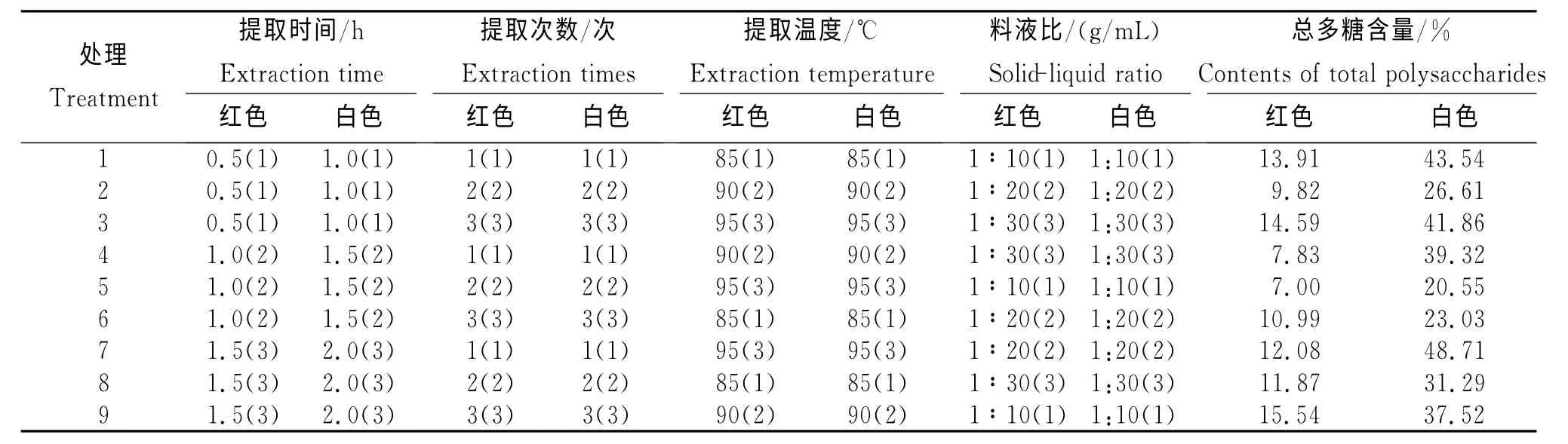
表3 土茯苓切面红色和白色的L9(34)正交试验各处理的总多糖含量Table 3 Contents of total polysaccharides for S.glabra with red and white transverse sections in the L9(34)orthogonal test

表4 土茯苓切面红色和白色正交试验各因素水平的总多糖含量的均值与极差Table 4 The average content and range of total flavonoids of polysaccharides for S.glabra with red and wuite transverse section under different factor levels of orthogon test
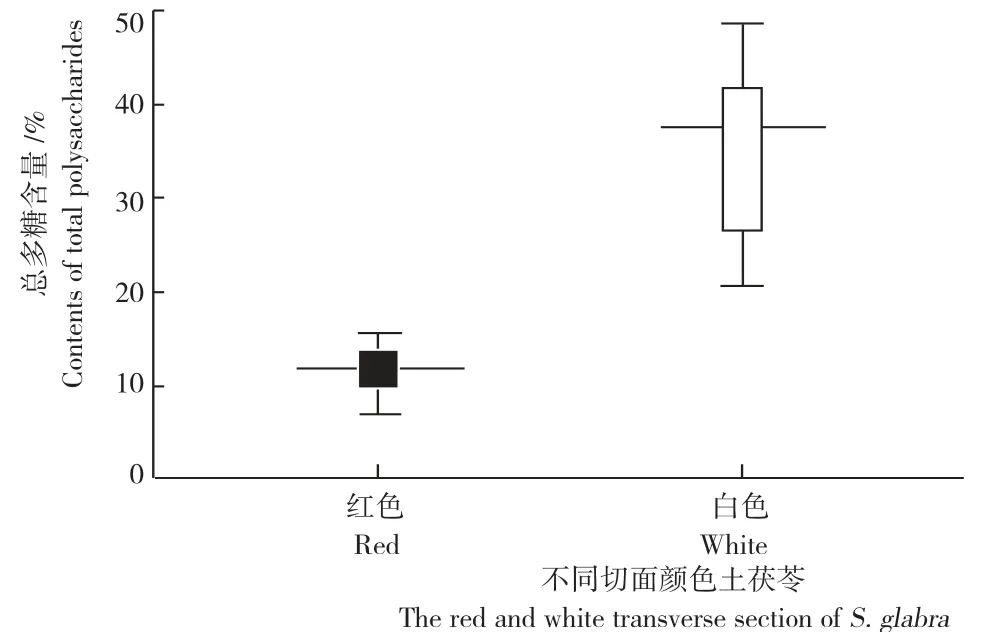
图示 土茯苓切面红色和场面白色的总多糖含量(95%的置信区间)Fig.The box plot of total polysaccharides percentage contents in red and white transverse section of S.glabra(95%confidence interval)
综上所述,土茯苓切面红色总多糖的最佳提取工艺为蒸馏水85℃回流提取1.5h,提取3次,料液比为1∶10(g/mL);土茯苓切面白色总多糖的最佳提取工艺为蒸馏水95℃回流提取2h,提取1次,料液比为1∶30(g/mL)。
将表3结果进行独立样本T 检验,比较数据之间的差异性。由图示可知,2组数据均服从正态分布,统计学上具有显著性差异,P<0.01。即土茯苓切面红色与切面白色的总多糖含量存在着较大差异,后者较高。
2.6 工艺验证
按土茯苓切面红色总多糖的最佳提取工艺A3B3C1D1提取,即用蒸馏水85℃回流提取1.5h,提取3次,料液比为1∶10(g/mL),平行3份样,平均提取率为19.40%,RSD=1.79%;按土茯苓切面白色总多糖的最佳提取工艺A3B1C3D3提取,即用蒸馏水95℃回流提取2h,提取1 次,料液比为1∶30(g/mL),平行3份样,平均提取率为48.43%,RSD=2.26%。表明,正交试验所选参数合理,提取工艺重复性、稳定性均较好。
3 结论与讨论
1)通过正交优化试验,考察提取温度、提取时间、提取次数和料液比等因素对土茯苓不同切面颜色总多糖提取率的影响,优选出最佳提取工艺,并对该工艺进行了方法验证,结果表明土茯苓切面红色总多糖的最佳提取工艺为蒸馏水85℃回流提取1.5h,提取3次,料液比为1∶10(g/mL);土茯苓切面白色总多糖的最佳提取工艺为蒸馏水95℃回流提取2h,提取1次,料液比为1∶30(g/mL)该方法重复性良好,工艺稳定,该工艺下切面红色和白色的多糖提取率分别为19.40%和48.43%土茯苓总多糖的提取率较高。同时,也为土茯苓筛选关键有效部位的药效学试验提供了最佳给药组。
2)通过对蒽酮-硫酸比色法的显色条件进行系统优化发现,2010版《中国药典》收载的显色方法并非为最佳的显色条件,因药材及成分不同,显色条件差异较大,故试验中要根据具体的药材进行显色条件的优化。同时,在试验中,蒽酮-硫酸溶液必须现配现用,检测条件不同,空白溶液的配制亦不同,优选蒽酮-硫酸溶液浓度时,需配制与样品溶液相对应的5种空白溶液。
3)试验采用SPSS18.0进行统计分析,由方差分析结果可知,土茯苓不同切面颜色各因素的P值均大于0.05,然切面红色土茯苓中提取时间与提取次数的P值均接近于0.05。通过LSD多重比较分析:提取2次与3次的P值小于0.05,两者之间具有显著性差异。提取时间中,提取0.5h 与1.0h、1.0h与1.5h之间的P值均小于0.05,表明2个总体均数之间具有显著性差异;而提取0.5h与1.5h的P值大于0.05,两者之间不具有显著性差异,表明,长时间提取并非能达到有效提高其提取率的效果。表明,在实际生产中,将提取时间与提取次数作为工艺的主要影响因素,这为工业化生产中批量生产工艺的选择提供了一定的试验依据。
4)李时珍在《本草纲目》曾记载:“土茯苓,楚、蜀山箐中甚多,蔓生如莼,茎有细点,根状如菝葜而圆,连缀而生,有赤白二种,入药用白者良。研究发现,土茯苓切面白色的总多糖含量约为切面红色的2倍,将两个总体进行独立样本T 检验,结果两组数据之间具有显著性差异,表明土茯苓不同切面颜色总多糖的含量差异较大,其结果提示土茯苓可能存在一个未被认识的生态类型,该类型在贵州有着较为广泛的分布。然而,历代本草均认为,土茯苓“有赤白二种,入药白者良”[9],故总多糖是否为与该观点相吻合的药效学组分,还有待进一步研究。
[1]国家药典委员会.中国药典(一部)[M].北京:化学工业出版社,2010:17-18.
[2]杜洪志,农 亨,董立莎,等。正交试验优选土茯苓(断面红棕色及类白色)药材中总鞣质的提取工艺[J].时珍国医国药,2014,25(7):1570-1572.
[3]张 华,董立莎,陈虎彪,等.断面红棕色及类白色土茯苓药材中总鞣质的含量分析[J].中国中药杂志,2013,38(6):852-855.
[4]葛向前,董立莎,吴曙光,等.断面红棕色及类白色土茯苓抗炎作用的比较研究[J].中药药理与临床,2012,28(6):103-105.
[5]喻录容,石 平,何先元,等.野生墨旱莲粗多糖的超声提取工艺 [J].贵州农业 科 学,2013,41(4):124-126.
[6]Jian-an Wei,Xing Zeng,Ling?Han,et al.The regulatory effects of Polyporus polysaccharide on the nuclear factor kappa B signal pathway of bladder cancer cells stimulated by Bacillus Calmette-Guerin[J].Chinese journal of integrative medicine,2011,17(7):531-536.
[7]郑林龙,蒋剑平,许海顺,等.响应面法优化土茯苓多糖的提取工艺及抗氧化活性研究[J].中华中医药杂志,2014,29(3):918-922.
[8]张春华,严云良.医药数理统计[M].北京:科学出版社 ,2001:212.
[9]肖培根.新编中药志[M].北京:化学工业出版社,2002:60.

