内质网应激途径诱导肾小管上皮细胞凋亡在横纹肌溶解肾损伤过程中的作用
王远大,洪权,吕杨,张雪光,张利,吴镝,陈香美
内质网应激途径诱导肾小管上皮细胞凋亡在横纹肌溶解肾损伤过程中的作用
王远大,洪权,吕杨,张雪光,张利,吴镝,陈香美
目的 探讨内质网应激(ERS)诱导的肾小管上皮细胞凋亡是否参与了横纹肌溶解肾损伤过程。方法 雄性Wistar大鼠33只,根据标本采集时间分为对照组及模型组,后者又按照时间分为1、3、6、12、24、48、72、96、120、168h 10个亚组(n=3)。建立甘油诱导横纹肌溶解肾损伤大鼠模型,建模后于相应时间点分别处死大鼠,收集血清及肾脏组织,利用肾功能指标和肾组织病理评估不同时间点肾脏损伤程度;采用TUNEL染色评估肾小管上皮细胞凋亡程度;Western blotting检测死亡受体途径和线粒体凋亡途径关键凋亡因子caspase-8、细胞色素C及caspase-9活性片段的表达,同时检测ERS伴侣蛋白GRP-78和特异性内质网凋亡因子caspase-12活性片段的表达。结果 横纹肌溶解肾损伤后1h肾小管上皮细胞出现病变,24h出现大量坏死、脱落,肾小管上皮细胞凋亡数最高,72h肾小管-间质损伤达高峰。横纹肌溶解肾损伤后凋亡因子caspase-8、细胞色素C和caspase-9的表达上调,12h达到高峰(P<0.05),GRP-78表达升高趋势与caspase-12一致。结论 肾小管上皮细胞凋亡是横纹肌溶解肾损伤的主要发病机制,除了死亡受体及线粒体途径的活化,ERS也可能在此过程中发挥了重要作用。
横纹肌溶解;急性肾损伤;细胞凋亡;内质网应激
急性肾损伤(acute kidney injury,AKI)是横纹肌溶解的严重并发症[1]。横纹肌溶解导致的AKI的发生发展与炎症、氧化应激等多种病理生理过程有关[2-3],近年来有研究证实有害刺激可通过诱导肾小管上皮细胞凋亡参与横纹肌溶解导致的急性肾损伤[4]。在缺血再灌注肾损伤、急性肾衰竭及药物刺激肾小管上皮细胞过程中均会出现内质网应激(endoplasmic reticulum stress,ERS)。有研究显示,低氧状态可引起肾小管上皮细胞ERS标志物GRP-78蛋白表达上调[5-8],其根本原因是产生了氧自由基。在横纹肌溶解过程中肌细胞释放出肌红蛋白可导致活性氧分子失控,并产生大量氧自由基,诱发ERS。此外,横纹肌溶解导致急性肾损伤的发病过程中同样有肾脏缺血现象。因此我们推测,在横纹肌溶解导致急性肾损伤时,ERS参与了肾小管上皮细胞凋亡途径被激活的过程。本研究采用肌注甘油诱导横纹肌溶解急性肾损伤大鼠模型进行观察,以期发现横纹肌溶解导致急性肾损伤的新的发病机制。
1 材料与方法
1.1 实验动物 实验用雄性Wistar大鼠33只,清洁级(购自军事医学科学院实验动物中心)。实验期间以常规鼠饲料喂养,自由摄食、饮水,自然昼夜采光,室温18~28℃,相对湿度40%~70%。
1.2 主要试剂 小鼠细胞色素-C,兔抗caspase-3、8、9、12,山羊抗GRP-78多克隆抗体购自美国Santa Cruz Biotechnology公司;小鼠β-actin单克隆抗体购自美国Sigma公司;TUNEL染色试剂盒购自美国Promega公司。
1.3 实验分组及方法 33只Wistar雄性大鼠按照随机设计原则以标本采集时间分为对照组及模型组,后者又按照时间分为1、3、6、12、24、48、72、96、120、168h 10个亚组,每组3只。大鼠提前禁水24h,模型组分别在双后肢股内外侧肌肉注射等剂量50%甘油生理盐水(10ml/kg),对照组则注射等体积生理盐水。各组大鼠分别于相应时间点用2%戊巴比妥钠(40mg/kg)腹腔注射麻醉,腹正中切口,取出双肾,用冰盐水冲洗后迅速沿冠状面切成薄片,部分置于4%甲醛溶液中固定48h,用于制备石蜡切片;部分液氮冷冻后于-80℃冻存,用于提取蛋白质行Western blotting分析。腹主动脉穿刺取血,4℃、3000r/min离心15min,分离血清,-20℃冰箱保存备用。
1.4 血清肌酸激酶、血肌酐检测 采用日立7150型全自动生化分析仪进行测定。
1.5 肾组织病理学改变检测 肾组织标本用4%甲醛固定24h,常规脱水、石蜡包埋,2μm切片,常规脱蜡,经HE、PAS染色观察肾脏组织病理改变。肾小管-间质损伤采用Paller法进行评分[9],每只大鼠肾组织随机选择10个无重叠视野(×200),每个视野下随机选择10个肾小管,共按100个肾小管计分:肾小管明显扩张、细胞扁平(1分);刷状缘脱落(1分);空泡变性(1分);肾小管内出现管型(1~2 分);肾小管上皮细胞坏死(1~2分);上皮细胞颗粒变性(1分);细胞核固缩(1分)。
1.6 细胞凋亡的检测 肾组织用4%甲醛固定过夜,脱水、透明、石蜡包埋,切片厚2μm,置于包被有多聚赖氨酸的载玻片上。TUNEL染色按试剂盒说明书操作。计数每个视野中TUNEL阳性细胞数及细胞总数。每张切片随机取6~8个不重叠视野,每个肾脏观察2~3张切片。每个肾脏的细胞凋亡程度以TUNEL阳性细胞数占细胞总数的百分比表示[10]。
1.7 Western blotting检测肾组织内caspase-3、caspase-8、caspase-9、细胞色素C、caspase-12、GRP-78蛋白的表达 RIPA细胞裂解液匀浆裂解肾组织,冰浴30min,4℃、12 000r/min离心30min,取上清,BCA法测定蛋白浓度。SDS加样缓冲液变性蛋白后进行电泳和转膜。随后分别进行caspase-3、caspase-8、caspase-9、细胞色素C、caspase-12、GRP-78的杂交。以β-actin蛋白表达作为参照,采用Image J 1.42图像分析软件进行半定量分析。
1.8 统计学处理 采用SPSS 17.0软件进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析,非参数资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血清肌酸激酶及肾功能(血肌酐)变化情况 注射甘油后1h血清肌酸激酶即开始升高,第12h达峰值,之后逐渐下降,48h下降至正常水平;与对照组比较,模型组1、3、6、12、24h血清肌酸激酶水平明显升高(P<0.01)。注射甘油后1h血肌酐即开始升高,第48h达峰值,之后逐渐下降,168h下降至正常水平;与对照组比较,模型组3、6、12、24、48、72、96、120h血肌酐水平明显升高(P<0.01,图1)。
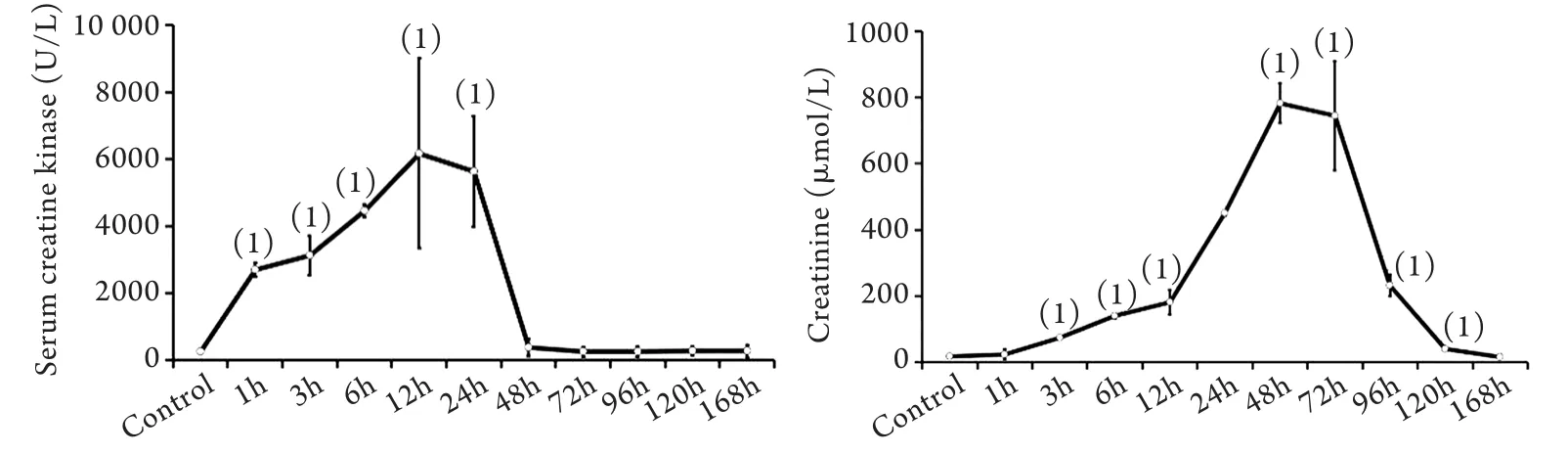
图1 横纹肌溶解肾损伤后血清肌酸激酶(A)和血肌酐(B)检测结果Fig.1 Serum creatine kinase (CK) and creatinine (Scr) level in rhabdomyolysis kidney injury
2.2 肾组织病理学改变 PAS染色结果显示,注射甘油后1h近端肾小管上皮细胞开始出现空泡样变性和颗粒样变性;3h时空泡样变性和颗粒样变性加重,近端肾小管扩张,肾小管腔内可见均质红染的蛋白管型;6h肾小管上皮细胞核开始出现去极化,管型增多;12h肾小管上皮细胞变性继续加重,可见刷状缘脱落,管腔内管型数量减少;24h时刷状缘消失,可见细胞核染色质浓集,肾小管上皮细胞排列紊乱,有明显的上皮细胞脱落及基底膜裸露,管腔内可见脱落的细胞和细胞碎片;48h肾小管上皮细胞大量脱落,管腔内坏死细胞碎片增多,细胞管型增加;72h管腔内有大量坏死细胞碎片,开始出现修复,裸露的基底膜上开始出现重排的上皮细胞;96h坏死小管上皮细胞明显减少,管腔内细胞管型数量也明显减少,小管上皮细胞明显修复;120h及168h组织病变明显修复(图2)。肾脏组织学评分自第1h开始明显升高,第72h达峰值,随后逐渐下降(表1)。
表1 肾小管-间质损伤组织学评分(±s, n=3)Tab.1 Histological score of tubular- interstitial injury (±s, n=3)
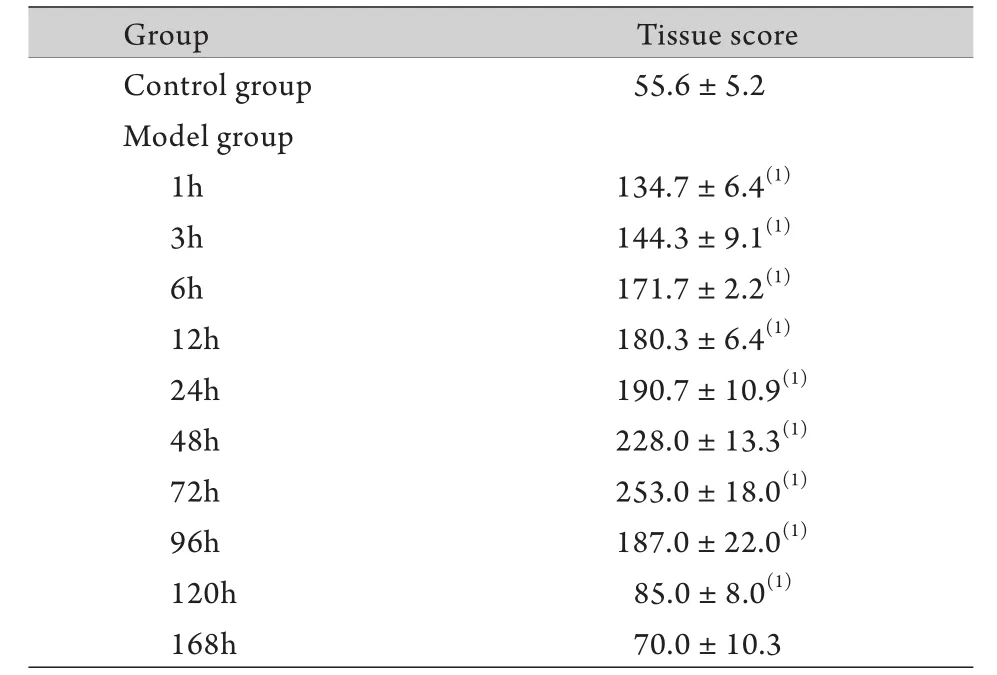
表1 肾小管-间质损伤组织学评分(±s, n=3)Tab.1 Histological score of tubular- interstitial injury (±s, n=3)
(1)P<0.01 compared with control group
2.3 横纹肌溶解急性肾损伤大鼠肾组织凋亡情况
横纹肌溶解急性肾损伤大鼠肾组织细胞核染成棕褐色的细胞为TUNEL阳性细胞(即凋亡细胞),主要见于肾脏皮髓质交界处的小管壁和管腔,皮质部分也可见到部分凋亡细胞,管腔脱落细胞中大部分TUNEL染色阳性。正常对照组无凋亡细胞,注射甘油后1h开始即出现凋亡细胞,随着时间的延长,凋亡细胞数目明显增多,12h管腔内开始出现脱落的凋亡细胞,24h凋亡细胞数目达到峰值且多数脱落于管腔,48h开始凋亡细胞明显减少,第72h基本恢复正常(图3)。各时间点肾小管凋亡评分与对照组比较差异均有统计学意义(P<0.05,表2)。
表2 肾小管上皮细胞凋亡计数(±s, n=3)Tab.2 Counts of apoptotic renal tubular epithelial cells (±s, n=3)
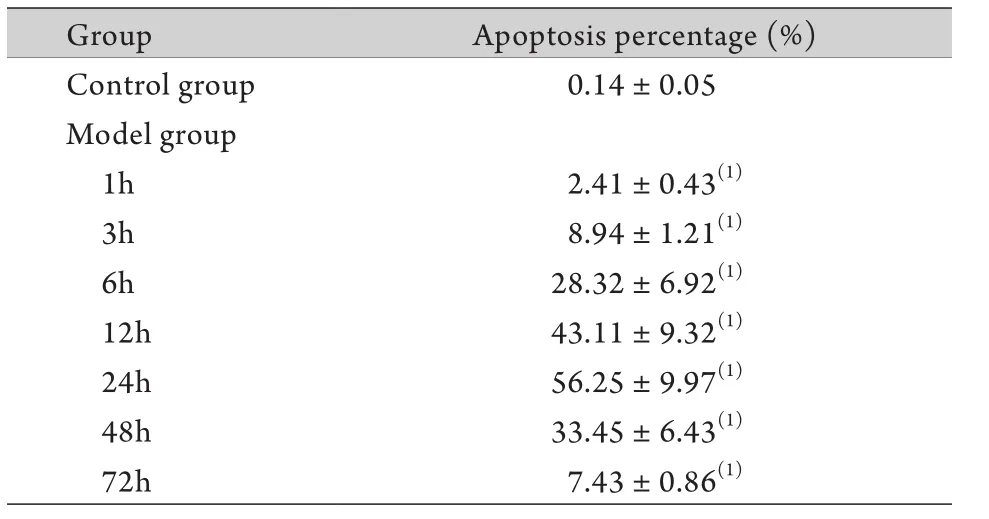
表2 肾小管上皮细胞凋亡计数(±s, n=3)Tab.2 Counts of apoptotic renal tubular epithelial cells (±s, n=3)
(1)P<0.01 compared with control group
2.4 肾组织凋亡相关蛋白caspase-8、细胞色素C、caspase-9、caspase-3活性片段蛋白的表达情况 选取病变最重时段1~72h及对照组肾组织进行蛋白质分析。死亡受体途径与线粒体途径的关键凋亡因子在横纹肌溶解肾损伤过程中均呈高表达,但表现出的时间趋势并不一致,死亡受体途径凋亡因子caspase-8在受到凋亡刺激的最初时间就开始高表达,而线粒体途径凋亡因子caspase-9的表达呈逐渐升高趋势,6h达到高峰。但两条途径凋亡因子的表达均在横纹肌溶解12h后明显下调。对照组大鼠caspase-8活性片段也有表达,但表达量非常低,而横纹肌溶解肾损伤大鼠肾组织caspase-8活性片段的蛋白表达自1h即高表达至峰值,之后随时间的延长逐渐下降,24h后开始明显下降,1、3、6、12、24h的表达水平差异均有统计学意义(P<0.05)。细胞色素C蛋白表达自1h开始逐渐升高,6h达到峰值,24h开始降低,1、3、6、12、24h的表达水平与对照组比较均明显升高(P<0.05)。Caspase-9活性片段蛋白的表达自1h即上升,随时间延长其表达逐渐升高,6h达峰值,12h开始下降,1、3、6、12、24、48h的表达水平与对照组比较差异有统计学意义(P<0.05)。Caspase-3活性片段蛋白在对照组大鼠中的表达量非常低,而横纹肌溶解肾损伤大鼠的caspase-3活性片段蛋白自1h即开始上升,12h内表达基本稳定,24h后开始下降,48h即明显降低,但仍高于对照组(P<0.05,图4)。
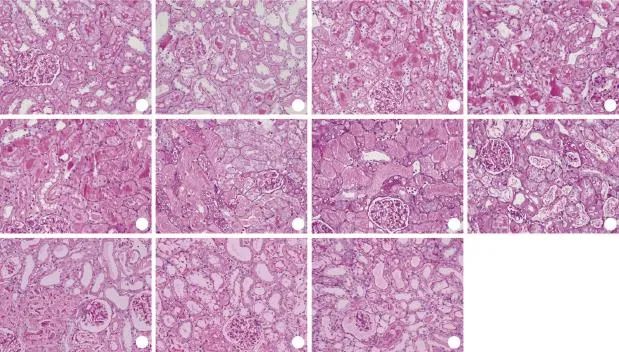
图2 横纹肌溶解肾损伤后的肾脏病理改变(PAS ×200)Fig.2 The pathology changes and image analysis after rhabdomyolysis-induced kidney injury (PAS ×200)
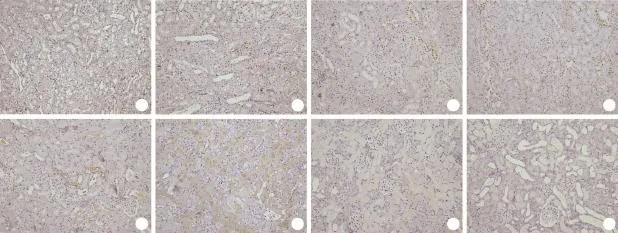
图3 横纹肌溶解急性肾损伤大鼠肾小管上皮细胞凋亡情况(TUNEL ×200)Fig.3 Cell apoptosis of the renal tubular epithelial cells in rats with rhabdomyolysis-induced kidney injury (TUNEL ×200)

图4 肾组织凋亡相关蛋白的表达情况(Western blotting)Fig.4 Expression profiles of apoptosis-related protein in the renal tissue (Western blotting)
2.5 肾组织中ERS相关蛋白GRP-78及caspase-12活性片段的表达 在横纹肌溶解导致急性肾损伤后1h,未折叠蛋白反应相关伴侣蛋白GRP-78表达即开始上升,12h达峰值,之后逐渐下降。模型组各时间点与对照组比较差异均有统计学意义(P<0.05)。ERS特异相关的凋亡因子caspase-12活性片段的表达改变与GRP-78一致,同样也是在横纹肌溶解肾损伤后1h就开始升高,随时间的延长逐渐升高,在第12h表达最高,24h即开始逐渐降低,1、3、6、12、24、48h的表达水平与对照组比较差异均有统计学意义(P<0.05,图5)。
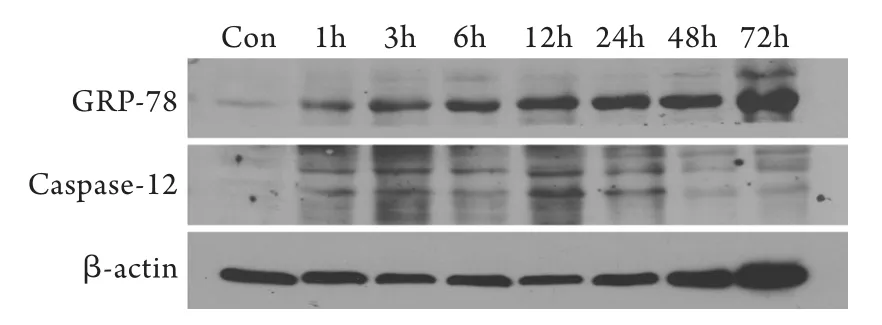
图5 肾组织GRP-78和caspase-12蛋白表达(Western blotting)Fig.5 Protein expression of GRP-78 and caspase-12 in the renal tissue (Western blotting)
3 讨 论
本研究采用甘油肌注方法[11]成功建立了挤压伤致肾损伤大鼠模型,大鼠血肌酐水平在肌内注射甘油48h达到峰值,之后逐渐下降,至1周时基本恢复正常。主要病理改变为肾小管上皮细胞肿胀和空泡变性、颗粒变性,细胞凋亡-细胞核固缩,上皮细胞脱落、坏死,以及远端肾小管大量的肌红蛋白管型等典型现象。
细胞凋亡的异常增加是某些损伤因素导致细胞死亡的主要形式[12]。本研究TUNEL染色结果显示,24h时肾小管上皮细胞凋亡数量达到峰值,且大部分脱落于肾小管管腔,与光镜下的病理表现一致,PAS染色也是在24h开始出现大量肾小管上皮细胞脱落于管腔。横纹肌溶解导致急性肾损伤时,随时间的延长大鼠肾组织细胞凋亡逐渐增多,24h时细胞凋亡数量达到峰值,肾脏组织病理改变也随时间延长逐渐加重,于第24h开始出现大量上皮细胞坏死、脱落,第48h达到峰值,提示肾小管上皮细胞凋亡在急性肾损伤发生发展中发挥着重要作用。
本研究结果提示,死亡受体途径和线粒体途径都参与了肾小管上皮细胞凋亡,与文献报道的结果一致[4]。但本研究中分别代表了死亡受体途径和线粒体途径的两种凋亡因子caspase-8和caspase-9随时间变化的趋势并不完全一致,caspase-8活性片段的表达在1h即达到峰值并随时间延长逐渐降低,12h之后明显降低,而caspase-9的表达最初随时间逐渐升高,6h达到峰值,之后才逐渐降低,提示死亡受体途径可能在接受有害刺激信号的时候首先开始活跃。
ERS是一条新的细胞凋亡信号传导通路[13-15],称之为内质网相关性死亡(ER-associated death,ERAD)途径,capase-12蛋白水解酶的活化是其标志[16]。ERS蛋白如GRP-78、GRP-94及CHOP等表达增加,可提高ERS状态下细胞处理未折叠蛋白或抵御其他细胞应激的能力,其中GRP-78是ERS的经典标志物[17]。
本研究发现在横纹肌溶解肾损伤大鼠模型中,ERS的经典标志物GRP-78的表达于注射甘油后1h即开始升高,并随时间延长呈逐渐升高趋势,提示ERS在横纹肌溶解肾损伤的早期阶段即开始启动,12h达最高,之后逐渐降低。而TUNEL染色显示凋亡细胞峰值出现在24h,GRP-78的表达峰值早于凋亡细胞峰值,提示ERS调节不能有效地逆转上皮细胞损伤,转而出现凋亡,激活凋亡信号(caspase-12表达升高),促进肾小管上皮细胞凋亡。这说明ERS途径很有可能参与了大鼠横纹肌溶解肾损伤诱导的肾小管上皮细胞凋亡。
综上所述,本研究证实对于横纹肌溶解肾损伤诱导的肾小管上皮细胞凋亡,除死亡受体途径和线粒体途径外,ERS途径很有可能参与其中,但三条途径活化的时间点不一致,考虑其原因可能是肾脏皮质、髓质等部位因为结构特点不同,导致在横纹肌溶解过程中病变的形式并不相同,从而引起的刺激信号也并不相同,因此启动了不同的凋亡途径,而每条途径凋亡因子活化的速度不同,导致每条途径反应的速度不完全一致。当细胞开始出现大量坏死时,凋亡细胞减少,凋亡信号的表达也逐渐减低,因此三条途径到达同一时间后共同减弱。比较一致的是三条凋亡途径的凋亡因子均在12h内高表达,提示提前或在发病早期阶段对凋亡信号进行干预可能更有效地抑制肾小管上皮细胞凋亡,达到改善横纹肌溶解肾损伤的目的。这也为我们治疗横纹肌溶解肾损伤提供了新的思路。
[1] Heyne N, Guthoff M, Weisel KC. Rhabdomyolysis and acute kidney injury[J]. N Engl J Med, 2009, 361(14): 1412-1413.
[2] Korantzopoulos P, Galaris D, Papaioannides D. Pathogenesis and treatment of renal dysfunction in rhabdomyolysis[J]. Intensive Care Med, 2002, 28(8): 1185.
[3] Melli G, Chaudhry V, Cornblath DR. Rhabdomyolysis: an evaluation of 475 hospitalized patients[J]. Medicine (Baltimore), 2005, 84(6): 377-385.
[4] Homsi E, Janino P, de Faria JB. Role of caspases on cell death, inflammation, and cell cycle in glycerol-induced acute renal failure[J]. Kidney Int, 2006, 69(8): 1385-1392.
[5] Montie HL, Kayali F, Haezebrouck AJ, et al. Renal ischemia and reperfusion activates the eIF 2 alpha kinase PERK[J]. Biochim Biophys Acta, 2005, 1741(3): 314-324.
[6] Bando Y, Tsukamoto Y, Katayama T, et al. ORP150/HSP12A protects renal tubular epithelium from ischemia-induced cell death[J]. FASEB J, 2004, 18(12): 1401-1403.
[7] Bando Y, Ogawa S, Yamauchi A, et al. 150-kDa oxygen-regulated protein (ORP150) functions as a novel molecular chaperone in MDCK cells[J]. Am J Physiol Cell Physiol, 2000, 278(6): C1172-C1182.
[8] Lorz C, Justo P, Sanz A, et al. Paracetamol-induced renal tubular injury: a role for ER stress[J]. J Am Soc Nephrol, 2004, 15(2): 380-389.
[9] Paller MS, Hoidal JR, Ferris TF. Oxygen free radicals in ischemic acute renal failure in the rat[J]. J Clin Invest, 1984, 74(4): 1156-1164.
[10] Zhu T, Au-Yeung KK, Siow YL, et al. Cyclosporine A protects against apoptosis in ischaemic/reperfused rat kidneys[J]. Clin Exp Pharmacol Physiol, 2002, 29(9): 852-854.
[11] Zager RA. Rhabdomyolysis and myohemoglobinuric acute renal failure[J]. Kidney Int, 1996, 49(2): 314-326.
[12] Hengartner MO. Apoptosis: corralling the corpses[J]. Cell, 2001, 104(3): 325-328.
[13] Nakagawa T, Zhu H, Morishima N, et al. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta[J]. Nature, 2000, 403(6765): 98-103.
[14] Zong WX, Li C, Hatzivassiliou G, et al. Bax and Bak can localize to the endoplasmic reticulum to initiate apoptosis[J]. J Cell Biol, 2003, 162(1): 59-69.
[15] Zeng W, Luo ZF, Qi W, et al. Effect of endoplasmic reticulum stress on uremic serum-induced endothelial cell dysfunction[J]. Med J Chin PLA, 2011, 36 (2): 133-136. [曾薇, 罗志锋, 齐伟, 等. 内质网应激在尿毒症血清致内皮细胞功能异常中的作用[J]. 解放军医学杂志, 2011, 36 (2): 133-136.]
[16] Oyadomari S, Araki E, Mori M. Endoplasmic reticulum stressmediated apoptosis in pancreatic beta-cells[J]. Apoptosis, 2002, 7(4): 335-345.
[17] Yoshida H. ER stress and diseases[J]. FEBS J, 2007, 274(3): 630-658.
Role of endoplasmic reticulum stress-induced apoptosis of renal tubular epithelial cells in rhabdomyolysis-associated acute kidney injury
WANG Yuan-da, HONG Quan, LV Yang, ZHANG Xue-guang, ZHANG Li, WU Di, CHEN Xiang-mei*
Department of Nephrology, General Hospital of PLA, Chinese PLA Institute of Nephrology, State Key Laboratory of Kidney Diseases, National Clinical Research Center of Kidney Diseases, Beijing 100853, China
*
, E-mail: xmchen301@126.com
This work was supported by the Army Medical Science Youth Development Project (13QNP180), National Natural Science Foundation of China (81470949), Beijing Science and Technology Nova Plan (Z121107002512078), National Science and Technology Support Program (2011BAI10B00), and the 973 Project of China (2013CB530800)
ObjectiveTo investigate whether apoptosis of renal tubular epithelial cells induced by endoplasmic reticulum stress (ERS) takes a role in the traumatic rhabdomyolysis-induced acute kidney injury (AKI).MethodsThe model of rhabdomyolysis-induced AKI was reproduced by intramuscular injection of hypertonic glycerol into the hind limbs in male Wistar rats. There were 11 animal groups (each n=3) including control, 1h, 3h, 6h, 12h, 24h, 48h, 72h, 96h, 120h and 168h groups. Serum and renal tissue were collected at various time points. Parameters of renal function and renal pathology were used to evaluate renal injury at various time points. The renal tubular epithelial cell apoptosis was revealed by TUNEL staining at each time point. The expressions of factors, caspase-8, cytochrome C and caspase-9 activity fragments, involved in apoptosis as induced by Fas ligand/ receptor interaction and mitochondria were determined by Western blotting at each time point. Furthermore, the expressions of endoplasmic reticulum chaperone protein GRP78 and apoptosis factor caspase-12 activity fragment were also assayed by Western blotting.ResultsPathological changes of tubular epithelial cells were detected at 1h, presenting a large area of necrosis at 24h, with the highest number of apoptotic renal tubular epithelial cells. Tubular-interstitial injury reached the peak at 72h. The expression of apoptotic factors (caspase-8, cytochrome C and caspase-9) was elevated reaching the peak at 12h. The change in endoplasmicreticulum stress protein expressions of GRP-78 showed a similar trend as that of caspase-12 (increased at 1h, and reached the peak at 12h).ConclusionsApoptosis of renal tubular epithelial cell is the main pathogenesis of rhabdomyolysis-induced renal injury. In addition to the activation of the death-receptor and the mitochondrial death pathway, endoplasmic reticulum stress also plays an important role in this process.
rhabdomyolysis, acute kidney injury, apoptosis, endoplasmic reticulum stress
R365
A
0577-7402(2015)03-0194-06
10.11855/j.issn.0577-7402.2015.03.05
2014-12-31;
2015-02-08)
(责任编辑:张小利)
全军医学科技青年培育项目(13QNP180);国家自然科学基金(81470949);北京市科技新星计划(Z121107002512078);国家支撑计划课题(2011BAI10B00);国家973项目(2013CB530800)
王远大,医学硕士,主治医师。主要从事急性肾损伤修复、再生相关的基础与临床研究
100853 北京 解放军总医院肾脏病科、解放军肾脏病研究所、肾脏疾病国家重点实验室、国家慢性肾病临床医学研究中心(王远大、洪权、吕杨、张雪光、张利、吴镝、陈香美)
陈香美,E-mail:xmchen301@126.com

