血清瘦素、NSE及S-100B水平与卒中后抑郁关系的前瞻性巢式病例对照研究
赵美英,王润青,刘威,赵杰,吕娟,李江涛
血清瘦素、NSE及S-100B水平与卒中后抑郁关系的前瞻性巢式病例对照研究
赵美英,王润青,刘威,赵杰,吕娟,李江涛
目的 探讨脑卒中患者血清瘦素、神经元特异性烯醇化酶(NSE)及S-100B水平与卒中后发生抑郁的危险性的关系。方法 2010年6月-2012年12月入住郑州大学附属郑州中心医院的急性缺血性脑卒中患者121例,随访半年后42例患者确诊为卒中后抑郁(汉密尔顿抑郁量表评分≥8分),按照入组时间、年龄、性别及脑损伤部位匹配原则,选择未患卒中后抑郁的脑卒中患者42例作为对照。收集出院时患者血清,采用酶联免疫吸附法检测患者血清瘦素、NSE 及S-100B浓度,分析其与卒中后抑郁发生的相关性。采用受试者工作特征曲线(ROC)检验各组数据值对诊断卒中后抑郁的效率。结果 卒中后抑郁组血清瘦素、NSE、S-100B浓度(分别为25.84±13.80、2.59±1.48、25.03±8.24μg/L)与对照组(分别为8.67±6.17、2.27±1.84、22.40±6.84μg/L)比较明显增高(P<0.05)。卒中后抑郁患者血清瘦素水平与NSE 及S-100B未见明显相关性;基于ROC曲线,卒中后患者血清瘦素曲线下面积为0.935(95%CI 0.885~0.984),血清瘦素值16.17μg/L是诊断卒中后抑郁的最佳临界点,敏感性为81.0%,特异性为90.1%,是具有较高精准度的诊断指标。结论脑卒中患者血清瘦素水平升高与卒中后发生抑郁密切相关,可作为诊断卒中后抑郁的血清预测标志物。
瘦素;磷酸丙酮酸水合酶;S100蛋白质类;抑郁
卒中后抑郁(post-stroke depression,PSD)是卒中后最常见的情感障碍,极大地影响脑卒中患者的康复进程和神经功能恢复,甚至增加患者的病死率。PSD的发病率呈逐年上升趋势,有文献报道,目前美国脑卒中后抑郁的发生率为22%~66%,且在脑卒中后的6~2 4个月发病率最高[1]。由于缺乏客观的检测指标和判断标准,再加上临床工作中将更多的注意力集中在肢体及其他神经功能缺损的治疗上,对卒中后抑郁未引起足够重视,其临床漏诊率可高达75%[2]。因此,深入研究卒中后抑郁的发病机制、影响因素等对于脑血管病的综合治疗、全面康复有重要意义。血清瘦素是由脂肪细胞分泌的蛋白质激素,广泛分布于大脑中枢,主要调节体内能量代谢平衡。神经元特异性烯醇化酶(NSE)及S-100B能反映中枢神经系统的损害程度,是判断和评估脑损害的血清标志物,且可能参与抑郁症的病理生理过程[3-5],但对于它们在卒中后抑郁中的作用国内尚未见报道。本研究分析血清瘦素、NSE及S-100B与发生卒中后抑郁的危险性及相关性,以期找到预测卒中后抑郁的血清标志物,从而为预防和治疗卒中后抑郁提供新方向。
1 资料与方法
1.1 研究对象 纳入2010年6月-2012年12月在郑州大学附属中心医院神经内科就诊的发病24h以内的急性缺血性脑卒中患者,所有患者均符合中华医学会第四届全国脑血管病会议制定的脑血管病诊断标准,并按照中国脑血管病防治指南2010要求,接受缺血性脑血管常规治疗。排除标准:入院时重症脑卒中患者(美国国立卫生研究院卒中量表NIHSS评分>20),语言障碍,抑郁症(临床诊断或既往治疗),任何不稳定的系统性疾病(包括活动性感染,全身免疫性疾病,不稳定心绞痛,充血性心力衰竭,严重肝、肾或代谢性疾病),预期寿命<1个月。
在卒中后第1、3、6个月分别由两位具有丰富经验的精神科医师,以美国精神障碍诊断统计手册第4版(DSM-Ⅳ)有关抑郁障碍的诊断内容为诊断标准,以汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分≥8分为入组条件。共收集121例脑卒中患者,诊断卒中后抑郁患者42例,患病率为34.71%(42/121),包括出院后半年内随访期间出现的卒中后抑郁患者。所有患者均未接受抗抑郁药物治疗。
对照组为:按照入组时间、年龄、性别及脑损伤部位匹配原则,选择未患卒中后抑郁的脑卒中患者42例为对照组。所有入组患者HAMD评分<8分,本研究经过郑州大学附属郑州中心医院伦理委员会同意,所有患者签署知情同意书。
1.2 方法
1.2.1 患者血清样本采集 所有入组患者在出院时抽取清晨空腹静脉血5ml,于2h内离心,2000r/ min×5min,取上清液,保存于–80℃冰箱待测。
1.2.2 检测方法 血清瘦素、NSE及S-100B蛋白试剂盒均购于瑞典CanAg Diagnostics AB公司。采用酶联免疫吸附法测定,实验步骤严格按照说明书进行。
1.3 统计学处理 采用SPSS 19.0统计软件进行分析。计量数据以±s表示,多样本均数比较采用方差分析,两样本均数比较采用独立样本t检验,血清瘦素、NSE及S-100B值之间的相关性采用Pearson相关分析;采用受试者工作特征曲线检验各组数据值对诊断卒中后抑郁的效率。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者血清中瘦素、NSE及S-100B含量比较 两组卒中患者的基线资料平衡,未见明显差异(表1)。卒中后抑郁组患者血清中瘦素、NSE及S-100B蛋白水平较对照组升高,血清瘦素蛋白水平变化更为明显,差异均有统计学意义(P<0.05)。
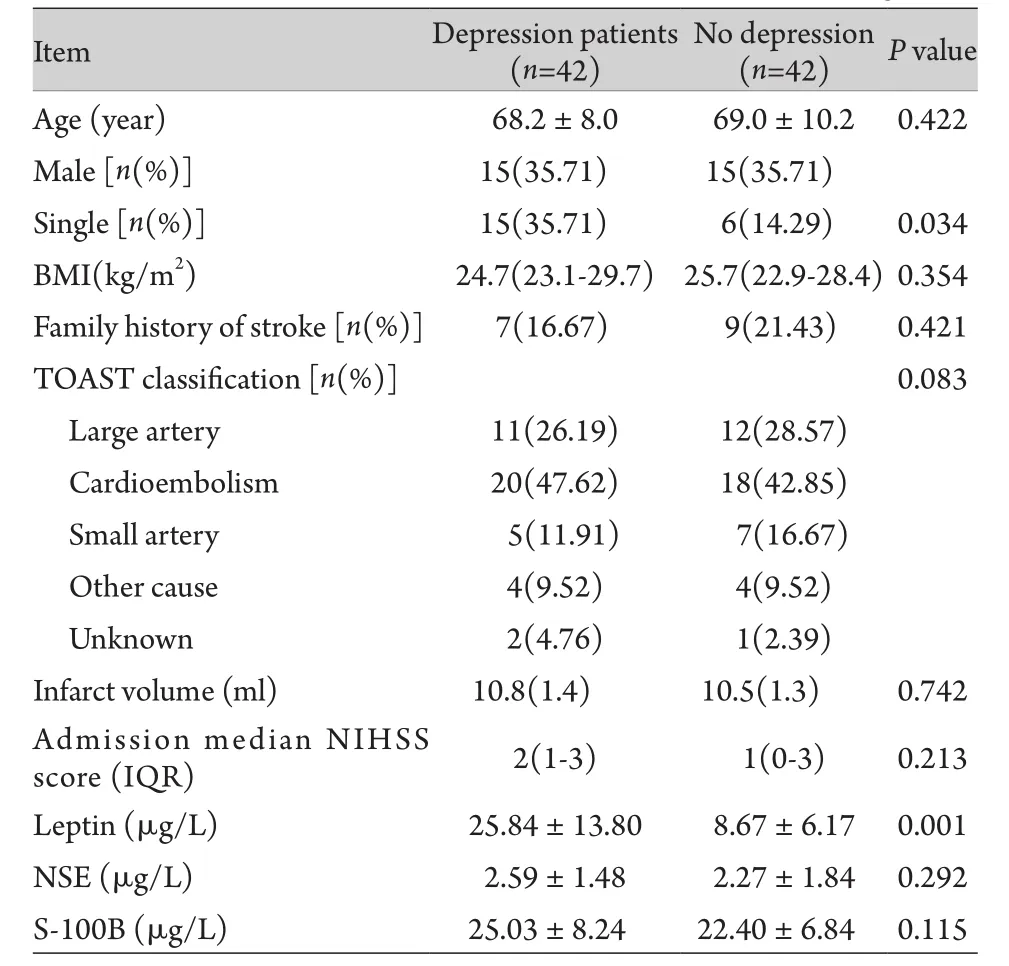
表1 两组脑卒中患者的临床基线资料Tab.1 Baseline data of patients with ischemic stroke in both groups
2.2 卒中后抑郁患者中血清瘦素与NSE、S-100B之间的相关性 卒中后抑郁组患者血清瘦素与NSE、S-100B均未见明显相关性(r=0.106、P=0.504;r= –0.071、P=0.653,图1)。
2.3 卒中后患者血清瘦素、NSE及S-100B蛋白水平对卒中后抑郁的检验效率 根据患者血清瘦素、NSE及S-100B的数值,分别绘制出ROC曲线,计算卒中后伴发或不伴发抑郁的临界点、灵敏度、特异度(图2)。结果显示,血清瘦素的ROC曲线下面积大于其他两个血清标志物的ROC曲线下面积;卒中后患者血清瘦素16.17μg/L可作为卒中后抑郁的最佳诊断临界点,敏感性为81.0%,特异性为90.1%,是具有较高精准度的诊断指标。
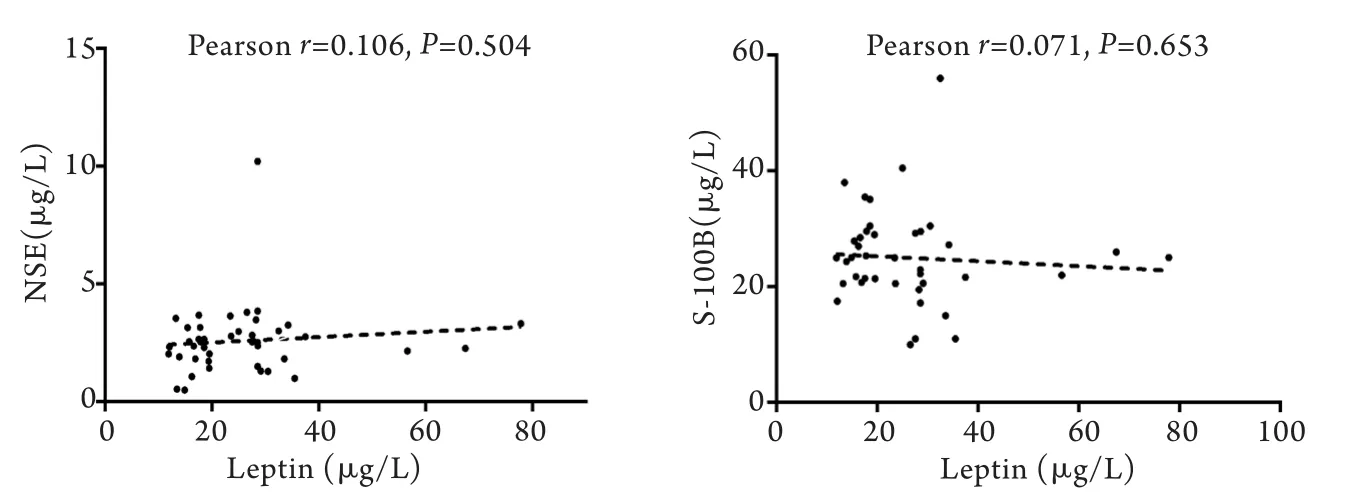
图1 卒中后抑郁患者血清瘦素与NSE及S-100B的相关性分析Fig.1 Correlation between serum leptin and NSE, S100B levels in PSD patients

图2 基于瘦素、NSE及S-100B水平诊断的卒中后抑郁患者的ROC曲线Fig.2 Receiver operator characteristic curve of PSD patients based on the relative serum marker leptin, NSE and S-100B
3 讨 论
PSD是脑卒中最常见的情感障碍并发症之一,严重影响卒中患者的预后和死亡发生率。主要表现为:情绪悲观、睡眠障碍、精神活动能力下降、认知功能障碍及周期性躯体不适等。尽管学者们对PSD进行了深入研究,但PSD的发生机制仍不清楚,目前主要集中在炎症介质释放、神经递质变化及脑卒中后相关影响分子的变化等方面[2,6-7]。本研究中,我们分析了脑卒中后患者的血清瘦素、NSE 及S-100B的水平与发生卒中后抑郁之间的关系,发现脑卒中后患者血清瘦素蛋白水平升高,卒中后抑郁的发病率明显增加(P<0.05),同时也发现血清NSE、S-100B表达水平升高,但在预测诊断卒中后抑郁的敏感性及特异性方面无明显作用。
瘦素是一种由脂肪组织分泌的蛋白类激素,主要调节体内能量代谢平衡[8]。瘦素受体广泛分布于中枢神经系统(尤其是下丘脑),可能在调节情绪方面有重要作用[9]。已有研究发现,与健康志愿者相比,原发抑郁症患者血清瘦素表达水平增高或降低差异有临床意义[10-11],提示血清瘦素对原发性抑郁的发生可能发挥一定作用。目前,国内对于血清瘦素在脑卒中后抑郁障碍中的作用研究较少,国外有研究显示血清瘦素水平在卒中后抑郁患者中有所升高并密切相关[12]。在本研究中,与对照组(8.67±6.17μg/L)相比,卒中后抑郁患者血清瘦素水平(25.84±13.80μg/L)明显升高,提示瘦素可能参与了抑郁症的发病过程。目前对卒中后抑郁发生机制的研究主要集中在影响下丘脑-垂体-肾上腺轴(HPA轴)的活性、5-HT系统以及神经营养因子等方面。脑卒中后机体处于应激状态,HPA轴功能亢进,糖皮质激素分泌增加,从而促进脂肪组织中瘦素的合成及释放[13],导致卒中后血清瘦素水平升高,血结合型或游离型瘦素通过血脑屏障与下丘脑等处的ob-RI结合,然后通过JAK-STAT等途径的信号转导,发挥瘦素的生理功能。瘦素可通对HPA轴的作用参与情绪调节[14]。5-HT系统是控制食欲及情绪的主要通路,也是目前抗抑郁治疗的主要通路。一些实验表明瘦素及5-HT在分布及功能上均有密切关系,间接预示着瘦素与卒中后抑郁的关系[15]。目前研究证实脑卒中后脑内神经营养缺乏,即神经生长因子、脑源性神经营养因子(BDNF)等水平降低[16],导致神经元形态、功能、适应性的改变,也可能是引起PSD的主要因素;瘦素与BDNF在对神经元功能、代谢调节方面存在一致性,瘦素也具有神经营养因子功能,可与其他神经营养因子相互协调发挥抗抑郁效应[17]。
另外本研究也对与脑损伤密切相关的血清指标NSE与S-100B[18-19]的临床意义进行了研究。NSE是主要存在于大脑神经元和神经内分泌细胞内并参与糖酵解的特异性酶。当神经元损伤或坏死后,NSE从细胞内溢出,进入脑脊液和血液中,因脑胶质细胞和其他脑神经组织不含NSE,故NSE是检测脑神经元坏死的客观指标[20];S-100B蛋白是钙离子通道蛋白的一个主要组成部分(相对分子质量21kD),是一类分子量较小的EF手型钙结合蛋白,具有广泛的生物学活性,主要存在于中枢神经系统的星形细胞、少突神经胶质细胞以及周围神经系统的雪旺细胞,是神经胶质细胞的标记蛋白,部分存在于神经元,是一种存在于细胞质的可溶性蛋白质。S-100B蛋白具有神经营养作用,可以作用于神经元和神经胶质细胞,从而促进其生长修复,但高水平的S-100B蛋白具有神经毒性作用,可诱导神经元和神经胶质细胞凋亡,因此,S-100B蛋白可反映中枢神经系统的损害程度,可作为判断和评估脑损害的特异性指标[21]。本研究中卒中后患者血清N1SE 及S-100B水平与对照相比有所升高,但未见明显差异,提示脑部损伤程度可能与卒中后抑郁的发生无明显相关性。
以往研究对象主要为原发抑郁症患者或者脑卒中急性期患者,而本研究采用前瞻性巢性病例对照研究,研究对象为恢复期脑卒中患者,在发病年龄、性别、脑卒中部位、高血压、糖尿病等方面无明显差异,此类患者更能真实反映卒中后抑郁的发病规律。本研究结果表明,脑卒中患者血清瘦素水平升高,是发生卒中后抑郁的血清预测指标,为卒中后抑郁的进一步预防和治疗提供了依据。同时本研究也提示卒中后抑郁组血清NSE及S-100B蛋白表达水平有所升高,但与卒中后抑郁的发生无明显相关性,可能是卒中严重程度的标志物,而非PSD的预测指标。由于本研究存在样本量较小、为单中心研究等局限,因此仍需要依据血清瘦素表达水平来划分卒中后患者,进一步开展大型多中心随机对照研究。
[1] Ellis C, Zhao Y, Egede LE. Depression and increased risk of death in adults with stroke[J]. J Psychosom Res, 2010, 68(6): 545-551.
[2] Alajbegovic A, Djelilovic-Vranic J, Nakicevic A, et al. Post stroke depression[J]. Med Arch, 2014, 68(1): 47-50.
[3] Kranaster L, Janke C, Mindt S, et al. Protein S-100 and neuron-specific enolase serum levels remain unaffected by electroconvulsive therapy in patients with depression[J]. J Neural Transm, 2014, 121(11): 1411-1415.
[4] Ullrich H, Kranaster L, Sigges E, et al. Neuron specific enolase and serum remain unaffected by ultra high frequency left prefrontal transcranial magnetic stimulation in patients with depression: a preliminary study[J]. J Neural Transm, 2013, 120(12): 1733-1736.
[5] Wiener CD, Jansen K, Ghisleni G, et al. Reduced serum levels of neuron specific enolase (NSE) in drug-naive subjects with major depression and bipolar disorder[J]. Neurochem Res, 2013, 38(7): 1394-1398.
[6] Tsai SY, Chung KH, Huang SH, et al. Persistent inflammation and its relationship to leptin and insulin in phases of bipolar disorder from acute depression to full remission[J]. Bipolar Disord, 2014, 16(8): 800-808.
[7] Carvalho AF, Rocha DQ, McIntyre RS, et al. Adipokines as emerging depression biomarkers: A systematic review and metaanalysis[J]. J Psychiatr Res, 2014, 59: 28-37.
[8] Wang YN, Li Z, Wu XH, et al. Correlation between serum soluble leptin receptor level and gestational diabetes mellitus[J]. Med J Chin PLA, 2014, 39(2): 125-128. [王亚男, 李真, 吴晓华, 等.血清可溶性瘦素受体浓度与妊娠期糖尿病的相关性研究[J]. 解放军医学杂志, 2014, 39(2): 125-128.]
[9] Abd El-Aziz TA, Mohamed RH, Mohamed RH, et al. Leptin, leptin gene and leptin receptor gene polymorphism in heart failure with preserved ejection fraction[J]. Heart Vessels, 2012, 27(3): 271-279.
[10] Lu XY, Kim CS, Frazer A, et al. Leptin: a potential novel antidepressant[J]. Proc Natl Acad Sci USA, 2006, 103(5): 1593-1598.
[11] Labad J, Price JF, Strachan MW, et al. Leptin levels and depressive symptoms in people with type 2 diabetes: the edinburgh type 2 diabetes study[J]. Psychosom Med, 2012, 74(1): 39-45.
[12] Li YT, Zhao Y, Zhang HJ, et al. The association between serum leptin and post stroke depression: results from a cohort study[J]. PLoS One, 2014, 9(7): e103137.
[13] Zhu CQ, Li ZG, Liu Y, et al. Ethology assessment and detection of serum GPX-3 levels in rat model of depression induced by chronic unpredictable mild stress[J]. Med J Chin PLA, 2013, 38(9): 710-713. [朱长强, 李治国, 刘勇, 等. 慢性不可预测轻度应激诱导的抑郁模型大鼠行为学评定及血清谷胱甘肽过氧化物酶水平检测[J]. 解放军医学杂志, 2013, 38(9): 710-713.]
[14] Cizza G, Nguyen VT, Eskandari F, et al. Low 24-hour adiponectin and high nocturnal leptin concentrations in a casecontrol study of community-dwelling premenopausal women with major depressive disorder: the Premenopausal, Osteopenia/ Osteoporosis, Women, Alendronate, Depression (POWER) study[J]. J Clin Psychiatry, 2010, 71(8): 1079-1087
[15] Collin M, Hakansson-Ovesjo ML, Misane I, et al. Decreased 5-HT transporter mRNA in neurons of the dorsal raphe nucleus and behavioral depression in the obese leptin-deficient ob/ob mouse[J]. Brain Res Mol Brain Res, 2000, 81(1-2): 51-61.
[16] Jiang HY, Wang YG. Meta analysis of relationship between serum brain derived neurotrophic factor level and post stroke depression[J]. J Zhengzhou Univ (Med Sci), 2014, 49(5): 626-628. [蒋华玉, 王永刚. 血清脑源性神经营养因子水平与脑卒中后抑郁关系的meta分析[J]. 郑州大学学报(医学版), 2014, 49(5): 626-628.]
[17] Komori T, Morikawa Y, Nanjo K, et al. Induction of brainderived neurotrophic factor by leptin in the ventromedial hypothalamus[J]. Neuroscience, 2006, 139(3): 1107-1115.
[18] Nash DL, Bellolio MF, Stead LG, et al. S100 as a marker of acute brain ischemia: a systematic review[J]. Neurocrit Care, 2008, 8(2): 301-307.
[19] Anand N, Stead LG. Neuron-specific enolase as a marker foracute ischemic stroke: a systematic review[J]. Cerebrovasc Dis, 2005, 20(4): 213-219.
[20] Ye S, Lin SP, Xie LC. Correlation between Serum Level of Neuron Specific Enolase and Brain Damage in Patients with Ischemic Stroke[J]. Tianjin Med J, 2014, 42(7): 674-676. [叶珊,林绍鹏, 解龙昌. 血清神经元特异性烯醇化酶水平与缺血性卒中脑损伤程度的相关性[J]. 天津医药, 2014, 42(7): 674-676.]
[21] Jauch EC, Lindsell C, Broderick J, et al. Association of serial biochemical markers with acute ischemic stroke: the National Institute of Neurological Disorders and Stroke recombinant tissue plasminogen activator Stroke Study[J]. Stroke, 2006, 37(10): 2508-2513.
Serum leptin, neuron specific enolase and S-100B in relation to post-stroke depression in a prospective nested case-control study
ZHAO Mei-ying, WANG Run-qing, LIU Wei, ZHAO Jie, LV Juan, LI Jiang-tao
Department of Neurology, Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450007, China
This work was supported by the Science and Technology Projects of Zhengzhou (2010SFXM221)
ObjectiveTo investigate the relationship between the serum levels of leptin, neuron-specific enolase (NSE) and S-100B in patients of stroke and the incidence of post-stroke depression (PSD).MethodsThe clinical data of 121 cases of acute ischemic stroke, admitted to Zhengzhou Central Hospital affiliated to Zhengzhou University from Jun. 2010 to Dec. 2012, were retrospectively analyzed. After six months of follow-up 42 patients were diagnosed as suffering from PSD (Hamilton Depression Scale score ≥8). Another 42 participants with available matching data on onset time, age, gender and lesions of brain were selected. The serum samples were collected from all patients at time of discharge, and the concentrations of serum leptin, NSE and S-100B were analyzed by enzyme-linked immunosorbent assay (ELISA) kit. Correlation and efficiency of diagnosing PSD among them was validated by receptor operator curve (ROC).ResultsThe concentration of serum leptin, NSE, and S-100B in PSD group (25.84±13.80, 2.59±1.48 and 25.03±8.24μg/L, respectively) was higher than that in the control group (8.67±6.17, 2.27±1.84 and 22.40±6.84μg/L, respectively). No obvious correlation was found between serum leptin and the NSE and S-100B in PSD patients. Based on the ROC curve, the area under the curve of serum leptin in PSD patients was 0.935 (95%CI 0.885-0.984), and the optimal cutoff value of serum leptin level was 16.17μg/L, which was an indicator for predicting of PSD with 81.0% sensitivity and 90.1% specificity.ConclusionElevation of serum leptin level at admission was found to be associated with PSD, and it may act as a new marker for predicting the occurrence of PSD.
leptin, NSE, S-100B, post-stroke depression
R749.42
A
0577-7402(2015)03-0226-05
10.11855/j.issn.0577-7402.2015.03.11
2014-10-22;
2014-12-20)
(责任编辑:张小利)
郑州市科技攻关计划项目(2010SFXM221)
赵美英,医学硕士,主治医师。主要从事脑血管疾病及循证医学研究等
450007 郑州 郑州大学附属郑州中心医院神经内科(赵美英、王润青、刘威、赵杰、吕娟、李江涛)
·信 息·

