棉花微管结合蛋白基因GhCLASP1的克隆与表达分析
朱守鸿,薛 飞*,赵兰杰,刘永昌,李艳军,熊显鹏,孙 杰
(1石河子大学农学院/新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子832003;2石河子大学生命科学学院,新疆石河子832003)
棉花微管结合蛋白基因GhCLASP1的克隆与表达分析
朱守鸿1,薛 飞1*,赵兰杰2,刘永昌1,李艳军1,熊显鹏1,孙 杰1
(1石河子大学农学院/新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子832003;2石河子大学生命科学学院,新疆石河子832003)
CLASP蛋白(CLASPs)是一种能够特异地与微管结合,参与调节微管结构与功能的微管结合蛋白(MAPs),在植物细胞形成、细胞伸长等方面起着关键作用。该研究利用电子克隆结合RT-PCR技术从陆地棉(Gossypium hirsutum L.)中克隆获得1个CLASP基因,命名为GhCLASP1(NCBI登录号为KP742966)。序列分析显示,GhCLASP1属于CLASP基因家族,开放阅读框长度为4 188 bp,编码含1 395个氨基酸残基的蛋白;Gh-CLASP1蛋白含有1个HEAT重复结构域和2个CLASP-N端结构域。进化分析表明,GhCLASP1与可可树(Theobroma cacao)CLASP蛋白的亲缘关系最近。q RT-PCR分析表明,GhCLASP1在棉花的根、茎、叶、花及纤维发育的不同时期均有表达,且GhCLASP1基因表达量最大值出现在纤维发育次生壁加厚期(开花后27 d),推测GhCLASP1基因可能对棉花纤维次生壁的形成起着重要的作用。利用本氏烟草(Nicotiana benthamiana)叶片瞬时表达系统对GhCLASP1基因编码的蛋白进行亚细胞定位结果显示,GhCLASP1蛋白定位在细胞膜上。上述结果为进一步研究CLASP基因在棉花中的功能奠定了基础。
棉花;纤维发育;CLASP;表达分析;亚细胞定位
微管是植物细胞骨架的重要组成部分,在植物细胞分化、生长(伸长)和次生壁加厚以及物质运输、信号转导等方面均起着广泛而重要的作用,尤其是在棉纤维伸长和次生壁合成过程中发挥着重要的作用[1-4]。
CLASP蛋白(CLIP-Associated Proteins,CLASPs)是一种能够特异地与微管结合,参与调节微管结构与功能的微管结合蛋白(microtubule-associated proteins,MAPs)。它属于膜蛋白的基质结合分子—1[5],能够特异地结合在微管的正端,又称为微管正端跟踪蛋白。同时,CLASP蛋白和微管结合也受到GSK3β(glycogen synthase kinase 3β)激酶磷酸化调节,该调节对于影响细胞内微管局部的稳定性起到很重要的作用[6]。有研究表明,kinesin-13家族使微管变得不稳定,增加崩塌的机会,使微管解聚。相反,CLASP蛋白具有调节动态微管的稳定性,促进微管多聚的功能[7],在细胞内抑制微管崩塌的机会,起到重建因子的作用[8]。Ambrose等[9-11]发现SNX1(sorting nexin 1)通过和CLASP相互作用与微管相连,CLASP依靠生长素运输通路PIN2(PIN-FORMED 2)回收调节微管。
在拟南芥基因组中CLASP基因只有1个拷贝,没有发现CLIPs(cytoplasmic linker proteins)的同源物,表明CLASP在植物中具有独特的作用[12]。与野生型拟南芥植株相比,CLASP的功能缺失突变体clasp-1表现出株型矮小,顶端优势不明显,叶表皮毛分支数目减少,下胚轴及根生长发育缓慢,侧根增多,细胞伸长受阻等不良表型[9,12]。当用微管解聚药剂处理突变体clasp-1时,突变体的根毛异常肿胀,下胚轴及根生长更加缓慢[12]。由于拟南芥表皮毛和棉纤维发育机制相似,棉花纤维细胞形状为直线形、无分支,推测CLASP在棉花中可能具有相同的生物学功能。鉴于CLASP家族的基因可能参与并影响了植物生长发育、细胞内物质的运输等主要生理过程,而棉花中有关CLASP基因的数量、功能的研究还未见有报道。所以,棉花中CLASP基因在纤维发育中的作用值得深入研究。
棉纤维细胞是研究植物细胞伸长和细胞壁纤维素生物合成的理想模型。本研究利用拟南芥At-CLASP蛋白为查询序列,查询雷蒙德氏棉基因组数据库,克隆陆地棉中的CLASP基因,并对其序列及在棉纤维中的表达模式进行分析,以理解其在棉花生长发育中的作用,揭示该类基因家族在棉纤维发育及棉花品质形成等方面的分子机制,为进一步探索CLASP基因在棉花中的功能奠定基础。
1 材料与方法
1.1 材 料
陆地棉(Gossypium hirsutum L.)品种‘新陆早33号'种子由石河子大学棉花研究所提供。种植在石河子大学试验站。为了观察基因的时空表达模式,取棉花种子,剥去种皮后用0.1%HgCl2浸泡10 min,灭菌水冲洗3~4次,播种于1/2 MS培养基上,28℃暗培养4 d,用霍格兰营养液培养至2片真叶时,取幼苗的根、茎、叶样品;在田间棉花盛花期挂牌标记当日开花花蕾,分别摘取开花后3、6、9、12、15、18、21、24、27和30 d的棉铃,室内剥取纤维样品;从田间植株摘取花。将上述材料液氮速冻后保存于—80℃冰箱,用于RNA的提取。
1.2 方 法
1.2.1 棉花总RNA提取及cDNA第一链合成 采用CTAB法提取棉花样品总RNA[13],用DNase I处理后,利用ND1000紫外分光光度计测定OD260和OD280值,计算RNA的浓度与纯度。用1.2%琼脂糖凝胶电泳检测RNA的完整性,保存于—80℃备用。按照Reverse Transcriptase M-MLV(RNase H-)说明书合成cDNA的第一链。
1.2.2 棉花GhCLASP1基因克隆 以拟南芥At-CLASP基因(AT 2G20190)作为探针序列,与二倍体雷蒙德氏棉的基因组序列进行Blast比对(http://www.phytozome.net/),获得其同源基因,用Primer3设计扩增开放阅读框的引物(表1)。
以棉纤维cDNA为模版进行PCR扩增,反应体系含10×buffer 2μL、2.5 mmol·L—1d NTP 1.6 μL、c DNA模版2μL、5 U·μL—1LA Taq DNA聚合酶0.2μL、10μmol·L—1上下游引物各1μL,补dd H2O至20μL。PCR反应程序94℃预变性5 min;94℃变性45 s,58℃退火45 s,72℃延伸4.5 min;重复32个循环;72℃延伸10 min。PCR产物用1%琼脂糖电泳进行检测,回收并纯化后连接至p MD20-T载体,转化大肠杆菌TOP10感受态细胞融合表达载体。构建好的载体通过限制性内切酶KpnⅠ和Bam HⅠ进行酶切鉴定,鉴定正确的重组质粒转入农杆菌GV3101中。经过转化液(100 μmol·L—1AS和10 mmol·L—1MgSO4)重悬的农杆菌注入生长3周的本氏烟草幼苗的叶片背面,将注射后的本氏烟草放入25℃、16 h/18 h光暗周期的培养箱中共培养3 d后,在激光共聚焦显微镜(Leica TCS SP5)下检测荧光。(本实验室保存),挑取单菌落,提取质粒进行PCR和酶切鉴定,鉴定正确的质粒送至北京华大基因公司测序。
1.2.3 GhCLASP1基因序列的生物信息学分析
用ProtParam(http://web.expasy.org/protparam/)分析蛋白质的基本理化性质;用SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线预测和分析蛋白质的二级结构组成形式;用EBLEBI(http://www.ebi.ac.uk/interpro/search/sequence-search)和NCBI的Blast P分析氨基酸序列的蛋白质保守区;采用DOG 2.0软件绘制蛋白结构域图;用WOLF PSORT(http://psort.hgc.jp/)进行信号肽及亚细胞定位分析;采用Vector NTI和Clustal X进行多重序列比对及同源性比对,采用MEGA 6.0软件构建进化树分析。
1.2.4 GhCLASP1基因在棉花不同组织中的表达分析 根据GhCLASP1基因的cDNA序列,设计特异引物,利用q RT-PCR方法,以根、茎、叶、花和不同发育时期的棉纤维cDNA为模板,进行PCR扩增,检测GhCLASP1基因在不同组织的表达情况。在罗氏LightCycler480实时荧光定量PCR仪上进行,内参基因为UBI,程序为94℃预变性1 min,95变性15 s,60℃退火20 s,72℃延伸30 s,45个循环。实验重复3次,每次实验3个重复,按照2—ΔΔCt法分析结果。
1.2.5 亚细胞定位载体构建及观察 使用本实验室保存的亚细胞定位瞬时表达载体pCambia1300221-GFP,构建GhCLASP1基因的植物亚细胞定位载体。分别将GhCLASP1全长CDS克隆到表达载体p Cambia1300221-GFP的KpnⅠ和Bam HⅠ之间,构建p Cambia1300221-GFP-CLASP
2 结果与分析
2.1 GhCLASP1基因的克隆及序列分析
利用拟南芥AtCLASP基因(AT 2G20190)序列作为探针,在二倍体雷蒙德氏棉中发现4个同源性较高的基因,其序列号分别为Gorai.001G235400.1、Gorai.004G223500.1、Gorai.001G183300.1和Gorai. 006G054600.1。由于它们在微管的动态性和组织结构方面的作用及其在棉花纤维发育中的功能还未知,选取其中1个在棉纤维发育过程中具有优势表达的基因(Gorai.006G054600.1)为研究对象,其序列全长为12 641 bp,包含长度为4 188 bp的开放阅读框(ORF),与拟南芥AtCLASP基因ORF核苷酸序列的相似性为60.52%,氨基酸序列一致性为53.70%。以‘新陆早33号'棉纤维cDNA为模板,用特异引物GhCLASP1F和GhCLASP1R,进行RT-PCR扩增,经1.0%琼脂糖凝胶电泳检测,获得1条约4 200 bp目的条带(图1)。回收目的片段,测序结果分析显示扩增获得的cDNA序列包含长度为4 188 bp的ORF,编码1 395个氨基酸,与Gorai.006G054600.1序列相似性为98.69%,氨基酸序列一致性为97.71%,与陆地棉Cot AD_48232序列相似性为98.40%,氨基酸序列一致性为98.09%,表明四倍体陆地棉与二倍体雷蒙德氏棉不同的种间核酸序列之间存在一些差异。鉴于棉花中CLASP基因尚未见到相关研究报道,将其命名为GhCLASP1(NCBI登录号为KP742966)。
2.2 GhCLASP1基因编码蛋白的生物信息学分析
从GhCLASP1基因cDNA序列推测GhCLASP1蛋白包含1 395个氨基酸残基,运用ProtParam预测该蛋白的基本理化性质。结果表明,GhCLASP1成熟蛋白的分子式是C6808H10948N1904O2090S69,分子量为155.125 4 k D,理论等电点为6.39,负电荷的氨基酸残基数(Asp+Glu)是166,正电荷的氨基酸残基数(Arg+Lys)是156;脂肪系数为91.39,总平均亲水性为0.212,不稳定系数是47.69。
利用SOPMA在线预测分析GhCLASP1蛋白的二级结构,结果表明,该蛋白主要由α-螺旋、延伸直链、β-转角和无规则卷曲4种结构形式构成,α-螺旋包含747个氨基酸,约占53.55%;延伸直链包含55个氨基酸,约占3.94%;β-转角包含37个氨基酸,约占2.65%;无规则卷曲包含556个氨基酸,约占39.86%。可见,α-螺旋是该蛋白二级结构的主要组成部分。

图1 GhCLASP1基因RT-PCR扩增M.MarkerⅢ;1~2.GhCLASP1 PCR扩增结果Fig.1 Electrophoresis images of the RT-PCR amplification of GhCLASP1 gene M.MarkerⅢ;1—2.The amplified products of GhCLASP1

图2 GhCLASP1基因与陆地棉Cot AD-48232和AtCLASP基因的蛋白结构比较黑色和斜线区域分别表示CLASP-N端结构域和HEAT重复结构域Fig.2 GhCLASP1 gene and Gossypium hirsutum CotAD-48232 and AtCLASP gene protein structure Black area and that filled with oblique lines represent the CLASP-N terminal and HEAT repeat domain of protein,respectively

图3 GhCLASP1与其它植物CLASP蛋白的进化树分析系统树各分支上数字是Bootstrap 1 000次循环检验的置信度;标尺代表遗传距离;三角符号代表GhCLASP1Fig.3 Phylogenic relationship of GhCLASP1 and other plant CLASP proteins The numbers on the tree branches represent bootstrap confidence values as bootstrap is 1 000;The scale bar represents genetic distance;Triangle stands for GhCLASP1
为了进一步确定GhCLASP1基因是否属于CLASP家族,利用EBL-EBI在线分析,结合NCBI中Blast P比对,对该基因氨基酸序列进行蛋白质保守区分析,发现GhCLASP1基因具有1个HEAT重复结构域和2个典型的CLASP-N端结构域,该CLASP基因属于典型的CLASP基因家族成员,其位置如图2所示。由WOLF PSORT软件在线预测该蛋白的信号肽及亚细胞定位情况表明,Gh-CLASP1定位在细胞膜上。
2.3 GhCLASP1蛋白多重序列比对和蛋白进化树分析
为了解棉花GhCLASP1与其他植物CLASP蛋白的亲缘关系,利用Clustal X软件和MEGA6.0软件将GhCLASP1氨基酸序列与NCBI上公布的其他植物CLASP蛋白进行多重序列比较,结果(图4)表明,棉花GhCLASP1与GeneBank中葡萄、桑树、番茄等植物的序列相似性均较低,与雷蒙德氏棉和可可树相似性较高,与陆地棉Cot AD-48232序列的相似性最高,其同源区域主要集中在CLASP-N端结构域,即在N端含有2个串联的CLASP-N端结构域(图4)。基于棉花GhCLASP 1及其它植物CLASP基因蛋白序列构建系统进化树,分析结果(图3)表明,棉花GhCLASP1同陆地棉Cot AD-48232基因在同一个进化分支,与拟南芥、烟草等物种CLASP基因遗传距离较远。

图4 GhCLASP1与拟南芥AtCLASP等其他植物蛋白的CLASP-N端结构域多重序列比对所用植物CLASP包括陆地棉(Cot AD_48232)、雷蒙德氏棉(Gorai.006G054600)、可可树(XP007034511)、拟南芥(At2G20190)、莲藕(XP010263998)、葡萄(XP002265367)、桑树(XP010109669)、番茄(XP004247111)和茸毛烟草(XP009589791);黑色箭头表示2个CLASP-N端结构域Fig.4 Amino acid sequences alignment of GhCLASP1 and other plant CLASP proteins The plant CLASP sequences used are Gossypium hirsutum(Cot AD_48232),Gossypium raimondii(Gorai.006G054600),Theobroma cacao(XP007034511),Arabidopsis thaliana(At2G20190),Nelumbo nucifera(XP010263998),Vitis vinifera(XP002265367),Morus notabilis(XP010109669),Solanum lycopersicum(XP004247111)and Nicotiana tomentosiformis(XP009589791);The black arrows marked with two CLASP-N terminal domain of protein
2.4 GhCLASP1基因在棉花不同组织中的表达
为了解GhCLASP1基因在棉花中的时空表达特性,以棉花幼苗的根、茎、叶、田间采集的花及不同发育时期棉纤维的总RNA反转录的cDNA为模板,以棉花UBI基因作为内参基因,利用qRT-PCR技术,分析GhCLASP1在棉花不同组织的表达情况。结果表明,GhCLASP1基因在棉花的根、茎、叶、花及棉纤维中均有表达,并在棉纤维发育的早期表达量低;随着棉纤维的发育,GhCLASP1表达量逐渐升高,在开花后27 d棉纤维中表达量达到高峰(图5),暗示其可能在棉花纤维发育过程中发挥着重要的作用。
2.5 GhCLASP1亚细胞定位观察
为了解GhCLASP1编码蛋白的亚细胞定位情况,将构建酶切验证正确的pCambia1300221-GFPCLASP融合表达载体转化农杆菌,注射3 d后的烟草叶片于激光共聚焦显微镜下进行观察,结果显示该基因的GFP的荧光均分布在叶片的细胞膜上(图6)。以上结果说明,Gh CLASP1可能定位在细胞膜上,与生物信息学分析中预测的结果一致。
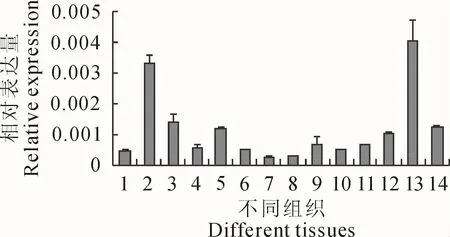
图5 GhCLASP1基因在棉花不同组织中表达的qRT-PCR分析1.根;2.茎;3.叶;4.花;5~14分别为开花后3、6、9、12、15、18、21、24、27、30 d纤维Fig.5 Quantitative real-time PCR analyses the expression level of GhCLASP1 gene in different tissues in cotton 1.Root;2.Stem;3.Leaf;4.Flower;5—14.Represent fiber cells at 3,6,9,12,15,18,21,24,27 and 30 d post anthesis,respectively

图6 棉花微管结合蛋白GhCLASP1亚细胞定位分析A~C.3周烟草叶片中GFP-CLASP蛋白的亚细胞定位;D~F.3周烟草叶片中GFP蛋白的亚细胞定位;其中,A、D为荧光图像;B、E为明场图像;C、F为叠加图像;标尺为20μmFig.6 Subcellular localization analysis of the microtubule associate protein GhCLASP1 A—C.Subcellular localization of the GFP-CLASP protein in leaf cells of 3-week-old Nicotiana benthamiana;D—F.Subcellular localization of the GFP protein in leaf cells of 3-week-old N.benthamiana;A and D for GFP fluorescence image;B and E for bright field image of the same leaf;C and F for merged image of the same leaf;Scale bar=20μm
3 讨 论
CLASP是与微管正端结合的蛋白,它既能结合微管也能结合细胞质连接蛋白(CLIP-Associated Proteins,CLAPs)[14]。CLASP蛋白的一般包括2个保守的结构域:HEAT重复结构域和CLASP-N端结构域。有些CLASP蛋白只含有CLASP-N结构。通过体内和体外试验已经证实,HEAT结构域能形成螺旋结构及调节蛋白之间的相互作用,参与细胞内物质的运输[15-16];CLASP-N端结构域是很保守的结构域,是与微管结合的部位,具有调节动态微管的稳定性作用[17-18]。本试验中克隆的Gh-CLASP1含有2个保守的CLASP-N端结构域和1个HEAT重复结构域,和拟南芥AtCLASP的结构域相比,GhCLASP1少了1个HEAT重复结构
域;与陆地棉Cot AD-48232的结构相比,多了1个HEAT重复结构域。这些HEAT重复结构域和CLASP-N端结构域可能对于蛋白功能的正常发挥是必需的。
棉花纤维发育分为纤维原始细胞分化和突起、纤维伸长、次生壁加厚和脱水成熟4个时期,这4个时期之间存在着某些重叠,没有截然区分的界限[19]。在纤维发育的各个时期都有大量的相关基因参与纤维的发育和调控。本研究qRT-PCR表明,GhCLASP1基因在花后27 d表达量最高,该时期正是处于纤维次生壁加厚期,表明该基因可能在纤维发育次生壁合成期发挥重要的作用,可能对棉纤维比强度有重要影响。CLASP主要在微管的正端富集,其聚集的点沿着微管的整个长度分布[20-21]。在拟南芥中通过细胞学研究分析发现AtCLASP基因编码的蛋白与所有的微管列阵共定位[20,22-23],Dhonukshe等[24]研究表明PLT-生长素-MAP65-CLASP模型在拟南芥根的定向细胞分裂中起着重要的作用。CLASP定位在细胞的上下两面有利于微管跨过边缘从横向排列变为纵向排列,从而使得细胞从垂周分裂转变成平周分裂,CIASP的定位变化调控微管列阵的方向[24]。本研究中GhCLASP1蛋白亚细胞定位表明,Gh CLASP1蛋白定位在细胞膜上,与生物信息学预测的一致。据此我们推测其为一个微管结合蛋白,同时作用于微管和细胞膜,可能与细胞内物质的运输相关,通过调控微管的排向和动态分布,参与纤维发育调控,影响纤维的伸长和次生壁的合成,从而改变纤维的品质。该基因在纤维发育过程中的功能还有待进一步深入研究。
到目前为止,在动植物基因组中发现的CLASP基因数目很少,如:人的基因组中只有2个CLASP基因[14],在果蝇和线虫基因组中已报道的有其同源相似物[25-27]。而在植物拟南芥基因组中只有1个CLASP基因[12]。根据已经公布陆地棉基因组数据库[28],预测棉花中有8个CLASP基因,其在棉花中的功能尚未知,彼此之间是否有功能冗余也有待进一步研究。本研究为进一步探讨棉花中CLASP基因的功能奠定了基础。
[1] DIXIT R,CYR R.Encounters between dynamic cortical microtubules promoter ordering of the cortical array through angle-dependent modifications of microtubule behavior[J].The Plant Cell,2004,16(12):3 274—3 284.
[2] MATHUR J,HÜLSKAMP M.Microtubules and microfilaments in cell morphogenesis in higher plants[J].Current Biology,2002,12(19):669—676.
[3] LI X B,FAN X P,WANG X L,et al.The cotton ACTIN 1 gene is functionally expressed in fibers and participates in fiber elongation[J]. The Plant Cell,2005,17(3):859—875.
[4] LI L,WANG X L,HUANG G Q,et al.Molecular characterization of cotton Gh TUA9 gene specifically expressed in fiber and involved in cell elongation[J].Journal of Experimental Botany,2007,58(12):3 227—3 238.
[5] GRIGORIEV I,GOUVEIA S M,VAART B V,et al.STIM1 is a microtubule plus end tracking protein involved in remodeling of the endoplasmic reticulum[J].Current Biology,2008,18(3):177—182.
[6] WITTMAN T,WATERMAN-STORER C M.Spatial regulation of CLASP affinity for microtubules by Rac1 and GSK3 beta in migrating epithelial cells[J].The Journal of Cell Biology,2005,169(6):929—939.
[7] MAIATO H,KHODJAKOV A,RIEDER C L.Drosophila CLASP is required for the incorporation of microtubule subunits into fluxing kinetochore fibres[J].Nature Cell Biology,2004,7(1):42—47.
[8] AI-BASSAM J,CHANG F.Regulation of microtubule dynamics by TOG-domain proteins XMAP215/Dis1 and CLASP[J].Trends in Cell Biology,2011,21(10):604—614.
[9] AMBROSE C,RUAN Y,GARDINER J,et al.CLASP interacts with sorting nexin 1 to link microtubules and auxin transport via PIN2 recycling in Arabidopsis thaliana[J].Development Cell,2013,24(6):649—659.
[10] BRANDIZZI F,WASTENEYS G O.Cytoskeleton-dependent endomembrane organization in plant cells:an emerging role for microtubules[J].The Plant Journal,2013,75(2):339—349.
[11] KAKAR K,ZHANG H T,SCHERES B,et al.CLASP-mediated cortical microtubule organization guides PIN polarization axis[J].Nature,2013,495:529—533.
[12] AMBROSE J C,SHOJI T,KOTZER A M,et al.The Arabidopsis CLASP gene encodes a microtubule-associated protein involved in cell expansion and division[J].The Plant Cell,2007,19(9):2 763—2 775.
[13] JIANG J X(蒋建雄),ZHANG T ZH(张天真).Extraction of total RNA in cotton tissues with CTAB-acidic phenolic method[J].Cotton Science(棉花学报),2003,15(3):166—167(in Chinese).
[14] AKHMANOVA A,HOOGENRAAD C C,DRABEK K,et al.Clasps are CLIP-115 and CLIP-170 associating proteins involved in the regional regulation of microtubule dynamics in motile fibroblasts[J].Cell,2001,104(6):923—935.
[15] GROVES M R,HANLON N,TUROWSKI P,et al.The structure of the protein phosphatase 2A PR65/A subunit reveals the conformation of its 15 tandemly repeated HEAT motifs[J].Canadian Metallurgical Quarterly,1999,96(1):99—110.
[16] ANDRADE M A,BORK P.HEAT repeats in the Huntingtonˊs disease protein[J].Nature Genetics,1995,11(2):115—116.
[17] GRALLERT A,BEUTER C,CRAVEN R A,et al.S.pombe CLASP needs dynein,not EB1 or CLIP170,to induce microtubule instability and slows polymerization rates at cell tips in a dynein-dependent manner[J].Genes&Development,2006,20(17):2 421—2 436.
[18] PEREIRA A L,PEREIRA A J,MAIA A R,et al.Mammalian CLASP1 and CLASP2 cooperate to ensure mitotic fidelity by regulating spindle and kinetochore function[J].Molecular Biology of the Cell,2006,17(10):4 526—4 542.
[19] KIM H J,TRIPLETT B A.Cotton fiber growth in planta and in vitro:models for plant cell elongation and cell wall biogenesis[J].Plant Physiology,2001,127(4):1 361—1 366.
[20] KIRIK V,HERRMANN U,PARUPALLI C,et al.CLASP localizes in two discrete patterns on cortical microtubules and is required for cell morphogenesis and cell division in Arabidopsis[J].Journal of Cell Science,2007,120(24):4 416—4 425.
[21] MÜLLER S,WRIGHT A J,SMITH LG.Division plane control in plants:new players in the band[J].Trends in Cell Biology,2009,19:180—188.
[22] AMBROSE J C,WASTENEYS G O.CLASP modulates microtubule-cortex interaction during self-organization of acentrosomal microtubules[J].Molecular Biology of the Cell,2008,19(11):4 730—4 737.
[23] AMBROSE J C,ALLARD J F,CYTRYNBAUM E N,et al.A CLASP-modulated cell edge barrier mechanism drives cell-wide cortical microtubule organization in Arabidopsis[J].Nature Communications,2011,2:430.
[24] DHONUKSHE P,WEITS D A,CRUZ-RAMIREZ A,et al.A PLETHOR-auxin transcription module controls cell division plane rotation through MAP65 and CLASP[J].Cell,2012,149(2):383—396.
[25] INOUE Y H,DO CARMO AVIDES M,SHIRAKI M,et al.Orbit,a novel microtubule-associated protein essential for mitosis in Drosophila melanogaster[J].The Journal of Cell Biology,2000,149(1),153—166.
[26] LEMOS C L,SAMPAIO P,MAIATO H,et al.Mast,a conserved microtubule associated protein required for bipolar mitotic spindle organization[J].The EMBO Journal,2000,19(14):3 668—3 682.
[27] GONCZY P,ECHEVERRI C,OEGEMA K,et al.Functional genomic analysis of cell division in C.elegans using RNAi of genes on chromosomeШ[J].Nature,2000,408:331—336.
[28] LI F G,FAN G Y,LU C R,et al.Genome sequence of cultivated upland cotton(Gossypium hirsutum TM-1)provides insights into genome evolution[J].Nature Biotechnology,2015,33:524—530.
(编辑:宋亚珍)
Cloning and Expression Analysis of GhCLASP1 Gene in Gossypium hirsutum L.
ZHU Shouhong1,XUE Fei1*,ZHAO Lanjie2,LIU Yongchang1,LI Yanjun1,XIONG Xianpeng1,SUN Jie1
(1 College of Agronomy,Shihezi University/Key Oasis Eco-agriculture Laboratory of Production and Construction Group,Shihezi,Xinjiang 832003,China;2 College of Life Sciences,Shihezi University,Shihezi,Xinjiang 832003,China)
CLIP-Associated Proteins(CLASPs)is specifically binding to microtubules of microtubule associated proteins(MAPS),involved in mediating the structure and function of microtubules,and play key roles during cell formation and cell elongation.A new CLASP gene was obtained from Gossypium hirsutum L. by electronic cloning and reverse-transcription polymerase chain reaction(RT-PCR)technology.Sequence analysis showed that GhCLASP1 belongs to the CLASP gene family,the full length ORF of GhCLASP1 is 4 188 bp,encoding 1 395 amino acids.Gh CLASP1 has one HEAT domain and two CLASP-N structures. The phylogenetic analysis of homologue CLASP proteins of other plants showed that Gh CLASP1 had a close relationship with TcCLASP of Theobroma cacao.Real-time quantitative reverse transcription PCR(qRT-PCR)showed that GhCLASP1 was expressed in root,stem,leaf,petal and fiber at different development periods.The highest expression of the GhCLASP1 was observed in the secondary period of the cotton fiber wall thick(27 day post anthesis)and suggesting that GhCLASP1 might play an important role in the formation of secondary wall synthesis of cotton fiber.Transient expression system of the Nicotiana benthamiana leaves was used to analyze subcellular localization,and showed that GhCLASP1 might locatein the cell membrane.This study proved a foundation for studying the functions of CLASP genes in fiber development.
cotton;fiber development;CLASP;expression analysis;subcellular localization
Q785;Q786
A
1000-4025(2015)10-1941-08
10.7606/j.issn.1000-4025.2015.10.1941
2015-05-26;修改稿收到日期:2015-08-02
国家自然科学基金(U1128301);国家“十二五”科技支撑计划(2011BAD35B05);石河子大学高层次人才专项(RCZX201212)
朱守鸿(1987—),男,在读博士研究生,主要从事棉花遗传育种研究。E-mail:zhushouhong2014@126.com
*通信作者:薛 飞,博士,副教授,主要从事棉花遗传育种及棉花功能基因组学研究。E-mail:xuefei2013@hotmail.com
——水芹主要害虫识别与为害症状

