2种杨树光合色素和抗氧化系统对UV-B与NaCl胁迫的响应
马 瑄,李涛涛,赵亚男,杨玉龙,罗宇霞,高永峰*
(1西南科技大学生命科学与工程学院,四川绵阳621010;2中国科学院新疆生态与地理研究所,乌鲁木齐830011)
2种杨树光合色素和抗氧化系统对UV-B与NaCl胁迫的响应
马 瑄1,李涛涛2,赵亚男1,杨玉龙1,罗宇霞1,高永峰1*
(1西南科技大学生命科学与工程学院,四川绵阳621010;2中国科学院新疆生态与地理研究所,乌鲁木齐830011)
以胡杨和俄罗斯杨(黑杨杂交种)为材料,通过设置增强UV-B辐射、NaCl胁迫(100 mmol/L NaCl)、复合胁迫(增强UV-B辐射+100 mmol/L NaCl)及对照(不额外施加NaCl和UV-B)4组处理,研究2种杨树对UV-B辐射、NaCl胁迫及其复合胁迫的生理响应及其种间差异。结果显示:(1)增强UV-B辐射、NaCl胁迫及其复合胁迫下,2种杨树的叶绿素含量降低,叶绿素a/b比值减小,类胡萝卜素含量升高;叶片中的膜脂过氧化产物(MDA)和H2O2含量均显著升高;但在复合胁迫下,俄罗斯杨MDA含量要明显低于各单一胁迫处理,而胡杨MDA含量和2种杨树H2O2含量均介于2种单一胁迫处理之间。(2)在3种不同胁迫条件下,俄罗斯杨和胡杨叶片中过氧化物酶(POD)和过氧化氢酶(CAT)活性比对照显著升高,且POD活性在复合胁迫下最高。(3)2种杨树叶片中渗透调节物质(脯氨酸、甜菜碱、可溶性蛋白)含量在各胁迫条件下均比对照明显升高,且脯氨酸和可溶性蛋白含量在复合胁迫下最高;胡杨甜菜碱含量在3种胁迫条件下的升高幅度均远大于俄罗斯杨,而俄罗斯杨可溶性蛋白含量升高的幅度在增强UV-B辐射和复合胁迫下却明显高于胡杨。研究表明,增强UV-B辐射、NaCl胁迫及其复合处理对2种杨树生长均造成不同程度的胁迫伤害,但2种杨树在复合胁迫下表现出的抗氧化保护能力比在2种单一胁迫下更强,因而复合胁迫对2种杨树的伤害更小,UV-B辐射可能与NaCl胁迫相互拮抗最终减缓了对植物的伤害。
胡杨;俄罗斯杨;UV-B;NaCl胁迫;光合色素;抗氧化系统
日光紫外线-B(UV-B,280~315 nm)是太阳光谱中的固有成分。大气平流层中的臭氧(O3)层能够吸收全部的短波紫外线UV-C(<280 nm)和绝大部分的(90%)UV-B辐射。然而,自20世纪70年代以来,随着工业化进程的迅速推进,大量有害气体如氟氯烃(CFCs)、硫化物和一氧化氮(NO)等排放到空气中,使臭氧层遭到严重的破坏,从而导致到达地表的UV-B辐射不断增加[1]。紫外波谱中介于中等波段(280~315 nm)的UV-B在太阳光谱中具有最高的能量,植物在光照下不可避免地受到UV-B辐射,而一些植物大分子物质如核酸、蛋白质和脂质等均可吸收紫外线,因此UV-B光量子能够通过一系列的光化学反应对细胞造成损伤[2]。国内外的大量研究表明,UV-B辐射的增加会使绝大部分植物表现出植株矮化、叶面积减小、叶片增厚、植物器官生长不均匀和根冠比改变等形态上的变化;此外,还会影响植物的光合作用,降低其地上部株高和生物量,抑制蛋白质合成等[3-5];同时,UV-B诱导产生的环丁烷嘧啶二聚体(CPDs)和6-4嘧啶酮光产物(6-4PPs)等会阻碍DNA的复制和转录,从而影响植物的一系列生理生化过程[6]。
随着世界人口的不断增长,对于粮食生产的需求也将越来越大。在全世界可耕种土地面积逐年萎缩的现实情况下,土壤盐渍化问题已成为人类面临的一大严峻挑战。据2000年FAO统计报告全球约有8.31×108hm2的盐碱化土地,占到全球总陆地面积的6%以上。加上现代化灌溉业发展的影响以及土壤次生盐渍化程度的加剧,盐碱化土地面积正在逐年地增加[7]。如何解决土地盐碱化造成的农林作物减产是人类面临的一个严峻问题。土地盐碱化以及不断增加的UV-B辐射等问题已引起了国内外学者的高度关注,近年来对于土地盐碱化和UVB辐射的相关研究正在逐年增多。但是,目前对于这2种非生物胁迫相结合对植物造成影响的研究还较少。而植物在自然环境中往往会处于多种非生物胁迫之下,因此研究植物在多重胁迫条件下的生存机制非常必要。
杨树(Populus)隶属杨柳科(Salicaceae)杨属多年生木本植物,是世界上分布最为广泛也是适应性最强的树种之一。因其易于繁殖、生长迅速及抗逆性强等特点,被作为木本植物研究中的新型模式植物之一[8]。近年来,国内外对于胡杨(Populus euphratica Olive.)耐受盐碱及干旱胁迫方面已有较多研究,然而对于胡杨是否也抗日光紫外线辐射还鲜有报道。因此,本研究中选用对盐碱胁迫具有极强耐受性的胡杨(P.euphratica)和对盐较为敏感的黑杨杂交种俄罗斯杨(P.russkii)为实验材料,考察2种杨树对UV-B辐射、NaCl胁迫及其复合胁迫的生理响应及其种间差异,为深入探讨植物耐受UVB辐射和盐胁迫等多重非生物胁迫的机制提供一定的理论依据。
1 材料和方法
1.1 植物材料
供试材料为一年生胡杨(Populus euphratica)实生苗和俄罗斯杨(Populus russkii)的扦插苗,2种杨树苗均购自新疆昌吉州阜康实验林场。植物生长基质采用田园土(取自西南科技大学水稻试验田),土壤基本理化性质为:有机质含量10.56 g· kg—1,有效氮含量47.23 mg·kg—1,有效磷含量30.27 mg·kg—1,速效钾含量16.34 mg·kg—1,可溶性钠盐含量22.78 mg·kg—1,p H 7.48。实验采用盆栽方式进行,将两种杨树苗栽植于10 L塑料盆(高25 cm,直径33 cm),每盆土壤干重为10 kg。
1.2 实验设计
实验于2014年4月中旬在西南科技大学玻璃温室(31°53'N,104°69'E)进行,植物材料培养期间定期浇水施肥,常规管理。3个月后选取生长良好长势均一的植株进行实验处理。实验共设4组处理,分别为CK(不额外施加NaCl和UV-B辐射)、NaCl(100 mmol/L NaCl处理)、UV-B(增强UV-B辐射处理)和UV-B+NaCl(增强UV-B辐射+100 mmol/L NaCl处理),每组处理设5个重复。
NaCl处理通过配制含有100 mmol/L NaCl的Hoagland水培营养液每隔5 d浇灌1次,对照组(CK)与UV-B辐射单一处理组浇灌不含NaCl的Hoagland营养液。分别在NaCl处理前及处理进行的第2、7和12天采集土样测定土壤中的NaCl含量,按照陈少良等[9]的方法计算土壤中的NaCl浓度,即NaCl浓度(mmol/L)=NaCl含量(mmol/ kg)/土壤含水量(kg/kg),NaCl处理前和处理第2、7和12天土壤中的NaCl浓度分别为3.25、90.12、104.23和130.10 mmol/L。NaCl处理共进行16 d。
在NaCl处理1 d后开始增补UV-B辐射处理,通过在杨树上方垂直悬挂40W的UV-B荧光灯(北京电光源研究所,UV-B 308nm)进行。灯管距杨树顶端保持80 cm的高度,灯管用厚度为0.13 mm的醋酸纤维素膜包裹以滤除UV-A(315~400 nm)和UV-C(<280 nm)的影响。通过紫外辐照计(北京师范大学光电仪器厂,UV-297)测量增补UV-B辐射的强度为18μW·cm—2(是当地7月份正午时间UV-B辐射强度的1.5倍,是温室内部自然光下UV-B辐射的9倍),UV-B辐照时长为每天8 h(9:00~17:00),处理时间共15 d。对照组(CK)和NaCl单一处理组置于温室内自然光下生长。
1.3 测定指标及方法
UV-B辐射处理进行15 d后(NaCl处理16 d),分别采集2种杨树各处理组植株的顶端以下第4~6片完全展开叶(UV-B辐射处理和UV-B+NaCl处理组的叶片样本据紫外灯管的距离保持完全一致),每种杨树每一组处理各采集5个重复样本,分别用于测定以下各项生理生化指标。
叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)含量采用王学奎等的方法通过紫外分光光度计(UV-5500PC,上海元析)测定[10]。按照Arnon法的修正公式分别计算叶绿素a、叶绿素b以及类胡萝卜素的含量,单位为mg·g—1FW。超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑蓝(NBT)光氧化还原法测定;过氧化物酶(POD)活性参照Prochazkova等的方法测定[11];可溶性蛋白质(Soluble Protein)含量采用考马斯亮蓝G-250染色法测定,可溶性糖(Soluble Sugar)含量用蒽酮比色法测定[10];游离脯氨酸(Proline)含量采用茚三酮比色法测定[10];甜菜碱(Glycine betaine)含量使用甜菜碱含量测定试剂盒(苏州科铭生物技术公司)测定,结果以干重计;丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法,过氧化氢(H2O2)含量参照Patterson等的方法测定[12]。
1.4 数据处理与分析
实验数据利用Microsoft Excel 2007软件进行处理并制作图表,用SPSS16.0软件进行方差分析及差异显著性检验(Tukey法,P<0.05)。
2 结果与分析
2.1 UV-B辐射和NaCl胁迫及其复合处理对两种杨树光合色素含量的影响
在UV-B辐射、NaCl胁迫(100 mmol/L)及UV-B+NaCl复合处理下,2种杨树(俄罗斯杨和胡杨)叶片总叶绿素含量较对照组(CK)均有不同程度的下降(图1,A),除NaCl胁迫的胡杨外均达到显著水平,且总叶绿素含量在俄罗斯杨中以单一UVB辐射处理下降幅度最大(13.5%),在胡杨中而以单一UV-B辐射及UV-B+NaCl复合胁迫下降的幅度较大,分别下降了30.7%和36.4%。UV-B+NaCl复合处理的总叶绿素含量在2种杨树中均与UV-B辐射单独处理无显著差异,在俄罗斯杨中也与NaCl胁迫无显著差异,但在胡杨中却显著低于NaCl胁迫。2种杨树总叶绿素含量在单独UV-B辐射下均显著低于NaCl胁迫。
同时,2种杨树叶片叶绿素a/b比值的表现与总叶绿素含量相似(图1,B),但其在3种不同处理下的降低幅度均达到显著水平,UV-B辐射处理下俄罗斯杨和胡杨叶片叶绿素a/b比值分别比对照显著降低13.2%和20.5%;UV-B+NaCl复合处理的叶绿素a/b值在胡杨中与NaCl胁迫无显著差异,而在俄罗斯杨中却显著低于NaCl胁迫。
另外,与总叶绿素含量和叶绿素a/b值的表现不同,2种杨树叶片中的类胡萝卜素含量在3种不同处理下均比对照不同程度升高,并均以UV-B辐射和复合处理显著较高(图1,C),两处理在胡杨中分别比对照显著提高17.2%和20.0%,在俄罗斯杨中则分别显著提高15.2%和12.5%;2种杨树叶片类胡萝卜素含量在复合胁迫下均与单独UV-B辐射无显著差异,但均显著高于NaCl胁迫。
以上结果说明,2种杨树叶片的总叶绿素含量及叶绿素a/b值在UV-B辐射和NaCl胁迫及其复合处理下均不同程度降低,而其叶片类胡萝卜素含量则不同程度升高(胡杨在NaCl处理下除外),且UV-B辐射和复合处理造成的影响更大。
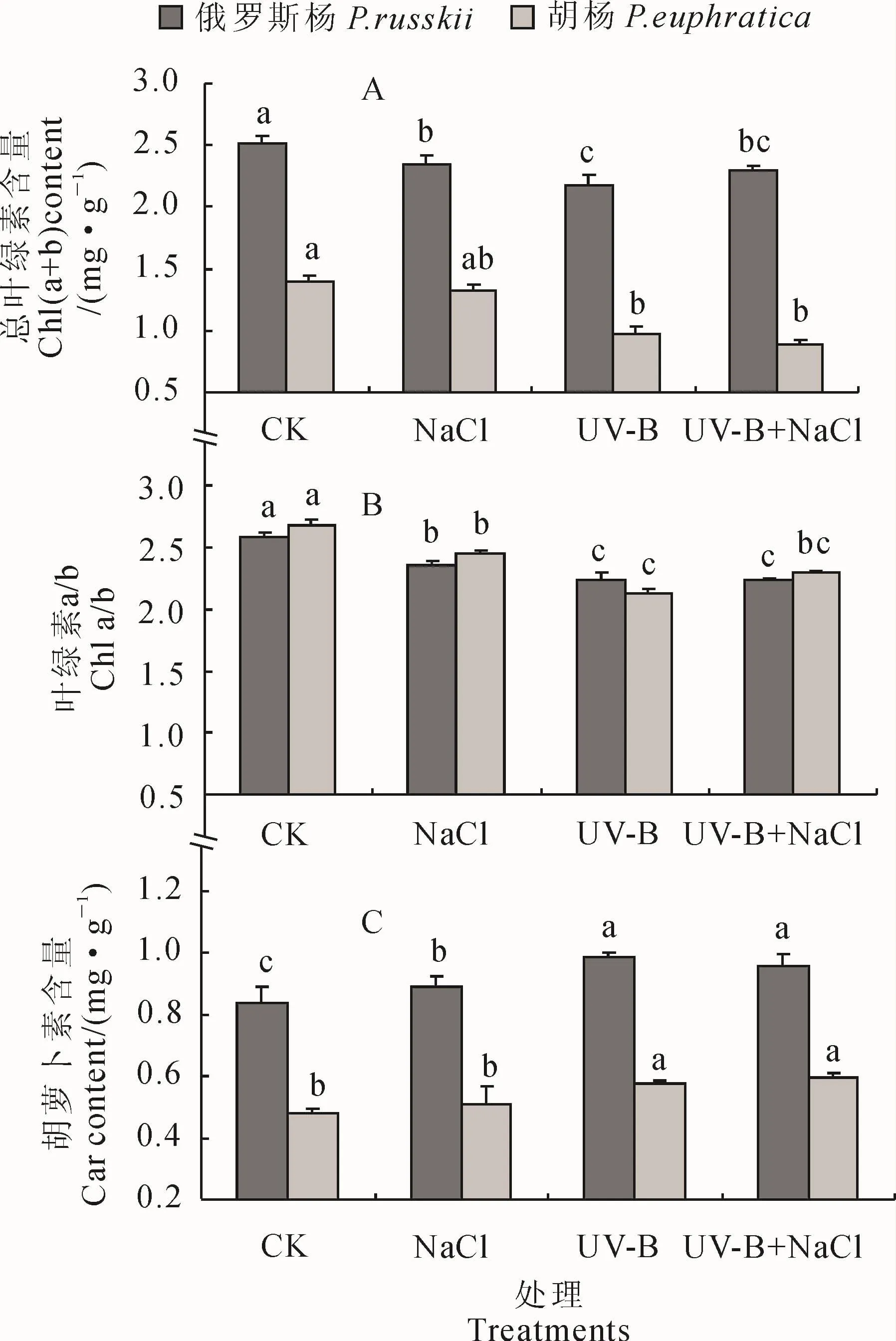
图1 2种杨树光合色素含量在UV-B辐射、NaCl胁迫及其复合处理下的变化图中数值均为平均值±标准误差(n=3);种内不同小写字母表示各个处理组之间在0.05水平存在显著性差异(Tukey多重比较);下同。Fig.1 Photosynthetic pigments content of Populus russkii and Populus euphratica seedlings with UV-B radiation,NaCl stress and their combined treatments The value is mean±SE(n=3);Different normal letters within the same species represent significant differences among treatment groups at 0.05 level(Tukey test for multiple comparisons);The same as below.
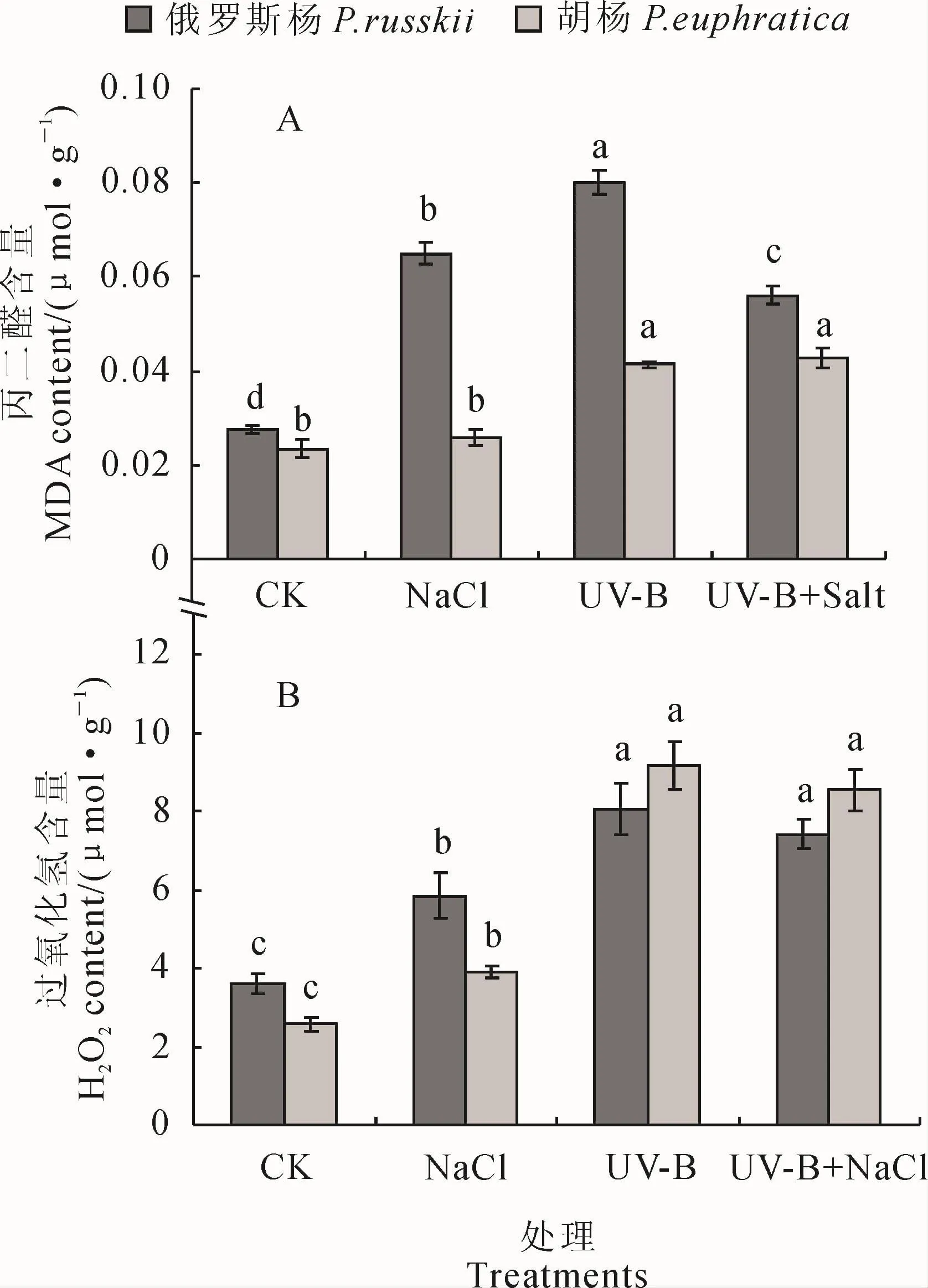
图2 不同处理下2种杨树叶片中丙二醛(MDA)含量和过氧化氢(H2O2)含量的变化Fig.2 Changes of malondialdehyde(MDA)and hydrogen peroxide(H2O2)contents in leaves of two species of Populus under different treatments
2.2 UV-B辐射和NaCl胁迫及其复合处理对2种杨树膜脂过氧化物(MDA)和过氧化氢含量的影响
2种杨树叶片中的丙二醛(MDA)含量在UV-B辐射、NaCl胁迫及其复合胁迫处理下较对照(CK)均不同程度升高,且除NaCl胁迫下胡杨外均达到显著水平(图2,A)。其中,在NaCl处理下,胡杨叶片MDA含量较对照无明显变化,而俄罗斯杨MDA含量却显著增加;在UV-B辐射处理下,2种杨树叶片MDA含量升高的幅度最大,胡杨和俄罗斯杨分别是其对照的1.76倍和2.90倍;在UV-B+NaCl复合胁迫下,俄罗斯杨叶片中的MDA含量显著低于2种单一胁迫(UV-B辐射、NaCl胁迫),而胡杨叶片MDA含量与单一UV-B辐射无显著差异,却显著高于NaCl胁迫单独处理。可见,胡杨对NaCl胁迫具有极强的抗性,俄罗斯杨则较敏感;UV-B辐射对2种杨树的影响要明显强于NaCl胁迫;复合胁迫效应并非2种单一胁迫效应的简单叠加。
同时,俄罗斯杨和胡杨叶片中的过氧化氢(H2O2)含量在3种胁迫条件下较对照值均有显著上升,而其在UV-B+NaCl复合胁迫与UV-B辐射处理间无显著差异,但这2种处理均显著高于NaCl胁迫单独处理(图2,B)。在UV-B辐射和UV-B+NaCl复合胁迫下,2种杨树叶片中的H2O2含量均处于较高水平,俄罗斯杨分别为对照的2.24和2.06倍,胡杨分别为对照的3.56和3.33倍。进一步表明UV-B辐射对两种杨树的影响较NaCl胁迫大。
2.3 UV-B辐射和NaCl胁迫及其复合处理对2种杨树抗氧化酶活性的影响
2.3.1 SOD活性 在3种不同处理下,俄罗斯杨和胡杨叶片中的超氧化物歧化酶(SOD)活性(以鲜重计)的变化具有明显差异(图3,A)。在NaCl胁迫下,胡杨SOD活性较对照无显著变化,而俄罗斯杨SOD活性较对照显著下降;在UV-B辐射条件下,2种杨树SOD活性较对照组均显著降低;在UV-B+NaCl复合胁迫下,俄罗斯杨叶片SOD活性与对照组无显著差异,但却显著高于两单一胁迫(UV-B辐射、NaCl胁迫),而胡杨较对照组和NaCl处理组均有显著下降。
2.3.2 POD活性 俄罗斯杨和胡杨叶片过氧化物酶(POD)活性(以鲜重计)在UV-B辐射、NaCl胁迫及其复合胁迫下呈逐步上升的变化趋势,且均显著高于相应对照,它们在复合胁迫下的POD活性分别为其对照的7.28和6.72倍(图3,B)。从2种杨树的种间差异分析,胡杨POD活性在3种处理下的增加幅度较俄罗斯杨更大,如俄罗斯杨的POD活性在NaCl胁迫下是对照的1.95倍,而胡杨则较对照上升2.89倍。
2.3.3 CAT活性 俄罗斯杨和胡杨叶片过氧化氢酶(CAT)活性(以鲜重计)在3种胁迫条件下较对照均显著上升(图3,C)。其中,胡杨和俄罗斯杨的CAT活性在UV-B辐射下均最大,分别为其对照的4.57和4.61倍;两杨树CAT活性在UV-B+NaCl复合胁迫下次之,分别为其对照的3.48和4.32倍,此时胡杨CAT活性与UV-B辐射处理无显著差异,俄罗斯杨则显著降低;胡杨和俄罗斯杨CAT活性在NaCl胁迫均较以上两处理显著降低,但仍分别为其对照3.45和2.12倍。
以上结果说明,2种杨树比较而言,叶片中主要抗氧化酶活性总体变化趋势在3种处理下相似,但其变化幅度不同;3种抗氧化酶之间相比较,POD、CAT活性在3种处理下变化幅度较大,且均比对照显著增加,在杨树应对逆境胁迫的过程中发挥着更重要作用。
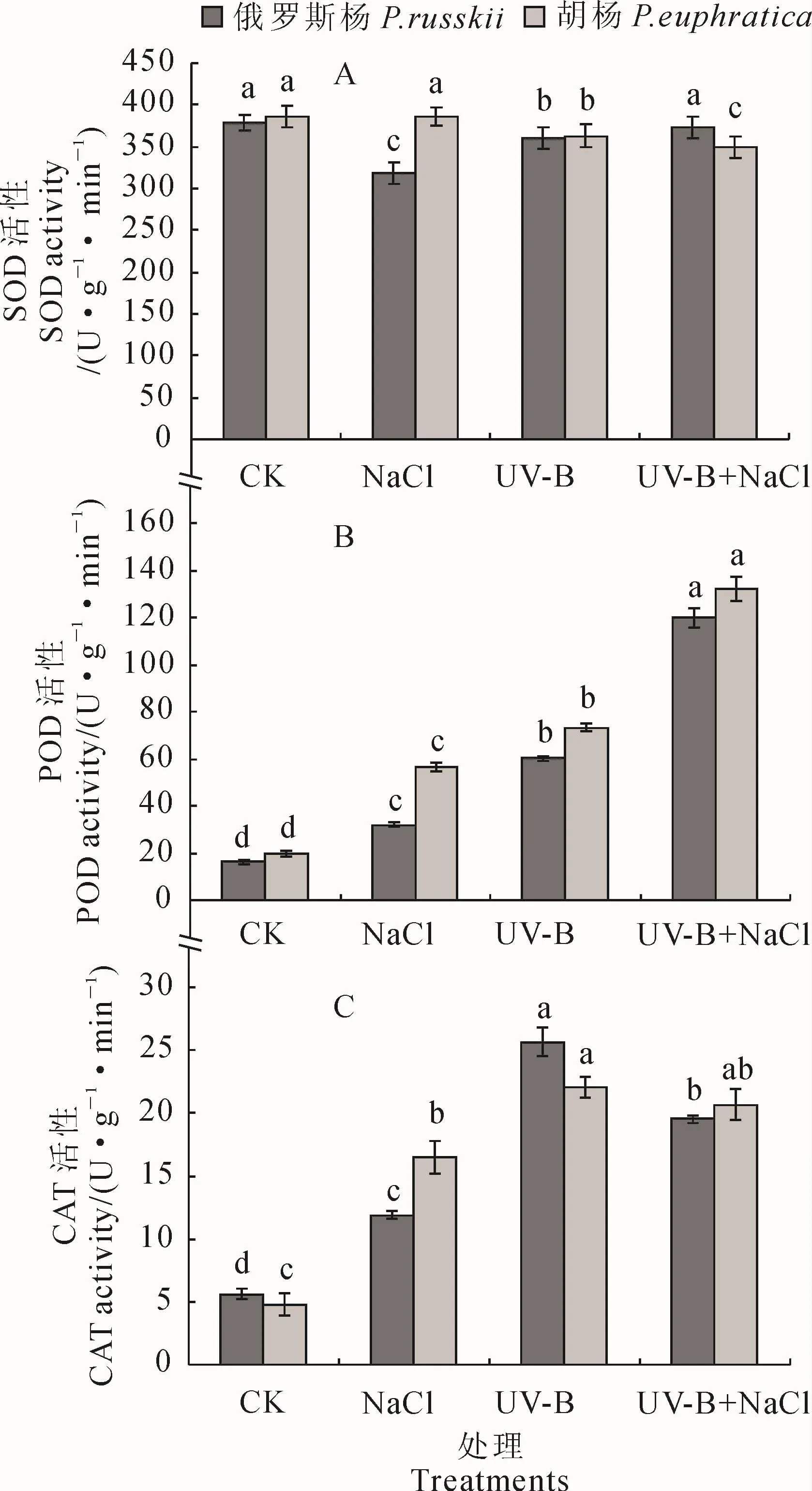
图3 不同处理下2种杨树叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的变化Fig.3 Changes in the activity of superoxide dismutase(SOD),peroxidase(POD)and catalase(CAT)in leaves of P.russkii and P.euphratica under different treatments
2.4 UV-B辐射和NaCl胁迫及其复合处理对2种杨树渗透调节物质的影响
2.4.1 游离脯氨酸含量 除UV-B辐射下俄罗斯杨叶片中游离脯氨酸(Proline)含量(以鲜重计)无显著变化之外,在UV-B辐射、NaCl胁迫及其复合胁迫下两种杨树叶片中的游离脯氨酸含量较对照均显著增高,并以复合胁迫下脯氨酸的含量最高,俄罗斯杨和胡杨分别为其对照的1.20和1.24倍(图4,A)。
2.4.2 甜菜碱含量 俄罗斯杨和胡杨叶片中甜菜碱(Glycinebetaine)含量(以干重计)在3种处理下较对照均显著增高(图4,B)。其中,胡杨叶片的甜菜碱含量在NaCl处理下最高,为对照的2.94倍;而俄罗斯杨甜菜碱含量则在复合胁迫处理下最高,为对照的1.63倍。在UV-B辐射下,俄罗斯杨叶片中甜菜碱含量较对照无显著变化,而胡杨却有显著增高。整体上看,在3种处理条件下,胡杨叶片中甜菜碱含量增高幅度远大于俄罗斯杨。
2.4.3 可溶性蛋白含量 在3种胁迫条件下,俄罗斯杨和胡杨叶片中可溶性蛋白含量(以鲜重计)较对照均有显著升高(图4,C)。其中,在UV-B辐射及UV-B+NaCl复合胁迫下,俄罗斯杨叶片中可溶性蛋白含量升高的幅度最大,分别为对照的2.37和2.51倍,而胡杨只在复合胁迫下的含量最高,为对照的1.96倍,且在UV-B辐射和复合胁迫下2种杨树可溶性蛋白含量的变化表现出较为明显的种间差异。
2.4.4 可溶性糖含量 在NaCl胁迫条件下,俄罗斯杨和胡杨叶片中可溶性糖含量(以鲜重计)较对照也显著升高(图4,D)。在UV-B辐射和UV-B+NaCl复合胁迫下,2种杨树叶片中可溶性糖含量的变化表现出明显的种间差异,俄罗斯杨较对照显著下降,其在UV-B辐射下降低的幅度最大,为对照的37.9%,而胡杨在这两种处理下可溶性糖含量与对照无显著差异。
以上结果表明,2种杨树均可通过渗透调节来缓解逆境胁迫造成的伤害,并且在复合胁迫下2种杨树的渗透调节能力最强。
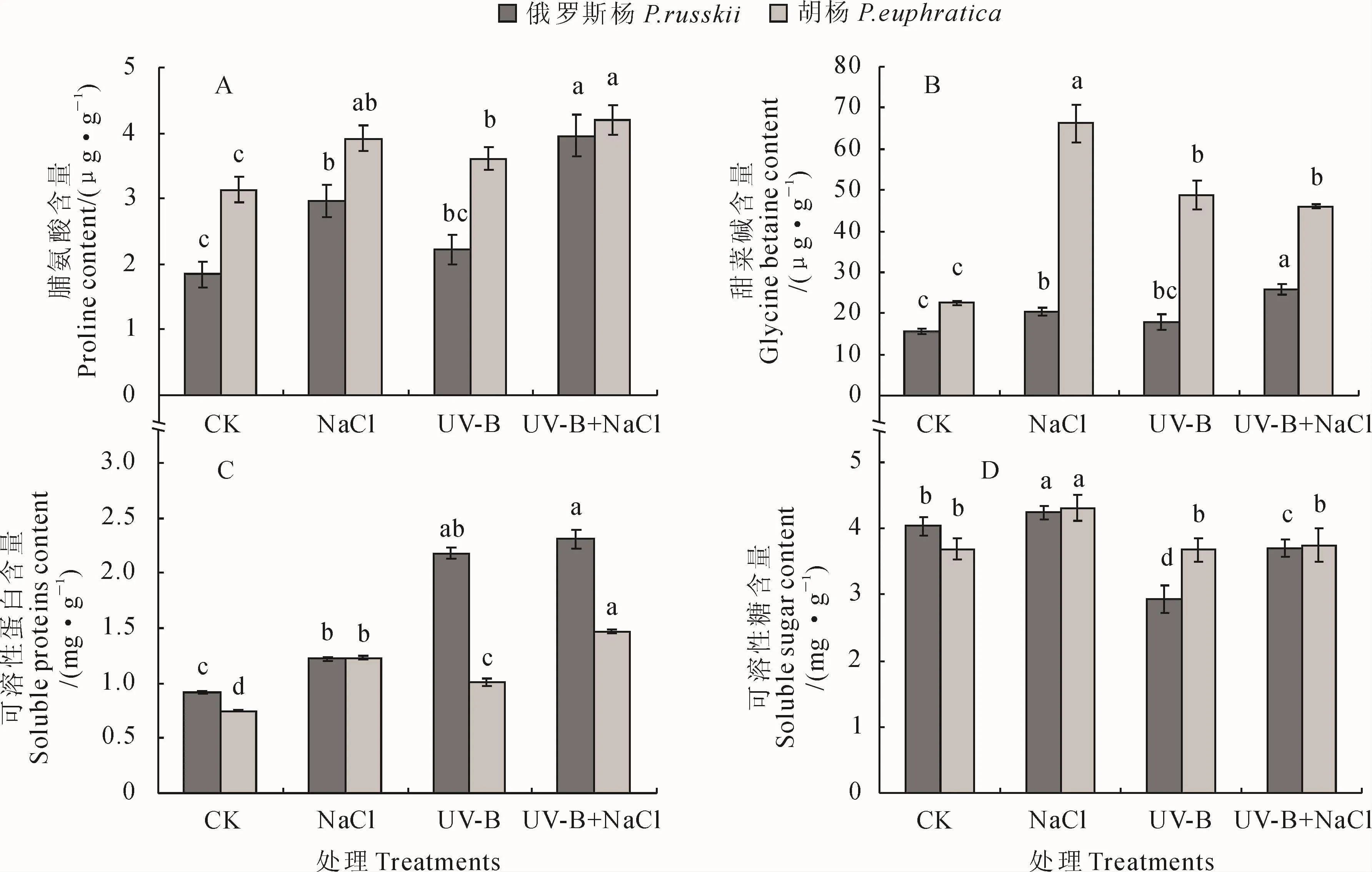
图4 不同处理下2种杨树叶片中的脯氨酸、甜菜碱、可溶性蛋白和可溶性糖含量的变化Fig.4 The content of proline,glycine betaine,soluble protein and soluble sugar in leaves of P.russkii and P.euphratica under different treatments
3 讨 论
逆境胁迫下绿色植物的叶绿素含量和组成的变化直接反映了植物受损伤的程度[13]。在本研究中,增强UV-B辐射、NaCl胁迫及UV-B+NaCl复合胁迫均使2种杨树叶片的叶绿素含量显著下降,但复合胁迫下其叶绿素的含量与2种单一胁迫相比并没有明显的下降,这表明复合胁迫并非这2种单一胁迫的简单叠加。李元等认为UV-B辐射使植物叶绿素含量降低的原因是其导致植物细胞内产生活性氧(ROS),加速叶绿素的降解[14],本研究结果也充分证明了这一观点。本实验中还发现,2种杨树在UV-B辐射和NaCl胁迫以及复合胁迫下叶绿素a/ b比值均呈下降趋势,且在UV-B单一胁迫时下降的幅度最大,表明作为光合中心色素和天线色素的叶绿素a受到的影响更大一些。作为辅助色素的类胡萝卜素可通过散失高光强下多余能量来保护叶绿素[15],且胡萝卜素还是叶绿体内重要的抗氧化剂,有助于清除植物组织内部多余的活性氧。本研究中,UV-B辐射和复合胁迫下2种杨树叶片中类胡萝卜素含量的增加有助于增强其抗逆性;有研究者预测UV-B辐射可以作为一种信号因子诱导类胡萝卜素的合成代谢途径,从而产生更多的类胡萝卜素来抵御UV-B对植物细胞造成进一步的伤害[15]。
H2O2是植物体内一种较为稳定的活性氧,而植物在逆境胁迫下这种平衡状态会被破坏[16];而作为植物膜脂过氧化终产物之一的丙二醛(MDA),其含量的高低能够反映出生物膜系统的受损程度以及植物受到胁迫的严重程度[17]。多数研究表明,在增强UV-B辐射和盐胁迫下植物H2O2和MDA含量均会增加[16-19]。本研究得到的结果与之相同(胡杨在盐胁迫条件下除外)。与叶绿素含量变化的结果相一致,我们同样发现复合胁迫下H2O2和MDA的含量较单一胁迫相比没有升高,俄罗斯杨MDA含量在复合胁迫下甚至明显低于各单一胁迫。这进一步证明了复合胁迫对植物所造成的影响并非这两种单一胁迫的简单加和,可能预先的盐胁迫处理在一定程度上能够减轻随后的UV-B辐射对植物的胁迫伤害。
抗氧化酶系统在植物抵抗氧化胁迫的过程中起到关键作用。在细胞中SOD是构成植物抵抗氧化应激反应的第一道防线[20-21],也是最早响应于逆境胁迫的一种抗氧化酶,但长期的胁迫条件会对植物的生理生化过程产生抑制作用,钝化和削弱相关保护酶的活性[22]。因此,本研究中长期增强UV-B辐射使两种杨树SOD活性下降,尤其是对盐敏感的俄罗斯杨SOD活性下降显著;同时增强UV-B辐射下两种杨树的POD和CAT活性均显著升高;与单一胁迫比较,在UV-B+NaCl复合胁迫下俄罗斯杨和胡杨CAT活性均无下降趋势。POD是植物体内活性较高的一种抗氧化酶,与呼吸作用、光合作用及生长素的氧化等有密切关系[22]。在3种不同处理下,俄罗斯杨和胡杨的POD活性均显著升高,且在复合胁迫下POD活性最高。这一研究结果与郝文芳等[23]在胡枝子中的研究结果相似,其原因可能是这2种胁迫在植物体内相互之间形成一种拮抗作用,从而缓减了对植物本身的伤害程度,而这种复合胁迫却能诱导植物产生有效的抗氧化保护作用,很大程度上降低了胁迫对植物造成的伤害。
遭受到非生物胁迫时,植物可通过激发一系列内源性保护物质以减缓和消除胁迫造成的伤害[24]。脯氨酸(Proline)、甜菜碱(Glycine betaine)、可溶性蛋白(SP)和可溶性糖(SS)是植物体内重要的渗透保护物质,它们能够迅速调节胞质中的渗透势缓解逆境胁迫对植物细胞造成的渗透压力。本研究中,除俄罗斯杨在增强UV-B辐射下脯氨酸和甜菜碱含量较对照无显著差异之外,在3种胁迫条件下胡杨和俄罗斯杨叶片中脯氨酸、甜菜碱和可溶性蛋白含量均有不同程度的增加,且在复合胁迫下2种杨树叶片中脯氨酸和可溶性蛋白含量最高。这表明2种杨树均可通过渗透调节来缓解逆境胁迫造成的伤害,并且在复合胁迫下2种杨树的渗透调节能力最强。甜菜碱是植物体内一种重要的代谢保护物质,植物在盐或干旱胁迫下会积累甜菜碱[9]。本研究表明胡杨在UV-B辐射和复合胁迫下同样大幅度提高了其甜菜碱含量,这可能与胡杨具有更强的抗渗透胁迫能力和灵敏地调节植物体内渗透保护物质有关,胡杨的这个特点在脯氨酸上也表现明显。陈少良等[9]的研究也表明耐盐性较强的胡杨可能在NaCl胁迫的诱导下能够迅速提高甜菜碱合成酶活性,促进甜菜碱的合成。可溶性蛋白质含量的变化主要取决于辐射强度和植物对UV-B的敏感程度[25]。3种不同胁迫条件下,俄罗斯杨在UV-B辐射和复合胁迫下可溶性蛋白含量升高的幅度显著高于胡杨,表明俄罗斯杨对UV-B辐射的敏感性较胡杨更高。
综上所述,增强UV-B辐射、NaCl胁迫及其复合胁迫均对2种杨树造成不同程度的胁迫。尽管其伤害程度会因胁迫类型以及植物的特性不同而有所异,但总体而言在复合胁迫下两种杨树启动的防御保护机制最强,NaCl的预处理使杨树启动了防御机制,从而减缓了UV-B伤害。本研究还发现对盐胁迫较为敏感的黑杨杂交种俄罗斯杨的丙二醛含量、可溶性蛋白和可溶性糖含量变化在UV-B辐射和复合胁迫下变化更明显,表明俄罗斯杨同样对UV-B辐射更为敏感。
[1] CALDWELL M M,FLINT S D.Stratospheric ozone reduction,solar UV-B radiation and terrestrial ecosystems[J].Climatic Change,1994,28(4):375—394.
[2] BALLARE C L.Stress under the sun:spotlight on ultraviolet-B responses[J].Plant Physiology,2003,132(4):1 725—1 727.
[3] GITZ III D C,GITZ L L,BRITZSJ,et al.Ultraviolet-Beffects on stomatal density,water-use efficiency,and stable carbon isotope discrimination in four glasshouse-grown soybean(Glycine max)cultivars[J].Environmental and Experimental Botany,2005,53(3):343—355.
[4] FENG H Y,An L Z,CHEN T,et al.The effect of enhanced ultraviolet-B radiation on growth,photosynthesis and stable carbon isotope composition(δ13C)of two soybean cultivars(Glycine max)under field conditions[J].Environmental and Experimental Botany,2003,49(1):1—8.
[5] WEI X L(魏小丽),ZHENG N(郑 娜),LI X Y(李晓阳),et al.Effect of Enhanced UV-B Radiation on Arabidopsis Mesophyll Cell Protein[J].Bulletin of Botanical Research(植物研究),2013,33(2):186—190(in Chinese).
[6] SANCAR A.and SANCAR G.B.DNA repair enzymes[J].Annual Review of Biochemistry,1988,57,29—67.
[7] MARTINEZ-BELTRAN J,MANZUR C L.Overview of salinity problems in the world and FAO strategies to address the problem[J]. Proceedings of the International Salinity Forum,Riverside,California,April,2005:311—313.
[8] TAYLOR G.Populus:Arabidopsis for forestry.Do we need a model tree?[J].Annals of Botany,2002,90(6):681—689.
[9] CHEN SH L(陈少良),LI J K(李金克),BI W F(毕望富),et al.Genotypic variation in accumulation of salt ions,betaine and sugars in poplar under conditions of salt stress[J].Chinese Bulletin of Botany(植物学通报),2001,18(5):587—596(in Chinese).
[10] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:134—202.
[11] PROCHAZKOVA D,SAIRAM R K,SRIVASTAVA G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science,2001,1 614(4):765—771.
[12] PATTERSON B D,MZCRAE E A,FERGNSON I B.Estimation of hydrogen peroxide in plant extract using titanium(IV)[J].Analytical Biochemistry,1984,139(2):487—492.
[13] JEOM M W,ALI M B,HAHN E J,et al.Photosynthetic pigments,morphology and leaf gas exchange exvitro acclimatization of micropropagated CAM Doritaenopsis plantlets under relative humidity and air temperature[J].Environmental and Experimental Botany,2006,55(1—2):183—194.
[14] 李 元,岳 明.紫外辐射生态学[M].北京:中国环境科学出版社,2000.
[15] MIDDLETON E M,TERAMURA A H.The role of flavonol glycosides and carotenoids in protecting soybean from ultraviolet-B damage[J].Plant Physiology,1993,103(3):741—752.
[16] CHEN T(陈 拓),WANG X L(王勋陵).Influence of enhanced UV-B radiation on H2O2metabolism in wheat leaves[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),1999,19(2):284—289(in Chinese).
[17] ZHAO T H(赵天宏),LIU Y O(刘轶鸥),WANG Y(王 岩),et al.Effect of elevated O3concentration and UV-B radiation on the chlorophyll content and oxygen metabolism of soybean leaves[J].Chinese Journal of Applied Ecology(应用生态学报),2013,24(5):1 277—1 283(in Chinese).
[18] FENG H Y(冯虎元),AN L ZH(安黎哲),CHEN SH Y(陈书燕),et al.The interactive effects of enhanced UV-B irradiation and water deficit on physiological properties of spring wheat seeding[J].Acta Ecologica Sinica(生态学报),2002,22(9):1 564—1 568(in Chinese).
[19] HE J M(贺军民),SHE X P(佘小平),WANG R B(王瑞斌),et al.Physiological and ecological effects of enhanced UV-B radiation on Wheat seeding under NaCl stress condition[J].Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2004,24(10):1 810—1 815(in Chinese).
[20] RUTH G A,NEVAL E,LENWOOD S H.Role of superoxide dismutases(SODs)in controlling oxidative stress in plants[J].Journal of Experimental Botany,2002,53(372):1 331—1 341.
[21] DING M Q,HOU P CH,SHEN X,et al.Salt-induced expression of genes related to Na+/K+and ROS homeostasis in leaves of salt-resistant and salt-sensitive poplar species[J].Plant Molecular Biology,2010,73(3):251—269.
[22] ZHAN SH Y(战莘晔),YIN H(殷 红),LI X Y(李雪莹),et al.Effect of UV-B radiation on photosynthetic characteristics and protective enzyme activities of japonica rice[J].Journal of Shenyang Agricultural University(沈阳农业大学学报),2014,45(5):513—517(in Chinese).[23] HAO W F(郝文芳),ZHAO J(赵 洁),CAI C H(蔡彩虹),et al.Dynamic response of antioxidant enzymes and osmotic adjustment substances to drought and enhanced UV-B radiation in three Lespedezas[J].Acta Scientiae Circumstantiae(环境科学学报),2013,33(8):2 349—2 358(in Chinese).
[24] XIAO Q(肖 强),ZHENG H L(郑海雷),CHEN Y(陈 瑶),et al.Effects of salinity on the growth and proline,soluble sugar and protein contents of Spartina alterniflora[J].Chinese Journal of Ecology(生态学杂志),2005,24(4):373—376(in Chinese).
[25] NEDUNCHEZHIAN N.Induction of heat short-like proteins in Vigna sinensis seeding growing under UV-B enhanced radiation[J]. Physiologia Plantarum,1992,85:503—506.
(编辑:裴阿卫)
Response of Photosynthetic Pigments and Antioxidant System to Ultraviolet-B Radiation and NaCl Stress in Two Species of Populus
MA Xuan1,LI Taotao2,ZHAO Ya'nan1,YANG Yulong1,LUO Yuxia1,GAO Yongfeng1*
(1 School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang,Sichuan 621010,China;2 Xinjiang Institute of Ecology and Geography,Chinese Academy of Science,Urumqi 830011,China)
In this study,we investigated that the effects of ultraviolet-B radiation and NaCl stress and their combined treatments on the antioxidant system and photosynthetic pigments in two species of poplar,Populus euphratica and Populus russkii(black poplar hybrids),by setting four treatment groups including UV-B(enhanced UV-B radiation),NaCl(100 mmol/L NaCl),UV-B+NaCl(enhanced UV-B radiation and 100mmol/L NaCl),CK(No extra NaCl and UV-B treatment).The results show that:(1)under enhanced UV-B radiation and NaCl stress and their combined stresses,the content of chlorophyll of two species of Populus were decreased,the ratio of chlorophyll a/b was also decreased,but the content of carotenoid was increased.The contents of lipid peroxidation MDA and H2O2in leaves of P.euphratica and P.russkii wereboth significantly increased(P<0.05).However,under the combined stresses,the MDA content in leaves of P.russkii was significantly lower than each single stress,the MDA content in leaves of P.euphratica and the H2O2content in leaves of P.euphratica and P.russkii were between two single-stress.(2)The activities of POD and CAT in P.russkii and P.euphratica were all significantly increased under three different stresses,and POD activity was the highest under the combined stress.(3)The contents of osmotic protectants(such as proline,gylcinebetaine,soluble protein)in leaves of two species of populus were all significantly increased under three different stress conditions.Moreover,the contents of proline and soluble protein were the highest under the combined stresses.Compared with P.russkii,the content of gylcinebetaine in leaves of P.euphratica had larger increase in under three different stresses,while the content of soluble protein of P.russkii was significantly more than P.euphratica under enhancement of UV-B radiation and the combined stresses.In summary,two species of Populus were subject to different degrees of damage under three different stress conditions.But compared with two kinds of single stress,the antioxidative ability of two species of Populus was the strongest under the combined stresses,so the degree of two species of Populus damaged was more less under the combined stresses.It show that the enhanced UV-B radiation and NaCl stress may antagonized each other's effects in plantlet.
Populus euphratica;Populus russkii;UV-B;NaCl stress;photosynthetic pigments;antioxidant system
Q945.79
A
1000-4025(2015)10-2042-08
10.7606/j.issn.1000-4025.2015.10.2042
2015-06-02;修改稿收到日期:2015-08-15
国家自然科学基金(31270660);四川省青年科技基金(2014JQ0016);西南科技大学博士启动基金(14zx7157);西南科技大学研究生创新基金(15ycx091)
马 瑄(1989—),男,在读硕士研究生,主要从事植物抗逆生理研究。E-mail:MaX_uan@163.com
*通信作者:高永峰,博士,讲师,主要从事植物抗逆生理与分子生物学研究。E-mail:gaoyongfeng0263@gmail.com

