HSP27及其磷酸化蛋白的表达对实验性急性胰腺炎细胞骨架稳定性的影响①
李宏旭,田 桦,程 开,卓 越
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
HSP27及其磷酸化蛋白的表达对实验性急性胰腺炎细胞骨架稳定性的影响①
李宏旭,田 桦,程 开,卓 越
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的:探讨小热休克蛋白(HSP27)及其磷酸化蛋白(p-HSP27)表达对急性胰腺炎(AP)模型大鼠细胞骨架保护性作用的研究。方法:将45只正常成年雄性Wistar大鼠随机分空白对照组(A组)、急性胰腺炎组(B组)、假手术组(C组)。实验前12h禁食,正常饮水,确定AP动物模型建立成功后于1h、3h、6h三个时间段处死大鼠,且随机每个时间段每组各处死5只。确定动物模型建立成功,Western-blotting检测HSP27及其磷酸化蛋白含量,RT-PCR检测HSP27mRNA表达。结果:急性胰腺炎组大鼠各时间点SAM值明显高于空白对照组和假手术组(P<0.05);急性胰腺炎组大鼠各时间点胰腺组织HSP27蛋白、p-HSP27蛋白(Ser15)和HSP27mRNA相对表达量均明显高于空白对照组和假手术组(P<0.05)。结论:在AP早期胰腺细胞骨架稳定性出现明显变化,HSP27及其p-HSP27含量及HSP27mRNA表达明显升高,提示HSP27在AP早期对胰腺细胞骨架的稳定性起到非常重要作用。
急性胰腺炎;细胞骨架;HSP27;p-HSP27
急性胰腺炎的发病机制经研究显示是机体通过酶系统和非酶系统产生的氧自由基,直接攻击生物膜的多不饱和脂肪酸,从而引发脂质的过氧化形成脂质过氧化物,此氧化应激损伤使胰腺细胞骨架的稳定性受到严重影响。急性胰腺炎发生发展时,哺乳细胞体内的丝裂原活化蛋白激酶MAPK信号转导通路会发生一系列的级联反应,从而对细胞骨架,包括微管(microtubule,MT)、微丝(microfilament,MF)和中间纤维(intermediate,IF)起到重要的调节作用。小热休克蛋白27(HSP27)及其磷酸化形式通过MAPK信号转导通路参与细胞调节,表达增高可以增加受到毒性刺激的细胞的生存率[1],不利的应激环境可使HSP27迅速合成[2]及其易发生磷酸化后在蛋白质水平上起到防御和保护作用。本实验检测HSP27及其磷酸化蛋白表达,观察其对急性胰腺炎大鼠模型氧化损伤的保护作用。
1 材料与方法[3~5]1.1 实验动物
成年雄性Wistar大鼠(n=45),体重180~220g,由佳木斯大学实验动物中心提供。
1.2 实验主要试剂及仪器
牛磺胆酸钠(天津索罗门生物科技有限公司);10%水合氯醛、0.9%氯化钠、75%乙醇(佳木斯大学附属第一医院);淀粉酶检测试剂盒(Gal-G2-CNP底物法)(日本YZB/JAP4125-2014);兔抗HSP27(BA0475,武汉博士德公司);HSP27磷酸化(p-HSP27)抗体(Ser15)(UpState,深圳精美公司);二抗试剂盒(武汉博士德公司);TGL-16M/MI台式高速冷冻离心机(长沙湘丽离心机有限公司);DYCP-44P快速凝胶电泳仪(槽),郑州南北仪器设备有限公司;UV755B紫外可见分光光度计,上海;PCR扩增仪PCRSystem9700,美国等。
1.3 实验方法
将正常雄性Wistar大鼠45只,随机分为空白对照组(A组)、急性胰腺炎组(B组)、假手术组(C组),每组15只,每笼喂养5只。三组实验动物均在同等条件下给予正常饲料和高温灭菌自来水喂养,4周后,体重180~220g,实验前12h禁食(自由饮水),急性胰腺炎组腹腔注射10%水合氯醛(0.3mL/100g)麻醉动物后剖腹,找胆胰管行牛磺胆酸钠胆胰管逆行注射(牛磺胆酸钠:浓度5%,注射剂量:0.lmL/l00g,注射速度:0.lmL/min)造模;空白对照组麻醉剖腹后不予任何处理;假手术组麻醉剖腹后给予等剂量生理盐水胆胰管逆行注射。各组动物造模后随机于1h、3h、6h(每时点n=5)取腹主动脉血,通过采用淀粉酶检测试剂盒(Gal-G2-CNP底物法)进行测定血清淀粉酶(SAM)确定动物模型成功。切取十二指肠窗内胰腺组织(约250~300mg),采用western-blotting方法检测HSP27蛋白及其磷酸化蛋白含量并使用QuantityOne软件对
图像进行灰度值分析、采用RT-PCR方法检测HSP27mRNA水平的相对表达并使用LabWorks软件对图像进行灰度值分析。
1.4 统计学方法
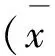
2 结果
2.1Gal-G2-CNP底物法检测各组大鼠血清淀粉酶(SAM)的检测
结果显示,B组大鼠各时间点血清淀粉酶值均明显高于同时间点的A组、C组,差异有统计学意义(P<0.05);B组随时间延长血清淀粉酶值明显增高,差异有统计学意义(P<0.05)。见表1。
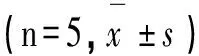
表1 各组大鼠SAM值(U/L)随时间变化情况
注:*与A组比较P<0.05;#各时点与相应1h比较P<0.05;△与B组比较P<0.05。
2.2Western-blotting检测各组大鼠胰腺组织HSP27蛋白、p-HSP27蛋白(Ser15)相对表达量的检测
结果显示,B组大鼠胰腺组织中HSP27蛋白、p-HSP27蛋白(Ser15)的相对表达量明显高于A、C组。如表所示,B组HSP27蛋白、p-HSP27蛋白(Ser15)均呈现高表达。见表2。
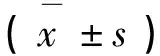
表2 各组大鼠HSP27及p-HSP27蛋白
注:*与A组比较P<0.05;#各时点与相应1h比较P<0.05;△与B组比较P<0.05。
2.3RT-PCR检测各组大鼠胰腺组织HSP27mRNA表达水平
结果显示,B组大鼠HSP27mRNA表达水平明显高于A、C组,A组和C组HSP27mRNA均呈现低表达(P<0.05)。如图所示,B组大鼠HSP27mRNA相对表达量明显高于A、C组。见图1。
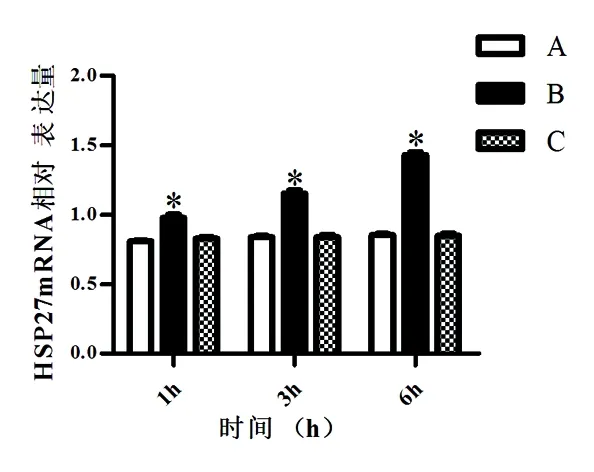
图1 各组大鼠胰腺组织HSP27mRNA相对表达量的变化情况
3 讨论
牛磺胆酸钠诱导的急性胰腺炎模型早期就可出现胰腺细胞的损伤,大量胰腺细胞被破坏,可表现为细胞极性消失、细胞间隙扩大及纤维肌动蛋白微丝降解等,最终导致细胞骨架发生剧烈的改变[6]。小热休克蛋白27(HSP27)是肌动蛋白actin聚合的磷酸化依赖性调控因子[7,8],HSP27蛋白及其磷酸化蛋白的变化可调控细胞骨架结构,其核内定位信号主要通过MAPK信号通路重新组装核内结构并参与调节各分子生成过程。HSP27在细胞内的过表达,可在一定程度上对某些刺激(如氧化应激反应)有相应的抵抗作用。研究表明,有害应激诱导产生的HSP27蛋白可抑制细胞凋亡,对后续细胞损伤有一定的抵抗,特别对肌动蛋白actin的调控有保护作用[9]。磷酸化后的HSP27可在细胞核内发挥功能使紊乱的细胞骨架更具稳定性,即使微管蛋白结合更紧密,阻止微丝的分裂及避免中间纤维发生异常聚合。在之前的研究中,我们发现在牛磺胆酸钠诱导的胆源性急性胰腺炎早期就出现了细胞骨架的解聚[10]。本研究通过构建AP大鼠模型,进一步在蛋白水平对牛磺胆酸钠诱导的胆源性急性胰腺炎早期细胞骨架的改变进行验证,并初步确定了HSP27及其磷酸化蛋白,参与细胞骨架的保护机制。
研究结果表明,在实验动物急性胰腺炎的早期,HSP27蛋白的表达量升高,随病程进展HSP27表达量进一步增高,p-HSP27蛋白及mRNA表达量均升高。出现这种表现的主要原因可能是由于在急性胰腺炎的发生发展中,产生大量的活性氧自由基,引起细胞内氧化应激水平升高,并最终导致细胞损伤。HSP27蛋白是细胞连接复合体结构的调控因子,基于以上这种氧化应激损伤的诱导, 进而激活其自身及p-HPS27蛋白的高表达,发挥其对细胞骨架的保护作用。在空白对照组中的HSP27 蛋白及其磷酸化蛋白、HSP27mRNA呈现低表达;在假手术组中,
细胞的结构较完整,HSP27蛋白及其磷酸化蛋白的表达亦呈低表达,其两组之间的差异无统计学意义。由此可见,HSP27蛋白及其磷酸化蛋白在对稳定细胞骨架的调控中起到关键的作用;在对细胞有害的应激环境中,HSP27蛋白也将对保护胰腺细胞骨架的稳定性发挥重要作用。这可能与HSP27蛋白在MAPK信号转导通路中易发生磷酸化,并以磷酸化方式进行调节细胞骨架结构有关。
本研究揭示了在AP早期的发生发展中,氧化应激损伤可使细胞骨架稳定性降低,同时可导致HSP27蛋白及其磷酸化蛋白呈现高表达状态。HSP27蛋白及其磷酸化蛋白表达显著升高,这说明胰腺细胞骨架受到氧化损伤程度更剧烈,提示以磷酸化方式调节胰腺细胞骨架结构的HSP27蛋白对细胞骨架稳定性具有一定的保护作用,为深入探讨急性胰腺炎的损伤机制提供了理论依据。
[1]BalogA,GyulaiZ,BorosLG,etal.PolymorphismoftheTNF-[alPha],HSP70-2,andCD14genesincreasessusceptibilitytosevereacutePanereatitis[J].Panereas,2005,30(2): 46-50
[2]李永武,尚进才,黄秀香. 热休克蛋白27、60、70在直肠癌中的表达及意义[J].黑龙江医药科学,2013,36(2):39-41
[3]孙国志,赵伟. 沙棘总黄酮对糖尿病大鼠心肌细胞的影响[J].黑龙江医药科学,2010,33(3):51-52
[4]王宇超,刘大伟,辛华,等. 体外无镁诱导海马神经元痫样放电后SOD的变化[J].黑龙江医药科学,2013,36(3):108-109
[5]张海彬,赵锦程,李春海,等. 尼可地尔预处理对家兔缺血再灌注损伤的保护作用研究[J].黑龙江医药科学,2007,30(3):44-45
[6]SugiK,MuschMW,FieldM,etal.InhibitionofNa+/K+-ATPasebyinterferon-[gamma]down-regulatesintestinalepithelialtransportandbarrierfunction[J].Gastroenterology, 2001,120(13):1393-1403
[7]GroblewskiGE,GradyT,MehtaN,etal.CholeeystokininstimulatesheatshoekProtein27PhosPhorylationinratPancreasbothinvivoandinvitro[J].Gastroenterology,1997,112:1354-1361
[8]SchaferC,RossSE,BragadoMJ,etal.ArolefortheP38mitogen-activatedProteinkinase/hsp27Pathwayincholeeystokinin-inducedchangesintheactincytoskeletoninratPanereaticacini[J].JB101Chem,1998,272: 24173-24180
[9]MerendinoAM,PaulC,VignolaAM,etal.HeatshockProtein-27ProtectshumanbronchialePithelialcellsagainstoxidativestress-mediatedapoptosis:possibleimplicationinasthma[J].CellStressChaperones,2002, 7:269-280
[10]王烨,田桦,卓越.β-C对急性出血坏死性胰腺炎胰腺细胞骨架稳定性的影响 [J]. 黑龙江医药科学,2007,30(3):5-6
The effects of the expressions of HSP27 protein and its phosphorylated protein on experimental acute pancreatitis cell skeleton stability
LIHong-xu,TIANHua,CHENGKai,ZHUOYue
(The First Affiliated Hospital of Jiamusi University,Jiamusi 154003, China)
Objective: To investigate the protective effect of small heat shock protein (HSP27) and its phosphorylated protein (p-HSP27) expression on rat skeleton model of acute pancreatitis (AP). Methods: 45 normal adult male Wistar rats were randomly divided into three groups, which were the control group (A), the acute pancreatitis group (B), and the sham group (C). All the rats were fasted for 12 hours and drank water normally before the experiment. Five rats were killed in each group at 1h, 3h, and 6h after determining the animal model of AP successfully. The serum amylase (SAM) was detected by using Gal-G2-CNP to determine the success of model. The Western-blotting and RT-PCR were used to detect the content of HSP27 and its p-HSP27 and the expression of HSP27mRNA, respectively. Results: SAM values of acute pancreatitis group at each point were significantly higher than those in control group and sham group (P<0.05).TherelativeexpressionofacutepancreatitisgroupateachtimepointforHSP27protein,p-HSP27protein(Ser15)andHSP27mRNAweresignificantlyhigherthanthatincontrolgroupandshamgroup(P<0.05). Conclusion: The skeleton stability for pancreatic cells in the early AP was changed significantly. The contents of HSP27 protein and its p-HSP27 and the expression of HSP27mRNA are increased significantly. The results suggested that HSP27 expression plays an important role on the stability of cytoskeleton of in the early age of AP.
acute pancreatitis; cytoskeleton; HSP27; p-HSP27
佳木斯大学研究生创新科技课题,编号:LM2014-036;佳木斯大学科技项目,编号:S2011-38;S2009-060。
李宏旭(1988~)女,黑龙江鸡西人,在读硕士研究生。
卓越(1964~)男,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。E-mail: zhuoyuejmsu@126.com。
R576;Q245 文章类别:A
1008-0104(2015)02-0072-03
2014-01-06)

