老芒麦种子发育时不同位叶光合速率和生物量变化与种子产量的相关分析
刘金平,游明鸿,曾晓琳,蔡 捡,张小晶
(1.西华师范大学生命科学院,四川南充637009;2.四川省草原科学研究院,四川成都611731)
老芒麦种子发育时不同位叶光合速率和生物量变化与种子产量的相关分析
刘金平1,游明鸿2,曾晓琳1,蔡 捡1,张小晶1
(1.西华师范大学生命科学院,四川南充637009;2.四川省草原科学研究院,四川成都611731)
本文通过在开花期、灌浆期、乳熟期、蜡熟期、完熟期测定不同位叶的光合速率和生物量,分析种子发育过程中各位叶的光合速率、光合贡献率、叶生物量及含水量、花穗生物量和种子千粒重的变化,研究种子产量与不同发育期不同位叶光合性能的关系。结果表明,1)种子发育过程中,不同位叶的光合速率和光合贡献率均存在显著变化,同一发育期各位叶的光合速率和光合贡献率表现出显著差异。2)不同位叶的叶生物量和含水量随种子发育均发生显著变化,同一位叶在种子发育不同时期的叶生物量和含水量表现出显著差异。3)种子产量与开花期1~5叶的光合速率和生物量及叶总生物量均呈正相关;与灌浆期第1,3叶光合速率和第1,2叶生物量呈显著正相关(P<0.05);与乳熟期第4,5叶的光合速率及叶生物量为负相关;与蜡熟期、完熟期第1叶光合速率为正相关,与第3~5叶光合速率为极显著负相关,与第1,2叶生物量呈正相关,与第3~5叶生物量呈显著负相关。4)种子产量与灌浆期之后的叶总生物量均为负相关,与灌浆期和乳熟期花穗生物量呈负相关,与蜡熟期和完熟期花穗生物量为显著正相关。所以,在营养生长阶段要采取合理栽培措施,促进不同位叶叶片生长和营养累积,为种子发育奠定物质基础,而灌浆期后要注意调控各位叶的生物量和光合速率,着重保护第1~3叶的完整性与健康度,以提高老芒麦种子产量与千粒重。
老芒麦;光合作用;叶位;种子产量;生物量
老芒麦(Elymus sibiricus)是禾本科披碱草属多年生疏丛型中旱生植物,为披碱草属中营养价值最高的牧草。“川草2号”老芒麦(Elymus cv.chuancao No.2)具有适应性广,生长速度快,分蘖力强,草质优,产量高,抗寒,耐湿等优点,是目前我国高寒地区广泛种植的一个优良牧草品种[1-2]。近年来,在川西北高原建立了约3500 hm2种子生产基地,由于缺乏适合高原气候特点的系统性、实用性生产技术支撑,种子实际产量约400 kg/hm2左右,仅为潜在种子产量的10%左右[3],远远不能满足青藏高原东缘生态恢复重建、退化沙化草地治理、退牧还草、种草养畜等工程建设对优质“川草2号”老芒麦种子需求。所以,立足生产需求,深入开展老芒麦种子生产技术研究,探讨和总结适合川西北高原气候特点的生产技术措施,加强对种子生产、加工、调整的技术支持,是急需解决的生产实践问题。
国内外关于老芒麦种子生产技术的报道较少,多集中于资源评价、品种选育及适应性等方面[4-6],种子生产技术主要集中在行距、播量、施肥、收获时间对老芒麦种子产量及构成因子[7-9]等的研究。光合作用是植物生长发育的原初动力,川西北高原太阳辐射强、日照时间长,年总辐射量为20.93×106~29.30×106kJ/m2,为老芒麦光合作用提供了良好的光照条件。但关于老芒麦光合生理的报道较少,仅对光合特性[10]、光合日变化[11-12]、行距对光合影响[13]及辐射对再生草光合影响[14]进行了初步的研究。有关玉米(Zea mays)、水稻(Oryza sativa)、高粱(Sorghum bicolor)等作物研究认为,不同叶位叶片光合特性和光合贡献率存在差异,且对物质合成及种子产量的影响也不同[15-18]。本文通过在开花期、灌浆期、乳熟期、蜡熟期、完熟期测定不同位叶的光合速率和生物量,分析种子发育过程中各位叶的光合速率、光合贡献率、叶生物量及含水量、花穗生物量和种子千粒重的变化,研究种子产量与不同发育期不同位叶光合性能的关系,探讨种子发育过程不同位叶的贡献差异,为选择提高种子产量与质量的田间管理技术提供科学依据,以期为青藏高原草地畜牧业发展、农业产业结构调整和生态环境治理等提供“量多质优”的牧草种子,同时为规模化、产业化种子生产提供理论依据。
1 材料与方法
1.1 试验地概况
试验于阿坝州红原县邛溪镇二农场进行,为大陆性高原温带季风气候,东经102°32′,北纬32°46′,海拔3497 m,年均温1.1℃,极端高温23.5℃,极端低温-33.8℃,年降水量738 mm,相对湿度71%,≥10℃年积温仅865℃。土壤为草甸土,0~20 cm土壤的有效氮、磷、钾含量分别为276,10.2和131 mg/kg,有机质含量5.87%,p H值5.91。
1.2 试验材料及测定指标
于2014年7月,在面积10 m2(2 m×5 m)、间距1 m、行距60 cm、密度约1000生殖枝/m2、播后第4年且生长均衡的“川草2号”老芒麦种子试验小区中,以健壮无病虫害的生殖枝为材料,选保留完整健康5叶的生殖枝为研究对象。
光合速率及光合贡献率:在开花期、灌浆期、乳熟期、蜡熟期、完熟期分别随机选10个生殖枝,于晴朗无风上午,用LI-6400便携式光合仪,在自然光下,测定由上而下第1~5叶的光合速率Pn(photosynthetic rate),每叶中部随机选3点,每点连续测3个数值。计算不同位叶的光合贡献率(该叶光合速率占第1到第5叶总光合速率的百分比)。
叶生物量、叶生物量比例及含水量:在开花期、灌浆期、乳熟期、蜡熟期、完熟期分别随机选10个生殖枝,按叶位顺序剪取10个生殖枝的叶片,称鲜重后,按叶位分别装袋,同时茎与花穗分开分别装袋,于105℃烘至恒重,称干重为生物量,计算叶片含水量及叶生物量比例,3次重复。
种子千粒重:在开花期、灌浆期、乳熟期、蜡熟期、完熟期分别随机选10个生殖枝,取种子200粒,105℃烘至恒重,计算千粒重,3次重复。
种子产量:在完熟期随机选10个生殖枝,人工采种,风干后,计算每个生殖枝的种子产量,3次重复。
1.3 数据处理
采用SAS 9.3进行数据分析。
2 结果与分析
2.1 种子发育过程中不同位叶光合速率变化
2.1.1 种子发育期不同位叶的光合速率比较 第1~5位叶在开花期、灌浆期、乳熟期、蜡熟期、完熟期的光合速率均存在显著差异(P<0.05)(表1),由F值可见,不同位叶光合速率差异由大到小为:乳熟期>蜡熟期>完熟期>开花期>灌浆期。进一步多重比较说明,开花期第2,3叶的光合速率显著高于其他位叶(P<0.05),而第1,4,5叶间无显著差异;灌浆期第5叶的光合速率显著低于其他叶位(P<0.05),但第1~4叶间无显著差异;乳熟期第2叶光合速率显著高于第3~5叶(P<0.05),第1叶与第2,3叶无显著差异,第4,5叶均与其他位叶差异显著(P<0.05),第5叶光合速率显著低于其他位叶(P<0.05);蜡熟期第1~3叶的光合速率显著高于4,5叶(P<0.05),但第1~3叶无差异;完熟期不同位叶间的光合速率差异进一步增加,仅第3,4叶间无显著差异。
2.1.2 同一位叶在不同发育期的光合速率比较 同一位叶在种子发育的不同时期光合速率均存在极显著差异(P<0.01)(表1),第1,3,4,5叶的光合速率在灌浆期达最大值,第2叶乳熟期达最大值,后随种子发育各位叶的光合速率均逐渐降低。由F值可见,在种子发育过程中,位叶光合速率变化大小顺序为:第4叶>第3叶>第2叶>第5叶>第1叶。第1叶虽变化最小,但在灌浆期、乳熟期的光合速率显著高于其他时期(P<0.05),开花期和蜡熟期差异较小,完熟期的光合速率显著降低,为蜡熟期的46.06%,为灌浆期的33.78%;第2和第3叶的光合速率在开花期、灌浆期、乳熟期均无显著差异,蜡熟期和完熟期下降幅度也相似;第4和第5叶的光合速率在乳熟期就显著下降,到蜡熟期比灌浆期分别下降了51%和67%,完熟期比蜡熟期又分别下降了79%和109%。总的来看,第1~3叶光合速率显著下降从蜡熟期开始,第4~5叶从乳熟期开始,不同位叶的光合速率下降趋势相同,但下降幅度不同,叶位越低下降越快。
2.2 不同位叶光合贡献率变化
2.2.1 种子发育期不同位叶的光合贡献率比较 种子发育的同一时期,不同位叶的光合贡献率间存在极显著差异(P<0.01)(表2),由F值可见,不同位叶光合贡献率差异由大到小为:蜡熟期>乳熟期>完熟期>开花期>灌浆期。多重比较说明,开花期第2和第3叶的贡献率显著高于其他位叶,第1叶显著低于第2~3叶,但显著高于第4~5叶(P<0.05),第4~5叶的贡献率无差异;灌浆期第1~3叶的贡献率间无差异,但显著高于第4~5叶(P<0.05),第5叶的贡献率显著低于第4叶;乳熟期第1~3叶的贡献率间仍无差异,均显著高于第4~5叶(P<0.05),而第4和第5叶贡献率无差异;蜡熟期第1叶贡献率显著高于其他位叶(P<0.05),第2和第3叶贡献率间无差异,但显著高于第4~5叶(P<0.05),第5叶的贡献率显著低于第4叶;完熟期各位叶的光合贡献率均表现出显著差异(P<0.05),叶位越低贡献率越小。

表1 不同位叶光合速率的多重比较Table 1 Multiple comparison about photosynthetic rate of leave in different position

表2 不同位叶光合贡献率的多重比较Table 2 Multiple comparison about photosynthetic contribution rate of leave in different position
2.2.2 同一位叶在不同发育期的光合贡献率比较 同一位叶在种子发育的不同时期光合贡献率均存在显著差异(P<0.05)(表2),由F值可见,在种子发育过程中,位叶光合贡献率变化大小顺序为:第1叶>第5叶>第3叶>第2叶>第4叶。多重比较说明,第1叶的光合贡献率随种子发育而不断显著增大,从开花期的19.57%增加到完熟期的45.15%;第2叶贡献率相对稳定,在开花期、灌浆期、乳熟期、蜡熟期的贡献率间均无显著差异,仅完熟期贡献率高于种子发育前期(P<0.05);第3叶贡献率仅完熟期下降而显著低于其他时期(P<0.05),而其他时期间无显著差异;第4和第5叶的贡献率在开花期、灌浆期、乳熟期间均无差异,从蜡熟期起显著下降,第5叶贡献率在完熟期下降为负值。总的来看,在种子发育的前期,不同位叶都起着不可或缺的作用,第1~3叶的贡献率在乳熟期、蜡熟期和完熟期起主导性作用,尤其第1叶贡献率对种子完熟起决定性作用。
2.3 种子发育过程中不同位叶生物量变化
2.3.1 种子发育期不同位叶的生物量比较 在种子发育的开花期、灌浆期、乳熟期、蜡熟期、完熟期,不同位叶的生物量均存在极显著差异(P<0.01)(表3),由F值可见,不同位叶生物量差异由大到小为:蜡熟期>乳熟期>完熟期>开花期>灌浆期。多重比较表明,开花期第3叶的生物量显著高于第1和第5叶(P<0.05),第1叶与其他位叶生物量间无显著差异,第2~4叶生物量间无显著差异;灌浆期、乳熟期、蜡熟期及完熟期第1~3叶的生物量显著高于第4和5叶的生物量(P<0.05),且1~3叶生物量间无显著差异,第4和第5叶生物量在灌浆期和乳熟期无差异,但到蜡熟期和完熟期,第5叶生物量显著低于第4叶(P<0.05)。

表3 不同位叶生物量的多重比较Table 3 Multiple comparison about biomass of leave in different position
2.3.2 同一位叶在不同发育期的生物量比较 同一位叶在种子发育的不同时期生物量均存在极显著差异(P<0.01)(表3),由F值可见,在种子发育过程中,位叶生物量变化大小顺序为:第2叶>第4叶>第3叶>第1叶>第5叶。第1叶灌浆期生物量显著高于其他时期(P<0.05),开花期和乳熟期显著高于蜡熟期和完熟期,但彼此之间无差异;第2~5叶生物量在开花期和灌浆期均显著高于其他时期,且均在乳熟期显著下降(P<0.05),第2和3叶在乳熟期生物量显著高于蜡熟期和完熟期,第4和第5叶生物量在乳熟期、蜡熟期和完熟期均无显著差异。由上可见,灌浆期各位叶生物量均不再继续增加,随种子发育进程各位叶生物量均显著下降,说明各位叶均为种子发育提供了营养物质,但第4和第5叶主要在开花期至灌浆期提供,第1,2和3叶在灌浆期至蜡熟期提供,而蜡熟期至完熟期各位叶均未继续向种子输送营养物质。
2.4 种子发育过程中不同位叶含水量变化
种子发育的不同时期,各位叶的含水量均存在显著差异(P<0.05)(表4),差异大小顺序为:灌浆期>蜡熟期>完熟期>乳熟期>开花期。开花期第5叶含水量显著低于其他位叶(P<0.05),而1~4叶含水量间无显著差异;灌浆期第1~3叶含水量显著高于第4和第5叶(P<0.05);乳熟期第1叶含水量显著高于其他位叶,其他位叶间含水量差异明显;蜡熟期第1~4叶含水量显著高于第5叶,第1~3叶含水量间无显著差异;完熟期第1叶含水量高于第3~4叶,第2与3叶和第4与5叶均无显著差异。
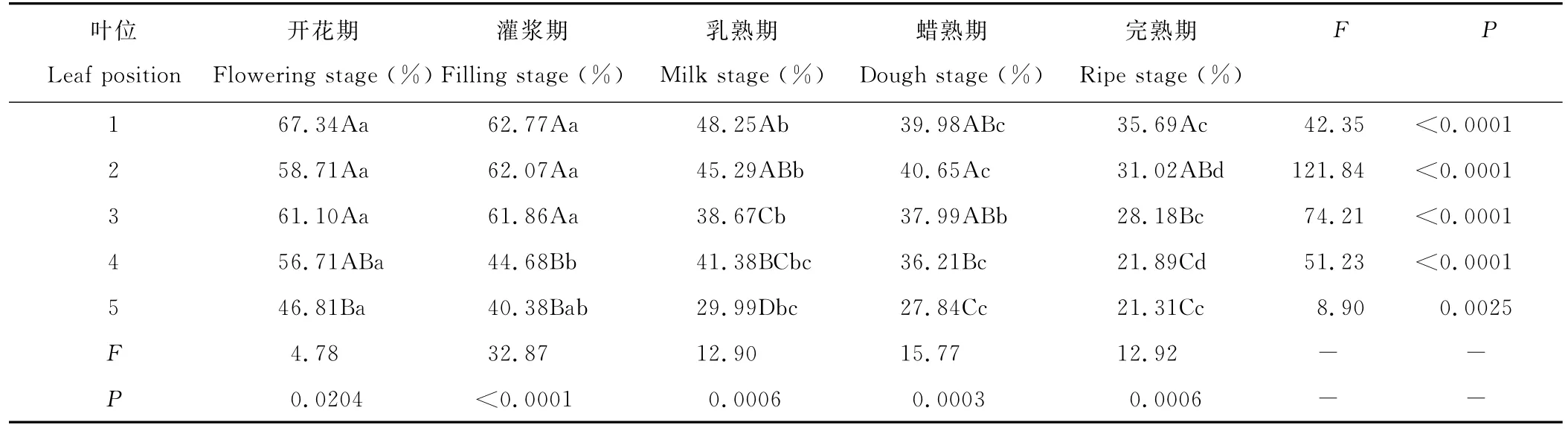
表4 不同位叶含水量的多重比较Table 4 Multiple comparison about water content of leave in different position
同一位叶在种子发育的不同时期含水量均存在极显著差异(P<0.01)(表4),种子发育过程中,位叶含水量变化顺序为:第2叶>第3叶>第4叶>第1叶>第5叶。第1~3叶含水量显著下降在灌浆期至乳熟期和乳熟期至蜡熟期,第4~5叶则在开花期至灌浆期显著下降。叶位越低随种子发育叶片的含水量下降越早,且下降幅度越大。
2.5 叶位和种子发育期双因子对位叶光合及生物量影响的方差分析
双因子方差分析表明,老芒麦叶片的光合速率、光合贡献率、生物量及含水量在总处理、叶位间、发育期间及互作间均存在着极显著差异(P<0.01)(表5)。由F值可见,总处理和种子发育期对光合速率影响最大,光合贡献率次之,对叶片含水量第三,叶片生物量最小。叶位主要影响叶片生物量,其次影响光合速率,对光合贡献率影响最小。而叶位和发育期互作主要影响光合贡献率,其次为光合速率。总之,发育期是影响光合速率、光合贡献率、叶片含水量的主要因素,而叶位是影响叶片生物量的主要因素,叶位与发育期共同作用导致了老芒麦生殖枝的不同位叶在种子发育不同时间发挥的作用不同。
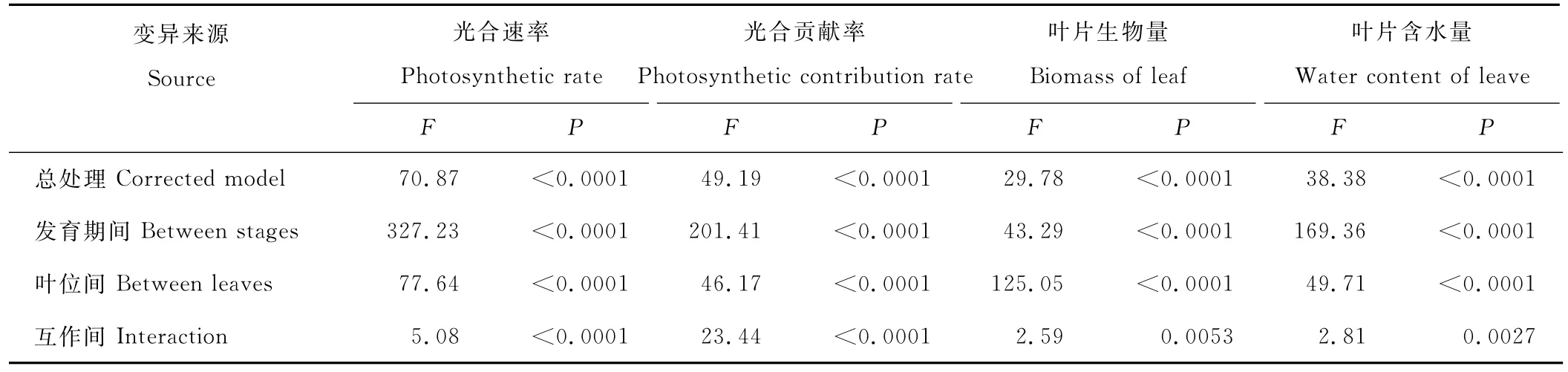
表5 叶位和种子发育期双因子的方差分析Table 5 Two-factor variance analysis about leaf position and seed development stage
2.6 种子发育过程中叶、花序生物量及种子饱满度变化
种子不同发育期,生殖枝叶片生物量及叶生物量比例均存在显著差异(P<0.01)(表6),开花期和灌浆期叶生物量及比例显著高于乳熟期、蜡熟期和完熟期(P<0.05),但叶生物量在乳熟期、蜡熟期和完熟期间差异极小,乳熟期叶生物量比例显著高于蜡熟期和完熟期(P<0.05)。乳熟期叶生物量及比例比开花期下降了32.40%和38.11%,完熟期叶生物量及比例仅为开花期的59.56%和53.07%。花穗生物量和种子千粒重随种子发育而极显著增加(P<0.01)(表6),开花期、灌浆期、乳熟期、蜡熟期、完熟期的花穗生物量和种子千粒重间均存在显著差异,从开花期到完熟期,花穗生物量和种子千粒重分别增加了1.26和2.51倍。

表6 种子发育过程中叶、花序生物量及种子饱满度多重比较Table 6 Multiple comparison about biomass of leaves and inflorescence and seed plumpness during seed development
2.7 生殖枝种子产量与叶光合速率、叶生物量及花穗生物量的相关分析
种子产量与不同位叶的光合速率和叶生物量相关性分析说明,老芒麦种子产量与开花期生殖枝1~5叶的光合速率和生物量及叶总生物量均呈正相关(表7),与开花期第1,3,4叶光合速率呈极显著正相关(P<0.01),与第1,3叶生物量呈显著正相关(P<0.05),与第4叶生物量呈极显著正相关(P<0.01)。种子产量与灌浆期第1,3叶光合速率呈极显著正相关(P<0.01),与灌浆期第1~2叶生物量呈极显著正相关(P<0.01)。种子产量与乳熟期第1~3叶的光合速率及叶生物量为正相关,而与第4~5叶的光合速率及叶生物量为负相关;种子产量与蜡熟期第1叶的光合速率为极显著正相关(P<0.01),与蜡熟期和完熟期第3~5叶的光合速率为极显著负相关(P<0.01),与蜡熟期和完熟期第1~2叶的生物量呈正相关,而与第3~5叶的生物量呈显著负相关(P<0.05),尤与第4叶生物量呈相关系数为-1.000的极显著负相关(P<0.01)。种子产量与灌浆期之后的生殖枝叶生物量均为负相关,与灌浆期和乳熟期花穗生物量呈负相关,但与蜡熟期和完熟期花穗生物量为显著正相关(P<0.05)。从相关分析可见,开花期之前不同位叶的光合速率和叶生物量累积对种子发育均有促进作用,所以在营养生长阶段要采取合理栽培措施,促进不同位叶叶片生长和营养累积,为种子发育奠定物质基础。而灌浆期和乳熟期仅第1~3叶光合产物与累积生物量可被种子发育利用,蜡熟期仅第1叶光合产物和第1,2叶累积的生物量能促进种子完熟。完熟期第1~2叶生物量与种子产量相关系数为1.000,表明第1~2叶剩余的生物量越高种子发育越饱满,但完熟期各位叶光合速率及第3~5叶生物量与种子产量负相关,表明贪青晚熟不利于种子成熟。

表7 种子产量与不同光合速率和叶生物量及花穗生物量的相关分析Table 7 Correlation analysis of seed yield with position leafs photosynthetic rate,leaf and inflorescence biomass during seed development
3 结论和讨论
3.1 不同位叶光合速率与种子发育的关系
老芒麦属长日照的C3上繁草类,年生活史中先后形成10~11片真叶,随株高增加和物候变化,上层新叶形成的同时下层叶片逐渐死亡,到生殖生长阶段仅保留健康完整叶5~6片。玉米、小麦(Triticum aestivum)等禾本科作物的旗叶,无论叶宽、叶长、平展角度都与其他位叶不同,常通过旗叶和倒2叶的光合特性和生物量来研究位叶对籽粒产量的影响,而老芒麦旗叶的叶长、叶宽等外观性状与其他上位叶差异较小,倒2叶已枯死,所以本研究中用从上而下第1~5叶来探讨不同位叶与种子发育的关系。试验结果说明,不同位叶的光合速率和光合贡献率在开花期、灌浆期、乳熟期、蜡熟期、完熟期均表现出显著差异(P<0.05),同一位叶在种子发育的不同时期光合速率和光合贡献率均表现出显著差异(P<0.05)。各位叶的光合速率和贡献率在灌浆期均达最大值且差异较小,随种子发育各位叶的光合速率均逐渐降低,第1,2叶的光合贡献率显著上升,第3叶贡献率相对稳定,而第4~5叶贡献率显著下降。在整个发育过程中,第1~3叶光合贡献率占绝对性优势,可见不同位叶在老芒麦生长阶段具有明确的分工,第1叶形成于抽穗期,第2叶形成于孕穗期,第3~5叶形成于拔节期,1~2叶为生殖生长提供营养,3~5叶主要为营养生长提供动力。但老芒麦叶片形态参数几无区别,仅第1,3位叶的叶长大于第2,4,5位叶,并非叶长、叶宽、叶面积、长宽比等形态参数随着叶位的下降自上而下逐渐变小[19]。在小麦、燕麦(Avena sativa)、黑麦(Secale cereale)等作物上的研究表明,不同叶位叶片的各类叶肉细胞形态、比例、密度均存在规律性差异[20-21],且随着叶位的上升叶片的叶绿素含量逐渐增加[22],叶绿体的基质、基质片层和基粒片层也随叶位上升增加[23],致使上位叶的光合速率和贡献率显著高于下位叶,从而对成粒率、籽粒充实度、千粒重和最终的产量起决定性作用。本试验,只对不同位叶在种子发育过程中光合速率变化进行了分析,光呼吸是与光合作用同时存在的消耗能量过程,有研究认为光呼吸可通过调节电子传递、消耗能量等方式,减轻由于光能过剩造成的光抑制及光氧化对光合机构的伤害[24],关于老芒麦不同位叶细胞形态、超微结构、叶绿素含量及光呼吸机理待于进一步深入研究。
3.2 不同叶位生物量与种子发育的关系
植物营养生长是生殖生长的基础,营养生长累积和贮存的物质,主要用于满足开花结实的需要。种子发育实质是营养器官向生殖器官输送营养物质的过程。叶作为光合同化的主要器官,是植物一切生命活动的能量来源,叶生物量一定程度上可反映种子产量源的大小。小麦、水稻等植物研究认为,源库互作对种子产量和品质形成起至关重要的作用,最终种子产量高低取决于产量源、库容和物质运输能力(流)及其协调程度[25]。籽粒的灌浆物质主要来源于开花后的光合产物,灌浆物质的积累数量必然与籽粒的库容量密切相关[26],而库的大小在抽穗前就已被决定,因此,种子发育过程中实质是源器官向库器官运输物质的过程,源器官光合产物合成和积累数量必然影响种子的成粒率、饱满度(千粒重)和实际产量。本试验,种子发育过程中不同位叶的生物量均存在显著变化,灌浆期各位叶生物量均达最大值,随种子发育进程各位叶生物量均显著下降,说明各位叶作为产量源均向产量库输送了营养物质,但各位叶生物量降低有明显的差异,第4,5位叶在灌浆期至乳熟期提供营养,第1,2和3叶在灌浆期至蜡熟期提供,蜡熟期至完熟期库源互作停止,各位叶生物量虽有降低,但主要用于自身的呼吸作用。老芒麦生殖枝在灌浆期叶生物量及比例显著高于乳熟期、蜡熟期和完熟期,而乳熟期、蜡熟期和完熟期间差异极小,说明灌浆期至乳熟期是源—库能量流动最强时期,也是决定种子充实度的关键时期,乳熟期之后叶生物量降低速度减慢即营养输送减慢,但种子千粒重增重加快,或许此时种子获得的营养物质是由穗柄提供。种子产量的形成是源库互作的结果,小花数量是决定库容大小及种子产量的关键[27],但小花数在抽穗后已确定,因而开花期之后结实率和千粒重是影响种子产量的最大因素,所以保证各位叶的健康度与完整率是源库协调和产量实现的关键所在,也是种子发育过程中田间养护的核心技术要求。
3.3 不同位叶与种子产量的关系
老芒麦叶片数量与质量受植物自身的遗传物质决定,也受水、肥、气、热、光照等环境因子的影响。大量研究表明,通过栽培技术可以提高叶片的数量与质量性状[28-29],从而影响老芒麦的生殖投入、生殖过程及生殖收益[30]。本试验说明,不同位叶在不同的种子发育期起着不同的作用,开花期第1~5叶的光合速率和叶生物量累积对种子发育均有促进作用,所以在营养生长阶段要采取合理栽培措施,促进不同位叶叶片生长和营养累积,为种子发育奠定物质基础。种子产量与灌浆期、乳熟期第1~3叶光合产物与累积生物量呈正相关,与蜡熟期第1~2叶生物量显著正相关,而与第3~5叶的光合速率和叶生物量为显著负相关,说明第4~5叶仅在灌浆期前对种子发育提供能量,而种子充实阶段主要由第1~3叶提供物质。在种子发育阶段,上位叶缺失对种子成粒率、千粒重及种子产量都有显著的影响[31]。在川西北高原,老芒麦处于孕穗期至灌浆期时,正是病虫害发生最为严重的时期,其中粘虫(Mythimna separata)与锈病(Puccinia reconditavar)的发生频率最高危害最大。由于天然草地草层低矮,种子生产田成为粘虫入侵、繁殖与危害的首选目标,且危害的主要是上位叶片,叶片损失率可高达47.23%[32]。伴随粘虫侵染,锈病爆发造成叶片的二次损伤。病虫害引起叶片受损致使光合效率降低和累积物质减少,产量源受损必然导致产量库的库容降低,造成种子的减产甚至绝收。所以,在种子生产过程中,采取合理的技术措施,增大叶片形态参数和防止叶片缺失与损伤,是栽培养护、大田管理的核心目标。
[1] You M H,Liu J P,Bai S Q,et al.Effect of mixed application of fertilizers and herbicides on production performance of Elymus sibiricus.Acta Prataculturae Sinica,2010,19(5):283-286.
[2] You M H,Zhang C B,Liu J P,et al.Effect of row spacing and fertilizing on productivity of Elymus sibiricus cv.chuancao No.2.Pratacultural Science,2008,25(2):69-72.
[3] You M H,Liu J P,Bai S Q,et al.Influence of row spacing on fertile tiller and characters of seed yield of Elymus sibiricus cv.chuancao No.2.Acta Prataculturae Sinica,2011,20(6):299-302.
[4] Yan J J,Bai S Q,Ma X,et al.Ear character diversity of native populations of Elymussibiricus in the northwest plateau of Sichuan province.Acta Prataculturae Sinica,2007,16(6):99-106.
[5] Chen G,He L F.Evaluation of ecological adaptability and productivity of two species of Elymus in alpine region.Pratacultural Science,2004,21(9):39-42.
[6] Yuan Q H,Zhang J Y,Zhang W S,et al.Biodiversity of native populations of Elymus dahuricus and Elymussibiricus.Pratacultural Science,2003,20(5):44-49.
[7] Liu J P,You M H.Response of fertile tiller characteristics and seed yield of Elymussibiricus to row space alteration.Journal of Animal and Plant Sciences,2014,21(3):3347-3355.
[8] Mao P S,Han J G,Wang Y,et al.Effects of fertilization on seed yield and seed quality of Elymus sibiricus.Pratacultural Science,2001,18(4):7-13.
[9] Mao P S,Han J G,Wu X C.Effects of harvest time on seed yield of siberian wildrye.Acta Agrestia Sinica,2003,11(1):33-37.
[10] Chen Y J.Study on Photosynthetic Traits and Production Performance of Elymus sibiricus in the Qinghai-Tibetan Plateau[D].Xining:Qinghai University,2013:34-36.
[11] Wang Y C,Gan Y M,Qiu Y,et al.Physiological and ecological characteristics of photosynthesis of Elymus sibiricus cv.Chuancao No.2 in alpine area.Jiangsu Agricultural Sciences,2007,35(6):211-213,235.
[12] Wang Y C,Gan Y M,Chen L K,et al.Primary study on physiological and ecological characteristics of photosynthesis of Elymussibiricus cv.Chuancao No.1 in summer in alpine area.Pratacultural Science,2007,24(11):42-45.
[13] You M H,Liu J P,Bai S Q,et al.Effect of row space on photosynthetic index and seed yield of Elymussibiricus L.Prataculture&Animal Husbandry,2013,(1):14-17,22.
[14] Huang D,Li Z Z,Fan F C.Study of net photosynthesis on Elymussibiricus L.regrowth under different sunlight radiations.Acta Agrestia Sinica,2003,11(4):338-342.
[15] Sun S J,Ma H T,Li F S.Effects of leaves at the different positions on grain weight in sorghum interaction.Chinese Agricultural Science Bulletin,1998,14(6):59-61.
[16] Li Z Y,Li S Q,Wang Q J,et al.Contributions of the leaves of winter wheat varieties at different positions to the yield formations of their individual plants.Acta Botanica Boreali-Occidentalia Sinica,2006,26(2):337-342.
[17] Sun J W,Li S F,Fu X S,et al.Effect of low potassium stress on photosynthetic characteristic and antioxidant systems in different position leaves of rice plants.Journal of Nuclear Agricultural Sciences,2006,21(4):404-408.
[18] Guan L L,Wu W,Zheng Y L,et al.Correlation analysis between photosynthesis and yield of the leaves at different positions of safflower.Acta Agronomica Sinica,2007,33(8):1352-1359.
[19] Luo J,Zhang H,Chen Y Q,et al.Relationship of energy sugarcane leaf forms and gas exchange with its yield.Chinese Journal of Applied and Environmental Biology,2006,12(6):754-760.
[20] Zheng P Y,Pan B.Study on the morphology and function of the mesophyll cells of leaf-blades and leaf-sheath(Secale cereale L.).Acta Agronomica Sinica,1993,19(1):29-34.
[21] Li X Y,Zheng P Y.Preliminary observation on the morphology of leaf-blade’s cells and other organ’s cells in barley.Acta Agronomica Sinica,1984,10(3):207-213.
[22] Zhu Y S,Zhang F Z,Fan J J,et al.Chlorophyll content and fluorescence parameter of different position leaves in maize seedlings.Southwest China Journal of Agricultural Sciences,2012,25(2):412-415.
[23] Wang Q Y,Hu C H.Ultrastructure of chloroplast and photosynthetic properties of the leaves at different position in maize.Acta Botanica Sinica,1988,30(2):146-150.
[24] Guo Y P.A study on advance in plant photorespiration.Acta Prataculturae Sinica,2014,23(4):322-329.
[25] Cao X Z,Zhu Q S.Study on characteristics of the relationship between source and sink in rice varieties and their classification.Acta Agronomica Sinica,1987,13(4):265-272.
[26] Tu N M,Guan C Y.Effects of leaf-cutting treatments on source-sink relation of rice during panicle initiation.Journal of Hunan Agricultural University,1999,25(6):430-436.
[27] Wang L M,Guo J,Shi Y W,et al.Analysis on source and sing relation of rice yield formation in cold region.Heilongjiang Agricultural Sciences,2005,(4):1-3.
[28] Liu J P,You M H,Bai S Q.Effect of row space on population component composition,biomass structure and energy distribution of Elymus sibiricus.Acta Prataculturae Sinica,2012,21(3):69-74.
[29] He X,Li Q F.Effect of four micro nutrients foliar sprays on seed quality of Elymus sibiricus.Acta Prataculturae Sinica,2007,16(3):88-92.
[30] Liu J P,You M H.Influence of row space on underground biomass structure of Elymussibiricus populations and soil chemical properties.Chinese Journal of Grassland,2012,34(4):55-60.
[31] Yu H L,Wang B L,Wang S,et al.Effects of different position leaves on grain plumpness in rice.Seed,2009,28(2):1-5.
[32] Liu J P,You M H,Bai S Q.Difference analysis of armyworm infection on four main cultivated grasses in the pastoral areas of northwest Sichuan.Hubei Agricultural Sciences,2012,51(18):4006-4009.
参考文献:
[1] 游明鸿,刘金平,白史且,等.肥料和除草剂混施对老芒麦生产性能的影响.草业学报,2010,19(5):283-286.
[2] 游明鸿,张昌兵,刘金平,等.行距和肥力对川草2号老芒麦生产性能的作用.草业科学,2008,25(2):69-72.
[3] 游明鸿,刘金平,白史且,等.行距对川草2号老芒麦生殖枝及种子产量性状的影响.草业学报,2011,20(6):299-302.
[4] 鄢家俊,白史且,马啸,等.川西北高原野生老芒麦居群穗部形态多样性研究.草业学报,2007,16(6):99-106.
[5] 陈功,贺兰芳.高寒地区两种老芒麦生态适应性和生产性能评价.草业科学,2004,21(9):39-42.
[6] 袁庆华,张吉宇,张文淑,等.披碱草和老芒麦野生居群生物多样性研究.草业科学,2003,20(5):44-49.
[8] 毛培胜,韩建国,王颖,等.施肥处理对老芒麦种子质量和产量的影响.草业科学,2001,18(4):7-13.
[9] 毛培胜,韩建国,吴喜才.收获时间对老芒麦种子产量的影响.草地学报,2003,11(1):33-37.
[10] 陈有军.青藏高原老芒麦光合特性及生产性能研究[D].西宁:青海大学,2013:34-36.
[11] 王岩春,干友民,邱英,等.高寒地区老芒麦川草2号的光合生理特性.江苏农业科学,2007,35(6):211-213,235.
[12] 王岩春,干友民,陈立坤,等.高寒地区川草1号老芒麦夏季光合生理特性的初步研究.草业科学,2007,24(11):42-45.
[13] 游明鸿,刘金平,白史且,等.行距对老芒麦光合性能及种子产量的影响.草业与畜牧,2013,(1):14-17,22.
[14] 黄顶,李子忠,樊奋成.日光辐射对老芒麦再生草光合特性的影响.草地学报,2003,11(4):338-342.
[15] 孙守钧,马鸿图,李凤山.高粱不同叶位叶相互作用对籽粒增重的影响.中国农学通报,1998,14(6):59-61.
[16] 李紫燕,李世清,王全九,等.不同冬小麦品种不同叶位叶片在个体产量形成中的作用.西北植物学报,2006,26(2):337-342.
[17] 孙骏威,李素芳,付贤树,等.低钾对水稻不同叶位叶片光合特性及抗氧化系统的影响.核农学报,2006,21(4):404-408.
[18] 官玲亮,吴卫,郑有良,等.红花蕾期不同叶位叶的光合特性及与产量的相关性.作物学报,2007,33(8):1352-1359.
[19] 罗俊,张华,陈由强,等.能源甘蔗不同叶位叶片形态、光合气体交换及其与产量关系.应用与环境生物学报,2006,12(6):754-760.
[20] 郑丕尧,潘波.黑麦不同叶位叶片、叶鞘叶肉细胞形态及其功能的研究.作物学报,1993,19(1):29-34.
[21] 李小云,郑丕尧.大麦不同叶位叶片细胞及其它器官细胞形态的初步观察.作物学报,1984,10(3):207-213.
[22] 朱延姝,张福珍,樊金娟,等.玉米幼苗不同叶位叶片叶绿素含量和荧光参数特性研究.西南农业学报,2012,25(2):412-415.
[23] 王群瑛,胡昌浩.玉米不同叶位叶片叶绿体超微结构与光合性能的研究.植物学报,1988,30(2):146-150.
[24] 郭玉朋.植物光呼吸途径研究进展.草业学报,2014,23(4):322-329.
[25] 曹显祖,朱庆森.水稻品种的源库特征及其类型划分的研究.作物学报,1987,13(4):265-272.
[26] 屠乃美,官春云.水稻幼穗分化期间减源对源库关系的影响.湖南农业大学学报,1999,25(6):430-436.
[27] 王连敏,郭杰,石玉文,等.寒地水稻产量形成的源库关系分析.黑龙江农业科学,2005,(4):1-3.
[28] 刘金平,游明鸿,白史且.行距对老芒麦种群构件组成、生物量结构及能量分配的影响.草业学报,2012,21(3):69-74.
[29] 贺晓,李青丰.4种微量元素对老芒麦种子质量的影响.草业学报,2007,16(3):88-92.
[30] 刘金平,游明鸿.行距对老芒麦种群地下部及土壤特性的影响.中国草地学报,2012,34(4):55-60.
[31] 于洪兰,王伯伦,王术,等.不同叶位叶片对水稻籽粒充实的影响.种子,2009,28(2):1-5.
[32] 刘金平,游明鸿,白史且.川西北牧区四种主栽禾草粘虫危害的差异性分析.湖北农业科学,2012,51(18):4006-4009.
Correlation analysis of photosynthetic rate and biomass of different leaf positions with seed yield of Elymus sibiricus
LIU Jin-Ping1,YOU Ming-Hong2,ZENG Xiao-Lin1,CAI Jian1,ZHANG Xiao-Jing1
1.College of Life Sciences,China West Normal University,Nanchong 637009,China;2.Academy of Sichuan Grassland Science,Chengdu 611731,China
In the present study,photosynthetic parameters(photosynthetic rate,photosynthetic contribution rate)and biomass parameters(leaf biomass,inflorescence biomass,1000-seed weight,seed yield)of leaves at different positions were measured during seed development of Elymus sibiricus.The aim of this study was to investigate changes in photosynthetic parameters and biomass parameters with the advance of seed development,and to determine the relationship between seed yield and photosynthetic performance of leaves at different positions during seed development.There were significant differences in photosynthetic rate and photosynthetic contribution rate of leaves at different positions at different stages of seed development,and among leav-es of different positions at the same stage.Leaf biomass and leaf water content of different leaf positions changed significantly with seed development.At the flowering stage,seed yield was positively correlated with photosynthetic rate,leaf biomass and total leaf biomass in leaves at positions 1 to 5.At the seed filling stage photosynthetic rate of the first and third leaves and leaf biomass of the first two leaves were correlated with seed yield.At the milk stage,seed yield had a negative correlation with photosynthetic rate and leaf biomass from the fourth to fifth leaf.At the dough and ripe stages,seed yield had a positive correlation with photosynthetic rate of the first leaf and with leaf biomass of the first two leaves,but a significant negative correlation with photosynthetic rate from the third to fifth leaf and with leaf biomass from the third to fifth leaf.Seed yield was negatively correlated with total leaf biomass after the filling stage and with inflorescence biomass at the filling and milk stages,but a positive correlation with inflorescence biomass at the dough and ripening stages.It was concluded that crop management should promote growth and nutrient accumulation of leaves at different positions during vegetative growth to promote seed production.After the filling stage,it is very important to protect the integrity and health of the first three leaves to increase seed yield and seed quality.
Elymus sibiricus;photosynthesis;leaf position;seed yield;biomass
10.11686/cyxb2014518 http://cyxb.lzu.edu.cn
刘金平,游明鸿,曾晓琳,蔡捡,张小晶.老芒麦种子发育时不同位叶光合速率和生物量变化与种子产量的相关分析.草业学报,2015,24(11):118-127.
LIU Jin-Ping,YOU Ming-Hong,ZENG Xiao-Lin,CAI Jian,ZHANG Xiao-Jing.Correlation analysis of photosynthetic rate and biomass of different leaf positions with seed yield of Elymus sibiricus.Acta Prataculturae Sinica,2015,24(11):118-127.
2014-12-15;改回日期:2015-02-11
四川省科技厅应用基础项目(2012JY0062),四川省科技支撑计划(2011NZ0064)和阿坝综合试验站(CARS35-35)资助。
刘金平(1972-),男,山西临县人,副教授,博士。E-mail:jpgg2000@163.com

