紫花苜蓿MsWRKY33转录因子的分离及遗传转化研究
冯光燕,王学敏,付媛媛,方志红,高洪文,张新全*
(1.四川农业大学草业科学系,四川温江611130;2.中国农业科学院北京畜牧兽医研究所,北京100193)
紫花苜蓿MsWRKY33转录因子的分离及遗传转化研究
冯光燕1,王学敏2*,付媛媛2,方志红2,高洪文2,张新全1*
(1.四川农业大学草业科学系,四川温江611130;2.中国农业科学院北京畜牧兽医研究所,北京100193)
WRKY转录因子是植物特有的转录因子,广泛参与植物对多种逆境胁迫的反应。但是对紫花苜蓿中WRKY转录因子的研究还较少。本研究从紫花苜蓿中克隆了一个WRKY I类转录因子MsWRKY33。该基因CDS全长1536 bp,编码512个氨基酸,结构分析显示MsWRKY33包括两个WRKY结构域和一个C2H2锌指结构(C-X4-CX23-H-X-H),表明其属于WRKY I族WRKY转录因子。亚细胞定位预测MsWRKY33蛋白定位在细胞核。MsWRKY33基因受盐、干旱和冷胁迫诱导,暗示基因可能参与了这些逆境胁迫的调控。构建原核表达载体p ETMsWRKY33,SDS-PAGE分析表明在大肠杆菌中表达了MsWRKY33蛋白。扩增MsWRKY33编码区cDNA,以pBI121为基础载体,构建植物超表达载体pBI121-MsWRKY33。采用农杆菌介导的愈伤组织培养法转化紫花苜蓿。利用nptⅡ基因引物和载体特异引物检测抗性苗呈阳性,表明目的基因已成功导入紫花苜蓿基因组中。qRT-PCR检测发现,MsWRKY33基因在转基因株系中得到增强表达。本研究为进一步探索WRKY转录因子基因在紫花苜蓿抗逆性调控中的作用奠定了基础。
紫花苜蓿;MsWRKY33;转录因子;遗传转化
转录因子(transcription factor),又称反式作用因子(trans acting factor),是指能够与真核基因的顺式作用元件(cis acting element)发生特异性相互作用,并对转录有激活或抑制作用的DNA结合蛋白。在植物中已发现了多种转录因子,如b ZIP类、ERF类、b HLH类、WRKY类和NAC类等。其中WRKY蛋白是植物所特有的一类转录因子家族,其结构域是一个60个氨基酸左右的保守结构,且所有结构域均含有高度保守的WRKYGQK氨基酸序列,并因此得名[1]。
WRKY转录因子在植物体中行使众多功能,大量研究证实植物WRKY基因的主要生物学功能是调控植物抗病反应及其信号转导途径的建立[2-5]。此外,该类转录因子还与植物衰老以及胚胎发育等一系列生长发育过程相关基因的表达调控具有重要联系[6-7]。近年来,研究者发现,WRKY转录因子也参与了植物的非生物逆境胁迫应答。AtWRKY33超表达增强转基因材料的耐盐性[8],OsWRKY08基因受PEG、NaCl、ABA的诱导表达,可以增强转基因拟南芥(Arabidopsis thaliana)抗渗透胁迫的能力[9]。大豆(Glycine max)的WRKY转录因子在拟南芥中过量表达可以增强转基因植株的抗冷能力(WRKY 21)和抗旱耐盐性(WRKY 54)[10]。长叶红砂(Reaumuria trigyna)中的两个WRKY基因受到干旱、高盐和冷胁迫等多种非生物胁迫的诱导[11]。此外,WRKY转录因子还参与高温[12-13]、伤害[14-15]、ABA[8]、双氧水[9]、紫外线[16]等非生物胁迫的调控。然而,与在生物胁迫中取得的研究成果相比,WRKY转录因子在非生物胁迫中的研究还很少。
紫花苜蓿(Medicago sativa)是重要豆科牧草,不仅是家畜日粮中不可缺少的组分,而且是生态恢复、土壤改良的优选植物。近年来,苜蓿干草消费逐年增加,同时紫花苜蓿种植面积也迅猛扩大,但干旱、高盐、冷害等非生物胁迫极大影响其产量和品质的提高。过去对WRKY转录因子家族的研究多集中于生物胁迫领域,且多以拟南芥或水稻(Oryza sativa)等模式植物为对象。紫花苜蓿属于异花授粉四倍体豆科牧草,其遗传转化困难,生长周期长,基因功能的研究比较滞后,到目前为止,对紫花苜蓿WRKY转录因子功能深入研究几乎是空白。对这一重要豆科植物WRKY转录因子的研究,不仅在理论上有助于我们了解WRKY转录因子在牧草抗性调控中的作用,而且有助于指导我们通过调控机制来增强牧草的抗逆能力。
1 材料与方法
1.1 实验材料
紫花苜蓿“中苜1号”为中国农业科学院北京畜牧兽医研究所育成品种。
DNA聚合酶Ex Taq、DNA Makers、p MD18-T vector、限制性内切酶、T4 DNA连接酶均购自Takara公司(Japan);cDNA Synthesis Kit购自Fermentas(USA),Trizol试剂购自Invitrogen(USA),SMARTTM RACE c DNA Amplification Kit购自Clontech(USA),ABA购自Sigma(USA),大肠杆菌感受态细胞Escherichia coli DH5α和BL21(DE3)p LysS购自北京天根生化科技有限公司。氯仿、异丙醇、乙醇、NaCl、PEG 6000等均为国产分析纯试剂。
1.2 实验方法
1.2.1 材料的种植与处理 2014年4月,将来自紫花苜蓿‘中苜一号’同一母株的枝条在温室内进行扦插,待扦插苗长出叶片和根后,选取长势一致的幼苗移到1/2 MS营养液中,一周换两次培养液,在温室中继续生长30 d。
选取长势一致的苜蓿幼苗进行干旱、高盐、低温和脱落酸胁迫人工模拟环境处理,具体处理方法如下:ABA激素处理:在1/2 MS营养液中加入ABA,浓度为100μmol/L,室温25℃条件下将植株分别处理0,2,4,8,12和24 h;干旱处理:将紫花苜蓿苗置于20%PEG 6000的1/2 MS营养液中,室温25℃作用条件下将植株分别处理0,2,4,8,12和24 h;高盐处理:将紫花苜蓿苗置于含有250 mmol/L NaCl的1/2 MS营养液中,室温25℃作用条件下分别处理0,2,4,8,12和24 h;冷处理:将种植于1/2 MS液体培养基的紫花苜蓿放在4℃下处理0,2,4,8,12和24 h。以上处理分别取其叶,-80℃保存备用。
1.2.2 WRKY基因3′末端序列、5′末端序列和全长cDNA序列的克隆 用TRizol试剂分别提取250 mmol/L NaCl溶液处理2,4,8,12和24 h后的幼叶总RNA后,按照质量比为1∶1∶1∶1∶1混合。根据cDNA Amplification Kit说明书,用混合RNA为模板制备RACE-Ready cDNA。根据转录组测序得到的类WRKY基因的Unigene序列(未发表),分别设计5′RACE(GSP1)和3′RACE(GSP2)特异性引物GSP1和GSP2。利用这些引物分别PCR扩增出3′末端和5′末端序列,连接到PMD18-T载体后,送英淮杰基公司测序。将所得序列拼接出全长cDNA序列。
核酸及氨基酸序列分析、开放阅读框ORF的查找和翻译用DNAStar 6.13软件进行分析,利用ScanProsite服务器(http://www.expasy.org/tools/scanprosite/)对WRKY蛋白进行功能预测。从GeneBank上下载其他植物中的同源蛋白,利用MEGA4软件Neighbor-Joining法构建系统进化树。
1.2.3 Real-Time PCR检测WRKY基因的组织表达特异性 用TRizol试剂分别提取1.2.1中获得的各处理RNA,根据cDNA Synthesis试剂盒说明书分别反转录为cDNA。参考Ta KaRa公司的SYBR Premix Ex Taq TM试剂盒说明书,使用ABI PRISM 7500 Real-time PCR System(ABI,USA)系统,采用两步法进行Realtime PCR扩增,第1步:95℃预变性30 s;第2步:95℃5 s,60℃34 s,40个循环。每次实验3个样品,每个样品做3次重复。基因特异引物为F1/R1,以紫花苜蓿ACT2基因为内参基因,引物为F2/R2。
根据得到的Ct值,将每种处理的0 h设为对照,2,4,8,12和24 h分别设为5个不同处理,利用2-△△Ct法[17],分别计算MsWRKY33基因在不同处理下的表达量。
1.2.4 蛋白原核表达与鉴定 MsWRKY 33编码蛋白全长512 AA,根据表位预测,决定以10-239 AA作为免疫原序列。以紫花苜蓿c DNA为模板,利用引物F3、R3进行PCR扩增。用Eco RⅤ和Eco RⅠ双酶切表达载体p ET30a以及PCR产物。用1%琼脂糖电泳,回收目的片段。在T4 DNA连接酶作用下,16℃反应2 h。转化大肠杆菌BL21(DE3)p LysS,以F3、R3为引物进行菌液PCR,挑选阳性克隆测序,正确插入目的基因的重组子p ET-WRKY 33用于表达分析。阳性克隆菌液20μL接种至3 m L LB(含50μg/m L Kan)培养基中37℃过夜培养。取30μL过夜培养菌液加入到含3 m L LB培养基中,37℃震荡培养至OD600约0.6;取部分液体作为未诱导的对照组,余下的加入IPTG诱导剂至终浓度0.5 mmol/L作为实验组,两组继续37℃震荡培养。在诱导1和3 h时取菌体1 m L,离心10000 r/min×30 s收获沉淀,用100μL 1%SDS重悬,混匀,100℃10 min。10000 r/min离心10 min,取上清进行SDS-PAGE分析。
1.2.5 构建植物表达载体 设计5′端包含XbaⅠ酶切位点的上游引物和Bam HI酶切位点的下游引物:F4和R4,其中,下划线部分为酶切位点;用该引物从紫花苜蓿cDNA模板中扩增MsWRKY33的全长阅读框,PBI载体和目的基因全长片段经XbaⅠ和Bam HI双酶切后回收产物,经T4DNA连接酶连接,得到插入有MsWRKY33基因的PBI121载体,转化E.coli DH5α感受态细胞。测序验证序列正确性后用于后续试验。含有目的片段的质粒载体的结构如图5A所示。
1.2.6 农杆菌转化及转基因植株筛选 提取PBI121-MsWRKY33质粒,使用冻融法转入农杆菌菌株GV3101。挑选健康的叶片作为外植体,随后经70%酒精2 min,0.1%的CoCl25 min,灭菌水洗3次后,置于灭菌的培养皿中。消毒好的叶片在农杆菌溶液,OD600为0.6~0.8的重悬液(灭菌的YEP)中侵染15~30 min,然后放到无菌滤纸上,吸去多余液体。在共培培养基上生长一周。把外植体取出,放入灭菌水中清洗,重复以上过程2~3次。随后转入筛选培养基上。2~3周后,愈伤组织转入诱导培养基上。3周后,胚将会发育成小枝、部分胚长出幼根。小植株移入生根培养基上。
提取转基因植株的基因组DNA,以nptⅡ基因引物F5/R5,以及转化载体特异引物F6/R6(载体35S启动子序列设计正向引物F6,MsWRKY33基因序列设计反向引物R6)进行PCR扩增检测。
实验中所用到的所有引物用Primer Premier 5.0软件设计,引物序列见表1。

表1 实验中的引物序列Table 1 Primer sequence used in the study
2 结果与分析
2.1 紫花苜蓿WRKY 33基因cDNA全长的克隆
根据高通量测序得到的335 bp类WRKY Unigene片段,利用RACE技术,分别扩增目的基因的3′和5′端,将特异性片段进行回收测序,获得3′端长度为610 bp,5′端长度为1395 bp的序列。利用DNAMAN 6.0软件进行序列拼接,获得全长为1891 bp的cDNA序列。将该序列进行BLAST比对,发现该序列与蒺藜苜蓿(Medicago truncatula)、大豆等物种的WRKY转录因子基因高度同源,认为获得的序列是一个WRKY转录因子基因序列。
2.2 紫花苜蓿WRKY 33基因的生物信息学分析
该基因含有一个1536 bp的读码框,编码512个氨基酸。该基因编码的蛋白质分子量为57.15 k Da,蛋白等电点为6.5,其中包含51个强碱性氨基酸(K、R),56个强酸性氨基酸(D、E),108个疏水氨基酸(A、I、L、F、W、V),203个极性氨基酸(N、C、Q、S、T、Y)。截型苜蓿(Accession number:XP-003599287);拟南芥(BAE 98456);大豆(XP-003538323)。
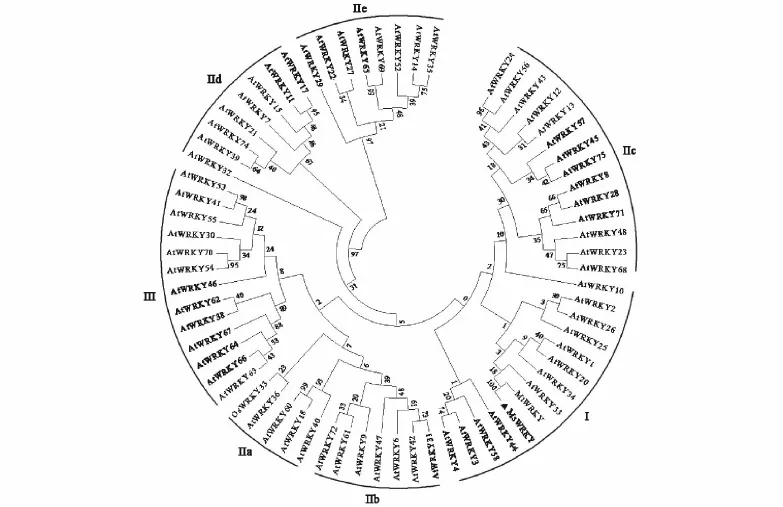
图2 WRKY基因家族DNA序列的系统进化关系Fig.2 Phylogenetic relationships of DNA sequences within the AtWRKY family
利用GenBank上的BlastP搜索到来源于不同物种的几个亲缘关系近的蛋白序列,并进行了比对分析。图1中可见,该基因编码蛋白与其他物种同一亚族关系相近的蛋白同源性相对较高。与蒺藜苜蓿WRKY、大豆WRKY 33在氨基酸水平上的相似性分别为92%和71%。进一步对同源区进行序列分析,该蛋白含有2个包括60个氨基酸在内的WRKY保守结构域(WRKYGKK)和2个Cys2-His2锌指结构。将该蛋白序列与拟南芥中的WRKY转录因子进行聚类分析,发现其与拟南芥的WRKY33和WRKY25聚为一类,属于第I类WRKY蛋白(图2)。说明该基因可能具有WRKY 33基因的相似功能。因此将该基因命名为MsWRKY 33。
用ProtComp 9.0软件(http://linux1.softberry.com/all.htm)进行亚细胞定位预测分析,该蛋白定位在细胞核的可能性为7.66,细胞膜的可能性为1.53,定位于其他亚细胞结构的可能性都小于1(表2)。因此该蛋白最有可能定位于细胞核中。
2.3 MsWRKY 33基因的表达分析
利用quantitive Real-Time PCR对紫花苜蓿MsWRKY33基因在非生物逆境胁迫下的基因表达进行了检测。结果显示,盐(NaCl),干旱(PEG模拟)和冷(4℃)胁迫均能诱导MsWRKY33基因表达上调(图3)。其中冷胁迫对基因的诱导较强,到处理12 h表达丰度提高了15倍以上(图3C)。干旱处理下,处理4 h基因表达开始明显上调,并一直维持上升的趋势到24 h(图3B)。表明该基因可能直接或间接的参与了植物对这些非生物逆境的响应。同时,还进行了ABA处理诱导,发现当紫花苜蓿受到ABA胁迫时,表达呈一个相对缓慢的上升趋势。随着处理时间的延长,MsWRKY33基因的表达量逐渐上升,在12 h的表达量达到最大值。随后表达量开始出现缓慢下降(图3D)。

表2 MsWRKY33蛋白亚细胞定位分析Table 2 Prediction of protein subcellular localization of MsWRKY33
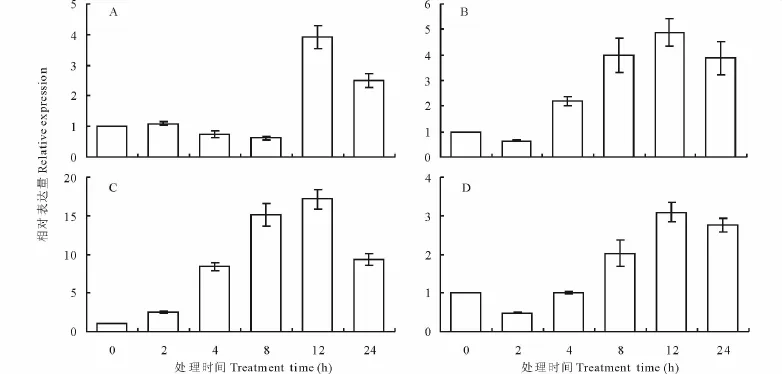
图3 MsWRKY33的基因表达分析Fig.3 Gene expression analysis of MsWRKY33
2.4 MsWRKY 33的蛋白原核表达
将目的片段连接p ET30a构成重组子,转化大肠杆菌BL21,测序检测证明序列正确,没有发生突变。表明蛋白表达载体已经构建成功。将含有阳性质粒大肠杆菌表达菌BL21(DE3)p LysS株系,用1 mmol/L IPTG诱导表达,并在诱导的0,1和3 h分别取样。结果显示,含有MsWRKY33片段的表达载体菌体蛋白在诱导后有特异性条带出现。该表达蛋白在45 KDa附近,分子量与预期相同(图4)。表明该蛋白可以在大肠杆菌中诱导表达。这为进一步的蛋白表达研究奠定了基础。
2.5 MsWRKY 33基因的遗传转化
本研究将来自紫花苜蓿的MsWRKY 33 cDNA全长片段通过农杆菌介导的遗传转化的方法同源导入紫花苜蓿进行超量表达。首先将MsWRKY33 cDNA全长片段克隆到植物双元表达载体PBI121中,如图5A所示。通过限制性内切酶XbaⅠ/Bam HⅠ双酶切检测,获得与预期大小相符1500 bp左右的条带(图5B)。再将酶切阳性的克隆测序检测,插入序列完整,无缺失,无突变,表明MsWRKY33基因已经成功克隆到植物表达载体中。

图4 MsWRKY33融合蛋白SDS-PAGE电泳考马斯亮蓝染色检测Fig.4 Coomassie-stained SDS-PAGE gel illustrating MsWRKY33 His-tag fusion protein expression in E.coli

图5 紫花苜蓿遗传转化过程Fig.5 The genomic transformation of alfalfa
采用紫花苜蓿叶片为外植体,用转化了p BI121-MsWRKY33的农杆菌侵染后,在筛选培养基上培养(图5C),外植体切口处诱导出愈伤组织(图5D);愈伤组织继续培养,长出幼胚(图5E);幼胚逐渐发育成为成熟胚,并长出幼叶(图5F),移到生根培养基上,在生根培养基上长出幼根(图5G)。再生苗经GUS组织化学染色,显示蓝色,表明目的基因在紫花苜蓿植株中成功表达(图5G小图)。通过初步筛选,共获得7株阳性转基因植株。将这些阳性幼苗移入人工气候室,进行炼苗,待植株强壮后,移入室外生长(图5H)。
为进一步检测转化阳性植株,对转基因材料进行了分子水平检测。以未转化的植株作为对照,提取转基因植株DNA,对T-DNA中nptⅡ基因以及载体特异引物进行PCR检测。结果表明,筛选出的7株阳性植株均扩增出PCR产物,且扩增产物与目的片段大小吻合(图6A)。
进一步的,对DNA检测阳性的株系进行了目的基因表达量的qRT-PCR检测。结果显示,所有受检株系的MsWRKY33表达都上调,其中株系1,2,19的表达丰度最高(图6B),可以作为下一步基因功能验证的候选材料。
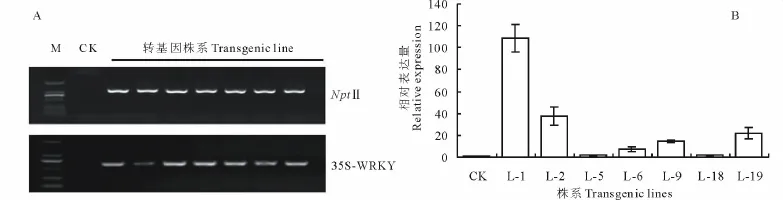
图6 转基因植株的分子检测Fig.6 Molecular detection of transgenic plants by PCR
3 讨论
WRKY转录因子是植物中一个庞大的基因家族,到目前为止,在拟南芥中共发现74个WRKY基因[18],水稻中共发现102个[19](一说为114个),大豆中197个[20],大麦(Hordeum vulgare)中45个[21]等等。在最近的一项研究中,从蒺藜苜蓿的基因组中搜索到了28个WRKY转录因子基因[22]。所有的WRKY蛋白均含有一个或两个WRKY结构域。最初根据所含WRKY结构域的数目和锌指结构的特征将WRKY蛋白划分3组:第Ⅰ组含有两个WRKY结构域,其锌指结构为Cys2-His2(C-X4-5-C-X22-23-H-X1-H);第Ⅱ组含有一个WRKY结构域,锌指结构与第1组相同;第Ⅲ组也只含一个WRKY结构域,锌指结构为Cys2-His/Cys(C-X7-C-X23-H-X1-C)[23]。关于WRKY分类方式也不一而足,其中Zhang和Wang[24]对迄今为止已克隆到的所有WRKY超级家族基因进行了聚类分析,除了上述的根据WRKY域和锌指结构的分类之外,分析结构显示,根据第二类型的WRKY蛋白结构域内所包含的其他较为保守的结构域又可进一步将其分为a、b、c、d和e 5个亚类。本研究以模式植物拟南芥中的WRKY转录因子为参考基因,对MsWRKY33基因的进化地位进行了分析。根据Zhang和Wang[24]进行的进化分析,进化树将MsWRKY33、MtWRKY和拟南芥的66个WRKY基因共同分为7类,分别是WRKY I、WRKY IIa、IIb、IIc、IId、IIe和WRKYⅢ,MsWRKY33和Mt WRKY紧紧聚在一起,共同归在WRKY I类。因此,紫花苜蓿WRKY33基因可能具有WRKY I类转录因子相似的功能,尤其是与AtWRKY33相似的功能。在系统进化分析中,我们还引入了水稻的WRKY 33基因,但是,该基因并没有如我们预期的那样与AtWRKY33和MsWRKY33聚类在一起,而是聚在了IIb亚族。究其原因,可能是水稻与拟南芥中WRKY的编号各自独立,编号相同的基因并没有进化和功能上的相关性。
转录因子只有在细胞核中才能发挥其功能。本研究利用生物在线软件Softberry ProtComp对MsWRKY33的亚细胞定位进行了预测。该软件将几种蛋白定位预测方法结合在一起,包括基于网络的细胞核预测,与已知定位信息的同源蛋白比较,特定功能蛋白多肽预测,以及搜索定位特异motif等。该软件与其他预测软件相比较,具有独立的植物蛋白和动物/真菌蛋白识别器,极大的提高了识别的准确性。用该软件的分析结果表明,MsWRKY33定位于细胞核,这与MsWRKY33的转录因子身份是相符的。当然这一预测结果还需要后续试验做进一步证明。
如前所述,MsWRKY33基因属于WRKY I亚族,与拟南芥AtWRKY33基因的亲缘关系非常近。这暗示其很可能具有与At WRKY33相似的功能。以往对WRKY转录因子的研究多集中在抗病性上。有研究显示,At-WRKY 33与植物的真菌抗性相关,病原菌诱导基因的表达以及异源表达基因能够增强植物抵御病原菌的能力[25-26]。也有少量针对非生物胁迫的研究,如Li等[13]在对WRKY25、26和33的研究中(这3个基因均属于WRKYⅠ类)发现,3基因与植物的耐热性调控相关,在植物的耐热性中功能互作,协同相关。玉米(Zea mays)中与At WRKY33同源的基因Zm WRKY33受高盐、干旱、冷胁迫和ABA的诱导,基因增强表达提高植物的耐盐性[27]。因此我们认为MsWRKY33基因可能也参与了非生物胁迫的调控。根据这一预测,对该基因对不同非生物逆境的响应进行了研究,发现干旱、盐、冷均可以诱导m RNA的累积(图3)。暗示WRKY 33基因可能参与了这些逆境调控。于是我们进行了基因的遗传转化,在此基础上,后续我们将对该基因继续深入进行抗逆功能研究,期望揭示紫花苜蓿WRKY转录因子基因在抗非生物逆境中的作用。
[1] Rushton P J,Tortes J T,Parniske M,et al.Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes.EMBO Journal,1996,15(20):5690-5700.
[2] Asai T,Tena G,Poltnikova J,et al.MAP kinase signaling cascade in Arabidopsis innate immunity.Nature,2002,41(5):977-983.
[3] Deslandes L,Olivier J,Theulieres F,et al.Resistance to Ralstonia solanacearum in Arabidopsis thaliana is conferred by the recessive RRS1-R gene,a member of a novel family of resistance genes.Proceeding of the National Academy of Sciences,2002,99(4):2404-2409.
[4] Pandey S P,Roccaro M,Schon M,et al.Transcriptional reprogramming regulated by WRKY18 and WRKY40 facilitates powdery mildew infection of Arabidopsis.Plant Journal,2010,64(6):912-923.
[5] Yu D,Chen C,Chen Z.Evidence for an important role of WRKY DNA binding protein in the regulation of NPRl gene expression.Plant Cell,2001,13(7):1527-1539.
[6] Johnson C S,Kolevski B,Smyth D R.TRANSPARENT TESTA GLABRA2,a trichome and seed coat development gene of Arabidopsis,encodes a WRKY transcription factor.Plant Cell,2002,14(6):1359-1375.
[7] Luo M,Dennis E S,Berger F,et al.MINISEED3(MINI3),a WRKY family gene,and HAIKU2(IKU2),a leucine-rich repeat(LRR)KINASE gene,are regulators of seed size in Arabidopsis.Proceeding of the National Academy of Sciences,2005,102(48):17531-17536.
[8] Jiang Y Q,Deyholos M K.Functional characterization of Arabidopsis NaCl inducible WRKY 25 and WRKY 33 transcription factors in abiotic stresses.Plant Molecular Biology,2009,69(1):91-105.
[9] Song Y,Jing S J,Yu D Q.Overexpression of the stress induced OsWRKY08 improves the osmotic stress tolerance in Arabidopsis.Chinese Science Bulletin,2009,54(24):4671-4678.
[10] Zhou Q Y,Tian A G,Zou H F,et al.Soybean WRKY-type transcription factor genes,Gm WRKY13,Gm WRKY21,and GmWRKY54,confer differential tolerance to abiotic stresses in transgenic Arabidopsis plants.Plant Biotechnology Journal,2008,6(5):486-503.
[11] Wang J,Zheng L L,Gu T P,et al.Cloning and expression analysis of two WRKY transcription factors from the recretohalophyte Reaumuria trigyna.Acta Prataculturae Sinica,2014,23(4):122-129.
[12] Li S J,Zhou X,Chen L G,et al.Functional characterization of Arabidopsis thaliana WRKY 39 in heat stress.Molecules and Cells,2010,29:475-483.
[13] Li S J,Fu Q T,Chen L G,et al.Arabidopsis thaliana WRKY 25,WRKY 26,and WRKY 33 coordinate induction of plant thermo-tolerance.Planta,2011,233(6):1237-1252.
[14] Zhang X F,Zhao R,Sun H L,et al.The Mg-Chelatase H subunit of Arabidopsis antagonizes a group of transcription repressors to relieve ABA-responsive genes of inhibition.Plant Cell,2010,22(6):1909-1935.
[15] Skibbe M,Qu N,Galis I.Induced plant defenses in the natural environment:Nicotiana attenuata WRKY 3 and WRKY 6 coordinate responses to herbivory.Plant Cell,2008,20(7):1984-2000.
[16] Wang H H,Hao J J,Chen X J,et al.Overexpression of rice WRKY89 enhances ultraviolet B tolerance and disease resistance in rice plants.Plant Molecular Biology,2007,65(6):799-815.
[17] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△ctmethod.Method,2001,25:402-408.
[18] Ulker B,Somssich I E.WRKY transcription factors:from DNA binding towards biological function.Current Opinion in Plant Biology,2004,7(5):491-498.
[19] Wu K L,Guo Z J,Wang H H,et al.The WRKY family of transcription factors in rice and Arabidopsis and their origins.DNA Research,2005,12(1):9-26.
[20] Schmutz J,Cannon S B,Schlueter J,et al.Genome sequence of the palaeopolyploid soybean.Nature,2010,463(7278):178-183.
[21] Mangelsen E,Kilian J,Berendzen K W,et al.Phylogenetic and comparative gene expression analysis of barley(Hordeum vulgare)WRKY transcription factor family reveals putatively retained functions between monocots and dicots.BMC Genomics,2008,9:194-201.
[22] Jiang T,Lin Y X,Liu X,et al.Genome-wide analysis of the WRKY transcription factor family in Medicago truncatula.Pratacultural Science,2011,20(3):211-218.
[23] Eulgem T,Rushton P J,Robatzek S,et al.The WRKY superfamily of plant transcription factors.Trends in Plant Science,2000,5:199-206.
[24] Zhang Y,Wang L.The WRKY transcription factor superfamily:its origin in eukaryotes and expansion in plants.BMC Evolutionary Biology,2005,5:1-12.
[25] Dong J X,Chen C H,Chen Z X.Expression profiles of the Arabidopsis WRKY gene superfamily during plant defense response.Plant Molecular Biology,2003,51(1):21-37.
[26] Zheng Z Y,Qamar S A,Chen Z,et al.Arabidopsis WRKY 33 transcription factor is required for resistance to necrotrophic fungal pathogens.Plant Journal,2006,48(4):592-605.
[27] Li H,Gao Y,Xu H,et al.Zm WRKY 33,a WRKY maize transcription factor conferring enhanced salt stress tolerances in Arabidopsis.Plant Growth Regulation,2013,70(3):207-216.
参考文献:
[11] 王佳,郑琳琳,顾天培,等.珍稀泌盐植物长叶红砂两个WRKY转录因子的克隆及表达分析.草业学报,2014,23(4):122-129.
[22] 江腾,林勇祥,刘雪,等.苜蓿全基因组WRKY转录因子基因的分析.草业科学,2011,20(3):211-218.
Isolation of MsWRKY33 transcription factor and its genetic transformation in Medicago sativa
FENG Guang-Yan1,WANG Xue-Min2*,FU Yuan-Yuan2,FANG Zhi-Hong2,GAO Hong-Wen2,ZHANG Xin-Quan1*
1.Department of Grassland Science,College of Animal Science and Technology,Sichuan Agricultural University,Wenjiang 611130,China;2.Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China
Plant-specific WRKY transcription factors(TFs)are widely involved in various stress responses.However,their roles in abiotic stresses are still not well known in alfalfa(Medicago sativa).In this study,a WRKY gene,containing 1536 bp CDS length encoding a putative protein of amino acid 512,designated as MsWRKY33,was isolated from alfalfa.The alignment results revealed that the MsWRKY33 protein contains two conserved DNA-binding domains(WRKY domain)of 60 amino acids and a C2H2 zinc finger region(C-X4-C-X23-H-X-H),falling into group I of the WRKY protein.Protein localization prediction analysis indicated that Ms WRKY33 is a nuclear-targeting protein.The expression of MsWRKY 33 gene was up-regulated by salin-ity(NaCl),drought(PEG)and cold temperature(4℃),indicating that MsWRKY33 gene may be involved in the regulation of environmental stress responses in alfalfa.The fragment encoding 10-239AA was inserted into p ET-30α(+)to construct the expression vectors,and SDS-PAGE analysis revealed that the MsWRKY33 protein could be expressed in prokaryotic cells.The full length cDNA of MsWRKY33 was amplified from alfalfa RNA and the plant expression vector pBI121-MsWRKY33 was constructed based on the pBI121 vector.Transgenic plants were obtained through somatic embryogenesis by Agrobacterium tumefaciens-mediated transformation.The nptⅡgene and vector sequence were tested by PCR in the genome of transgenic plants and indicated that the target gene had been transferred.The qRT-PCR testing showed that the MsWRKY33 gene was over expressed in transgenic plants.This study will lay a foundation for further study of the function of the WRKY transcription factor in stress-tolerance regulation in alfalfa.
Medicago sativa;MsWRKY33;transcription factor;genetic transformation
10.11686/cyxb2015131 http://cyxb.lzu.edu.cn
冯光燕,王学敏,付媛媛,方志红,高洪文,张新全.紫花苜蓿MsWRKY33转录因子的分离及遗传转化研究.草业学报,2015,24(11):48-57.
FENG Guang-Yan,WANG Xue-Min,FU Yuan-Yuan,FANG Zhi-Hong,GAO Hong-Wen,ZHANG Xin-Quan.Isolation of MsWRKY33 transcription factor and its genetic transformation in Medicago sativa.Acta Prataculturae Sinica,2015,24(11):48-57.
2015-03-10;改回日期:2015-05-20
现代农业产业技术体系牧草产业体系(CARS-35-01),国家自然科学基金项目(31101755)和中国农业科学院科技创新工程(ASTIPIAS10)资助。
冯光燕(1988-),男,四川遂宁人,在读硕士。E-mail:fg62586336@163.com
*通讯作者Corresponding author.E-mail:wangxuemin@caas.cn,zhangxq@sicau.edu.cn

