AsA-GSH循环参与2,3-丁二醇、2R,3R-丁二醇诱导后匍匐翦股颖的抗病反应
房媛媛,马晖玲
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
AsA-GSH循环参与2,3-丁二醇、2R,3R-丁二醇诱导后匍匐翦股颖的抗病反应
房媛媛,马晖玲*
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
用250μmol/L的2,3-丁二醇(2,3-BD)与100μmol/L的2R,3R-丁二醇(2R,3R-BD)注射至匍匐翦股颖根部后接种立枯丝核菌,诱导匍匐翦股颖对褐斑病的抗性。测定两诱导剂处理对立枯丝核菌发病率的影响,分析诱导后匍匐翦股颖叶片抗坏血酸-谷胱甘肽循环中关键酶活性及氧化还原水平变化情况,确定2,3-BD与2R,3R-BD在诱导匍匐翦股颖抗病性过程中,抗坏血酸-谷胱甘肽循环的变化及其与抗病性的相关性。结果表明,2,3-BD与2R,3R-BD处理匍匐翦股颖后明显降低接菌后的病叶率,同时叶片抗坏血酸过氧化物酶(APX)活性增幅低于对照,谷胱甘肽还原酶(GR)活性提高,还原型抗坏血酸(As A)含量呈前期减少后期增加趋势,脱氢抗坏血酸(DHA)含量在第1,9天出现两次高峰,与对照相比显著提高,且两处理的As A/DHA在第5天达到最大值,分别为对照的5.0,3.4倍,还原型谷胱甘肽(GSH)含量显著提高,并且两处理的GSH与氧化型谷胱甘肽(GSSG)比值在第9天达到最大值,分别为对照的2.34,1.66倍。2,3-BD与2R,3R-BD诱导匍匐翦股颖抗褐斑病的过程中,抗坏血酸-谷胱甘肽循环维持较高效率参与植物抗病反应。
匍匐翦股颖;2,3-丁二醇;2R,3R-丁二醇;褐斑病
匍匐翦股颖(Agrostis stolonifera)属禾本科翦股颖属,是高尔夫球场果岭、草地网球场、草地保龄球场等精细草坪的首选草种,也用于庭院、公园等养护水平较高的绿地,是重要的冷季型草坪草之一。匍匐翦股颖的不定根入土较浅,喜水,易感病,如币斑病(Sclerotinia homoeocarpa)、褐斑病(Rhizoctonia solani)、霜霉病(Sclerospora graminicola)、雪腐病(Pythium iwayamai)、黑粉病(Ustilagomaydis)等是其常见病害[1]。草坪病害的传统防治多采用培育和利用抗病品种及使用化学杀菌剂[2]。传统抗病育种方法育种周期长,亲本材料获取有限,其应用受到很大限制。化学杀菌剂对病害的防除效果大多不理想,并且化学农药的喷施严重污染环境[3-4]。大量研究证明,植物本身具有抵抗病原菌侵染的潜能[5]。诱导植物抗病性是通过物理、化学及生物等方式激发植物对病原微生物的本原抵抗力。利用诱导剂诱发植物固有抗病性与化学杀菌剂相比具有抗性稳定、持久、不污染环境等优点[6-7]。引起诱导抗病反应的系统性机制至今尚未完全阐明,目前植物抗病性诱导普遍认同两种方式,即系统获得抗性(SAR)和诱导系统抗性(ISR)。
SAR的信号传导、基因表达在不同植物上已有大量研究,ISR与乙烯(ET)/茉莉酸(JA)信号途径相关[8],在禾本科中ISR方面的报道并不多。2003年Suzuki等[9]在匍匐翦股颖的抗病诱导研究中发现荧光假单胞菌(P.fluorescens)株系HP72可引发匍匐翦股颖对立枯丝核菌(R.solani)产生抗性。2004年Ryu等[10]研究认为,植物根际促生菌分泌的挥发性有机物2,3-butanediol及其同分异构体在诱导植物产生抗病性的过程中具有重要的作用。2010年,加拿大学者Cortes-Barco等[11]报道了BDO(2R,3R-butanediol)和PC1(异链烷烃混合物)以ISR方式根部施入植株体后可抑制分别由核盘菌(Sclerotinia homoeocarpa),立枯丝核菌和镰刀菌(Microdochium nivale)引起的3种草坪叶病,施入PC1或BDO可减少匍匐翦股颖叶病区域约20%~40%。
研究现表明,ISR的信号分子一般是ET和JA等。Cortes-Barco等[12]在烟草的研究中发现丁二醇(BDO)和PC1对烟草炭疽病有显著的抑制作用,认为BDO诱导的抗病性是通过ISR方式产生的。2,3-butanediol作为根际促生菌的可挥发性分泌物,其不同异构体对诱导植物产生抗病性有不同影响。Han等[13]的研究表明,2,3-butanediol的左旋体2R,3R-BD可以诱导烟草抗马铃薯软腐病(Erwinia carotovora subsp.carotovora),但不能够对烟草野火病(P.syringae pv.tabaci)产生抗性,2,3-butanediol的右旋体2S,3S-BD则对植物体没有作用。而Ryu等[10]的研究表明2,3-butanediol的外消旋体(2R,3R-BD与2S,3S-BD的混合物)可诱导拟南芥产生ISR抗病方式。这表明2,3-butanediol及其同分异构体诱导不同植物对多种病原菌产生抗性具有个体差异性,诱导剂的施用浓度及其作用机理还需进一步研究。
抗坏血酸(As A)-谷胱甘肽(GSH)不仅有效维持活性氧代谢平衡,预防氧化伤害,在植物体防御反应中也发挥重要作用[14]。As A不仅自身可以改变植物体内PR蛋白的表达,提高植物的抗病性,低水平As A或As A氧化还原态不平衡也会调节MAP激酶(mitogen-activated protein)或直接诱导信号分子激活或增强抗病基因表达,从而提高植物抗病性[15-16]。研究表明谷胱甘肽作为信号分子诱导多种防御基因表达,介导植物体对病原菌的防御反应,如参与SA介导的信号途径[17]。抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等是促进并维持As A-GSH循环的重要酶组分,病原菌侵染时其酶活性被改变,如壳聚糖诱导脐橙抗霜霉病,果实中谷胱甘肽还原酶(GR)活性提高,抗坏血酸过氧化物酶(APX)活性被抑制,延缓还原性抗坏血酸(As A)含量下降的同时,引起诱导初期还原性谷胱甘肽(GSH)积累[18]。
本研究采用新型抗病诱导剂2,3-丁二醇(2,3-BD立体异构体的混合物)、2R,3R-丁二醇(2,3-BD的左旋体),诱导匍匐翦股颖对褐斑病产生抗性,并测定接种病原菌前后匍匐翦股颖As A-GSH循环多种酶及代谢物质含量变化,以期为探清2,3-丁二醇(2,3-BD)、2R,3R-丁二醇(2R,3R-BD)诱导匍匐翦股颖抗病机制提供基础材料。
1 材料与方法
1.1 供试品种、化学试剂及病原菌
供试匍匐翦股颖品种为Penn-A4,由北京克劳沃公司提供。诱导剂2R,3R-BD购自Sigma,2,3-BD购自西亚试剂。匍匐翦股颖褐斑病病原物为立枯丝核菌,购自中国科学院菌种保存中心。
1.2 2R,3R-BD与2,3-BD对匍匐翦股颖褐斑病的抗性诱导
试验于2014年4月开始,设置3个处理:250μmol/L的2,3-BD(2,3丁二醇立体异构体的混合物)、100 μmol/L的2R,3R-BD(2,3-丁二醇的左旋体)、不用诱导剂处理只接种病原菌为CK。240 m L组培瓶装入灭菌的沙土混合物(土∶沙=2∶1)70 g。种子用灭菌水浸泡5 h,70%乙醇溶液浸泡1 min,10%次氯酸钠浸泡15 min,无菌水冲洗6~7次,每瓶0.3 g种子,种植于组培瓶。每个处理15瓶,重复3次,(25±2)℃组培室中培养,光周期为16 h/d。
种植后第8天,将10 m L诱导剂注射入匍匐翦股颖幼苗根部,对照用无菌水代替。立枯丝核菌在PDA固体培养基中,25℃培养4 d后用打孔器取6 mm直径菌丝块,加入到PDA液体培养基,在25℃、100 r/min的摇床培养5 d后研磨为菌丝,确定浓度为OD340=0.8,使用该浓度菌丝悬浮液喷雾法接种诱导剂处理后第7天的匍匐翦股颖。
1.3 病叶率统计
接种后第7,10,15天,参考任继周[19]的方法统计发病率。病叶率计算方法如下:
病叶率(%)=发病叶片数/调查总数×100
1.4 抗病指标测定
2,3-BD、2R,3R-BD、CK共3个处理,接种立枯丝核菌后第1,3,5,7,9天分别取样,测定匍匐翦股颖抗坏血酸过氧化物酶(APX)与谷胱甘肽还原酶(GR)活性,还原型抗坏血酸(As A)、脱氢抗坏血酸(DHA)、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)含量及As A/DHA、GSH/GSSG的变化。
1.4.1 抗坏血酸过氧化物酶(APX)活性测定 参考Nakano和Asada[20]方法测定并修改。酶促反应体系依次加入2.6 m L的0.1 mol/L、p H 7.5的磷酸反应缓冲液(含0.1 mmol/L EDTA,1 mmol/L坏血酸和2% PVP)和0.1 m L的酶提取液,最后加入0.3 m L H2O2(2 mmol/L)溶液启动酶促反应,从启动后15 s开始记录每30 s反应体系在290 nm处的吸光度值,连续测定3 min。酶活性单位定义为:氧化1μmol/min As A为1单位(U)APX酶活性。
1.4.2 谷胱甘肽还原酶(GR)活性测定 参考Foyer和Halliwell[21]方法并修改。酶促反应体系依次加入2.8 m L的0.1 mol/L、p H 7.5的磷酸缓冲液(含1 mmol/L EDAT),0.1 m L氧化型谷胱甘肽溶液(5 mmol/L)和0.1 m L的酶提取液,最后加40μL NADPH(4 mmol/L)溶液以启动酶促反应。从启动后15 s开始记录每30 s反应体系在340 nm的吸光度值,连续测定3 min。酶活性单位定义为:氧化1μmol/min NADPH为1单位(U)GR酶活性。
1.4.3 还原型抗坏血酸(As A)含量测定 参照Kampfenkel等[22]的方法并修改。测定总As A时,反应体系中含有:200μL提取液,500μL的200 mmol/L PBS(内含5 mmol/L EDTA,p H 7.4)和100μL的10 mmol/L DTT。室温下放置10 min,使DHA还原成As A。然后再加入100μL 0.5 mol/L的NEM,400μL的10% TCA,400μL的44%磷酸,400μL的4%双吡啶和100μL的3%FeCl3。反应混合液37℃温浴1 h,在525 nm处读取消光值。测定As A时,用100μL的dd H2O代替100μL的10 mmol/L DTT和50μL的0.5 mol/L NEM。用同样方法作标准曲线,计算总抗坏血酸和As A含量,DHA为总抗坏血酸与As A的差值。
1.4.4 还原型谷胱甘肽(GSH)含量测定 参考Knörzer等[23]的方法。0.2 m L上清液与0.1 m L的H2O混合用于测定总谷胱甘肽,0.2 m L的上清液与0.1 m L的2-乙烯吡啶(10%)混合用于测定氧化型谷胱甘肽(GSSG)。以上混合液在25℃中温浴60 min。再加入1.4 m L的50 mmol/L PBS(含2.5 mmol/L EDTA,p H 7.5),160μL的12.5 mmol/L DTNB和50μL的10 mmol/L NADPH。用40μL的2.5 U/m L的Sigma公司商用GR在25℃启动反应,测定412 nm下的吸光值变化。分别对GSH和GSSG制作标准曲线。GSH含量由谷胱甘肽总含量和GSSG的差值获得。
1.5 数据统计
全部数据用Microsoft Excel 2010和SPSS 17.0处理,计算标准误(±SE)或进行Duncan’s多重差异显著分析。
2 结果与分析
2.1 2,3-BD与2R,3R-BD处理对匍匐翦股颖接种立枯丝核菌病叶率的影响
接菌后随时间延长,处理与对照的病叶率均呈上升趋势,但250μmol/L的2,3-BD与100μmol/L的2R,3R-BD处理的病叶率明显低于CK。接菌后发病明显的第15天,CK的病叶率为91.67%,而2,3-BD与2R,3RBD处理的病叶率显著低于CK,分别仅为15.67%和34%,同时,2,3-BD处理的病叶率显著低于2R,3R-BD处理(图1)。
2.2 2,3-BD与2R,3R-BD对匍匐翦股颖体内APX活性的影响
接菌后APX活性呈先上升后下降趋势。2,3-BD与2R,3R-BD明显抑制了匍匐翦股颖APX活性(图2)。其中接菌后第3,5,7,9天,CK的APX活性显著高于2,3-BD处理(P<0.05),分别是其1.21,1.05,1.28和1.09倍。CK的APX活性在接菌后第3,5,9天显著高于2R,3R-BD处理(P<0.05),分别是其1.05,1.05,1.51倍。2,3-BD与2R,3R-BD的APX活性出现差异,接菌后第1,9天除外,2R,3R-BD的APX活性均高于2,3-BD。

图1 2,3-BD与2R,3R-BD处理后匍匐翦股颖发病率Fig.1 The rate of diseased plants of creeping bentgrass under 2,3-BD and 2R,3R-BD

图2 2,3-BD与2R,3R-BD对匍匐翦股颖抗坏血酸过氧化物酶活性的影响Fig.2 Effects of 2,3-BD and 2R,3R-BD treatment on ascorbate peroxidase(APX)of creeping bentgrass
2.3 2,3-BD与2R,3R-BD对匍匐翦股颖体内GR活性的影响
接菌后GR活性呈先上升后下降趋势,2,3-BD与2R,3R-BD明显提高了病原菌入侵期间匍匐翦股颖体内GR活性(图3)。2,3-BD处理的GR活性在接菌后第1,3,5天显著高于CK(P<0.05),分别是其1.05,1.19,1.10倍。2R,3R-BD的GR活性在接菌后第1,3,5,9天显著高于CK(P<0.05),分别是其1.08,1.08,1.03,1.04倍。2,3-BD与2R,3R-BD的GR活性出现差异,其中第3,5天2,3-BD的GR活性显著高于2R,3R-BD,而第1,9天2R,3R-BD的GR活性显著高于2,3-BD(P<0.05)。
2.4 2,3-BD与2R,3R-BD对匍匐翦股颖体内As A含量的影响
As A含量在接菌后第1至3天出现小幅下降,第5至9天出现上升趋势,2,3-BD与2R,3R-BD处理变化明显(图4)。接菌后第1天,2,3-BD处理的As A含量低于其他两处理,在其他时间段均显著高于CK(P<0.05)。2R,3R-BD处理的As A含量在接菌后第2天出现最低值,在其他时间段均显著高于CK(P<0.05)。2,3-BD与2R,3R-BD的As A含量出现差异,2R,3R-BD在第1,5,9天显著高于2,3-BD,而2,3-BD仅在第3天显著高于2R,3R-BD(P<0.05)。
2.5 2,3-BD与2R,3R-BD对匍匐翦股颖体内DHA含量的影响
DHA含量变化也呈先上升后下降,之后再次上升的趋势(图5)。其中,接菌后第5天除外,2,3-BD处理的DHA含量均显著高于CK(P<0.05)。2R,3R-BD的DHA均高于CK,其中第5,7天差异显著(P<0.05),分别是CK的1.82和1.20倍。2,3-BD与2R,3R-BD的DHA含量出现差异,其中,接菌后第1,3,7,9天,2,3-BD的DHA均显著高于2R,3R-BD(P<0.05),分别是其1.64,1.50,1.18,1.45倍。
2.6 2,3-BD与2R,3R-BD对匍匐翦股颖体内As A/DHA的影响
2,3-BD与2R,3R-BD对匍匐翦股颖体内As A/DHA有显著影响,As A/DHA呈先上升后下降趋势,但CK的变化幅度不大(图6)。2,3-BD的As A/DHA在接菌后第5天上升至最高峰,且显著大于2R,3R-BD与CK(P<0.05),分别是其1.4和5.0倍。接菌后第3天除外,2R,3R-BD的As A/DHA均大于CK,其中第5,7天差异显著(P<0.05),分别是其3.4和3.5倍。2,3-BD与2R,3R-BD的As A/DHA除在第5天出现差异外,在第1,7,9天2R,3R-BD的As A/DHA显著大于2,3-BD(P<0.05)。
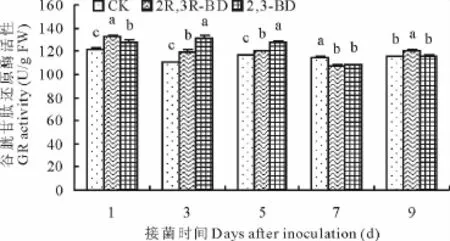
图3 2,3-BD与2R,3R-BD对匍匐翦股颖谷胱甘肽还原酶活性的影响Fig.3 Effects of 2,3-BD and 2R,3R-BD treatment on glutathione reductase(GR)of creeping bentgrass
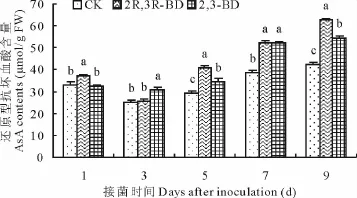
图4 2,3-BD与2R,3R-BD对匍匐翦股颖还原型抗坏血酸含量的影响Fig.4 Effects of 2,3-BD and 2R,3R-BD treatment on ascorbic acid(AsA)content of creeping bentgrass

图5 2,3-BD与2R,3R-BD对匍匐翦股颖脱氢抗坏血酸含量的影响Fig.5 Effects of 2,3-BD and 2R,3R-BD treatment on dehydroascorbic acid(DHA)content of creeping bentgrass

图6 2,3-BD与2R,3R-BD对匍匐翦股颖AsA/DHA的影响Fig.6 Effects of 2,3-BD and 2R,3R-BD treatment on AsA/DHA of creeping bentgrass
2.7 2,3-BD与2R,3R-BD对匍匐翦股颖体内GSH含量的影响
GSH含量在接菌后呈缓慢上升趋势(图7)。接菌后第7天除外,2,3-BD的GSH均显著高于CK(P<0.05)。2R,3R-BD的GSH在接菌后各时间段均高于CK,其中第1,7,9天差异显著(P<0.05),分别是CK的1.48,1.15,1.77倍。2,3-BD与2R,3R-BD出现差异,接菌后第7天除外,2,3-BD的GSH均显著高于2R,3RBD。
2.8 2,3-BD与2R,3R-BD对匍匐翦股颖体内GSSG含量的影响
2,3-BD与2R,3R-BD对GSSG没有明显影响,接菌后3个处理GSSG含量变化没有显著差异(图8)。接菌后第5天除外,2,3-BD的GSSG含量均高于CK,但差异不显著(P>0.05)。2R,3R-BD的GSSG在接菌后第5,7,9天高于CK,仅第5天出现显著差异(P<0.05)。
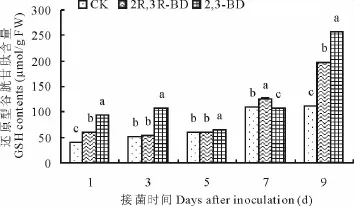
图7 2,3-BD与2R,3R-BD对匍匐翦股颖GSH的影响Fig.7 Effects of 2,3-BD and 2R,3R-BD treatment on GSH of creeping bentgrass

图8 2,3-BD与2R,3R-BD对匍匐翦股颖氧化型谷胱甘肽含量的影响Fig.8 Effects of 2,3-BD and 2R,3R-BD treatment on L-glutathione oxidized(GSSG)of creeping bentgrass

图9 2,3-BD与2R,3R-BD对匍匐翦股颖GSH/GSSG的影响Fig.9 Effects of 2,3-BD and 2R,3R-BD treatment on GSH/GSSG of creeping bentgrass
2.9 2,3-BD与2R,3R-BD对匍匐翦股颖体内GSH/ GSSG含量的影响
接菌后GSH/GSSG呈上升趋势,在第7至9天达高峰(图9)。2,3-BD与2R,3R-BD对匍匐翦股颖GSH/GSSG具有显著影响。接菌后第7天除外,2,3-BD的GSH/GSSG均高于CK,其中第3,9天差异显著(P<0.05),分别是其2.12,2.34倍。2R,3R-BD的GSH/GSSG在第1,3,9天高于CK,第9天差异显著(P<0.05),是其1.66倍。2,3-BD与2R,3R-BD的GSH/GSSG出现差异,2,3-BD在第9天出现最大峰值,且分别在第3,9天显著大于2R,3R-BD(P<0.05)。
3 讨论
3.1 不同浓度2,3-BD与2R,3R-BD作用后匍匐翦股颖发病率分析
本研究结果表明,接菌后发病明显的第15天,250μmol/L的2,3-BD与100μmol/L的2R,3R-BD病叶率显著低于对照,说明两种诱导剂能够有效诱导匍匐翦股颖抗褐斑病。Han等[13]设置不同浓度2R,3R-BD诱导烟草的ISR,结果表明,2R,3R-BD的剂量为100μg/株时抵抗软腐病(E.carotovora)效果最佳,当剂量小于10μg/株时不能诱导烟草产生ISR。Cortes-Barco等[12]的研究表明,100μmol/L的2R,3R-BD可诱导本氏烟草抗炭疽病(Colletotricium orbiculare)叶面病害面积降低77%。本研究结果与上述研究报道有共同之处。本结果表明2,3-BD及其同分异构体在一定浓度范围以ISR方式诱导匍匐翦股颖产生抗病性。值得重点强调的是2,3-BD与2R,3R-BD两种新型抗病诱导剂具有抗性稳定、持久、不污染环境等优点。适宜浓度诱导剂产品的研发与应用将为开展节能、环保和低碳的草坪管理提供新途径。
3.2 抗坏血酸及APX参与2,3-BD、2R,3R-BD诱导后匍匐翦股颖的抗病过程
As A作为一种还原性物质参与植物体氧化还原过程,不仅通过减少或清除某些有害自由基对植物起保护作用[24],还参与诱导SA合成的信号传递,如SAR机制诱导剂SA处理后黄瓜叶片中As A、DHA含量显著增加,壳聚糖诱导脐橙抗青霉病的同时延缓果实As A含量下降[15,18,25]。本研究结果表明,250μmol/L的2,3-BD与100μmol/L的2R,3R-BD能够有效诱导匍匐翦股颖抗褐斑病的同时,As A与DHA含量明显高于CK,在接菌后第3天,2,3-BD与2R,3R-BD的As A/DHA达到最大值,分别是CK的5.0和3.4倍。Conklin和Barth[16]的研究认为,As A氧化态与还原态的不平衡会诱导脱落酸(ABA)、水杨酸(SA)、茉莉酸(JA)和乙烯(ET)来调节SAGs(Senescence assiciated genes)和PRs表达,从而提高植物体抗病性。诱导剂2,3-BD与2R,3R-BD以ISR方式诱导植物产生较强的防御反应,抗坏血酸的两种存在形态As A、DHA参与此过程,这与SAR方式诱导剂有类似之处。
APX主要存在于叶绿体,As A作为电子供体经APX催化将叶绿体中产生的H2O2还原为H2O,抑制H2O2积累的同时自身氧化为DHA。SA处理缓解轮纹病(Physalosproa piricola)时,APX活性与对照相比提高了21.11%[26],而壳聚糖诱导柑橘抗炭疽病过程中APX活性受到抑制[23]。本研究中,2,3-BD和2R,3R-BD与CK的APX活性出现明显上升趋势,但在此过程中,两处理的APX活性略低于CK,可能是APX用于防止过量活性氧对细胞产生伤害的同时又确保活性氧在直接抑菌、细胞壁强度增强、诱导植保素合成及诱导防卫基因表达等植物抗病反应中发挥作用[27-29]。
3.3 谷胱甘肽及GR参与2,3-BD、2R,3R-BD诱导后匍匐翦股颖的抗病过程
As A的再生循环与As A-GSH循环中GR活性密切相关,GR活性提高,促进DHA还原为As A,也催化氧化型谷胱甘肽(GSSG)还原为还原型谷胱甘肽(GSH),在此过程中GSH直接或间接调控活性氧合成,同时也作为信号分子介导植物体防御反应,诱导防御基因表达,如参与NPR1基因依赖的SA信号途径[17,30]。本研究结果表明,2,3-BD与2R,3R-BD有效提高病原菌入侵期间匍匐翦股颖体内GSH含量,在第7~9天出现最高峰值,两处理的GSH含量高于CK,但处理与对照间GSSG含量差异不显著,且在第7天出现下降,可能是GR活性增强,将过多GSSG还原为GSH。GSH/GSSG是谷胱甘肽活性的重要指标之一。本研究中2,3-BD与2R,3R-BD能够明显提高GSH/GSSG,在第9天达最大峰值,分别是CK的2.34和1.66倍。在对拟南芥的研究表明,GSH在与JA相关基因表达的信号途径中起调控作用,而JA是ISR过程中的关键信号分子[31]。SAR方式诱导水杨酸类似物(INA,isonicotiniac acid)与丁香疫霉病菌(P.syringae)共同处理诱导产生SAR,谷胱甘肽总量和GSH/GSSG也呈上升趋势[32]。这表明GSH在ISR、SAR过程中参与调节活性氧代谢平衡的同时,更重要的作用是作为信号分子参与诱导抗病基因表达。不仅植物体内的GSH可在植物抗病中发挥作用,研究还发现外源GSH刺激菜豆悬浮细胞抗病防卫反应相关基因表达,调控植保素积累[33-34]。
综上所述,本研究结果表明,植物抗病诱导剂2,3-BD与2R,3R-BD,以ISR机制能够有效诱导匍匐翦股颖抗褐斑病过程中,As A-GSH循环参与此抗病反应。As A含量在接菌初期处于较低水平,后期明显上升,GSH含量显著提高,As A/DHA及GSH/GSSG均不同程度提高。说明诱导剂处理后匍匐翦股颖的抗病反应中,As A与GSH作为活性氧清除剂参与活性氧代谢的同时,也参与ISR抗病信号的传导,但2,3-BD与2R,3R-BD诱导的ISR中,As A与GSH在JA/ET信号途径中如何发挥作用,需要更进一步的研究。
[1] He Q,Liu J X.Advances in fungi disease research on turfgrasses.Pratacultural Science,2006,23(4):95-104.
[2] Wen K J,Luo T Q,Zhang L,et al.Control efficacy of 6 fungicides against 3 pathogens of turfgrass disease.Acta prataculturae Sinica,2013,22(3):124.
[3] Zhang L,Hu F R,Shen X H,et al.Advances in turfgrass biotechnology and hot research topics.Acta Agriculturae Nucleatae Sinica,2004,18(5):372-375.
[4] Zhang C X,Nan Z B,Li C J,et al.Studies progress of fungicide seed treatments on the control of turfgrass diseases.Acta Prataculturae Sinica,2005,14(6):14-22.
[5] Guo J F,Pan J S,Wang C,et al.Research on relationships of pathogenesis-related proteins with plant disease resistance and their application in turfgrass disease resistance breeding.Acta Prataculturae Sinica,2008,17(6):156.
[6] Godard J,Ziadi S,Monot C,et al.Benzothiadiazole(BTH)induces resistance in cauliflower(Brassica oleracea var.botrytis)to downy mildew of crucifers caused by Peronospora parasitica.Crop Protection,1999,18(6):397-405.
[7] Colson-Hanks E S,Deverall B J.Effect of 2,6-dichloroisonicotinic acid,its formulation materials and benzothiadiazole on systemic resistance to alternaria leaf spot in cotton.Plant Pathology,2000,49(2):171-178.
[8] Walters D,Newton A,Lyon G.Induced Resistance for Plant Defence[M].Oxford:Blackwell Publishing,2007:31-81.
[9] Suzuki S,He Y,Oyaizu H.Indole-3-acetic acid production in Pseudomonasfluorescens HP72 and its association with suppression of creeping bentgrass brown patch.Current Microbiology,2003,47(2):138-143.
[10] Ryu C,Farag M A,Hu C,et al.Bacterial volatiles induce systemic resistance in Arabidopsis.Plant Physiology,2004,134(3):1017-1026.
[11] Cortes-Barco A M,Hsiang T,Goodwin P H.Induced systemic resistance against three foliar diseases of Agrostisstolonifera by(2R,3R)-butanediol or an isoparaffin mixture.Annals of Applied Biology,2010,157(2):179-189.
[12] Cortes-Barco A M,Goodwin P H,Hsiang T.Comparison of induced resistance activated by benzothiadiazole,(2R,3R)-butanediol and an isoparaffin mixture against anthracnose of Nicotiana benthamiana.Plant Pathology,2010,59(4):643-653.
[13] Han S H,Lee S J,Moon J H,et al.GacS-dependent production of 2R,3R-butanediol by Pseudomonas chlororaphis O6 is a major determinant for eliciting systemic resistance against Erwinia carotovora but not against Pseudomonas syringae pv.tabaci in tobacco.Molecular Plant-Microbe Interactions,2006,19(8):924-930.
[14] Smith A G,Croft M T,Moulin M,et al.Plants need their vitamins too.Current Opinion in Plant Biology,2007,10(3):266-275.
[15] Kuzniak E,Skl Z S,Odowska M.Ascorbate,glutathione and related enzymes in chloroplasts of tomato leaves infected by Botrytis cinerea.Plant Science,2001,160(4):723-731.
[16] Conklin P L,Barth C.Ascorbic acid,a familiar small molecule intertwined in the response of plants to ozone,pathogens,and the onset of senescence.Plant,Cell&Environment,2004,27(8):959-970.
[17] Ghanta S,Bhattacharyya D,Chattopadhyay S.Glutathione signaling acts through NPR1-dependent SA-mediated pathway to mitigate biotic stress.Plant Signal&Behavior,2011,6(4):607-609.
[18] Deng Y Y,Ming J,Zhang Z Q,et al.Effect of chitosan on salicylic acid and active oxygen metabolism of navel orange fruit.Scientia Agricultura Sinica,2010,(04):812-820.
[19] Ren J Z.Grassland Research Methods[M].Beijing:China Agriculture University Press,1998:214-236.
[20] Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts.Plant and Cell Physiology,1981,22(5):867-880.
[21] Foyer C H,Halliwell B.The presence of glutathione and glutathione reductase in chloroplasts:a proposed role in ascorbic acid metabolism.Planta,1976,133(1):21-25.
[22] Kampfenkel K,Van Montagu M,Inze D.Extraction and determination of ascorbate and dehydroascorbate from plant tissue.Analytical Biochemistry,1995,225(1):165-167.
[23] Knörzer O C,Burner J,Boger P.Alterations in the antioxidative system of suspension-cultured soybean cells(Glycine max)induced by oxidative stress.Physiologia Plantarum,1996,97(2):388-396.
[24] Chen L F,Ye M B,Chen Y X,et al.The relationship between ascorbic acid and resistance of wheat to scab.Acta Phytopathologia Sinica,1997,27(2):113-118.
[25] Shi Q H,Zhu Z J,Xu M,et al.Effects of exogenous salicylic acid on activities of some enzymes and antioxidants in cucumber leaves.Acta Horticulturae Sinica,2004,(05):666-667.
[26] Liu Z L,Zhang S L,Gao F Y.Effect of exogenous salicylic acid on antioxidant enzymes and Ca2+density in pear leaves infected by Physalosproa piricola Nose.Chinese Journal of Applied&Environmental Biology,2011,17(2):215-218.
[27] Bradley D J,Kjellbom P,Lamb C J.Elicitor-and wound-induced oxidative cross-linking of a proline-rich plant cell wall protein:a novel,rapid defense response.Cell,1992,70(1):21-30.
[28] Desikan R,Reynolds A,Hancock J T,et al.Harpin and hydrogen peroxide both initiate programmed cell death but have differential effects on defence gene expression in Arabidopsis suspension cultures.Biochemical Journal,1998,330(1):115-120.
[29] Rogers K R,Albert F,Anderson A J.Lipid peroxidation is a consequence of elicitor activity.Plant Physiology,1988,86(2):547-553.
[30] Mhamdi A,Hager J,Chaouch S,et al.Arabidopsis glutathione reductase1 plays a crucial role in leaf responses to intracellular hydrogen peroxide and in ensuring appropriate gene expression through both salicylic acid and jasmonic acid signaling pathways.Plant Physiology,2010,153(3):1144-1160.
[31] Foyer C H,Noctor G.Redox homeostasis and antioxidant signaling:a metabolic interface between stress perception and physiological responses.Plant Cell,2005,17(7):1866-1875.
[32] Mou Z,Fan W,Dong X.Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes.Cell,2003,113(7):935-944.
[33] Vanacker H,Carver T L,Foyer C H.Early H2O2accumulation in mesophyll cells leads to induction of glutathione during the hyper-sensitive response in the barley-powdery mildew interaction.Plant Physiology,2000,123(4):1289-1300.
[34] Ma H L,Fang Y Y.Induction of plant disease resistance and its application for disease control in creeping bentgrass.Acta Prataculturae Sinica,2014,23(5):312-320.
参考文献:
[1] 何秋,刘建秀.草坪草真菌病害的研究进展.草业科学,2006,23(4):95-104.
[2] 文克俭,罗天琼,张莉,等.种杀菌剂对3种禾草病害的防治研究.草业学报,2013,22(3):124.
[3] 张磊,胡繁荣,沈希宏,等.草坪草生物技术进展及研究热点.核农学报,2004,18(5):372-375.
[4] 张成霞,南志标,李春杰,等.杀菌剂拌种防治草坪草病害的研究进展.草业学报,2005,14(6):14-22.
[5] 郭金芳,潘俊松,王琛,等.病程相关蛋白与植物抗病性关系的研究及其在草坪草抗病育种中的应用.草业学报,2008,17(6):156.
[18] 邓雨艳,明建,张昭其,等.壳聚糖诱导脐橙果实抗病性、水杨酸及活性氧代谢变化.中国农业科学,2010,(4):812-820.
[19] 任继周.草业科学研究方法[M].北京:中国农业出版社,1998:214-236.
[24] 陈利锋,叶茂炳,陈永幸,等.抗坏血酸与小麦抗赤霉病性的关系.植物病理学报,1997,27(2):113-118.
[25] 史庆华,朱祝军,徐敏,等.外源水杨酸对黄瓜叶片几种酶活性和抗氧化物质含量的影响.园艺学报,2004,(5):666-667.
[26] 刘招龙,张绍铃,高富永.外源水杨酸对梨叶片感染轮纹病菌后抗氧化酶活性及Ca2+浓度的影响.应用与环境生物学报,2011,17(2):215-218.
[34] 马晖玲,房媛媛.植物抗病性及其诱导抗性在匍匐翦股颖病害防治中的应用.草业学报,2014,23(5):312-320.
Involvement of the ascorbate-glutathione cycle in resistance of creeping bentgrass to Rhizoctonia solani induced by 2,3-butanediol and 2R,3R-butanediol
FANG Yuan-Yuan,MA Hui-Ling*
Pratacultural College,Gansu Agricultural University,Key Laboratory of Grassland Ecosystem,Ministry of Education,Sino-U.S.Centersfor Grazingland Ecosystem Sustainability,Lanzhou 730070,China
The compounds 2,3-butanediol(BD)and 2R,3R-BD can cause creeping bentgrass to show increased resistance against Rhizoctonia solani.To evaluate the mechanisms of this induced resistance,we determined the activities of antioxidant enzymes in the ascorbate-glutathione cycle and the redox states of various antioxidant compounds in leaves of creeping bentgrass that were injected with 250μmol/L 2,3-BD and 100μmol/L 2R,3R-BD before inoculation with R.solani.The 2,3-BD and 2R,3R-BD treatments significantly decreased the disease incidence in creeping bentgrass plants inoculated with R.solani and increased the activities of glutathione reductase(GR)and ascorbate peroxidase(APX).However,the increase in APX activity was smaller than that in the control(no BD).In the plants treated with 2,3-BD and 2R,3R-BD,the ascorbic acid(As A)content decreased at an early stage and increased at a later stage after inoculation,while the content of de-hydroascorbic acid(DHA)peaked at 1 and 9 d after inoculation at levels significantly higher than those in the control.The As A/DHA ratios of plants treated with 2,3-BD and 2R,3R-BD reached a maximum at 5 days after inoculation(5.0 and 3.4 times the As A/DHA ratio in the no-BD control at 5 d after inoculation,respectively).In plants treated with 2,3-BD and 2R,3R-BD,the glutathione(GSH)content significantly increased and the GSH/GSSG ratios peaked at 9 days after inoculation at 2.34 and 1.66 times that in the no-BD control,respectively.These results suggest that in creeping bentgrass,the resistance against R.solani induced by 2,3-BD and 2R,3R-BD involves the ascorbate-glutathione cycle,which maintains efficient metabolism and participates in the plant disease resistance response.
creeping bentgrass;2,3-BD;2R,3R-BD;Rhizoctonia solani
10.11686/cyxb2014519 http://cyxb.lzu.edu.cn
房媛媛,马晖玲.As A-GSH循环参与2,3-丁二醇、2R,3R-丁二醇诱导后匍匐翦股颖的抗病反应.草业学报,2015,24(11):82-90.
FANG Yuan-Yuan,MA Hui-Ling.Involvement of the ascorbate-glutathione cycle in resistance of creeping bentgrass to Rhizoctonia solani induced by 2,3-butanediol and 2R,3R-butanediol.Acta Prataculturae Sinica,2015,24(11):82-90.
2014-12-15;改回日期:2015-03-10
国家自然科学基金(丁二醇诱导匍匐翦股颖抗病性及其ISR机理研究-31360583)资助。
房媛媛(1988-),女,甘肃兰州人,在读硕士。E-mail:estherfyy@163.com
*通讯作者Corresponding author.E-mail:mahl@gsau.edu.cn

