中华绒螯蟹点状产气单胞菌的分离鉴定与药敏试验
曹海鹏,温乐夫,白金尊,张 帆,何 珊
(上海海洋大学农业部淡水水产种质资源重点实验室,上海市水产养殖工程技术研究中心,水产动物遗传育种上海市协同创新中心(ZF1206),上海201306)
中华绒螯蟹(Eriocheirsinensis)肉味鲜美,营养丰富,是我国重要的水产养殖经济物种之一,深受消费者的青睐。近年来,随着中华绒螯蟹经济价值的日益显现,中华绒螯蟹市场需求量不断增加,规模化养殖日益扩大,其养殖产业在江苏、安徽、湖北、浙江及北方的辽宁等主产地迅猛发展,年产量已经超过了60余万吨,年产值已达400亿元[1]。然而,由于养殖户投饲不科学、水质恶化等诸多因素,病害问题也越来越严重,给中华绒螯蟹养殖造成了巨大的经济损失。其中,肠炎是目前严重影响我国中华绒螯蟹养殖发展的细菌性病害之一,但从现有文献资料来看,中华绒螯蟹肠炎的研究基础薄弱,未见点状产气单胞菌引起的中华绒螯蟹肠炎及其防控药物等方面研究的详细报道。2014年8月,江苏省泗洪县一养殖户池塘养殖的中华绒螯蟹出现了严重的肠炎,每天死亡量高达180多只,主要病症为病蟹行动迟缓,摄食减少或不摄食;剖检可见,肠道发炎,有脓状黏液且无粪便,肝胰腺呈暗黄色。本研究从自然发病的中华绒螯蟹体内分离鉴定病原菌,并进一步分离鉴定菌株的分类地位与药敏特性,以期为中华绒螯蟹肠炎的病原学研究与防控提供资料。
1 材料与方法
1.1 材料
患肠炎的中华绒螯蟹,12只,平均体重为62.3g,取自江苏泗洪县自然发病养殖池。
1.2 方法
1.2.1 病原菌的分离 选取具有典型发病症状的濒死中华绒螯蟹,用750mL/L酒精表面消毒后常规无菌取其肝胰腺组织,分别在TCBS琼脂平板和普通营养琼脂平板上划线,30℃恒温培养18h~24h后纯化分离菌株,然后转接到普通营养琼脂斜面培养基上于4℃冰箱保存备用。
1.2.2 分离菌株的人工回归感染试验 选取无病伤、体质健壮、大小均匀(平均体重为36.1g)的健康中华绒螯蟹进行人工回归感染试验。试验共包括5个试验组和1个对照组,每组试验中华绒螯蟹各10只。用无菌生理盐水分别洗下培养基斜面上各分离菌株的菌苔,用稀释涂布平板法测定并调节各菌悬液浓度为1.0×107CFU/mL,然后分别在健康中华绒螯蟹第3步足基部注射[2],每尾注射0.1mL,对照组注射相同剂量的无菌生理盐水。连续6d观察中华绒螯蟹的发病症状及死亡情况,发现死蟹及时捞出,解剖检查其病变情况,同时对回归感染发病濒死的中华绒螯蟹肝胰腺组织进行常规病原菌再分离。每组试验中华绒螯蟹各10只,水温控制在为28℃。
1.2.3 病原菌的鉴定
1.2.3.1 生理生化鉴定 参照余银春等[3]方法,用API 20E细菌鉴定系统对病原菌株进行生理生化鉴定。
1.2.3.2 分子鉴定 以病原菌株的基因组DNA为模板,对其16SrDNA进行PCR扩增。其中,正向引物为 27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物为1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR的扩增条件为:94 ℃3min;94℃1min,60℃1min,72℃1min,共35个循环;72℃10min。PCR产物的纯化与测序由上海生工生物工程技术服务有限公司完成。将测得序列用DNA Man软件编辑后,在美国国立生物技术信息中心(NCBI)中利用BLASTN软件与Gen-Bank基因库中已知的16SrDNA序列进行同源性比较,选取同源性较高的序列并利用软件BioEdit 7.0和MEGA 4.0进行多重比较后通过邻接法构建系统发育树。
1.2.4 病原菌药敏特性的测定 参照KB纸片扩散法[4]进行,并根据《抗菌药物敏感性试验执行标准:第19版信息增刊》,判定病原菌株对抗菌药物的敏感性。其中,药敏纸片为杭州天和微生物试剂有限公司产品。
2 结果
2.1 病原菌的分离
结果见表1。从自然发病的中华绒螯蟹的肝胰腺中分离纯化到5株优势细菌,经人工回归感染试验,证实菌株DD5对中华绒螯蟹有致病作用,人工感染中华绒螯蟹的发病与死亡症状与自然病症基本相同,而且从人工感染的中华绒螯蟹的肝胰腺内又可分离到与原菌株形态特征、理化性质一致的菌株,表明菌株DD5是引起该病的病原菌。
2.2 病原菌的鉴定
结果见表2。API 20E细菌鉴定系统对菌株DD5的生化鉴定结果表明,菌株DD5为点状产气单胞菌(Aeromonaspunctata),鉴定结果的可信度为99.9%。此外,通过对菌株DD5的16SrDNA进行PCR扩增,获得了1400bp大小的片段,其在Gen-Bank上的登录号为:KP260655。通过NCBI网站中的BLASTN软件对菌株DD5的16SrDNA序列与基因库中已知菌株的16SrDNA序列进行了同源性比较。结果表明,菌株DD5的16SrDNA序列与GenBank数据库中气单胞菌属菌株的16SrDNA序列有99%~100%的同源性。通过邻接法构建的基于菌株DD5 16SrDNA序列的系统发育分析(图1)进一步可以看出,菌株DD5与点状产气单胞菌136c株(GenBank登录号:EU488688)的亲缘关系最近。结合传统的生理生化鉴定及16SrDNA序列系统发育分析的结果,判定菌株DD5为点状产气单胞菌。

表1 分离菌株对中华绒螯蟹人工回归感染试验结果Table 1 The results of artificial infection test of bacterial isolates Eriocheir sinensis

表2 菌株DD5的生化特征性鉴定Table 2 Identification of biochemical characteristics of strain DD5
2.3 病原菌的药敏特性
结果见表3。菌株DD5对12种抗菌药物的敏感试验结果表明,菌株DD5对四环素、链霉素、卡那霉素、庆大霉素、恩诺沙星、氧氟沙星、左氟沙星、复方新诺明等8种抗生素高度敏感,对多黏菌素中度敏感,对氨苄西林、麦迪霉素、万古霉素等3种抗生素耐药。
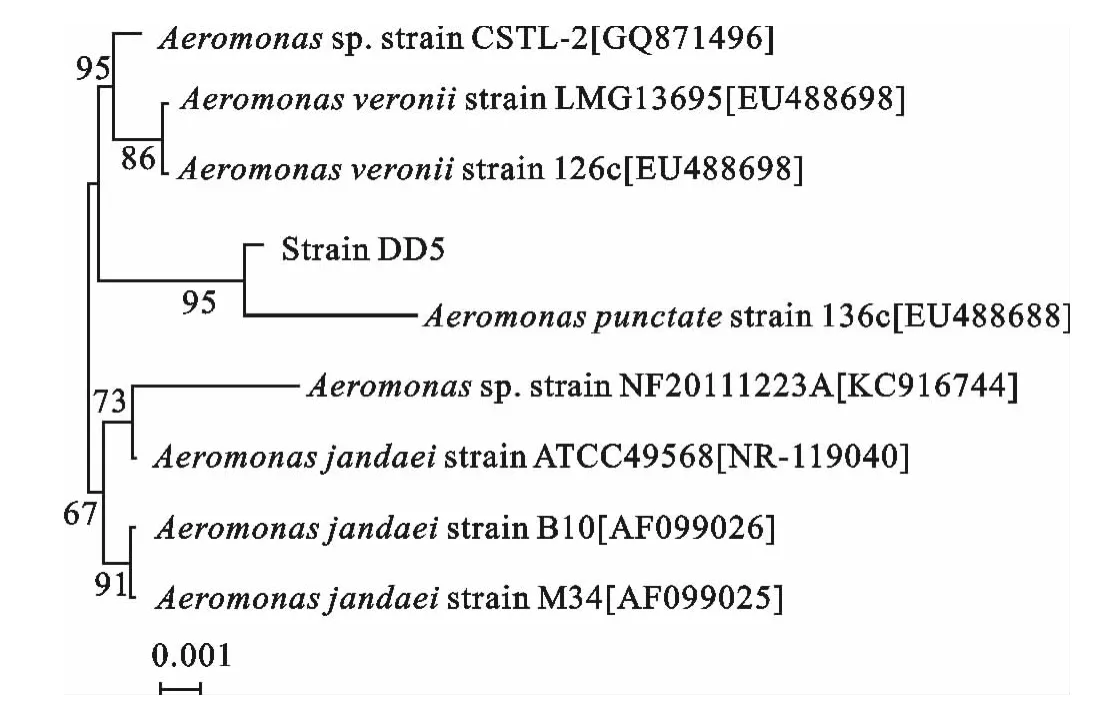
图1 通过邻接法构建的基于菌株DD5及相关菌株16SrDNA序列的系统发育树Fig.1 The phylogenetic tree based on 16SrDNA sequences of strain DD5and other related strains by neighbor-joining method

表3 菌株DD5的药敏试验结果Table 3 Drug sensitivity test results of strain DD5
3 讨论
点状产气单胞菌是水产养殖重要病原菌之一[5],对水产养殖动物具有极强的致病能力[6],可引起中华鳖(Trionyxsinensis)、鲫鱼(Carassiusauratus)、虹鳟(Oncorhynchusmykiss)、草鱼(Ctenopharyngodonidllus)、缢 蛏(Sinvnovaculaconstricta)等海水、淡水养殖动物出现大量死亡,给养殖业造成了巨大的经济损失。然而,从现有文献资料来看,未见到点状产气单胞菌引起中华绒螯蟹肠炎的研究报道。本试验证实点状产气单胞菌对中华绒螯蟹具有致病性,并分析了其生理生化特性与药敏特性,再一次表明了点状产气单胞菌对水产养殖的广泛危害性,也进一步丰富了点状产气单胞菌的病原学研究资料。
肠炎是水产养殖生产中常见的细菌性病害之一,病死率一般为30%~60%,严重的可达95%以上,给养殖户带来重大经济损失[7]。本试验证实点状产气单胞菌是中华绒螯蟹肠炎的病原菌,能够导致中华绒螯蟹出现大量死亡。点状产气单胞菌引起中华绒螯蟹肠炎的发病机理,可能是由于点状产气单胞菌在肠道内大量生长增殖后侵入肠壁血管,通过血液循环遍布至肝胰腺,同时产生毒力因子,导致肝胰腺和肠道出现病变,引起中华绒螯蟹死亡。当然,除了点状产气单胞菌本身因素外,该病的发生可能与养殖户投喂变质饲料或不正常投饲也有较大的关系。
生理生化鉴定是细菌分类鉴定的重要依据之一[8-9]。然而,本试验发现菌株DD5对鸟氨酸、肌醇等指标的生理生化反应与温海深等[10]报道的鲫源分离株不同,对柠檬酸盐、肌醇等指标的生理生化反应与李军等[11]报道的草鱼源分离株不同。这可能与来源于不同地区、养殖动物的点状产气单胞菌菌株在地区、气候、水质条件及实验室培养条件等方面存在差异有关。因此,为了准确鉴定菌株DD5,本试验进一步采用了16SrDNA序列分析对菌株DD5的分类地位进行分析,以弥补生理生化鉴定的不足,最终证实了菌株DD5的16SrDNA序列分析结果与生理生化鉴定结果一致,确定菌株DD5为点状产气单胞菌。
水生环境残留的抗生素对细菌耐药性的诱导产生、耐药基因水平扩散和垂直传播具有重要的作用,造成养殖水环境及动物体内细菌对抗生素耐药性的增强、养殖动物抗病能力降低、抗菌药物在体内积聚而残留量增大等不良影响,进而通过食物链传递到人体内,对消费者身体健康产生了潜在威胁[12]。本试验发现,点状产气单胞菌菌株DD5对链霉素、庆大霉素、恩诺沙星等多种水产常用抗菌药物均未产生耐药性,说明养殖户在养殖生产过程中没有滥用抗菌药物,验证了现场调查中养殖户反映没有滥用抗菌药物的说法,这也为该病的合理用药防控提供了科学依据。除该病的药物防治外,国外学者[13]也针对生物防治进行了点状产气单胞菌噬菌体的分离,为该病生物控制技术的建立奠定了良好的基础。
[1]王成辉.中华绒螯蟹产业技术体系建设成效显著[J].上海农村经济,2013(12):28-30.
[2]徐海圣,舒妙安,占秀安,等.养殖河蟹病原菌分离鉴定及其胞外产物的致病性[J].水产学报,2002,26(4):357-362.
[3]余银春,王锡波,彭程远,等.养殖乌鳢皮肤溃烂病的病原及血液病理研究[J].淡水渔业,2014,44(4):73-76.
[4]冷 闯,邓舜洲,张文波,等.中华鳖致病性嗜水气单胞菌的分离鉴定及药敏试验[J].动物医学进展,2012,33(2):124-129.
[5]Yano Y,Hamano K,Tsutsui I,et al.Occurrence,molecular characterization,and antimicrobial susceptibility ofAeromonasspp.in marine species of shrimps cultured at inland low salinity ponds[J].Food Microbiol,2015,47:21-27.
[6]Piotrowska M,Popowska M.The prevalence of antibiotic resistance genes amongAeromonasspecies in aquatic environments[J].Ann Microbiol,2014,64:921-934.
[7]高文轩.渔业生产中肠炎病的防治技术[J].渔业致富指南,2014(14):59-59.
[8]Shamim K,Naik M M,Pandey A,et al.Isolation and identification ofAeromonascaviaestrain KS-1as TBTC-and lead-resistant estuarine bacteria[J].Environ Monit Assess,2013,185:5243-5249.
[9]王海娟,王 利.鲈鱼豚鼠气单胞菌的鉴定及其药敏试验[J].动物医学进展,2014,35(9):123-126.
[10]温海深,刘振琦,马国文.鲫腐皮病病原菌的初步研究[J].大连水产学院学报,1995,10(1):49-55.
[11]李 军,闵正沛,徐伯亥,等.草鱼肠型点状气单胞菌的分离和鉴定[J].水利渔业,2007,27(2):107-108.
[12]李 琴,孙成波,陈美领,等.湛江东海岛对虾育苗场水体细菌的抗生素耐药性[J].热带生物学报,2014,5(1):8-14.
[13]Haq I U,Chaudhry W N,Andleeb S,et al.Isolation and partial characterization of a virulent bacteriophage IHQ1specific forAeromonaspunctatafrom stream water[J].Microb Ecol,2012,63:954-963.

