马尾藻多糖对鸡脾脏淋巴细胞GSH和GSSG水平的影响
黎 江,尹 丹,刘洪丽,何 颖,胡庭俊*
(1.广西大学动物科学技术学院,广西南宁530005;2.广西壮族自治区兽医研究所,广西南宁530001)
马尾藻(Sargassum)是褐藻中的一类海藻,属褐藻门,墨角菜目,马尾藻科,是最大型的藻类,也是唯一能在开阔水域自主生长的藻类。马尾藻盛产于我国广东、广西沿海,资源丰富,但尚未很好地开发利用。马尾藻多糖(Sargassumpolysaccharide,SP)是从马尾藻中分离提取出来的易溶于水、黏度较高的多糖复合物,在抗菌、抗肿瘤、抗氧化、抗病毒及提高机体免疫力方面均有重要作用[1-3]。张玲等[4]研究表明,100mg/L~400mg/L的马尾藻多糖能显著促进体外培养的鸡脾脏淋巴细胞体外增殖,且400mg/L马尾藻多糖能显著增加氧化应激状态下细胞内的还原型谷胱甘肽(reduced glutathione sodjum,GSH)含量。有研究表明,淋巴细胞表面存在多糖受体,多糖能通过与其受体结合启动淋巴细胞信息传递[5]。论文通过观察马尾藻多糖对鸡脾脏淋巴细胞内氧化还原水平的影响,探讨其体外抗氧化作用。
1 材料与方法
1.1 材料
1.1.1 药物 马尾藻多糖由广西大学动物科学技术学院药理实验室提取、分离、纯化,还原糖含量为87.76%。
1.1.2 试验用动物 三黄鸡,60日龄,临床健康。1.1.3 试剂和仪器 RPMI-1640粉剂,Gibco公司产品;N-乙 基马来酰亚胺(N-ethylmaleimide,NEM,Alfa Aesar)、GSH 标准品、氧化型谷胱甘肽(glutathione oxidized,GSSG)标准品、邻苯二甲醛(O-phenaldehyde,OPT)和其他试剂均为国产分析纯;RF-5301PC荧光分光光谱仪,日本岛津公司产品;高速冷冻台式离心机、微量离心机,Sigma公司产品;台式低速离心机,湖南凯达科学仪器有限公司产品;超声波清洗器(KQ-250B),昆山市超声仪器有限公司产品;CO2培养箱(5500E),美国Nuaire公司产品;生物显微镜为YS100型,Nikon公司产品。
1.2 方法
1.2.1 鸡脾脏淋巴细胞的制备与培养 参考文献[6]的方法,将鸡颈静脉放血处死,无菌条件下采其脾脏,用D-Hank's液洗去表面的血液,然后在加入适量D-Hank's液的培养皿中将脾脏轻轻研磨,再用200目滤网过滤,收集滤液,并将其加在等体积的鸡淋巴细胞分离液中,2 000r/min离心10min,收集中间层的淋巴细胞,用D-Hank's液洗涤2次后加入适量完全RPMI-1640培养液,用台盼蓝拒染法测定培养液中活细胞数,活细胞数大于95%才可用。调淋巴细胞浓度为4×106cells/mL。
1.2.2 试验分组及处理 试验分6个组,即对照组(只含淋巴细胞)和5个多糖组(马尾藻多糖终浓度分别为12.5、25、50、100、200μg/mL),每孔培养体积为2mL,每组设4个平行。
1.2.3 细胞培养及样品收集 采用24孔培养板,每个时间段用1个培养板,共4个24孔培养板。置38℃、体积分数为5%的CO2培养箱中分别孵育4、8、12、24h,然后分别离心收集不同培养时间的脾脏淋巴细胞,加入50g/L三氯醋酸400μL,冰水浴超声破碎1min,4℃、12 000r/min离心15min,取上清分装于-80℃保存,备用。
1.2.4 细胞内GSH水平测定 参考文献[7]的方法,取裂解后的细胞上清液或GSH标准品200μL,加入3.6mL PBS-EDTA缓冲液(pH8.0)和200μL OPT,混匀,室温孵育40min,于荧光分光光度计以激发波长350nm和发射波长425nm测定荧光值,按下列公式计算样品中GSH含量:
GSH浓度(μmol/L)=样品管荧光读数/标准品管荧光读数×1 000/307.3
1.2.5 GSSG标准曲线制作 将各管内液体混匀,室温放置30min,以上操作均避光进行。然后设定激发波长337.8nm,发射波长421.6nm,以“0”管作对照,测定各管荧光强度。以GSSG标准液的浓度为横轴(X),以对应的荧光强度值为纵轴(Y),绘制标准曲线,求直线回归方程。将样品管的荧光测定值代入方程,可求出待测样品液中的GSSG含量。

表1 GSSG标准曲线制作及操作方法Table 1 The standard curve of GSSG and manipulation mL
1.2.6 细胞内氧化性谷胱甘肽(GSSG)的测定 参照文献[7]的方法,取裂解后的细胞上清液100μL,加入40μL N-乙基马来酰亚胺(N-ethylmaleimide,NEM)(0.04mol/L)室温孵育 30min,再加入1.9mL NaOH(0.1mol/L)和 100 μL OPT(1mg/mL),混匀,室温孵育30min,以上操作均避光进行。于荧光分光光度计以激发波长337.8nm和发射波长421.6nm测量荧光值。并根据标准曲线计算GSSG含量。
1.2.7 统计学处理 试验数据用M±SD表示,数据用SPSS11.0for Windows分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 马尾藻多糖对鸡脾脏淋巴细胞内GSH的影响
结果见表2。由表2可见,马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均不同程度升高了细胞内GSH含量,与空白对照组比较差异显著或极显著(P<0.05或P<0.01),表明马尾藻多糖能升高鸡脾脏淋巴细胞内GSH水平。
2.2 标准曲线制作
GSSG标准曲线见图1,得到直线回归方程:y=2.845 5x+0.118 7,R2=0.996 2。
2.3 马尾藻多糖对鸡脾脏淋巴细胞内GSSG的影响
结果见表3。由表3可见,各浓度马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均不同程度降低细胞内GSSG含量,与空白对照组比较,差异极显著(P<0.01),表明马尾藻多糖能降低鸡脾脏淋巴细胞内GSSG水平。

图1 GSSG标准曲线Fig.1 The standard curve of GSSG
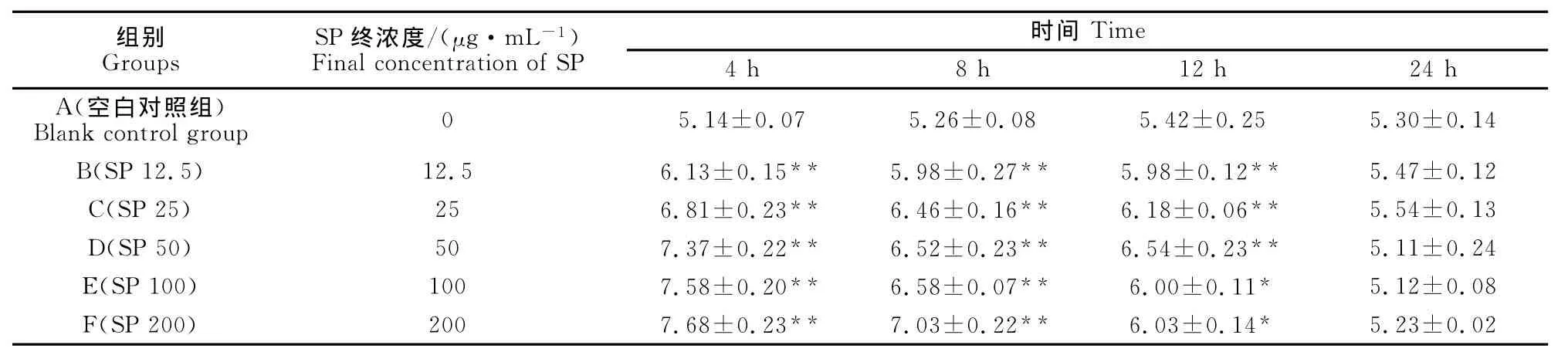
表2 马尾藻多糖对鸡脾脏淋巴细胞内GSH含量的影响Table 2 Effect of the SP on the content of GSH in the spleen lymphocytes of chickens(μmol·L-1)
2.4 马尾藻多糖对鸡脾脏淋巴细胞内GSH/GSSG比值的影响
结果见表4。由表4可见,各浓度马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均不同程度升高细胞内GSH/GSSG比值,与空白对照组比较,差异显著或极显著(P<0.05或P<0.01),表明马尾藻多糖能升高鸡脾脏淋巴细胞内GSH/GSSG比值。
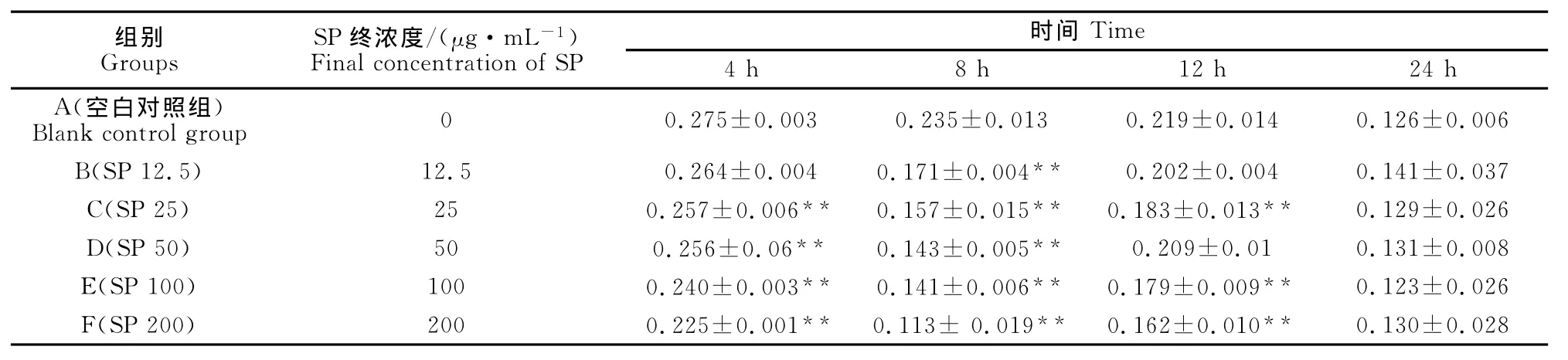
表3 马尾藻多糖对鸡脾脏淋巴细胞内GSSG含量的影响Table 3 Effect of the SP on the content of GSSG in the spleen lymphocyte of chickens(μmol·L-1))
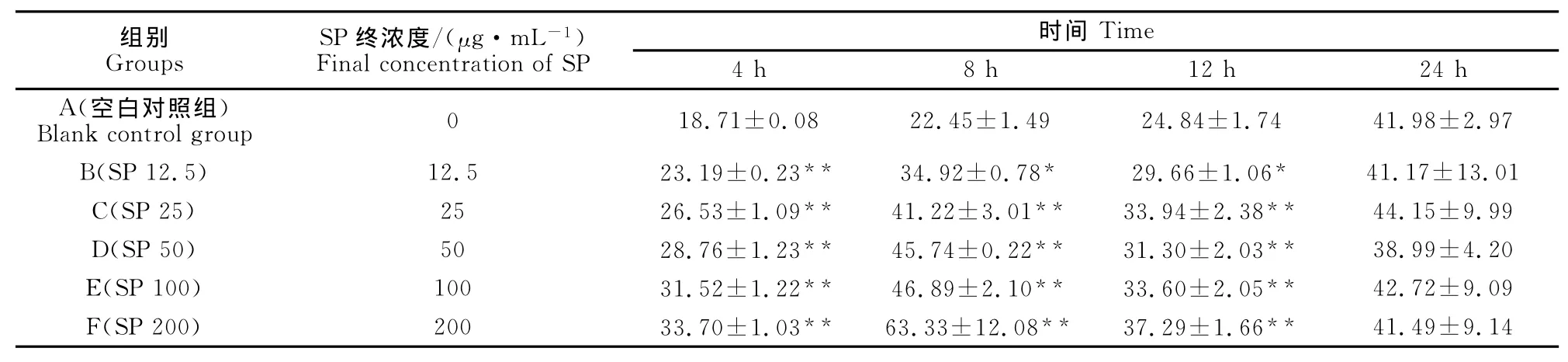
表4 马尾藻多糖对鸡脾脏淋巴细胞内GSH/GSSG比值的影响Table 4 Effect of the SP on the ratio of GSH/GSSG in the spleen lymphocyte of chickens(μmol·L-1)
3 讨论
氧化还原状态在细胞调控中的重要性已逐渐被人们所认识。在生理条件下,细胞对氧化还原状态有着精密的调控,使细胞内的氧化还原状态维持在相对稳定的状态,以保证细胞的正常生命活动。氧化还原作用影响细胞的基因转录、细胞信号转导、酶和生物大分子的活性,以及细胞的增殖、分化、凋亡、坏死等许多生理、病理过程[8]。因此,监测体液的氧化还原状态已成为近年来人们高度重视的一个研究领域。氧化剂与抗氧化剂的活性与比例决定着细胞内的氧化还原状态,而氧化还原对是直接应对细胞内氧化还原状态的物质,是直接反映氧化还原状态的可靠指标。细胞内主要的氧化还原对包括氧化型与还原型辅酶Ⅱ(NADPH/NADP+)、氧化型与还原型硫氧还蛋白(TRXRED/TRXOX)、氧化型与还原型谷胱甘肽(GSH/GSSG)。其中,GSH/GSSG是这三对氧化还原对中作用最大的,其含量比其他两个高出100倍以上[9]。
还原型谷胱甘肽(GSH)是细胞内最重要的非酶类抗氧化物质,大量存在于各种细胞之中,并在多种生理过程中起着重要作用[10],是构成细胞防御氧化损伤机制中的第一道防线,是细胞中的主要氧化还原缓冲剂。GSH能单方面改善细胞的还原状态,提高细胞的抗氧化能力[11],因此,其在抵抗自由基损伤、维持细胞内氧化还原平衡方面发挥着重要作用[11-13]。在本研究中,终浓度为12.5、25、50、100、200μg/mL的马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均能不同程度的提高细胞中GSH水平,与对照组相比差异显著(P<0.05),但随培养时间的延长至24h时有明显下降趋势,培养到24h时恢复到正常水平。马尾藻多糖浓度仅为12.5μg/mL时即能提高细胞内GSH含量,说明马尾藻多糖有使细胞趋于还原状态的趋势,有助于细胞抵御过多的氧化剂对细胞内环境的直接作用。
氧化型谷胱甘肽(GSSG)本身并无清除自由基的作用,但其能作为GSH还原酶底物参与维持两种形态的谷胱甘肽的动态平衡,也是测定细胞氧化还原能力的指标之一。GSSG在细胞中积累过多时,会破坏细胞氧化还原动态平衡,给生物体带来不良影响[14]。本研究结果表明,终浓度为12.5、25、50、100、200μg/mL的马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均能明显降低鸡脾脏淋巴细胞内GSSG水平,与对照组相比差异显著(P<0.05),且随着多糖浓度的增加GSSG水平降低程度增大,但随培养时间延长至24h时,逐渐恢复到正常水平。提示马尾藻多糖使GSSG在鸡脾脏淋巴细胞内的含量维持在较低的生理水平,防止细胞处于过氧化状态,维持着细胞内氧化还原状态平衡。
GSH/GSSG比值是衡量细胞内氧化还原状态的重要指标,生物体内GSH和GSSG通常处于稳恒性动态平衡下,即当机体内GSH清除自由基作用导致GSSG累积,GSH还原酶将GSSG还原成GSH。当细胞处于过氧化状态时,可引起GSSG浓度升高或比值降低,常用来评价氧化剂与抗氧化剂间的动态平衡[15]。本研究结果表明终浓度为12.5、25、50、100、200μg/mL的马尾藻多糖与鸡脾脏淋巴细胞共同培养4、8、12h均能明显升高GSH/GSSG的比值,与对照组相比差异极显著(P<0.01)。提示马尾藻多糖能通过升高GSH/GSSG的比值,使细胞处于还原态,从而发挥其抗氧化作用。
[1]Chen X M,Nie W,Yu G,et al.Antitumor and immunomodulatory activity of polysaccharides fromSargassumfusiforme[J].Food Chem Toxicol,2012,50(3):695-700.
[2]Wang W,Lu J B,Wang C,et al.Effects ofSargassumfusiformepolysaccharides on antioxidant activities and intestinal functions in mice[J].Inter J Biolog Macromol,2013(58):127-132.
[3]Sinha S,Astani A,Ghosh T,et al.Polysaccharides fromSargassumtenerrimum:structural features,chemical modification and anti-viral activity[J].Phytochemistry,2010,71(2):235-242.
[4]张 玲,胡庭俊,陈炳全.马尾藻多糖对鸡脾脏淋巴细胞增殖及氧化应激影响的实验观察[J].西南农业学报,2011,24(5):1967-1971.
[5]帅学宏,苏子杰,胡庭俊,等.山豆根多糖对鸡脾脏淋巴细胞信号传导相关分子水平的影响[J].动物医学进展,2010,31(1):36-41.
[6]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2003:179-181.
[7]庞战军,周 玫,陈 瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000:259-263.
[8]郭志英,任启伟,林 琳.谷胱甘肽GSH/GSSG氧化还原态各指标的测定[J].济宁医学院学报,2007,30(1):36-38.
[9]刘漪沦,孙 静,刘月明.氧化还原状态与细胞信号传导[J].成都医学院学报,2009,4(2):127-131.
[10]Jones D P.Redox potential of GSH/GSSG couple:assay and biological significance[J].Meth Enzymol,2001(348):93-112.
[11]张 霞,胡庭俊,郑荣梁.蕨麻多糖对小鼠脾脏淋巴细胞内氧化还原状态的影响[J].中兽医医药杂志,2008(2):40-42.
[12]Schafer F Q,Buetter G R.Redox enviroment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J].Free Radic Bio Med,2001(30):1191-1212.
[13]Hiss P J,Hilf R A.Fluorometric method for determination of oxidized and reduced glutathione in tissuses[J].Anal Biochem,1976(74):214-226.
[14]金春英,崔京兰,崔胜云.氧化型谷胱甘肽对还原型谷胱甘肽清除自由基的协同作用[J].分析化学研究简报,2009,37(9):1349-1353.
[15]马 森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J].动物医学进展,2008,29(10):53-56.
- 动物医学进展的其它文章
- 夏枯草对草酸结石小鼠钙代谢及肾脏组织结构的影响

