猫ω-like干扰素在家蚕中的表达和生物活性检测
刘兴健, 杨 鑫, 张志芳, 李轶女, 易咏竹, 胡小元*
1.中国农业科学院生物技术研究所, 北京 100081;2.中国农业科学院蚕业研究所, 江苏 镇江 212018
猫ω-like干扰素在家蚕中的表达和生物活性检测
刘兴健1, 杨 鑫1, 张志芳1, 李轶女1, 易咏竹2, 胡小元1*
1.中国农业科学院生物技术研究所, 北京 100081;2.中国农业科学院蚕业研究所, 江苏 镇江 212018
干扰素在畜牧养殖业和宠物治疗中可以用于治疗病毒性传染病和提高疫苗免疫效力。用杆状病毒表达系统在家蚕中表达猫ω-like干扰素,将猫ω-like干扰素基因进行优化后合成,克隆到杆状病毒转移载体pVL1393上,与病毒复制基因失活拯救型BmBacmid病毒DNA共转染BmN细胞系,获得重组BmNPV病毒,猫ω-like干扰素基因位于多角体基因启动子下游,用重组病毒感染家蚕收获表达产物。采用细胞病变法利用干扰素抑制VSV-GFP感染猫肾细胞的方法来测定干扰素活性,结果显示干扰素效价可以达到4.53×106IU/mL以上。研究结果有望为研制新型动物干扰素疫苗提供参考。
猫ω-like干扰素;家蚕;杆状病毒表达系统;抗病毒活性
一直以来猫、犬等动物作为宠物和人类的关系很密切,尤其是近年来,随着城镇中宠物喂养的比例大大增加,国家对城镇居民宠物饲养的监管也更加正规,宠物已经融入到人们的日常生活中,随之而来的就是如何应对宠物疾病。病毒性疾病如冠状病毒病、免疫缺陷病毒等引起的传染性病毒病严重威胁着猫、犬的健康。开发高效的宠物用抗病毒制剂用于宠物治疗甚至畜牧养殖业有很重要的作用。干扰素(interferon)是一种广谱的抗病毒、抗肿瘤以及具有免疫调节作用的细胞因子[1],1957年,Isaacs[2]在用鸡胚绒毛尿囊膜研究流感干扰现象时发现被感染细胞产生了一种影响其他细胞从而干扰病毒感染复制的因子,并将其命名为干扰素。猫干扰素(feline interferon,FeIFN)基因在1992年被Nakamura等[3]首次分离,后来其被归为ω型干扰素。用BmNPV-家蚕表达系统生产的猫干扰素(Intercat©)在20世纪初就在日本投入生产并上市,产值达到13亿日元,用于治疗猫杯状病毒感染等疾病[4,5],另外在后来的研究中发现其在抗犬细小病毒[6,7]和犬肠炎病毒[6]等方面都具有一定的效果。
猫的ω型干扰素基因经分析在基因组中至少有13种,在大肠杆菌和毕赤酵母的表达发现,不同的干扰素基因的抗病毒活性差异较大[8,9]。我们选用了报道中首次用于表达的商品化的猫ω-like干扰素[8],该基因全长585 bp,它是α干扰素的一种突变类型,商品化产品中的名称为ω-like,因此本文中也沿用此名称。为了开发新型的重组猫干扰素生物制剂,本课题组利用重组杆状病毒在家蚕生物反应器[10]中进行了表达,并在猫肾上皮细胞(CRFK)中检测表达产物的抗病毒活性。
BmBacmid家蚕杆状病毒表达系统是结合常用的Bac-to-Bac、BacPAK6和flashBAC杆状病毒表达系统的特点在BmNPV的基础上构建的一种新型重组病毒和外源基因表达系统[10]。该系统可以在大肠杆菌中进行基因操作和大量制备,在共转染过程中可以批量制备重组病毒,共转染获得的重组病毒纯合率几乎达到100%,适于快速构建重组病毒和表达外源蛋白。
为了利用家蚕生物反应器快速、高效制备具有抗病毒活性的猫ω干扰素,从而使得宠物病毒病的防治和治疗更加有效,本研究以BmBacmid系统进行了该干扰素的表达,以期为新型动物干扰素疫苗的研制提供参考。
1 材料和方法
1.1 实验材料
限制性内切酶、T4 DNA连接酶购自Promega公司;TC100培养基购自AppliChem公司;DMEM(高糖)培养基、FBS购自Gibco公司;脂质体购自Invitrogen公司;Intercat购自Virbac公司。
杆状病毒转移载体pVL1393购自Invitrogen公司;BmBacmid缺陷型杆粒、VSV-GFP病毒、大肠杆菌DH10B、BmN细胞系、CRFK细胞系等为本实验室保存。
1.2 实验方法
1.2.1 猫ω-like干扰素的获得 根据文献报道[8],获得该干扰素的基因序列,另外有研究报道天然的猫ω-like干扰素氨基酸序列信号肽位置存在两个切割位点[11],推测可能会影响其表达后的分泌效率,因此本文对其信号肽区域进行了优化改造,将第21位的丝氨酸(S)突变为缬氨酸(V),提高其在该位点的切割效率。在优化后的基因序列的5′端加上BamHⅠ酶切位点和Kozak序列,3′端加上终止密码子和EcoRⅠ酶切位点,设计完成交由南京金斯瑞公司进行合成并克隆到pUC载体上,得到含有猫ω-like干扰素基因的质粒pUC-FeIFNωl。
1.2.2 猫ω-like干扰素基因插入到转移载体上 将pUC-FeIFNωl载体用BamHⅠ和EcoRⅠ双酶切,琼脂糖凝胶电泳回收600 bp左右的目的片段,与进行同样酶切处理的pVL1393转移载体用T4 DNA连接酶连接,连接产物转化大肠杆菌DH10B感受态细胞,在Amp抗生素的LB平板上培养转化的克隆,利用质粒快速粗提的方法筛选出阳性克隆,提取质粒进行酶切鉴定,筛选出连接有相应大小目的片段的克隆,测序鉴定确认FeIFN ω-like基因连接到转移载体上获得了pVL1393-FWL。
1.2.3 家蚕细胞的培养和准备 根据Summers[12]的操作手册,用含有FBS的TC100昆虫培养基培养家蚕BmN细胞系,达到合适的浓度后接种到六孔板中或者35 mm的细胞培养皿上(1×106cells/mL)培养8~12 h,用于共转染构建重组病毒。
1.2.4 重组杆状病毒的构建 根据失活拯救型BmBacmid构建重组病毒的方法[10],将适量的转移载体pVL1393-FWL和纯化的BmBacmid病毒DNA混合后加入脂质体,室温孵育20 min,共转染BmN细胞系,27℃培养4~5 d后待细胞感染发病并剥落后收集共转染上清液,获得重组病毒reBm-FWL。
1.2.5 斑筛选高表达重组病毒 在35 mm培养皿中接种适量的BmN细胞并在27℃培养12 h,将含有重组病毒的共转染上清液稀释100倍,取10 μL稀释液感染BmN细胞,27℃孵育1 h后将无血清TC100培养基换成含血清、低熔点凝胶的TC100培养基,27℃培养5~6 d后挑取病毒斑获得单独的毒株,在24孔板中用液体TC100培养的BmN细胞系扩增筛选的病毒,鉴定获得24个reBm-FWL的重组病毒毒株。
1.2.6 猫ω-like干扰素在家蚕中的表达 用共转染获得的重组病毒或者斑纯化获得的重组病毒注射感染5龄起家蚕(105pfu/头),在湿度65%,温度25~27℃条件下培养108~120 h,观察家蚕发病情况并收集含有重组FeIFN ω-like表达产物的蚕血淋巴,-20℃保存备用。
1.2.7 猫ω-like干扰素抗病毒活性检测 用微量细胞病变抑制法检测猫ω-like干扰素的活性[13]。用VSV-GFP病毒感染猫ω-like干扰素处理过的CRFK细胞,通过绿色荧光反应的病毒感染发病情况来检测其抗病毒活性。具体操作方法如下:在96孔板中接种CRFK细胞(2×105~3×105cells/mL),37℃贴壁培养8~12 h;含有猫ω-like干扰素的蚕血淋巴超声破碎后离心去除细胞碎片,再用0.2 μm滤膜过滤除菌,用含有FBS的DMEM高糖培养基稀释至不同的梯度,分别用100 μL稀释液在96孔板中孵育CRFK细胞12 h左右;去除96孔板中每个孔中的孵育培养基,加入100 μL含有100TCID50的VSV-GFP病毒DMEM培养基,37℃侵染1 h;弃掉含有病毒的培养基,换成正常含有FBS的DMEM培养基,在37℃、50 mL/L CO2的条件下培养24 h后倒置在荧光显微镜下观察细胞感染情况。
最初的抗病毒活性检测中估算样品稀释梯度,确定一定的范围后设计合适的稀释梯度来计算最准确的抗病毒活性。
2 结果与分析
2.1 信号肽优化分析
将干扰素氨基酸序列第21位的丝氨酸突变为缬氨酸后,经过分析发现其蛋白序列在第23位的切割特异性明显提高,如图1(彩图见图版二)所示,序列优化前分析预测在第21位和第23位处均有可能发生信号肽切割,序列优化后第21位的切割特异性消失,第23位的切割特异性提高,推测突变有利于最终产物的表达和分泌。
2.2 含有FeIFN ω-like转移载体的获得
对获得的pVL1393-FWL质粒进行BamHⅠ和EcoRⅠ双酶切,用1%琼脂糖凝胶电泳检测酶切产物(图2),9 kb左右片段为pVL1393载体片段,600 bp左右片段为FeIFN ω-like基因片段,说明猫ω-like干扰素已成功插入到pVL1393转移载体的MCS序列中,后续的测序进一步验证了该结果。
2.3 猫ω-like干扰素抗病毒活性检测
在细胞病变抑制的实验中,通过观察用不同稀释梯度的FeIFN ω-like表达产物处理的CRFK细胞抗VSV-GFP病毒感染情况来计算干扰素的抗病毒活性,以商品化的猫干扰素(Intercat©,以1×106IU/mL的母液进行梯度稀释)为阳性对照。
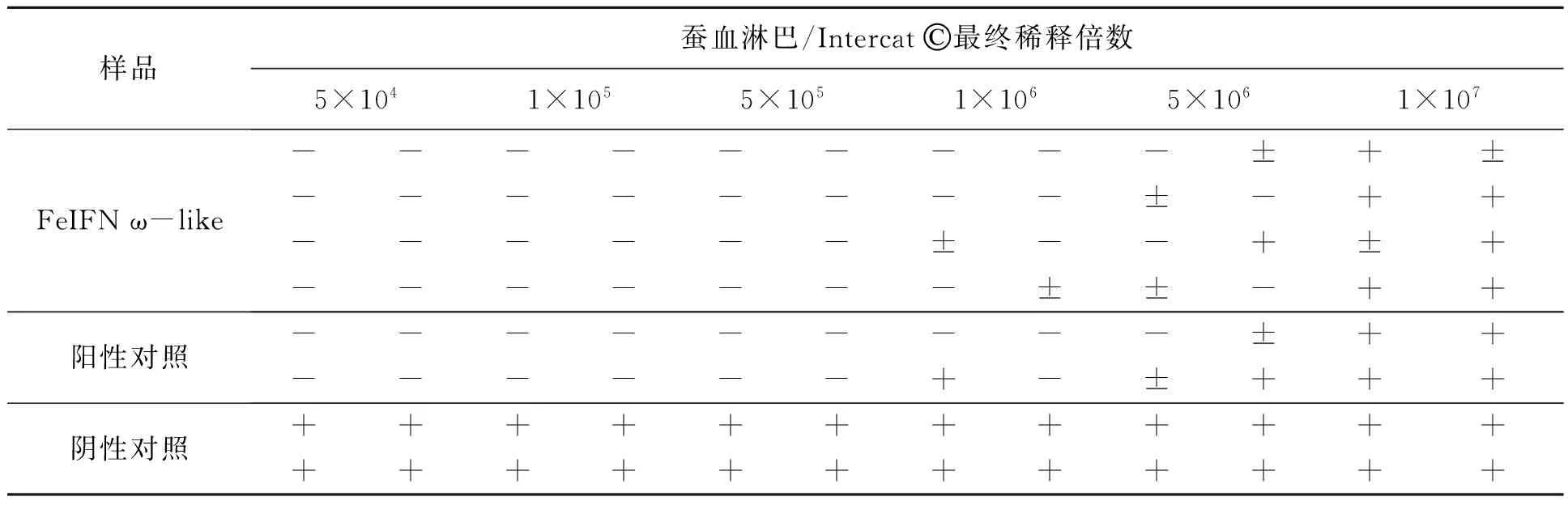
CRFK细胞用VSV-GFP(100TCID50)侵染后24 h观察细胞的发病情况。实验组中干扰素在低稀释倍数下可以完全抑制VSV病毒,细胞无荧光出现(图3A,彩图见图版二),在5×106倍数稀释的情况下,开始有部分细胞出现绿色荧光(图3C),说明干扰素浓度无法完全抑制病毒复制,但仍能抑制大部分病毒;在1×107倍数稀释的情况下,大部分细胞出现了大面积的绿色荧光(图3B),说明干扰素浓度过低,无法有效抑制病毒复制。同样观察记录阳性对照组和阴性对照组,记录病毒感染发病后的绿色荧光情况(表1)。根据细胞感染发病情况计算,以Intercat©为阳性对照,在蚕血淋巴中表达的FeIFN ω-like抗病毒效价可以达到2.0×106IU/mL左右。通过斑纯化筛选得到的24个重组病毒株在家蚕中进行表达并检测活性,最好的毒株表达产物的抗病毒活性可以达到4.53×106IU/mL,较共转染液感染家蚕的产物活性提高了2倍左右。
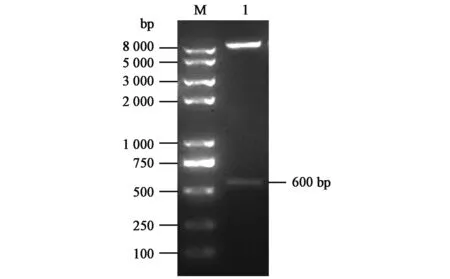
图2 pVL1393-FWL酶切鉴定结果

图3 猫肾上皮细胞(CRFK)感染VSV病毒发病的情况
表1 重组猫ω-like干扰素抗病毒活性检测结果
Table 1 The results of antiviral activity test of recombinant FeIFN ω-like.
样品蚕血淋巴/Intercat最终稀释倍数5×1041×1055×1051×1065×1061×107FeIFNω-like---------±+±--------±-++------±--+±+-------±±-++阳性对照---------±++------+-±+++阴性对照++++++++++++++++++++++++
注:“-”:无荧光,细胞未感染;“±”:少量细胞感染表达绿色荧光蛋白;“+”:50%以上细胞感染表达绿色荧光蛋白。
3 讨论
猫ω-like干扰素已经应用于宠物饲养等行业,并且采用杆状病毒表达系统进行大规模生产,杆状病毒表达系统作为真核表达系统,适于真核来源的外源蛋白的表达,能够形成正确的折叠和后期修饰,包括糖苷化、脂肪酸酰基化和乙酰化等,最大程度的保证表达的重组蛋白可以成为天然状态且具有生物活性[14]。家蚕杆状病毒表达系统作为杆状病毒表达系统的一种也具有以上优点,另外在家蚕中还存在特有的N端糖基化过程,更加有利于外源基因的表达[15]。有研究报道称杆状病毒可以在哺乳动物细胞上诱导引发基础免疫[16],这一点使得利用该系统表达的重组猫ω-like干扰素在抗病毒时受到协同促进作用,更加有利于抗病毒应用。在我国家蚕可以大规模饲养,并且生产周期短、生物安全性高、生产成本低。因此,使用重组杆状病毒在家蚕体内表达猫ω-like干扰素是一个很好的选择。
在之前的研究中,Nakamura等[8]同样利用家蚕表达过猫的干扰素,并且进行了商品化生产,在猫杯状病毒感染、犬细小病毒和肠炎病毒感染的治疗中进行应用,但是并未进行优化改造;另外猫干扰素也在研究中利用大肠杆菌进行表达[17],也可以检测到抗病毒活性,但是原核表达系统表达干扰素类的基因较真核表达系统是有差距的。在本研究中我们在Nakamura研究的基础上对干扰素基因进行了优化,并利用优化后的家蚕杆状病毒表达体系进行了表达[10],收获产物的抗病毒活性检测验证了表达出的干扰素是有高抗病毒活性的,病毒初步筛选后的表达产物抗病毒效价可以达到4.53×106IU/mL蚕血淋巴,已经高于商品化对照组的样品。用GFP报告基因监测VSV病毒感染CRFK细胞的情况使得抗病毒活性检测更加方便、灵敏、准确。
本研究中首先对其信号肽序列进行了改造,预测信号肽切割特异性在第23位有所提高,可能会提高表达产物的特异性、产量和分泌效率,进而提高表达产物的抗病毒活性;利用病毒复制缺陷型杆粒快速构建了重组病毒并实现了猫ω-like干扰素在家蚕中的表达并检测具有高抗病毒活性,这为进一步开发生产相应的免疫和治疗药剂提供了条件。为了进一步的鉴定该干扰素的表达,后期可以进行相应的免疫印迹检测,以及采用动物实验检测该产物在动物个体上对相应病毒病的治疗效果。
[1] Gresser I. Interferon: An unfolding tale [J]. J. Interf. Cytok. Res., 2007, 27(6): 447-452.
[2] Isaacs A, Lindenmann J. Virus interference. I. The interferon [J]. Proc. Royal Soc. London Series B: Biol. Sci., 1957, 147(927): 258-267.
[3] Nakamura N, Sudo T, Matsuda S,etal.. Molecular cloning of feline interferon cDNA by direct expression [J]. Biosci. Biotechnol. Biochem., 1992, 56(2): 211-214.
[4] National Institute of Agrobiological Sciences. Annual Report 2005[R]. Tsukuba Ibaraki, 2005.
[5] Yasukawa K, Saito S, Kubo T.etal.. Low-dose recombinant canine interferon-gamma for treatment of canine atopic dermatitis: An open randomized comparative trial of two doses [J]. Veter. Dermatol., 2010, 21(1): 42-49.
[6] de Mari K, Maynard L, Eun H M,etal.. Treatment of canine parvoviral enteritis with interferon-omega in a placebo-controlled field trial [J]. Veter. Record, 2003, 152(4): 105-108.
[7] 韩久全. 猫干扰素-ω治疗犬细小病毒感染 [J]. 中国动物保健, 2000,5: 15.
[8] Nakamura N, Sudo T, Ueda Y,etal.. Molecular cloning of feline interferon cDNA by direct expression and its mass production using silkworm[R]. In:Biochemical Engineering for 2001[C]. Springer, 1992, 31-34.
[9] 许秋香, 刘 娜, 刘 了, 等. 猫干扰素基因的克隆表达及其活性测定 [J]. 中国兽医杂志, 2007,9: 6-8.
[10] 张志芳, 李轶女, 易咏竹, 等. 表达多外源基因的昆虫生物反应器及其构建方法和应用[P]. 中国: CN102286534A, 2011.
[11] Ueda Y, Sakurai T, Yanai A. Homogeneous production of feline interferon in silkworm by replacing single amino acid code in signal peptide region in recombinant baculovirus and characterization of the product [J]. J. Veter. Med. Sci., 1993, 55(2): 251-258.
[12] Summers M D, Smith G E. A manual of methods for baculovirus vectors and insect cell culture procedures[R]. Texas Agricultural Experiment Station, 1987.
[13] Ge J, Wen Z, Wang X,etal.. Generating vesicular stomatitis virus pseudotype bearing the severe acute respiratory syndrome coronavirus spike envelope glycoprotein for rapid and safe neutralization test or cell-entry assay [J]. Ann. New York Acad. Sci., 2006, 1081: 246-248.
[14] Jarvis D L. Baculovirus-insect cell expression systems [J]. Methods Enzymol., 2009, 463: 191-222.
[15] Dojima T, Nishina T, Kato T,etal.. Comparison of the N-linked glycosylation of human beta-1,3-N-acetylglucosaminyltransferase 2 expressed in insect cells and silkworm larvae [J]. J. Biotechnol., 2009, 143(1): 27-33.
[16] Ono C, Ninomiya A, Yamamoto S,etal.. Innate immune response induced by baculovirus attenuates transgene expression in mammalian cells [J]. J. Virol., 2014, 88(4): 2157-2167.
[17] 王鸿宾. 猫干扰素FeIFN-ω和FeIFN-α的克隆、表达和体外生物学活性研究[D]. 四川雅安: 四川农业大学,硕士学位论文, 2008.
Expression and Antiviral Activity Detection of Feline Interferon ω-like in Silkworm
LIU Xing-jian1, YANG Xin1, ZHANG Zhi-fang1, LI Yi-nv1, YI Yong-zhu2, HU Xiao-yuan1*
1.BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China;2.SericulturalResearchInstitute,CAAS,JiangsuZhenjiang212018,China
Interferon is used for treating viral infectious diseases and enhancing vaccine efficacy in stockbreeding and pet healthcare. In this study, recombinant feline interferon ω-like (FeIFN ω-like) was expressed in silkworm using baculovirus expression vector system. The FeIFN ω-like gene was artificially synthesized after optimization. The optimized gene was first cloned into pVL1393 transfer vector, then inserted into BmNPV downstream the polyhedron promoter using co-transfection with BmBacmid DNA. The silkworm was infected by recombinant BmNPV to express the protein. Micro cytopathogenic effect inhibition assay in CRFK cell/VSV-GFP system was used to test the bioactivity of FeIFN ω-like. The antiviral activity assay indicated that the product in hemolymph exhibited antiviral activity that exceeded 4.53×106IU/mL. The results was expected to provide reference for new animal vaccine research.
feline interferon ω-like; silkworm; baculovirus expression system; antiviral activity
2015-05-28; 接受日期:2015-08-24
国家863计划项目(2011AA100603);国家973计划项目(2012CB114600);甘肃省科技重大专项项目(143NKDA019)资助。
刘兴健,博士研究生,研究方向病毒分子生物学。E-mail:liuxingjian87@gmail.com。*通信作者:胡小元,副研究员,研究方向为杆状病毒表达系统。E-mail:huxiaoyuan01@caas.cn
10.3969/j.issn.2095-2341.2015.06.07

