银柴胡离体培养与毛状根诱导技术初步研究
胡海英, 吴晓玲
1.宁夏大学科技处, 银川 750021;2.宁夏大学生命科学学院, 银川 750021
银柴胡离体培养与毛状根诱导技术初步研究
胡海英1, 吴晓玲2
1.宁夏大学科技处, 银川 750021;2.宁夏大学生命科学学院, 银川 750021
以银柴胡茎段为外植体,经消毒获得无菌再生材料后,筛选发根农杆菌介导毛状根诱导产生的最适条件。结果显示:最适的无菌消毒方法为:70%酒精浸5 s,0.1%升汞消毒3 min,获得了银柴胡离体培养材料;以发根农杆菌A4菌株介导的银柴胡毛状根诱导过程中,与叶片和不带腋芽茎段相比,带腋芽茎段为最适转化外植体,用OD600=0.8的菌液侵染茎段15 min,共培养3 d,800 mg/L头孢噻肟钠除菌,其诱导率及诱导密度最高,分别为100%和4.7,为最适诱导条件。研究结果说明在适合条件下,银柴胡带腋芽茎段适于诱导毛状根。
银柴胡;离体培养;发根农杆菌;毛状根;诱导
银柴胡(StellariadichotomaL. var.laceolataBge)别名银胡、山菜根,是被子植物石竹科(Garyophyllaceae)繁缕属(Stellaria)多年生草本植物,属于宁夏的道地性中药材,根入药,性微寒味甘,无毒,归肝经胃经,具有清虚热、除疳热等功效[1]。近年来随着对其活性成分甾体类、皂苷类、环肽类的深入研究,发现银柴胡根提取物具有解热、抗炎、抗动脉粥样硬化、抗变态反应等作用[2]。随着对银柴胡开发的不断深入,国内外需求量大增,其野生资源已近枯竭,而人工栽培技术还不够成熟,栽培生长周期较长,难以达到推广种植的目的,产量远不能满足市场的需求[1~3]。通过组织培养等无性繁殖技术培育中药材可以保证其优良的性状及遗传稳定性,并能缩短生产周期。吴晓玲等[4,5]筛选出了诱导银柴胡愈伤组织的最佳培养基配方,并对其细胞培养调控条件进行了研究。毛状根(hairy roots)是发根农杆菌(Agrobacteriumrhizogenes)感染植物后,在植株创伤表面诱导产生的一种特殊表现型,其生长速度快,遗传稳定性强,因此,毛状根培养技术在一些价格高、产量低、需求量大的药物成分研究方面应用广泛[6,7]。国内外目前已有近百种药用植物成功诱导出了毛状根,部分已建立了长期的毛状根培养系统并获得了次生代谢产物[8~13]。但目前利用此项技术进行银柴胡毛状根诱导培养方面的研究还未见报道。本文利用发根农杆菌诱导银柴胡不同外植体产生毛状根,筛选出了适合的诱导培养条件和方法,为银柴胡毛状根的大量培养和有效成分利用提供前期实验参考。
1 材料与方法
1.1 材料
银柴胡种子由宁夏大学生命科学学院彭励教授提供;发根农杆菌A4菌株购自中国农业科学院农业资源与农业区划研究所。
1.2 方法
1.2.1 银柴胡无菌苗的获得 将银柴胡种子种植于花盆内,种子发芽获得带4~5个叶腋的幼苗,用洗衣粉水反复冲洗,再用蒸馏水冲洗2~3次,用无菌水反复浸泡12 h以上。在超净工作台上,将幼苗切段,用0.1%的升汞和70%的酒精配合消毒后,切成0.5~1 cm带叶茎段,接种在MS+1.0 mg/L 6-BA+0.2 mg/L NAA培养基上,诱导不定芽分化,待腋芽长至3~4 cm,将其切下,再接种在MS+0.5 mg/L IBA培养基上诱导生根,获得银柴胡组培无菌苗。光照16 h/d,光照强度2 000 lx,温度25±1℃。
1.2.2 发根农杆菌的活化 活化培养采用YEB培养基,成分为:蛋白胨5 g/L、酵母粉5 g/L、蔗糖5 g/L、MgSO42 mmol/L,pH 7.2。活化时将A4菌株在YEB培养基上划线,28℃培养,直到长出单个菌落。挑取单菌落于5 mL YEB培养液中,120 r/min震荡36 h,按1%的量将摇好的菌液接种于YEB培养液中,继续培养至OD600为0.6~0.8。
1.2.3 抗菌素的筛选 将已经活化好的发根农杆菌A4菌株分别接种于含不同浓度(1 000 mg/L、800 mg/L、600 mg/L)的头孢塞污钠和不含头孢塞污钠的MS固体培养基上,7 d后观察筛选最适的抗菌素浓度。
1.2.4 转化外植体和共培养时间的筛选 转化用菌液于6 000 r/min离心5 min,弃上清液,用MS液体培养基悬浮,使其OD600=0.8。无菌条件下,将银柴胡无菌苗叶片、带腋芽茎段和不带腋芽茎段分别切成0.5~1 cm的小段,将材料小心地划些伤口平放于MS+0.5 mg/L IBA培养基中预培养,预培养2 d后,菌液侵染15 min,共培养2~3 d。预培养条件:暗培养,温度25±1℃。共培养条件:每天光照16 h,光照强度2 000 lx,温度25±1℃。
1.2.5 菌液浓度和侵染时间的筛选 预培养的植物材料分别放入4种不同浓度的菌液(OD600分别为0.6、0.8、1.0、1.2)中进行侵染,设计不同的侵染时间,分别为5 min、10 min、15 min和20 min,侵染后,取出外植体置于MS固体培养基共培养,以未感染的茎切段作对照。同时以激素诱导离体根为对照(培养基:MS+1.0 mg/L 6-BA+0.2 mg/L NAA)。共培养3 d后,除菌培养3~5次,30 d后统计。光照时间16 h/d,光照强度2 000 lx,温度25±1℃。
1.3 数据统计
腋芽发生率(%)=发出腋芽的外植体数/接种的外植体总数×100%;污染率(%)=污染的培养基瓶数/接种的培养基总瓶数×100%;毛状根诱导率=产生毛状根外植体数/总外植体数×100%;毛状根诱导密度=产生毛状根的总数/产生毛状根的外植体数。采用方差分析法分析培养条件对银柴胡毛状根诱导率的影响。
2 结果与分析
2.1 银柴胡外植体无菌消毒方法的选择
本研究预试验发现,银柴胡种子无菌播种发芽率极低,且容易污染,不易得到无菌苗,影响后续试验的进行。故采用栽培幼苗作为外植体,因银柴胡幼苗嫩弱,消毒后幼苗基本脱水死亡。由表1可知,最适0.1%升汞和70%酒精结合消毒的条件为:70%酒精中浸5 s(或者不浸),0.1%升汞消毒3 min,然后立即用无菌水冲洗4~5次,培养材料污染率能控制在30%以下,腋芽发出率达50%。
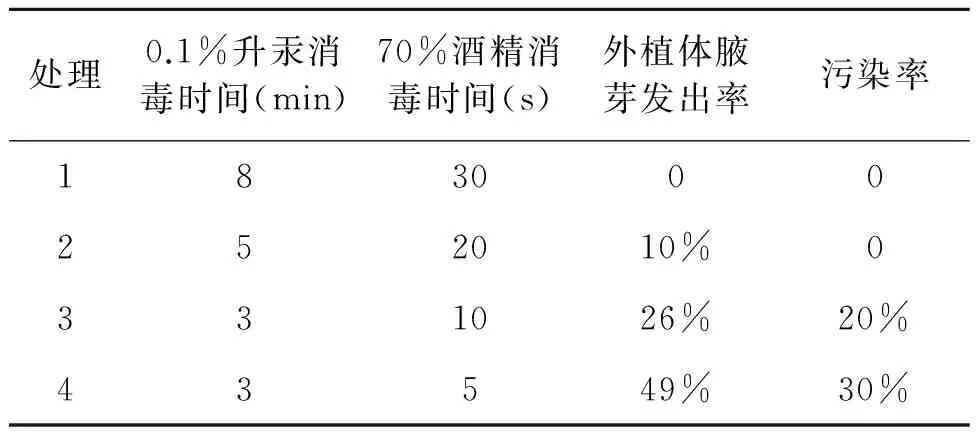
表1 银柴胡外植体最适消毒条件
2.2 银柴胡不同外植体诱导毛状根的效果比较
采用叶片、带腋芽茎段和不带腋芽茎段作为外植体,比较毛状根的诱导效果,结果(表2,图1,彩图见图版一)表明,发根农杆菌介导的银柴胡带腋芽茎段毛状根的诱导率最高,达100%,诱导密度为4.7,且有侧芽长出;不带腋芽茎段为外植体时,其诱导率为12.5%,诱导密度为2.1,出现毛状根时间晚,无明显分枝,生长缓慢;而叶片诱导率为0,无毛状根出现,叶片逐渐变软,变黄,最终死亡。因此,银柴胡带腋芽茎段为最佳外植体。
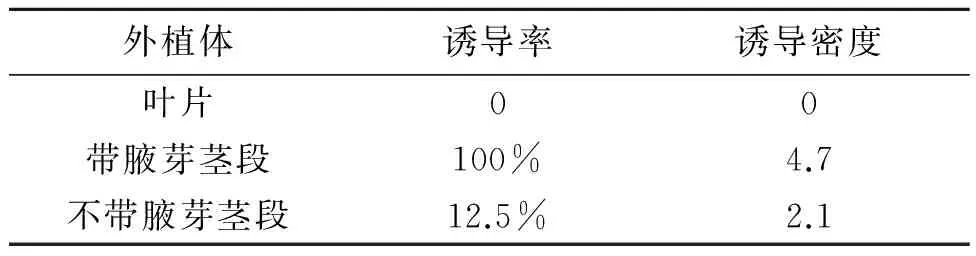
表2 银柴胡不同外植体诱导毛状根的效果比较
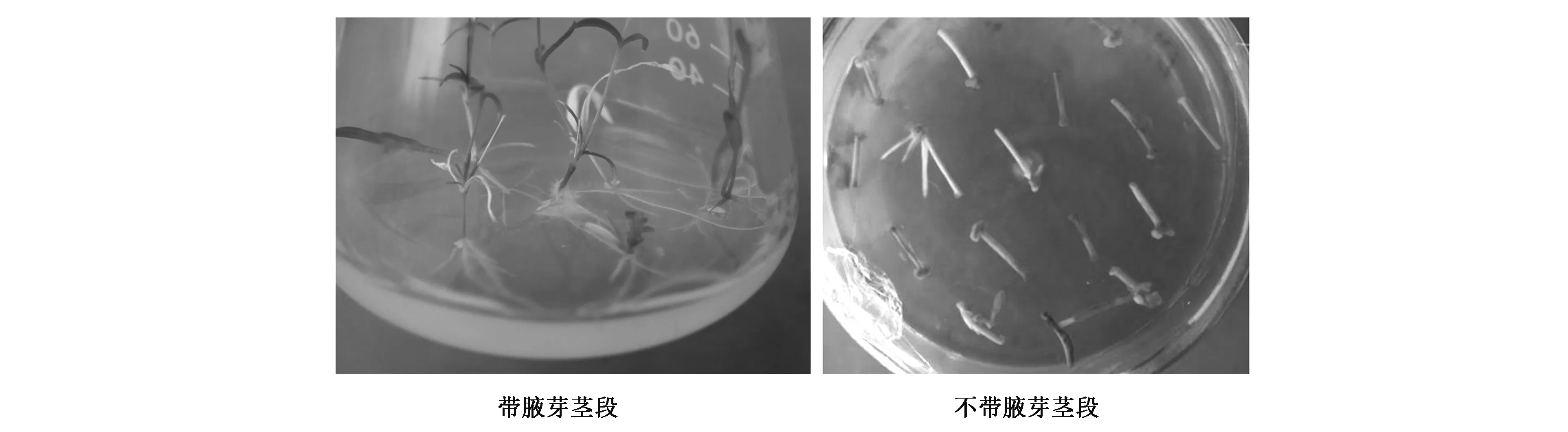
图1 发根农杆菌诱导茎段产生的毛状根
2.3 共培养时间对银柴胡毛状根诱导的影响
在创伤部位生存8~16 h之后的菌株才能诱发毛状根,因此筛选合适的农杆菌与外植体共培养时间也是非常重要的环节。将银柴胡带腋芽茎段与菌液共培养不同时间后发现,共培养3 d,毛状根诱导率最高,为51%(表3)。共培养时间过短,诱导率低;共培养时间过长,会促进农杆菌的过度生长而使植物细胞受到毒害,使外植体生活力下降,诱导率也下降,且对除菌培养造成困难,因此,共培养3 d为最适选择。
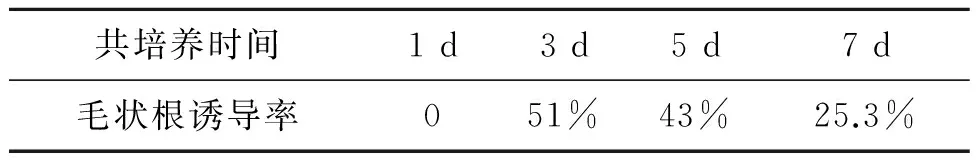
表3 不同共培养时间对银柴胡毛状根诱导的影响
2.4 菌液浓度与侵染时间对银柴胡毛状根诱导的影响
银柴胡带腋芽茎段发根诱导率随侵染时间和侵染菌液浓度的不同发根效果不同。如表4所示,在浓度为OD600=0.8的菌液侵染15 min后,共培养3 d,毛状根诱导率最高,达100%,诱导密度最高为4.7。方差分析结果(表5)可知侵染菌液浓度组间无显著差异,侵染时间的F=4.720(P<0.05),差异显著。结果显示,侵染时间超过10 min后,毛状根的诱导率都显著降低,说明侵染时间延长,菌液对外植体会造成负面影响,导致毛状根诱导率降低。诱导的毛状根(图2,彩图见图版一)具有大量的白色发状根,分支多,贴壁向上或者沿着培养基水平生长,失去向地性。含激素培养基(MS+1.0 mg/L 6-BA +0.2 mg/L NAA)诱导生根数量少,伸长生长不明显,容易褐化,生根率只有26.7%。
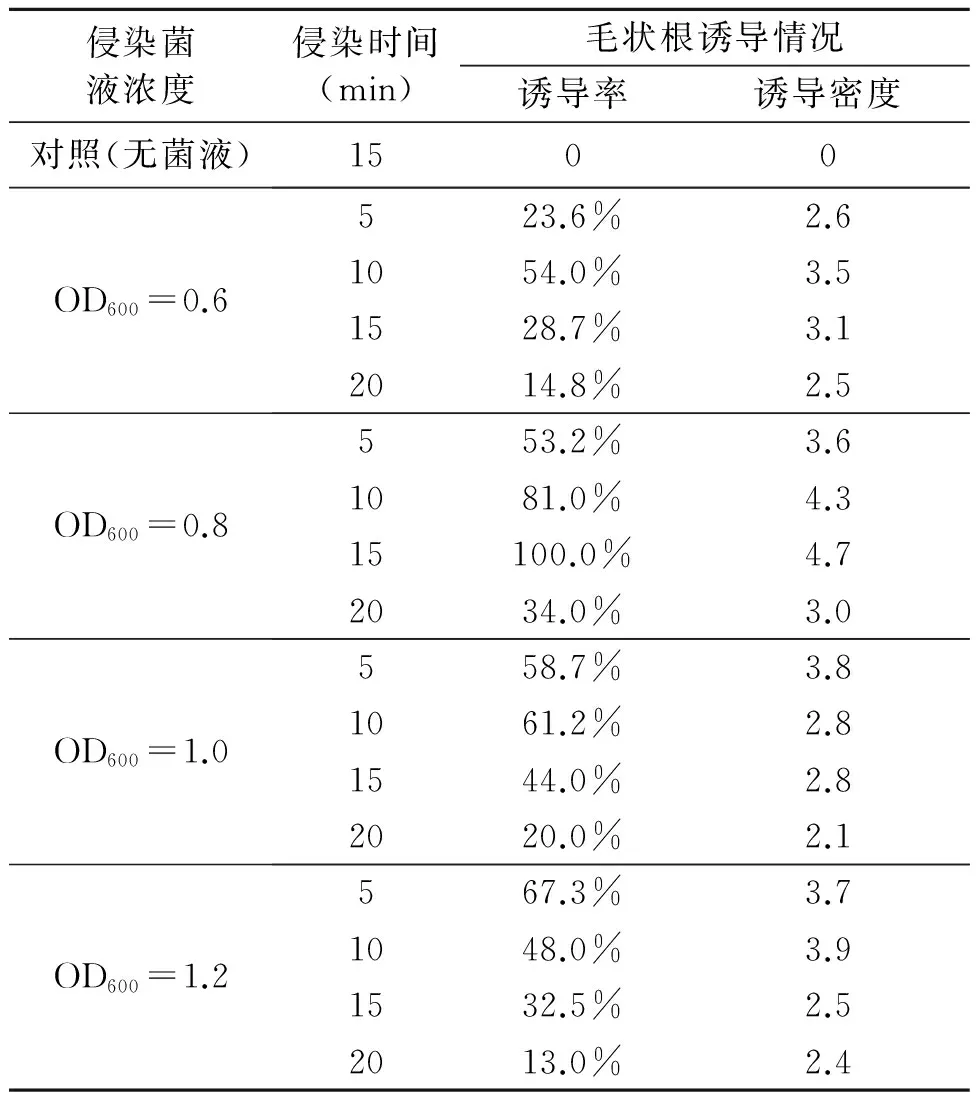
表4 不同侵染菌液浓度与侵染时间对银柴胡毛状根诱导产生的影响
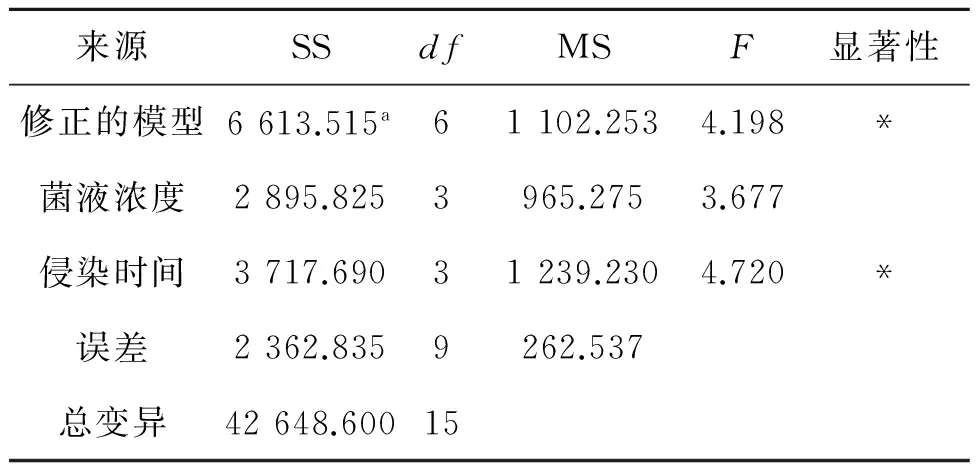
表5 方差分析结果
注:a.R2=0.737(调整的R2=0.561);*表示P<0.05水平上差异显著。
2.5 最适抗菌素浓度的筛选
不同浓度头孢噻肟钠除菌效果不同,培养7 d之后,在不含抗菌素的YEB平板上,发根农杆菌生长良好(图3A,彩图见图版一),而在含有头孢噻污钠的YEB平板上,未见生长(图3B)。培养14 d后,抗菌素浓度达1 000 mg/L对植物材料生长有影响,含600 mg/L抗菌素的平板上肉眼可见菌落,含800 mg/L抗菌素的平板上未见菌落,植物材料生长正常。因此,选择800 mg/L为最适抗菌素除菌浓度。
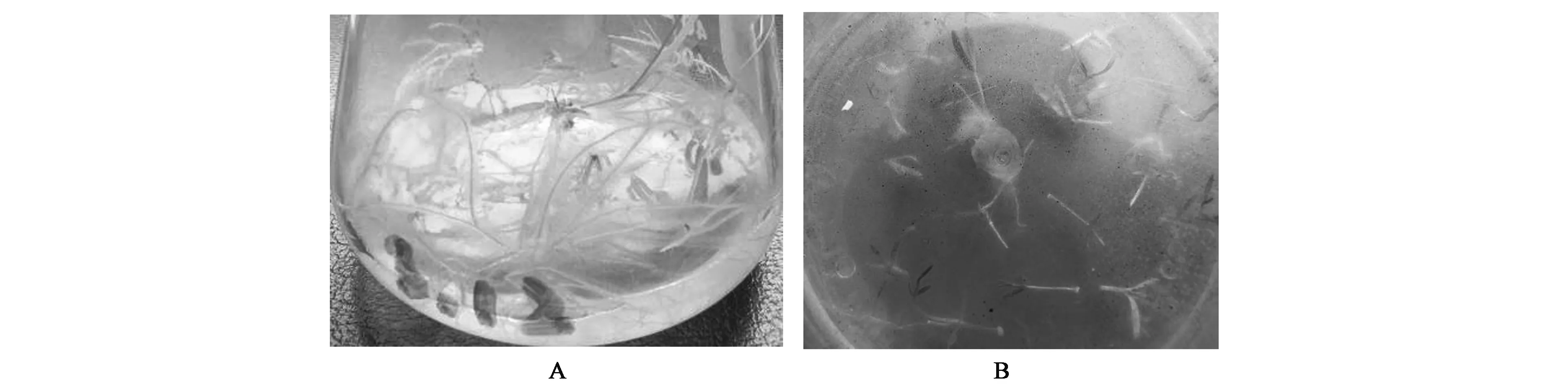
图2 发根农杆菌(A)与植物激素(B)诱导毛状根的生长效果

图3 不含抗菌素(A)和含抗菌素(B)的发根农杆菌抑菌效果比较
3 讨论
已有研究发现,在毛状根诱导过程中,侵染部位对转化效果的影响最大,而菌液浓度、侵染时间是影响转化的次要因素[6,9~17]。侵染部位多为叶片、茎段和下胚轴,且材料越幼嫩其转化效果越好[12,14~17]。本文所采用的侵染材料中,叶片细长幼嫩,但无毛状根产生,可能是转接操作对材料有一定的伤害,造成材料失去活性而无转化效果;不带腋芽茎段也存在同样问题,侵染后材料生活力不够导致转化效果不明显;带腋芽茎段的离体培养可能是由于去掉顶端优势促进了腋芽萌发,生活力较强,使茎段切割处的植物细胞分裂活跃,易于农杆菌的感染和转化。因此,本文研究中只有带腋芽茎段适合毛状根的诱导。
在菌液浓度、侵染时间和共培养时间3个影响因素的筛选试验过程中,已有的研究报道中有不同的结果,李景滨等[14]研究发现,菌液OD600=0.8左右时,金铁锁毛状根的诱导效果最佳,与本文研究结论一致;孙晶等[9]研究表明,北柴胡毛状根诱导的最佳侵染时间为20 min,与本文得到适于银柴胡毛状根诱导的最佳侵染时间为15 min有偏差。因此,研究对象、使用菌株及外植体等条件的不同会使转化条件略有不同,大多数药用植物[6,9~18]毛状根的诱导过程中其发根农杆菌菌液浓度在OD600= 0.6~0.8、侵染时间为10~25 min、共培养时间为2~4 d。
[1] 叶 方,杨光义,王 刚,等. 银柴胡的研究进展[J].医药导报,2012 ,31(9):1174-1177.
[2] 杨敏丽, 赵彦贵.宁夏银柴胡挥发性成分的分析[J]. 青岛科技大学学报:自然科学版, 2007,28(2):113-114,128.
[3] 杨小军,丁永辉.银柴胡资源及其可持续利用的研究[J].中药材,2004,27(1):7-8.
[4] 邓光存, 彭 励, 杨彩荣,等.不同激素对银柴胡细胞生长及营养成分消耗的影响[J]. 干旱地区农业研究,2006, 24(6):107-111.
[5] 吴晓玲,邓光存,邱智杰.银柴胡愈伤组织诱导技术的研究[J].宁夏大学学报:自然科学版,2005,26(3):271-273.
[6] 胡海英,吴晓玲,严秀蕊.老瓜头离体根与毛状根的诱导培养[J]. 江苏农业科学, 2010,6: 89-91.
[7] 罗成科,彭正松,蒲利民.发根农杆菌介导的药用植物遗传转化[J].生物技术,2004,14(11):58-61.
[8] 张 萌,高 伟,王秀娟.药用植物毛状根的诱导及其应用[J].中国中药杂志,2014,39(11):1956-1960.
[9] 孙 晶,徐洁森,赵立子,等.北柴胡毛状根诱导及其植株再生体系的建立[J]. 药学学报,2013, 48(9): 1491-1497.
[10] 罗 丽,周正渝.刺五加毛状根诱导条件的研究[J].中国农学通报,2013,29(10):178-181.
[11] 闫晓慧,胡世俊,谈 锋.狭叶松果菊的毛状根诱导及培养[J].时珍国医国药,2013,24(8):1990-1992.
[12] 赵 爽,郑妍研,谢 晖.钱子刚金铁锁毛状根诱导的初步研究[J].中药材,2012,35(2):176-179.
[13] Yoshlkawa T,Furaya T. Saponlin production by cultures ofPanaxginsengtransformed withAgrobacteriumrhyzogenes[J]. Plant Cell Rep.,1987,6:449-453.
[14] 李景滨,刘同祥,王培忠,等.金铁锁毛状根诱导及培养体系的建立[J].中国中药杂志,2011,36(5): 547-550.
[15] 黄伟剑,何梦玲,张宏意,等.发根农杆菌诱导广藿香毛状根的研究[J].广东药学院学报,2015,31(2):1-5.
[16] 郭生虎,王敬东,马洪爱.乌拉尔甘草毛状根的诱导及培养体系的建立[J].西北农业学报,2012,21(12):138-141.
[17] 刘连旺,张永清,祁建军,等.地黄毛状根的诱导及条件优化[J].山东农业科学,2015,47(1):47-50.
[18] 张 萌,高 伟,王秀娟.药用植物毛状根的诱导及其应用[J].中国中药杂志,2014,39(11):1956-1960.
Studies on Isolated Culture and Hairy Roots Inducing ofStellariadichotomaL. var.laceolataBge
HU Hai-ying1, WU Xiao-ling2
1.ScienceandTechnologyDepartment,NingxiaUniversity,Yinchuan750021,China;2.LifeScienceCollege,NingxiaUniversity,Yinchuan750021,China
In this study, stems ofStellariadichotomaL. var.laceolataBge as explants were sterilized, and sterile culture material were acquired. Then its hairy roots were induced byAgrobacteriumrhizogenesA4 with Ri-plasmid. Results showed the method that the explants was soaked in 70% alcohol for 5 s and in 0.1% HgCl2for 3 min, was the optimal sterilized method, so sterile culture material were acquired. During the induction byAgrobacteriumrhizogenesA4, comparing with the leaves and stems with no axillary bub taking the stems with axillary bud was the best explant for transformation. The induction rate and the density was 100% and 4.7, respectively, when the stems with axillary bud were infected for 15 min and co-cultured for 3 days withAgrobacteriumrhizogenes(OD600=0.8), and sterilized by 800 mg/L cefotaxime sodium. So these were the optimized factors, and the stems with axillary bud were the optimized explants for transformation.
StellariadichotomaL. var.laceolataBge; isolated culture;Agrobacteriumrhizogenes; hairy roots; induction
2015-05-22; 接受日期:2015-06-12
宁夏自然科学研究基金项目(NZ13034)资助。
胡海英, 副教授,研究方向为植物生物技术。E-mail:haiying@nxu.edu.cn
10.3969/j.issn.2095-2341.2015.06.06

