海生红藻多管藻中藻胆蛋白的分离纯化
郭凝,王玉,赵明日,龚雪琴,孙力
海生红藻多管藻中藻胆蛋白的分离纯化
郭凝,王玉,赵明日,龚雪琴,孙力
(烟台大学生命科学学院,山东烟台264000)
选用Middle Fine Sephadex G-150(MFG-150)、Fine Sephadex G-150(FG-150)以及Sephacryl S-300(S-300)3种凝胶过滤对富含R-藻红蛋白(R-PE)的多管藻藻胆蛋白提取液进行R-PE、R-藻蓝蛋白(R-PC)和别藻蓝蛋白(AP)的分离,并对所得R-PE、R-PC/AP组分用DEAE Sepharose-Fast Flow离子交换层析做进一步纯化,优化建立了从多管藻藻胆蛋白提取液中同时有效分离纯化R-PE、R-PC和AP 3类藻胆蛋白组分的技术方法.
层析;聚丙烯酰胺凝胶电泳;多管藻;藻红蛋白;藻蓝蛋白;别藻蓝蛋白
藻胆蛋白是广泛存在于蓝藻、红藻、部分隐藻中的一类水溶性的色素蛋白[1-2],主要功能是捕获和传递光能,使光合作用得以发生[3].根据其光谱特性,主要分为藻红蛋白、藻蓝蛋白、别藻蓝蛋白和藻红蓝蛋白[4-5].作为荧光探针与光敏化剂,藻胆蛋白在生物、医学荧光标记分析与光敏化抗肿瘤研究等方面应用广泛[6-8],无毒及鲜亮的颜色也使其在食品和化妆品中得以应用[9-10].藻胆蛋白在各领域应用的进展依赖于对其结构和光谱特性的全面了解[11],因此藻胆蛋白的分离纯化一直是国内外关注的研究内容[12].在红藻藻胆体中,藻红蛋白(R-phycoerythrin,R-PE)、藻蓝蛋白(R-phycocyanin R-PC)和别藻蓝蛋白(allophycocyanin AP)总量的相对比例可高达(6~8)∶1∶1,这使R-PE对RPC,尤其是AP的分离纯化产生很大干扰,成为迟滞国内外海生大型红藻藻胆体,尤其是“核”结构域及藻蓝、别藻蓝蛋白结构与功能研究的瓶颈因素[13-15].
藻胆蛋白分离纯化的方法最早由Glazer和 Fang基于分离血红蛋白亚基的方法而创立[16-17].目前,在多管藻Polysiphonia urceolata藻胆蛋白的相关研究中所用的分离纯化方法各有不同.例如:使用DEAE Sepharose-Fast Flow离子交换层析一步制备R -PE[18];用羟基磷灰石和凝胶过滤层析分离纯化R -PE[19]和R-PC[20];用DEAE离子交换纤维素和凝胶过滤分离纯化R-PE[21].第一步选用结合性层析虽然有通量大的优点,但由于高含量R-PE对R -PC尤其是AP组分的影响,很难同时跟踪到RPE、R-PC及AP分离组分,实现3类藻胆蛋白的同时分离纯化.
根据六聚体(αβ3Υαβ3)R-PE(240 ku)与三聚体(αβ3)R-PC(136 ku)或AP的分子大小差别,先顺序使用3种类型的凝胶过滤分离多管藻中的RPE和R-PC/AP,可以从高含量R-PE、低含量R -PC和AP的藻胆蛋白提取液中非常有效地制备出R-PE和R-PC/AP组分.这为R-PE,尤其是R-PC和AP的进一步纯化创造了有利条件[14].以本实验室前期研究工作[14-15,21-23]为基础,本研究选用2种Sephadex G-150凝胶过滤从多管藻藻胆蛋白提取液中分离R-PE和R-PC/AP组分,选用DEAE Sepharose-Fast Flow离子交换层析分别从凝胶过滤所得R-PE及R-PC/AP组分中进一步纯化制备R-PE、R-PC及AP组分,建立同时进行R -PE、R-PC及AP 3类藻胆蛋白分离纯化的层析技术方法.所建立的技术方法可用于海生大型红藻R-PE、R-PC及AP的有效分离与纯化,有利于促进大型红藻藻胆蛋白,尤其是低含量R-PC和AP的结构功能研究.
1 材料与方法
1.1 材料
实验选用的多管藻(Polysiphonia urceolata Grev)是一种生活在较低温度(5~15℃)环境中、烟台当地海域易于采集的海生大型红藻.多管藻藻体为红褐色,长丝状,手感滑腻,密集丛生,呈毛发状.多生长于低潮带的岩石或盐沼地带,每年2月-4月为其生长旺期.
1.2 实验方法
1.2.1 藻胆蛋白样品制备样品的前期处理与王玉在前期报导中所使用的方法类似[14],将采集的新鲜多管藻用海水洗净,经过磷酸缓冲液浸泡,抽滤、离心取上清液,使用超滤膜包截留、滤出部分杂蛋白并将提取液浓缩至一定浓度后避光、冷藏保存,用于凝胶过滤.
1.2.2 凝胶过滤层析R-PC组分的凝胶过滤选用2种颗粒大小不同的葡聚糖凝胶(5~300 ku): Middle Fine Sephadex G-150(MFG-150)和Fine Sephadex G-150(FG-150)(柱床3.7 cm×58 cm)进行多管藻藻胆蛋白提取液中R-PE与R-PC/ AP组分的分离.
R-PE组分的凝胶过滤选用2种分子大小分离范围不同的MFG-150与Sephacryl S-300(S-300)(10~1 500 ku、4 cm×58 cm)进行,以除去RPE组分中所含的分子较大的杂质.
凝胶过滤时用280 nm光吸收(A280)实时检测、记录洗脱曲线.通过分部收集样品在498 nm、618 nm和650 nm的光吸收跟踪、检测R-PE、R-PC和AP.根据洗脱曲线,以A498/A618和A565/A280值为参照,收集完整洗脱峰内的R-PE、R-PC/AP组分,并用50 ku超滤膜包将所得样品浓缩至A498>16、A618>4.5.避光、冷藏保存浓缩R-PE、R-PC/AP样品,用于R-PE、R-PC/AP的进一步分离纯化.
1.2.3 离子交换层析选用DEAE Sepharose-Fast Flow离子交换层析,分别对凝胶过滤收集的RPE、R-PC/AP样品进行纯化.
R-PC/AP离子交换层析的条件与曲艳在前期报导中所使用的方法类似[23].柱床为1.2 cm×5.0 cm,以7.5~8 cm/h流速、A618>2的样品10 mL上样,15.5~16 cm/h流速洗脱,所用NaCl梯度范围为50~200 mmol/L.
R-PE离子交换层析使用50 mM PBS缓冲液平衡柱床(2.0 cm×7.0 cm),以4.5~5 cm/h流速、A498>4的样品20 mL上样,9.5~10 cm/h流速洗脱,所用NaCl梯度范围为0~250 mmol/L.
离子交换层析时用280 nm光吸收(A280)实时检测、记录洗脱曲线.通过分部收集样品在498 nm、618 nm和650 nm的光吸收跟踪、检测R-PE、RPC、AP.参照A565/A280、A498/A618和A618/A650值,收集完整洗脱峰内的R-PE、R-PC和AP组分.用50 ku超滤膜包将所得样品浓缩至A498>16、A618>7.避光、冷藏保存浓缩R-PE、R-PC和AP样品.
1.2.4 光谱测定用UV-1900型紫外可见分光光度计,在pH 7.0磷酸缓冲液中检测各分离纯化阶段样品在498 nm、618 nm、650 nm光吸收值,并测定得样品在250~750 nm的吸收光谱.
1.2.5 凝胶电泳藻胆蛋白Aλmax与A280的比值,是纯化标准之一.R-PE与R-PC的纯度除了反映在A565/A280和A618/A280的比值上,还需通过非变性聚丙烯酰凝胶电泳(Native-PAGE)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行验证.
Native-PAGE的实验方法与王玉在前期报导中的方法[24]类似,选择Bis-Tris Hepes的电泳体系,稳流方式电泳.电泳结束后,用UVP-Biospectrum Imaging System凝胶成像系统分别记录在365 nm紫外光下的荧光带与考染结果.
SDS-PAGE与赵明日在R-PE多肽组成分析中[25]的方法类似,选择Tris-HCl的电泳体系,分离胶浓度为13%与16%,分离胶缓冲液为0.8 mol/L与1.5 mol/L Tris-HCl,分别用来进行R-PE和R -PC的电泳.记录在365 nm紫外光下的荧光带与考染结果.
2 实验结果
2.1 藻红、藻蓝、别藻蓝蛋白组分的凝胶过滤分离
藻胆蛋白提取液(A498=7.51,根据R-PE在498 nm的光吸收系数K498=4.89mL/(mg· cm)[26],R-PE含量为1 536 μg/mL,A498/A618= 6.44)的MFG-150、FG-150凝胶过滤结果如图1所示.由A618和A650分别跟踪、检测的R-PC和AP 2种藻胆蛋白的洗脱曲线完全重叠(图1中b).RPE位于R-PC和AP组分的前面(图1中a).在R -PC和AP组分之后为小分子R-藻红蛋白(SRPE)[14](图1中c).
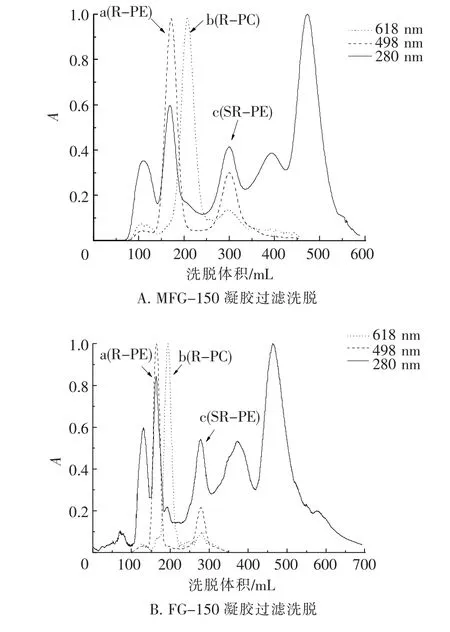
图1 藻胆蛋白提取液的凝胶过滤洗脱曲线Fig.1 Elution curves of the extracted phycobiliprotion gel filtration
如图1 A、B所示,与MFG-150相比,FG-150对R-PC/AP与R-PE、R-PC/AP与SR-PE有着更高的分离度,表明FG-150相比MFG-150对R-PE与R-PC/AP组分有着更好的分离效果,其中R-PC/AP组分更为明显.
为保证R-PC/AP组分的回收率,经2种G-150凝胶过滤得到的R-PC/AP组分中不可避免地仍会含有部分R-PE和SR-PE成分.因此,选择分离度相对较高的FG-150,对所收集的R-PC/ AP组分进行再次纯化(图2 A、B).
MFG-150和FG-150凝胶过滤所得R-PE组分中仍含有少量R-PC和分子大于R-PE的杂蛋白成分.在此,选择分离范围较大的S-300层析柱对所收集的R-PE组分进行再一次纯化(图2 C).
如图2 A、B所示,经FG-150凝胶过滤所得的R-PC/AP组分与经MFG-150凝胶过滤所得的R -PC/AP组分相比,在第2次FG-150凝胶过滤中,R-PE和SR-PE的峰值前者(图2 A)均比后者(图2 B)低.但从表1中可以看出,最终所得PC/ AP组分的A618/A280与A618/A498比值差别不大,说明2种纯化途径,G-150→FG-150和FG-150→FG -150,均可得到理想的R-PC/AP组分分离效果.与顺序使用MFG-150、S-300、S-200凝胶过滤[14]相比,本实验所得R-PC/AP组分的A618/A280与A618/A498比值(表1)均有提高,表明分离效率更高.
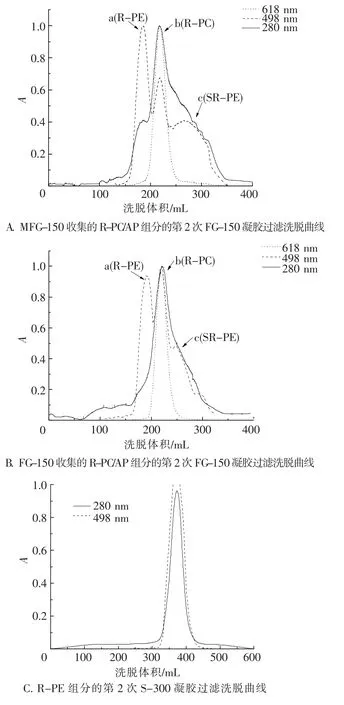
图22 种R-PC组分的FG-150凝胶过滤与R-PE组分的S-300凝胶过滤洗脱曲线Fig.2 Gel filtration elution curves of the two R-PC fractions on FG-150 gel and the R-PE fraction on
如图2 C所示,在R-PE组分的S-300洗脱曲线上没有表现明显出杂蛋白峰,但A565/A280比值从MFG-150/FG-150 R-PE组分的3.72/3.81增加到4.18(表1),表明仍有杂蛋白成分被除去.

表1 纯化流程中所收集的各个组分的光吸收变化Tab.1 The light absorption ratio variation of all fractions obtained in the purification process
2.2 藻红、藻蓝、别藻蓝蛋白组分的离子交换层析纯化
选用DEAE Sepharose-Fast Flow离子交换层析进行凝胶过滤所得R-PE、R-PC/AP组分的进一步纯化,实验结果如图3所示.
如图3 A所示,凝胶过滤所得R-PC/AP组分经梯度洗脱(50~200 mmol/L NaCl),分离出在618 nm有特征吸收的R-PC(图3 A中a)和在650 nm有特征吸收的AP(图3 B中b)2个组分.300 mmol/ L NaCl洗脱组分(图3 A中c)在650 nm与498 nm处均有吸收,但618 nm吸收相对较低.600 mmol/L NaCl洗脱组分(图3 A中d),在498 nm仍有较高吸收但在650 nm与618 nm处已几乎没有吸收.收集R-PC(图3 A中a)与AP(图3 A中b、图3 A中c)组分,光吸收比值列于表1中.
如图3 B所示,凝胶过滤所得R-PE组分在离子交换层析中只出现1个R-PE洗脱峰.300 mmol/L NaCl洗脱所得组分已没有明显的R-PE吸收.收集R-PE组分其光吸收比值如表1所示.
如表1和图4所示,经阴离子交换层析后的R -PE组分A565/A280>4.5,R-PC组分A618/A280>4.0,均已达到藻胆蛋白的纯化标准[23].但AP组分的吸收光谱(图4 C)表明其中仍含有R-PC和少量R-PE成分,说明单纯使用本实验中的层析方法还无法获取到纯度较高的AP组分[24].
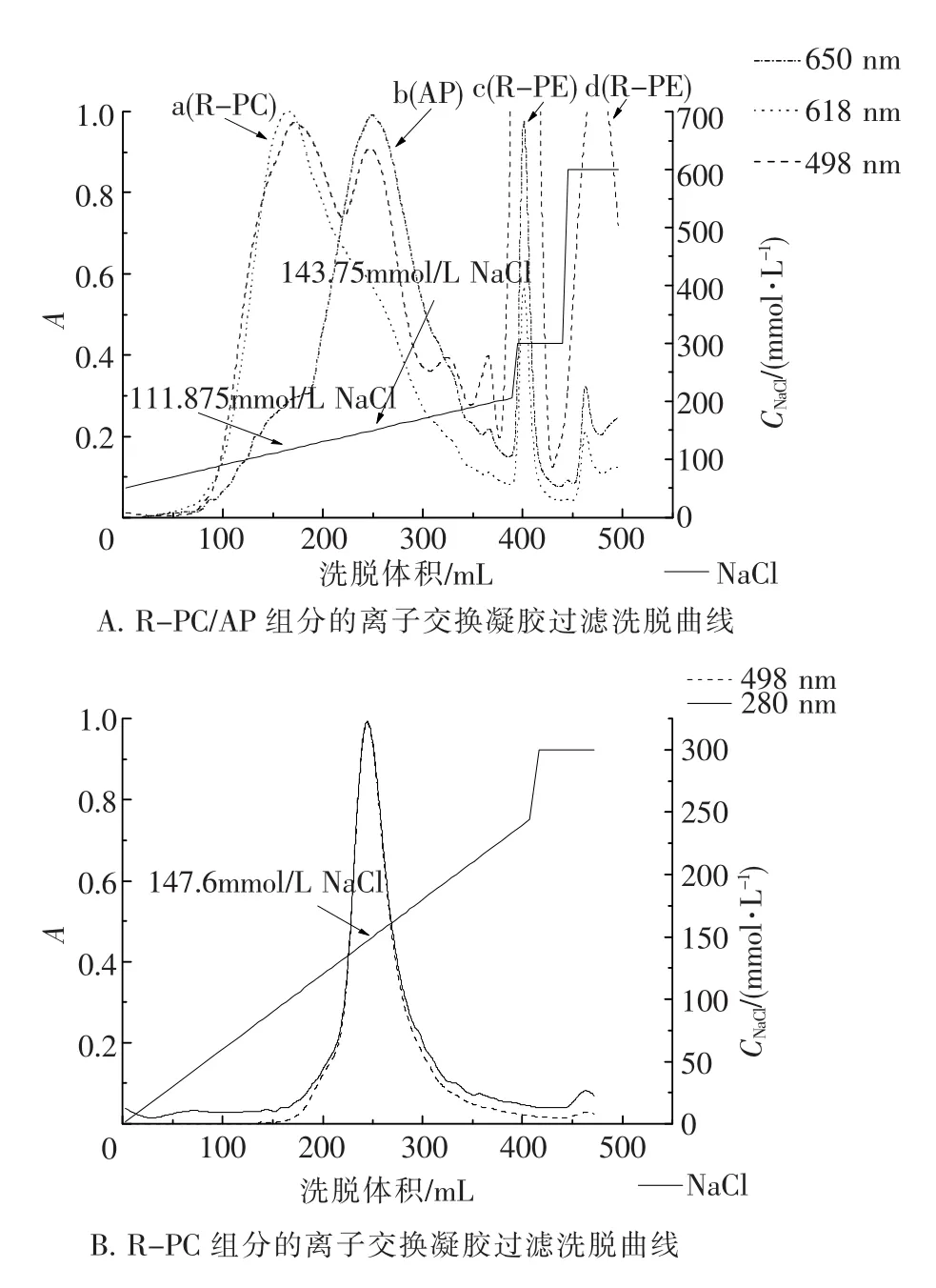
图3 R-PE与R-PC/AP组分的DEAE-Sepharose FF离子交换层析洗脱曲线Fig.3 Elution curves of the ion exchange chromatography of the R-PE and R-PC/AP fractions on DEAE-Sepharose FF
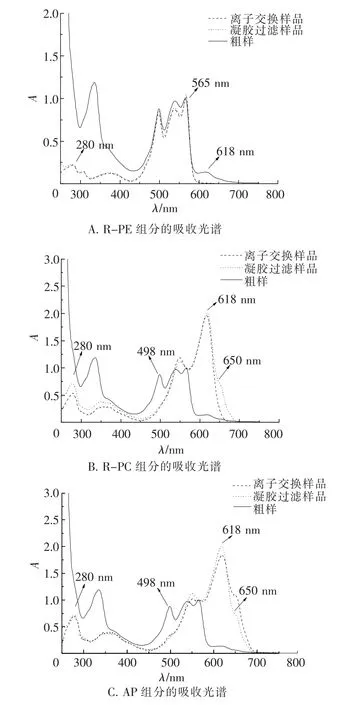
图4 分离纯化过程中所得各组分的吸收光谱变化Fig.4 The absorption spectrum variation of all fractions obtained in the purification process
2.3 藻胆蛋白组分的电泳分析
荧光结果如图5 A所示,藻胆蛋白提取液(泳道1)365 nm下有黄色和红色2条荧光带,其中R-PE的黄色荧光带较强,R-PC的红色荧光带较弱.泳道2的R-PC样品红色荧光带相比泳道1明显减弱,说明R-PC含量已经明显减小.泳道4粗样R -PC有明显的红色荧光带,说明已含有较高含量的R-PC.
考染结果如图5 B所示,藻胆蛋白提取液(泳道1)中含有较多在荧光结果中没有显示的无色条带,说明其含有较多无色杂蛋白.泳道3与泳道5中的纯化R-PE与R-PC与荧光结果相对应,没有其他条带,说明纯化后的R-PE与R-PC组分已有较高的纯度.

图5 藻胆蛋白提取液、凝胶过滤及离子交换所得R-PE与R-PC/AP组分的Native-PAGEFig.5 The Native-PAGE of the extracted phycobiliprotion solution and the fractions of R-PE and R-PC/AP from gel filtrations and ion-exchange chromatography
如图6所示,从锌染与考染结果的对比可以看出,两者的条带基本相对应,说明纯化后的R-PE与R-PC不存在其他无色多肽.电泳分析结果表明,经2次凝聚过滤和离子交换分离、纯化制备的R -PE和R-PC达到了用于其结构、功能研究的纯度要求.
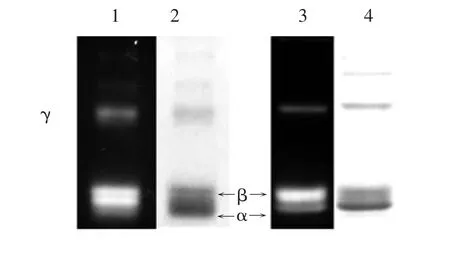
图6 纯化R-PE与R-PC组分的SDS-PAGEFig.6 The SDS-PAGE of the purified R-PE and R-PC
3 讨论
本研究选用了MFG-150和S-300、MFG-150和FG-150 2种不同的凝胶过滤层析剂,从富含R-PE的多管藻藻胆蛋白提取液中分离R-PE和R-PC/AP组分.结果(图1、2)证明,顺序使用MFG-150和S-300、MFG-150和FG-150进行2次凝胶过滤可以有效分离制备R-PE和R-PC/ AP组分.与选用MFG-150、S-300和S-200进行3次凝胶过滤分离制备R-PE和R-PC、AP组分[14]相比,所得R-PC/AP组分的光吸收比值,如A618/A280与A618/A498(表1)优于前者,且可省去1次凝胶过滤.MFG-150和FG-150组合有利于分离制备R-PC/AP组分的主要原因是细颗粒FG-150凝胶减小了层析样品带在层析过程中的纵向展宽,从而有效提高了柱效率和R-PE与R-PC/AP、R -PC/AP和S-R-PE之间的分离度.
以凝胶过滤分离所得R-PE和R-PC/AP组分为基础,用DEAE Sepharose-Fast Flow离子交换层析分别进一步分离纯化R-PE、R-PC和AP组分.实验结果(图3)表明,DEAE Sepharose-Fast Flow离子交换层析可以有效纯化制备R-PE、RPC和AP组分,而且光吸收比值(表1)、吸收光谱(图4)及凝胶电泳分析(图5、6)证明,离子交换层析制备的R-PE和R-PC成分具有较高的、符合藻胆蛋白结构功能研究和用作荧光探针的纯度.然而,所得AP组分仍含有R-PC和R-PE成分(图4 C).虽然所得AP组分由于总量小不适合再用层析纯化,但其所富含的AP成分已可以用非变性凝胶电泳进行有效制备[24].由各个步骤中所收集的R -PE与R-PC/AP组分特征吸收峰的吸光值与上样样品的该特征吸收峰的吸光值的比值所计算得出,R-PE、R-PC与AP的收集率约为28.8%、18.2%、22.5%.根据R-PE的光吸收系数[26]可以算出,每100 g多管藻中可纯化出约96 mg的RPE.
本研究以作者实验室前期研究工作为基础,依次使用MFG-150和S-300、MFG-150和FG-150凝胶过滤,从富含R-PE的多管藻藻胆蛋白提取液中分离R-PE和R-PC/AP,然后利用DEAE Sepharose-Fast Flow离子交换从所得R-PE和R -PC/AP组分中纯化制备R-PE、R-PC和AP成分.在红藻藻胆蛋白分离纯化中,目前最普遍的是在一个实验技术流程中仅分离纯化一种藻胆蛋白;与此相比,本研究建立了在一个实验流程中同时进行R-PE、R-PC和AP 3类藻胆蛋白成分的有效分离、纯化的技术方法.而且,通过增加超滤膜包的面积,将凝胶过滤柱直径扩大至约10 cm、离子交换柱直径扩大至约3.5 cm便可以将R-PE的制备量增大到约500 mg.本实验报道的技术方法不仅可用于其他富含R-PE海生大型红藻中藻胆蛋白的分离纯化,而且有利于深化大型红藻R-PC和AP的结构、功能及其在藻胆体中的有序组装等方面的研究.
[1]Binder A,Wilson K,Zuber H.C-phycocyanin from the thermophilic blue-green alga Mastigocladus laminosus,isolation,characterization and subunit composition[J].Federation of Biochemical Societies,1972,20(1):111-116.
[2]De Marsac N T.Phycobiliproteins and phycobilisomes: the early observations[J].Photosynthesis Research,2003,76(1 -3):197-205.
[3]Glazer A N.Phycobilisome:a macromolecular complex optimized for light energy transfer[J].Biochemical and Biophysical Acta,1984,768(1):29-51.
[4]Singhal G S,Rengerl G,Sopory S K,et al.Concepts in Photobiology:Photosynthesis and Photomorphogenesis[M].New Delhi:Narosa Publishing House,2001,38(4):520-597.
[5]王广策,邓田,曾呈奎.藻胆蛋白的研究概况(Ⅰ)——藻胆蛋白的种类与组成[J].海洋科学,2000,24(2):22-25.
[6]李冠武,王广策.R-藻红蛋白介导的光敏效应对DNA分子的生物学效应.生物化学与生物物理进展[J].2000,27 (6):621-624.
[7]吴萍.藻胆蛋白与荧光免疫分析[J].生理科学进展,2000,31(1):82-84.
[8]Sekar S,Chandramohan M.Phycobiliproteins as a commodity:trends in applied research,patents and commercialization[J].J Appl Phycol,2008,20(2):113-136.
[9]颜世敢,朱丽萍,张玉忠,等.R-藻红蛋白标记抗体荧光探针的高效制备及其在禽流感病毒检测中的应用[J].南京农业大学学报,2009,32(2):92-96.
[10]Niels T Erik sen.Production of phycocyanin-a pigment with applications in biology,biotechnology,foods and medicine[J].Appl Microbiol Biotechnol,2008,80(1):1-14.
[11]Sun Li,Wang Shumei,Chen Lixue,et al.Promising fluorescent probes from phycobiliproteins[J].Selected Topics in Quantum Electronics,2003,9(2):177-188.
[12]郑蔚然,丁玉庭.藻胆蛋白的分离纯化研究进展[J].微生物学杂志,2008,28(4):70-73.
[13]Su Hainan,Xie Binbin,Zhang Xiying,et al.The supramolecular architecture,function,and regulation of thylakoid membranes in red algae:an overview[J].Photosynth Res,2010,106(1-2):73-87.
[14]王玉,赵明日,孙力,等.海生红藻中藻蓝、别藻蓝蛋白的凝胶过滤分离[J].食品工业科技,2014,35(11):93-97.
[15]Wang Lu,Qu Yanyan,Sun Li,et al.Isolation,purification and properties of an R-phycocyanin from the phycobilisomes[J].Plos One,2014,9(2):e87833.doi:10.1371/journal.pone.0087833.www.plosone.org
[16]Glazer A N,Fang S.Chromophore content of blue-green algal phycobiliproteins[J].Biol Chem,1973,248(2):659-662.
[17]Glazer A N,Fang S.Formation of hybrid proteins from the α and β subunits of phycocyanins of unicellular and filamentous blue-green algae[J].Biol Chem,1973,248(2):663-671.
[18]Liu Luning,Chen Xiulan,Zhou Baicheng,et al.Onestep chromatography method for efficient separation andpurification of R-phycoerythrin from Polysiphonia urceolata[J].Journal of Biotechnology.2005,116(1):91-100.
[19]Rossano R,Ungaro N,D’Ambrosio A,et al.Extracting and purifying R-phycoerythrin from Mediterranean red algae Corallina elongata Ellis&Solander[J].Journal of Biotechnology 2003,101(3):289-293.
[20]Ma Yuhui,Xie Jie,Zhang Rui,et al.Molecular properties of R-phycocyanin subunits from Polysiphonia urceolata in potassium phosphate buffer[J].Photochem Photobiol Sci,2008,7 (2):263-268.
[21]王璐,龚雪琴,孙力,等.多管藻R-藻红蛋白和R-藻蓝蛋白的制备及其相对分子质量的测定[J].烟台大学学报:自然科学与工程版,2010,23(4):283-288.
[22]华萌萌,龚雪琴,孙力,等.海生红藻多管藻中的2种R -藻红蛋白[J].烟台大学学报:自然科学与工程版,2011,24 (3):201-208.
[23]曲艳艳,王玉,孙力,等.海生红藻多管藻R-藻蓝蛋白亚基组成及其特性[J].烟台大学学报:自然科学与工程版,2013,26(2):106-110.
[24]Wang Yu,Chen Lixue,Sun Li,et al.Seperation of N-ative Allophycocyanin and R-Phycocyanin from marine red macroalga Ploysiphonia Urceolata by the polyacrylamide gel electrophoresis performed in novel buffer system[J].Plos One,2014,9 (8):1-9.e106369.doi:10.1371/journal.pone.0106369.www.plosone.org
[25]Zhao Mingri,Sun Li,Chen Min,et al.The 42.1 and 53.7 kDa bands in SDS-PAGE of R-phycoerythrin from Ploysiphonia Urceolata[J].International Journal of Biological Macromolecules,2013:405-411.
[26]魏星,赵明日,付学军,等.海生红藻R-藻红蛋白和隐藻藻蓝蛋白光吸收系数测定[J].烟台大学学报:自然科学与工程版,2012,25(4):269-276.
Isolation and Purification of Phycobiliproteins from Marine Red Alga Polysiphonia urceolata
GUO Ning,WANG Yu,ZHAO Ming-ri,GONG Xue-qin,SUN Li
(School of Life Sciences,Yantai University,Yantai 264005,China)
R-phycerythrin(R-PE),R-phycocyanin(R-PC)and allophycocyanin(AP)are isolated from the extracted phycobiliprotein solution of Polysiphonia urceolata rich in phycoerythrin using gel filtration through Middle Fine Sephadex G-150(MFG-150),Fine Sephadex G-150(FG-150)and Sephacryl S-300(S-300).The obtained fractions of R-PE,R-PC and AP are further purified using ion-exchange chromatography through DEAE Sepharose-Fast Flow.An optimized technical procedure for simultaneous preparation of the three phycobiliprotein types from the extracted phycobiliproteins of Polysiphonia urceolata is established based on the present experiments.
chromatography;polyacrylamide gel electrophoresis;Polysiphonia urceolata Grev;phycoerythrin;phycocyanin;allophycocyanin
Q503
A
(责任编辑 周雪莹)
1004-8820(2015)03-0179-07
10.13951/j.cnki.37-1213/n.2015.03.006
2014-11-20
国家自然科学基金资助项目(30571720,40976083).
郭凝(1987-),男,山东烟台人,硕士研究生.
孙力(sunliytu@aliyun.com),教授,研究方向:生物化学与分子生物学.

