济生肾气汤联合骨髓间充质干细胞移植对肝硬化大鼠T淋巴细胞亚群及红细胞免疫功能的影响研究
刘莹,周晓玲,谢胜,侯秋科,李泽鹏,陈峭,李灿,韦金秀
·中医·中西医结合研究·
济生肾气汤联合骨髓间充质干细胞移植对肝硬化大鼠T淋巴细胞亚群及红细胞免疫功能的影响研究
刘莹,周晓玲,谢胜,侯秋科,李泽鹏,陈峭,李灿,韦金秀
目的探讨济生肾气汤联合骨髓间充质干细胞(BMSCs)移植对肝硬化大鼠T淋巴细胞亚群及红细胞免疫功能的影响。方法2014年10—12月,采用随机数字表法将造模成功的30只肝硬化大鼠分为对照组和实验组,每组各15只。对照组采用单纯BMSCs移植治疗,实验组采用济生肾气汤联合BMSCs移植治疗。治疗前及治疗后1、2、3、4周检测两组大鼠T淋巴细胞亚群和红细胞免疫功能指标。结果CD4+、CD8+、CD4+/CD8+比较,治疗方法与时间存在交互作用(P<0.05);组间比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。其中,治疗前和治疗后1、2周对照组大鼠CD4+、CD8+、CD4+/CD8+与实验组比较,差异均无统计学意义(P>0.05);治疗后3、4周对照组大鼠CD4+、CD8+、CD4+/CD8+与实验组比较,差异均有统计学意义(P<0.05);对照组和实验组大鼠治疗后2、3、4周CD4+、CD8+、CD4+/CD8+与治疗前比较,差异均有统计学意义(P<0.05)。红细胞C3b受体花环率(RBC·C3bRR)、红细胞免疫复合物花环率(RBC·ICR)比较,治疗方法与时间存在交互作用(P<0.05);组间比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。其中,治疗前和治疗后1、2周对照组大鼠RBC·C3bRR、RBC·ICR与实验组比较,差异均无统计学意义(P>0.05);治疗后3、4周对照组大鼠RBC·C3bRR、RBC·ICR与实验组比较,差异均有统计学意义(P<0.05);对照组和实验组大鼠治疗后3、4周RBC·C3bRR、RBC·ICR与治疗前比较,差异均有统计学意义(P<0.05)。结论与单纯BMSCs移植相比,济生肾气汤联合BMSCs移植可明显改善肝硬化大鼠的T淋巴细胞亚群和红细胞免疫功能的相关指标。
肝硬化;间质干细胞移植;济生肾气汤;T淋巴细胞亚群;模型,动物
刘莹,周晓玲,谢胜,等.济生肾气汤联合骨髓间充质干细胞移植对肝硬化大鼠T淋巴细胞亚群及红细胞免疫功能的影响研究[J].中国全科医学,2015,18(36):4501-4505.[www.chinagp.net]
Liu Y,Zhou XL,Xie S,et al.Effect of Jisheng Shenqi decoction combined with bone mesenchymal stem cells transplantation on T-lymphocyte subsets and red cell immune function of rats with liver cirrhosis[J].Chinese General Practice,2015,18(36):4501-4505.
肝硬化是一种由不同病因长期作用于肝脏而引起的慢性、进行性、弥漫性肝病。肝硬化患者早期无明显症状,进展至终末期则出现一系列不同程度的门静脉高压和肝功能障碍,直至出现上消化道出血、肝性脑病等并发症而死亡[1]。原位肝移植是治疗终末期肝病较理想的手段,但由于供体短缺、手术费用昂贵、免疫排斥及伦理道德等诸多条件的限制,难以在临床广泛应用。干细胞移植是近年发展起来的一种治疗终末期肝病的新技术,为解决供体肝来源的短缺开拓了新的途径。骨髓中除造血干细胞外,还有另一类间充质干细胞(mesenchymal stem cells,MSCs),是源于中胚层并具有多向分化潜能的细胞,具有在不同诱导条件下向中胚层和神经外胚层组织细胞分化的能力[2-3],研究人员还发现,MSCs在体外可分化为肝细胞样细胞[4-6]。本课题组通过长期的临床研究发现,联合济生肾气丸能够明显提高骨髓MSCs(BMSCs)移植的临床治疗效果[7-8]。最新药理研究发现,肾气丸具有抗衰老、调节免疫及血液系统的作用,用环磷酰胺制造小鼠免疫抑制模型观察肾气丸对其免疫调节的作用,结果显示,肾气丸能提高腹腔巨噬细胞的吞噬功能,提高胸腺重量,促进淋巴细胞的转化功能,提高红细胞数量[9]。而肝纤维化是所有慢性肝病发展到肝硬化的必经阶段,如何延缓肝纤维化过程成为治疗的关键点。为了探讨济生肾气汤是如何起到配合BMSCs移植发挥免疫调节作用从而减缓肝硬化的进程,本研究通过设立单纯BMSCs移植的对照组与济生肾气汤联合BMSCs移植的实验组,观察BMSCs移植治疗前后两组大鼠T淋巴细胞亚群和红细胞免疫功能的变化,以初步阐明这一免疫调节的作用所在。
1材料与方法
1.1动物、试剂、仪器与药物
1.1.1动物2014年10—12月选取4周龄大鼠10只,雄性,体质量(100±5)g(提取BMSCs用);健康SPF级SD大鼠37只,雄性,体质量(200±20)g(BMSCs移植用)。由广西中医药大学实验动物中心提供,动物合格证号:桂医动字第11004号。
1.1.2试剂、仪器分离BMSCs采用低糖DMEM培养基、胎牛血清及胰蛋白酶,均购自GIBCO公司;抗大鼠CD29-PE、抗大鼠CD34-PE、抗大鼠CD45-PE、抗大鼠CD90-PE均购自美国BioLegend公司;流式细胞仪购自美国BD公司;T淋巴细胞亚群检测采用Mouse CD4试剂盒,购自北京福瑞生物工程公司(批号:20110801);Mouse CD8试剂盒,购自西安舟鼎国生物技术有限公司(批号:20080817);红细胞免疫功能检测采用致敏及未致敏冻干酵母菌制剂,均购自上海第二军医大学长海医院免疫室;肝硬化大鼠模型造模采用橄榄油、四氯化碳(CCl4)溶液。
1.1.3药物济生肾气汤由熟地黄80 g、山茱萸40 g、山药40 g、泽泻30 g、茯苓30 g、丹皮30 g、肉桂10 g、附子10 g、车前子20 g、牛膝20 g构成。以上药物由天津三延公司生产的三延牌中药煎煮机煎煮,符合《中华人民共和国药典(2010年版)》相关规定[10],并由柳州市中医院制剂室煎制。以上复方以大火煎开,文火水煎2次,过滤去渣,合并水煎液后在中药液体包装机中浓缩成含生药3 g/ml溶液作为灌胃溶剂,4℃冰箱保存备用。
1.2 BMSCs分离鉴定、模型制备与给药途径
1.2.1大鼠BMSCs的分离培养将4周龄大鼠用异氟烷腹腔注射深度麻醉处死后,于无菌条件下分离出大鼠的股骨和胫骨,取其骨髓细胞制成单细胞悬液,用加10%胎牛血清的DMEM/F12细胞培养液接种于75 cm2的培养瓶中,置于37℃5%CO2饱和湿度的恒温培养箱中培养,3 d后首次换液,以后每2~3 d换液1次,7~10 d细胞生长融合,经0.25%胰酶消化,1∶2传代,其后一般3 d传代1次,选取生长良好的P3代细胞进行实验。之后分别加入抗大鼠CD29-PE、抗大鼠CD34-PE、抗大鼠CD45-PE、抗大鼠CD90-PE,同型对照,室温避光孵育,应用流式细胞仪检测BMSCs的表面标志物。
1.2.2肝硬化大鼠模型制备对健康大鼠腹腔注射50%的橄榄油CCl4溶液(橄榄油与CCl4的体积比为1∶1),剂量1 ml/kg,1次/3 d,逐渐增加到2 ml/kg,根据大鼠体质量变化调整剂量,以体质量不增加或者轻度降低为准,注射2个月后取肝组织活检,通过肝组织病理学证实造模成功。
1.2.3分组及给药途径采用随机数字表法将造模成功的30只肝硬化大鼠分为对照组15只、实验组15只。对照组大鼠采用单纯BMSCs移植治疗:经门静脉注入1.5 ml约含1.5×106个的BMSCs。实验组采用济生肾气汤中药灌胃联合BMSCs移植治疗:经门静脉注入1.5 ml约含1.5×106个的BMSCs;灌胃方法:在行BMSCs移植治疗前后各1周,分别于每日9:00予济生肾气汤中药灌胃治疗,2 ml/次,2次/d,总灌胃14 d。两组大鼠治疗后均动态观测1个月。
1.3观察指标及测定标准
1.3.1外周血T淋巴细胞亚群CD4+、CD8
+检测分别在治疗前及治疗后1、2、3、4周于大鼠尾部取血,肝素钠抗凝,100μl全血加CD4+、CD8+抗体各10μl,轻轻吹匀后,避光,室温温育30 min,加1 ml红细胞裂解液,1 000 r/min离心5 min(离心半径140 mm),弃上清液,用1 ml 0.001 mmol/L的磷酸盐缓冲液(PBS)重新悬浮细胞,200目过滤网过滤样本后上机检测,按照大鼠CD4+、CD8+试剂盒说明书,采用流式细胞仪检测,上样分析。从抽血采样到分析在8 h内完成。计算CD4+/CD8+。
1.3.2红细胞免疫功能指标检测按常规方法操作,分别在治疗前及治疗后1、2、3、4周采用郭氏法[11]检测大鼠红细胞C3b受体花环率(RBC·C3bRR)和红细胞免疫复合物花环率(RBC·ICR)。由于大鼠免疫细胞存在昼夜节律,故采样时间均定于9:00。
1.4统计学方法采用SPSS 18.0统计学软件进行数据分析。计量资料以(x±s)表示,两组间不同时间观察指标比较采用重复测量方差分析,两组间比较采用t检验,不同时间间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2结果
2.1大鼠一般情况肝硬化造模过程中共死亡大鼠7只,存活30只。造模成功的肝硬化大鼠日常表现为精神差、食欲差、喜卧少动。肝硬化大鼠肝组织病理学可见假小叶形成(见图1)。在BMSCs移植治疗过程中,对照组3只大鼠因门静脉注射BMSCs后止血不彻底而死亡;实验组2只大鼠因移植BMSCs后发生出血不止而死亡。对照组和实验组各有1只大鼠出现显著的腹部膨隆,解剖腹腔发现大量清亮腹腔积液。
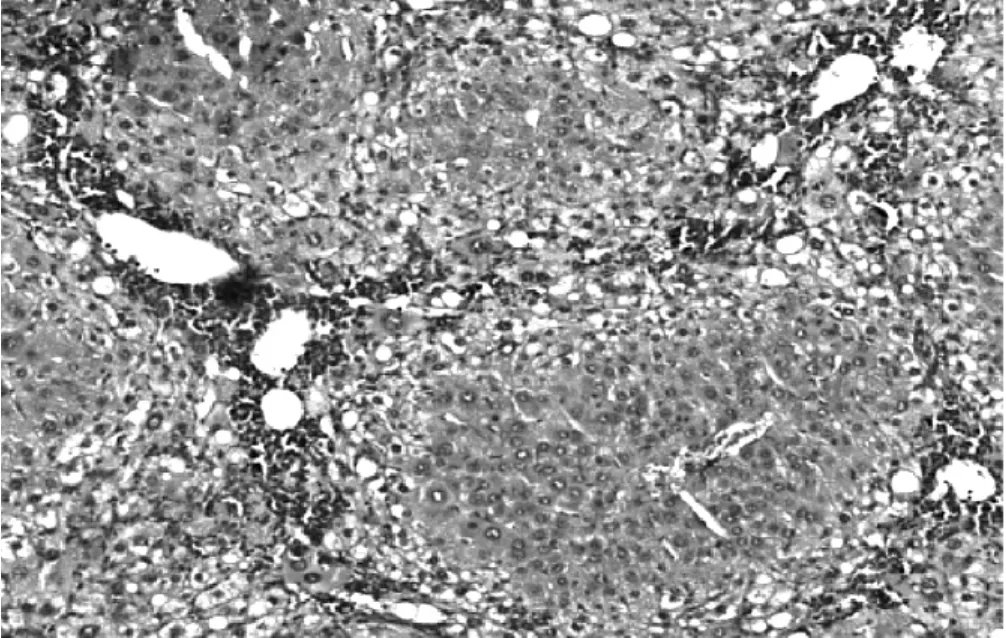
图1造模成功的肝硬化大鼠肝脏病理图片(HE染色,×100)Figure 1 Pathological picture of liver of rats with liver cirrhosis
2.2 BMSCs分离培养和鉴定结果原代培养的BMSCs多为不规则形状,细胞核较大,此后贴壁生长的细胞呈集落样生长,悬浮的细胞随着换液逐渐被去掉,生长良好的P3代细胞呈梭状,且细胞形态更趋于一致(见图2)。流式细胞仪检测表面抗原特性,结果显示,CD34、CD45阳性率分别为0.38%、0.62%,CD29、CD90阳性率分别为97.3%、98.5%,说明传代贴壁生长的梭形细胞是骨髓中区别于造血干细胞的另一群处于未分化状态的非定向干细胞——BMSCs。
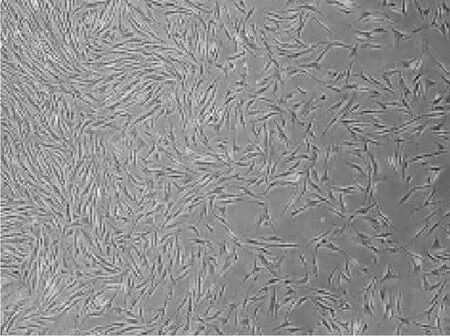
图2生长良好的P3代细胞呈形态一致的梭状Figure 2 P3'cells in well growth taking on fusiform in a consistent pattern
2.3两组大鼠治疗前后外周血T淋巴细胞亚群检测结果比较CD4+、CD8+、CD4+/CD8+比较,治疗方法与时间存在交互作用,差异有统计学意义(P<0.05);组间比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。其中,治疗前和治疗后1、2周对照组大鼠CD4+、CD8+、CD4+/CD8+与实验组比较,差异均无统计学意义(P>0.05);治疗后3、4周对照组大鼠CD+、CD+、CD+484/CD8+与实验组比较,差异均有统计学意义(P<0.05);对照组和实验组大鼠治疗后2、3、4周CD+、CD+、CD+484/CD8+与治疗前比较,差异均有统计学意义(P<0.05,见表1)。
2.4两组大鼠治疗前后外周血红细胞免疫功能指标比较RBC·C3bRR、RBC·ICR比较,治疗方法与时间存在交互作用,差异有统计学意义(P<0.05);组间比较,差异有统计学意义(P<0.05);时间间比较,差异有统计学意义(P<0.05)。其中,治疗前和治疗后1、2周对照组大鼠RBC·C3bRR、RBC·ICR与实验组比较,差异均无统计学意义(P>0.05);治疗后3、4周对照组大鼠RBC·C3bRR、RBC·ICR与实验组比较,差异均有统计学意义(P<0.05);对照组和实验组大鼠治疗后3、4周RBC·C3bRR、RBC·ICR与治疗前比较,差异均有统计学意义(P<0.05,见表2)。
3讨论
本研究通过对济生肾气汤联合BMSCs移植治疗肝硬化大鼠进行研究,观察治疗前后大鼠的T淋巴细胞亚群和红细胞免疫功能指标的变化,发现治疗后大鼠的CD+、CD+、CD+484/CD8+、RBC·C3bRR明显增高、RBC·ICR明显下降。众所周知,T淋巴细胞亚群在肝细胞损害、机体抗肿瘤免疫中起重要作用,其是最为活跃的免疫活性细胞之一,不仅是细胞免疫的效应细胞,还有调节细胞免疫的作用。CD4+T淋巴细胞主要由Th细胞构成,其功能可协助T、B淋巴细胞产生免疫应答。而CD8+T淋巴细胞主要由细胞毒性T淋巴细胞和Ts细胞构成,其不仅对B细胞合成和分泌抗体有抑制作用,而且对Th辅助作用、迟发型超敏反应以及Tc介导的细胞毒作用均可起到负调节作用[10]。
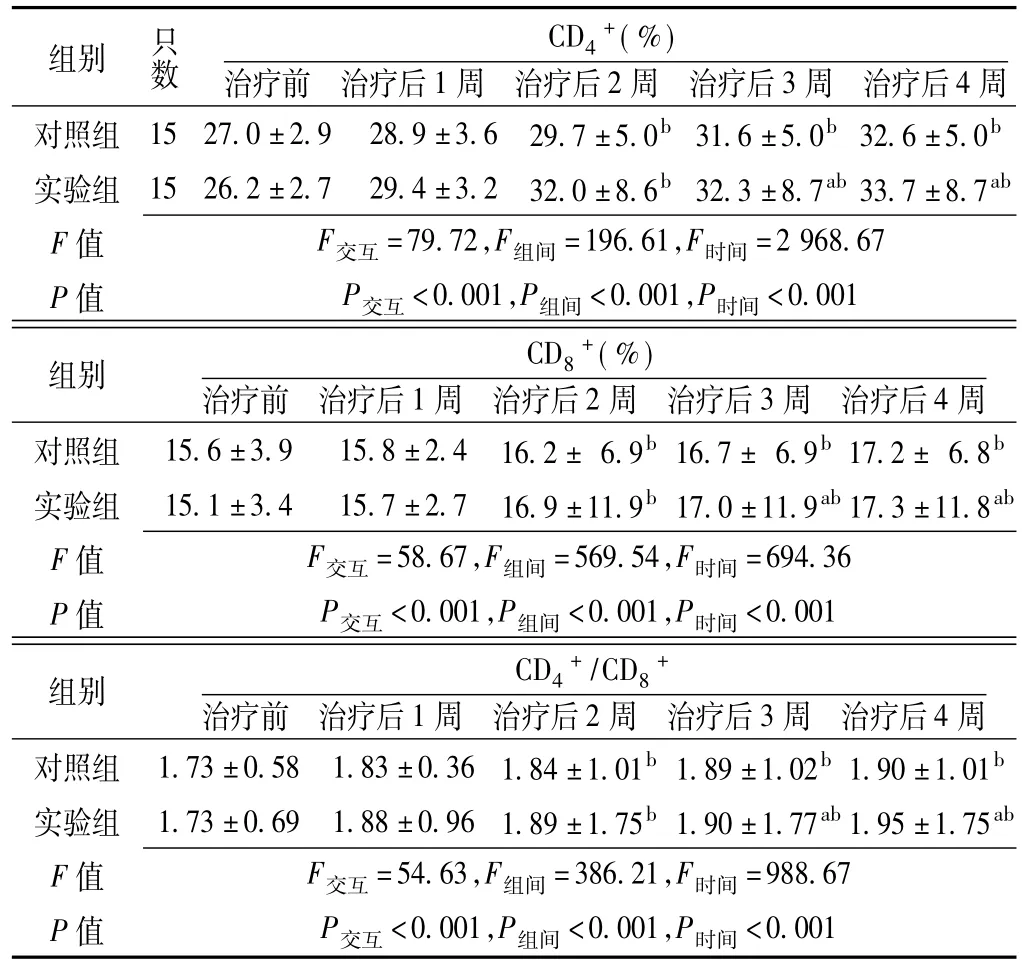
表1两组大鼠治疗前后外周血T淋巴细胞亚群检测结果比较(x±s)Table 1 Comparison of T cell subset in the peripheral blood between the two groups before and after treatment
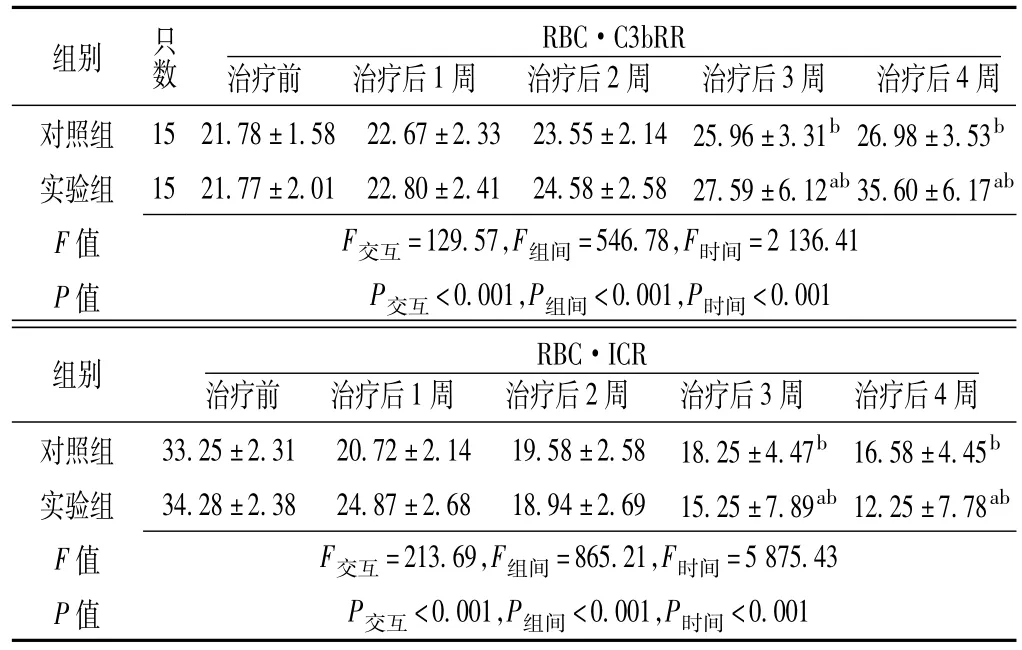
表2两组大鼠治疗前后外周血红细胞免疫功能指标比较(x±s,%)Table 2 Comparison of red blood cell immune function of peripheral blood between the two groups before and after treatment
从1981年Siegel等[11]提出红细胞具有免疫功能的理论后,该理论受到人们的重视,并被广泛应用于临床治疗的疗效评价体系中。红细胞不仅具有呼吸功能,而且还参与机体的免疫防御机制。由于红细胞数量多,其作用是白细胞无法比拟的,具有识别浓缩抗原、增强淋巴细胞免疫功能的作用,还可利用红细胞膜上的C3b受体转运销毁循环免疫复合物。红细胞与细菌、病毒等微生物黏附后,可以通过释放细胞内的过氧化物酶直接杀伤微生物,并且促进吞噬细胞的吞噬作用。此外,红细胞不仅自身具备完整的自我调控系统,还参与调控机体的整体免疫功能,从而发挥其在机体固有免疫应答中的重要作用。当肝细胞遭到严重破坏时,肝脏合成功能减退,红细胞免疫功能受损,其表现以RBC·C3bRR降低和RBC·ICR增高为主[12];另一方面,由于肝内巨噬细胞吞噬功能障碍,使红细胞CRI携带CIC卸下转运至巨噬细胞销毁能力减弱。肝细胞坏死、再生和肝纤维化造成脾脏淤血,网状内皮系统处于异常状态,清除、灭活CIC能力进一步减弱。对肝硬化大鼠的研究中,虽然肝硬化大鼠是人为药物所致,与人体长期感染病毒所致的肝炎后肝硬化不同,但均为肝细胞遭到大面积破坏,进而促使肝脏合成功能减退,这在一定程度上必然影响整个大鼠机体免疫功能的紊乱。本研究肝硬化大鼠虽未经过炎症的反复作用,但其肝功能在短期内遭到破坏致使其免疫功能紊乱,这与整个肝脏参与整个机体的运作是密切相关的。本研究发现,BMSCs移植治疗肝硬化大鼠,治疗后RBC·C3bRR升高而RBC·ICR降低,说明BMSCs移植后肝硬化大鼠红细胞调节免疫的功能得到了一定的恢复,有可能是移植后的干细胞在红细胞免疫重建中发挥了作用。
本研究还发现,济生肾气汤联合BMSCs移植可进一步提高治疗效果。近年来,中医药在治疗肝纤维化与肝硬化上已取得了一定的进展,已有多个抗肝纤维化经验方药与中药新药问世并广泛用于临床,其共同阐明“正虚血瘀”为肝硬化之病机特点,而“扶正化瘀”则成为了中医药治疗肝纤维化、肝硬化的基本治则[13]。正气亏耗为久病肝硬化患者的共同特点,其病以“正虚”为本,且多以脾肾两虚为主。本课题组前期研究中发现,济生肾气汤可能增强了干扰素α-2b治疗HBeAg阳性慢性乙型肝炎患者的免疫应答,并减少了干扰素α-2b治疗的不良反应[14]。刘静生等[15]采用益肾升白汤方治疗肝肾阴虚型失代偿性肝硬化,以扶正祛邪为原则,调补肝肾为治法,获得较好疗效。本研究采用的济生肾气汤是汉代医圣张仲景创制的著名方剂,该方具有填精益髓、温阳利水功能,已被广泛应用于临床。纵观全方,以小剂温阳药置于10倍之滋阴利水剂之中,恰似坎卦一阳爻藏于两阴爻之中,取象于火涵水中,藏而不露。又以山药厚其土以藏之,山茱萸敛其气以秘之,泽泻、丹皮、茯苓引亢火以归之,车前子、牛膝以消阴翳。如此则肾复其封蛰之职,水中之火,不亢不衰,缓缓蒸腾,温养五脏六腑,而不蓄水。该方配伍充分体现了水火既济之象,这一全新配伍从中医上增强温补脾肾助阳利水之效,临床上用于久病肝硬化患者,以少量腹腔积液多见,此方在温补肾阳的同时起到化湿之功效。本研究结果亦表明,济生肾气汤联合BMSCs移植治疗肝硬化大鼠,不仅其外周血T淋巴细胞亚群指标得到改善,红细胞免疫功能指标亦得到显著改善。这表明济生肾气汤具有优异的免疫调控功能,与BMSCs移植联合运用可起到免疫功能协同增效的作用,可能对BMSCs移植后的定植及增强细胞活性起到积极的调控作用。
综上所述,笔者通过相关检索发现,目前对BMSCs移植治疗肝硬化的具体作用机制尚未完全明确[16-17],在免疫相关性研究上,虽然红细胞免疫理论近年研究呈减少趋势,但其在肝硬化机体中的免疫功能作用是不能忽略的,本研究以外周血T淋巴细胞亚群及红细胞免疫功能指标变化作为出发点,旨在初步阐明肝硬化大鼠相关免疫功能的变化。而联合中医药的治疗方案及相关机制的研究则更是罕见,本研究通过建立肝硬化大鼠模型,观察两种方案在改善大鼠外周血T淋巴细胞亚群和红细胞免疫功能指标上的不同,发现济生肾气汤联合BMSCs移植的治疗效果优于单纯BMSCs移植,且其疗效指标也比对照组要稳定,从而初步阐明了济生肾气汤联合BMSCs移植治疗方案的作用机制之所在,为该疗法的临床推广应用提供了一定的理论基础。但同时,本研究对济生肾气汤联合BMSCs移植的具体协同机制和免疫调节机制仍存在诸多不明确性,这需要在后续的研究中进一步揭示,从而为肝硬化患者能获得更好、更有效的治疗提供新思路、新方法。
利益冲突声明:本课题未涉及任何厂家及相关雇主或其他经济组织直接或间接的经济或利益的赞助。无利益冲突。
[1]Zhang WZ.Epidemiological characteristics analysis of155 patientswith liver cirrhosis[J].Journal of Clinical Hepatology,2012,15(1): 55-56.(in Chinese)张文忠.155例肝硬化患者流行病学特征分析[J].实用肝脏病杂志,2012,15(1):55-56.
[2]Deng W,Obrocka M,Fischer I,et al.In vitro differentiation of human marrow stromal cells into early progenitors of neural cells by conditions that increase intracellular cyclic AMP[J].Biochem Biophys Res Commun,2001,282(1):148-152.
[3]Guo F,Zhang CG,Xu YZ.Advances of studies on mesenchymal stem cells[J].Chenese Journal of Difficultand Complicated Cases,2010,9(5):393-394.(in Chinese)郭峰,张翠改,许彦芝.骨髓间充质干细胞的研究进展[J].疑难病杂志,2010,9(5):393-394.
[4]Pietrosi G,Vizzini GB,Gruttadauria S,et al.Clinical applications of hepatocyte transplantation[J].World JGastroenterol,2009,15 (17):2074-2077.
[5]Schwartz RE,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[J].JClin Invest,2002,109(10):1291-1302.
[6]Wang H,Wu GC,Zhong Q.Clinical efficacy and safety of autologous bone marrow stem cell transportation in treating liver failure[J].Chinese General Practice,2013,16(3):933-935.(in Chinese)王辉,巫贵成,钟庆.自体骨髓干细胞移植治疗肝功能衰竭的临床疗效及安全性观察[J].中国全科医学,2013,16(3):933-935.
[7]Zhou XL,Xie S,Chen Q,et al.Influence of umbilical cord blood stem cell transplantation combined with therapy of invigorating kindney qi to remove dampness on immune function of patients with Child-Pugh A and B cirrhosis[J].Journalof ClinicalMedicine in Practice,2014,18(19):38-44.(in Chinese)周晓玲,谢胜,陈峭,等.脐血干细胞移植结合补益肾气利湿法对ChildA、B级肝硬化患者免疫功能的影响[J].实用临床医药杂志,2014,18(19):38-44.
[8]Zhou XL,Xie S,Chen Q,et al.Cord blood stem cell transplantation combined with traditional Chinese therapy for kidney nourishing and dampness elimination in treatment of patients with Child A or B grade liver cirrhosis[J].Journal of Clinical Medicine in Practice,2014,18(17):25-28.(in Chinese)周晓玲,谢胜,陈峭,等.脐血干细胞移植结合补益肾气利湿法治疗ChildA、B级肝硬化的疗效及机制探讨[J].实用临床医药杂志,2014,18(17):25-28.
[9]Zhou ZX,Wu ZP,Deng Q.Effect of shengqiwan on immunological function in rats[J].The Journal of Practical Medicine,2009,25 (24):4131-4133.(in Chinese)周智兴,吴正平,邓琴.肾气丸对衰老模型大鼠免疫功能的作用研究[J].实用医学杂志,2009,25(24):4131-4133.
[10]国家药典委员会.中华人民共和国药典(2010年版)[M].北京:中国医药科技出版社,2010:248-317.
[11]Siegel I,Liu TL,Gleicher N.The red-cell immune system[J].Lancet,1981,2(8246):556-559.
[12]Qin JB.Study on the relationship between red blood cell immunity and lipid peroxidation in patients with liver cirrhosis[J].Chinese Journal of Pest Control,2007,23(5):344-345.(in Chinese)秦继宝.肝硬化患者红细胞免疫功能与脂质过氧化关系的研究[J].医学动物防制,2007,23(5):344-345.
[13]Jiang J,Wang LH,Li L.Progressof clinical research on the effectof Chinese medicine on hepatic fibrosis[J].Hubei Journal of Traditional Chinese Medicine,2014,36(5):74-76.(in Chinese)江杰,王利红,李丽.中医药对肝纤维化影响的临床研究进展[J].湖北中医杂志,2014,36(5):74-76.
[14]Zhou XL,Xie S,Li C,et al.Clinical efficacy of Jisheng Shenqi decoction combined with interferon in HBeAg-positive chronic hepatitis B of Spleen-kidney Yang deficiency[J].Modern Journal of Integrated Traditional Chinese and Western Medicine,2013,22 (34):3772-3776.(in Chinese)周晓玲,谢胜,李灿.济生肾气汤联合α-2b干扰素治疗脾肾阳虚型HBeAg阳性慢性乙型肝炎疗效观察[J].现代中西医结合杂志,2013,22(34):3772-3776.
[15]Liu JS,Song ZM.Shengbai decoction in the treatment of kidney yin deficiency of liver and kidney in 60 cases of patients with decompensated liver[J].Traditional Chinese Medicinal Research,2010,23(2):46-48.(in Chinese)刘静生,宋振民.益肾升白方治疗肝肾阴虚型失代偿性肝硬化60例[J].中医研究,2010,23(2):46-48.
[16]黄坤,吴晓梅,王欣燕,等.甘草酸二胺对骨髓间充质干细胞治疗大鼠肺纤维化的干预作用[J].中国煤炭工业医学杂志,2013,16(10):1691-1693.
[17]Gong JZ,Du CX,Chen YN,et al.Human umbilical cord blood MSCs transplantation in treatment of decompensated liver cirrhosis[J].Chinese General Practice,2014,17(20):2392-2395.(in Chinese)公建庄,杜晨旭,陈雅宁,等.脐血间充质干细胞移植治疗失代偿期肝硬化的临床疗效观察[J].中国全科医学,2014,17 (20):2392-2395.
Effect of Jisheng Shenqi Decoction Combined W ith Bone M esenchym al Stem Cells Transp lantation on T-lym phocyte Subsets and Red Cell Immune Function of Rats W ith Liver Cirrhosis
LIU Ying,ZHOU Xiao-ling,XIE Sheng,et al.Guangxi University of Chinese Medicine,Nanning 530001,China
ObjectiveTo investigate the influence of Jisheng Shenqidecoction combined with bonemesenchymal stem cells(BMSCs)transplantation on T-lymphocyte subsets and red cell immune function of rats with liver cirrhosis.Methods From October to December in 2014,liver cirrhosismode was successfully built in 30 rats,and the ratswere divided into control group and trial group using convenience number table method with 15 in each group.Control group was administrated with only BMSCs transplantation,and trial group was administrated with Jisheng Shenqi decoction combined with BMSCs transplantation.Before treatmentand 1,2,3 and 4 weeks after treatment,the T-lymphocyte subsets and red blood cell immune function of the rats were measured.Results In the comparison of CD4+,CD8+and CD4+/CD8+,interaction effect existed between treatmentmethod and time(P<0.05);significant differences existed between the two groups(P<0.05);significant differences existed between different time points(P<0.05).Before treatment,1 week and 2 weeks after treatment,control group were not significantly different(P>0.05)from trial group in CD4+,CD8+and CD4+/CD8+;3 weeks and 4 weeks after treatment,control group and trial group were significantly different(P<0.05)in CD4+,CD8+and CD4+/CD8+;the CD4+,CD8+and CD4+/CD8+of control group and trial group at 2 weeks,3 weeks and 4 weeks after treatment were significantly different from those before treatment(P<0.05).In the comparison of RBC·C3bRR and RBC·ICR,interaction effectexisted between treatmentmethod and time(P<0.05);significant differences existed between the two groups(P<0.05);significant differences existed between different time points(P<0.05).Before treatment,1 week and 2 weeks after treatment,control group were not significantly different(P>0.05)from trial group in RBC·C3bRR and RBC·ICR;3 weeks and 4 weeks after treatment,control group and trial group were significantly different in RBC·C3bRR and RBC·ICR(P<0.05).Conclusion
Compared with the only use of BMSCs transplantation,BMSCs transplantation combined with Jisheng Shenqi decoction can significantly improve the T-lymphocyte subsets and red blood cell immune function of rats with liver cirrhosis.
Liver cirrhosis;Mesenchymal stem cell transplantation;Jisheng Shenqi decoction;T-lymphocyte subsets;Models,animal
R 657.31
A
10.3969/j.issn.1007-9572.2015.36.021
2015-03-24;
2015-10-09)
(本文编辑:陈素芳)
广西科学研究与技术开发计划项目课题(桂科攻1298003-2-10)
530001广西南宁市,广西中医药大学研究生学院(刘莹);柳州市中医院(周晓玲,侯秋科,李泽鹏,陈峭,李灿,韦金秀);广西中医药大学第一附属医院(谢胜)
周晓玲,545001广西柳州市中医院;E-mail:zxl_lz@163.com

