Fe3O4@TiO2壳核结构微球的制备及其光催化性能
吴 正,王 斌,朱 光,张 莉*
1.安徽理工大学化学工程学院,安徽淮南,232001;2.宿州学院自旋电子与纳米材料安徽省重点实验室,安徽宿州,234000
Fe3O4@TiO2壳核结构微球的制备及其光催化性能
吴 正1,2,王 斌2,朱 光2,张 莉2*
1.安徽理工大学化学工程学院,安徽淮南,232001;2.宿州学院自旋电子与纳米材料安徽省重点实验室,安徽宿州,234000
以水热法合成的Fe3O4为磁载体,合成了Fe3O4@TiO2磁性光催化剂。使用透射电子显微镜(TEM)、X射线衍射仪(XRD)、紫外-可见光谱(UV-vis)等对样品进行分析表征。透射电子显微镜观察表明,TiO2均匀地包覆在纳米Fe3O4颗粒表面,形成核壳结构。以Fe3O4@TiO2为光催化剂,降解亚甲基蓝(MB)水溶液,分析了Fe3O4@TiO2的光催化性能,结果表明:紫外光照射下,MB水溶液在15 min后降解率约为93%,Fe3O4@TiO2重复利用5次后,MB的降解率仍能达到87%。
Fe3O4@TiO2;光降解;亚甲基蓝
TiO2因具有化学性质稳定、无毒、催化活性高、无二次污染等优点[1-4]而被广泛用于光催化、气体传感器、锂电池材料等领域[5],但在光催化应用上尚存在一些缺点,如水中回收困难,难以重复利用[6],活性减弱,因此需要找到一种新方法来回收和利用。
近年来,研究人员发现,通过某种反应可以使TiO2沉积在磁性纳米粒子的表面,来解决催化剂难回收等问题;并且磁性纳米粒子具有大的比表面,运用磁铁很容易进行回收[7]。Chen和Gao两个研究小组分别合成了γ-Fe2O3@TiO2核壳结构微球,Chen研究小组还合成了花状Fe3O4@TiO2核壳纳米粒子[10]。虽然研究人员在磁性复合纳米材料上取得了一些成绩,但是寻找有效而且高效的光催化剂仍然是摆在学者面前的一个难题。
本文采用水热法合成Fe3O4,以钛酸四丁酯为前驱体,采用水热法合成具有磁性的Fe3O4@TiO2的光催化剂材料。在紫外灯光照下,对亚甲基蓝(MB)光降解,分析Fe3O4@TiO2的光催化性能。
1 实验部分
1.1 试剂与仪器
乙二醇、聚乙二醇、六水合氯化铁、无水乙酸钠、钛酸四丁酯、无水乙醇均为分析纯,购自国药集团化学试剂有限公司;实验用水均为自制二次蒸馏水。
UV-3310紫外可见分光光度计(日本日立公司)、DX-2600X射线衍射仪(丹东方圆仪器有限公司)、JEOL-2010高分辨透射电镜(日本电子株式会社)。
1.2 Fe3O4颗粒的制备
将2.7 g的FeCl3·6H2O溶解在80 mL的乙二醇中,溶解完全后放入磁力搅拌器进行搅拌,随即加入2 g聚乙二醇和7.2 g无水乙酸钠,搅拌30 min,直到这些试剂完全溶解。然后将溶液移入到100 mL内衬聚四氟乙烯的高压反应釜中,随后把反应釜放入200℃的烘箱中10 h,取出,自然冷却到室温,得到黑色粉末。产物用磁铁进行回收并用二次蒸馏水和无水乙醇洗涤若干次,把所得的产品60℃真空干燥10 h,待用。
1.3 Fe3O4@TiO2微球的制备
以钛酸四丁酯为钛源,通过水热法合成Fe3O4@TiO2:将制备的Fe3O430 mg分散到5 mL无水乙醇和15 μL钛酸四丁酯的混合溶液中,把溶液移入到10 mL的小烧杯中。然后将小烧杯移入到100 mL内衬聚四氟乙烯(聚四氟乙烯中先放入3 mL去离子水)的高压反应釜中,将反应釜放入150℃烘箱中10 h后取出,自然冷却至室温,产品用磁铁进行回收并用去离子水和无水乙醇洗涤若干次,放在60℃真空干燥箱中干燥10 h,待用。
1.4 Fe3O4@TiO2光降解MB溶液
将100 mg Fe3O4@TiO2磁性纳米材料分散到100 mL MB溶液中(5 mg/L),陈化30 min,以达到MB分子在磁性纳米材料表面达到吸附平衡。随后把该溶液放入功率为100 W的超强紫外灯下进行光照并搅拌。每隔10 min取一次溶液,用离心机进行离心分离,取上层溶液,测MB的吸光度。
2 结果与讨论
2.1 Fe3O4@TiO2微球的XRD表征
XRD通常被用来确定产物的物相,图1(A)显示了Fe3O4的XRD衍射峰,从图中可以看出,在2θ=30.5°、35.7°、43.4°、53.8°、57.4°、63.0°处的衍射峰分别对应着(220)、(311)、(400)、(422)、(511)、(440)面,与Fe3O4的标准图谱(JCPDS 65-3107)一致。从图1(B)可以看出,图形上不仅有Fe3O4的衍射峰,在2θ=25.5°、48.1°处还出现了TiO2的特征衍射峰。
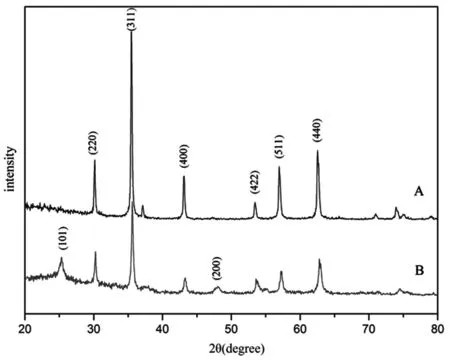
图1 Fe3O4(A) 和Fe3O4@TiO2(B)的XRD图
2.2 Fe3O4和Fe3O4@TiO2的TEM表征
图2(A)和(B)分别为Fe3O4和Fe3O4@TiO2的TEM图。从图2(A)可以看出,Fe3O4的颗粒粒径大小为200 nm左右,且均匀分散。从图2(B)可以看出,Fe3O4包覆TiO2后纳米颗粒的粒径增加,图中颜色较深的地方为Fe3O4核,边缘较浅的为TiO2外壳,形成独特的Fe3O4@TiO2壳核结构。
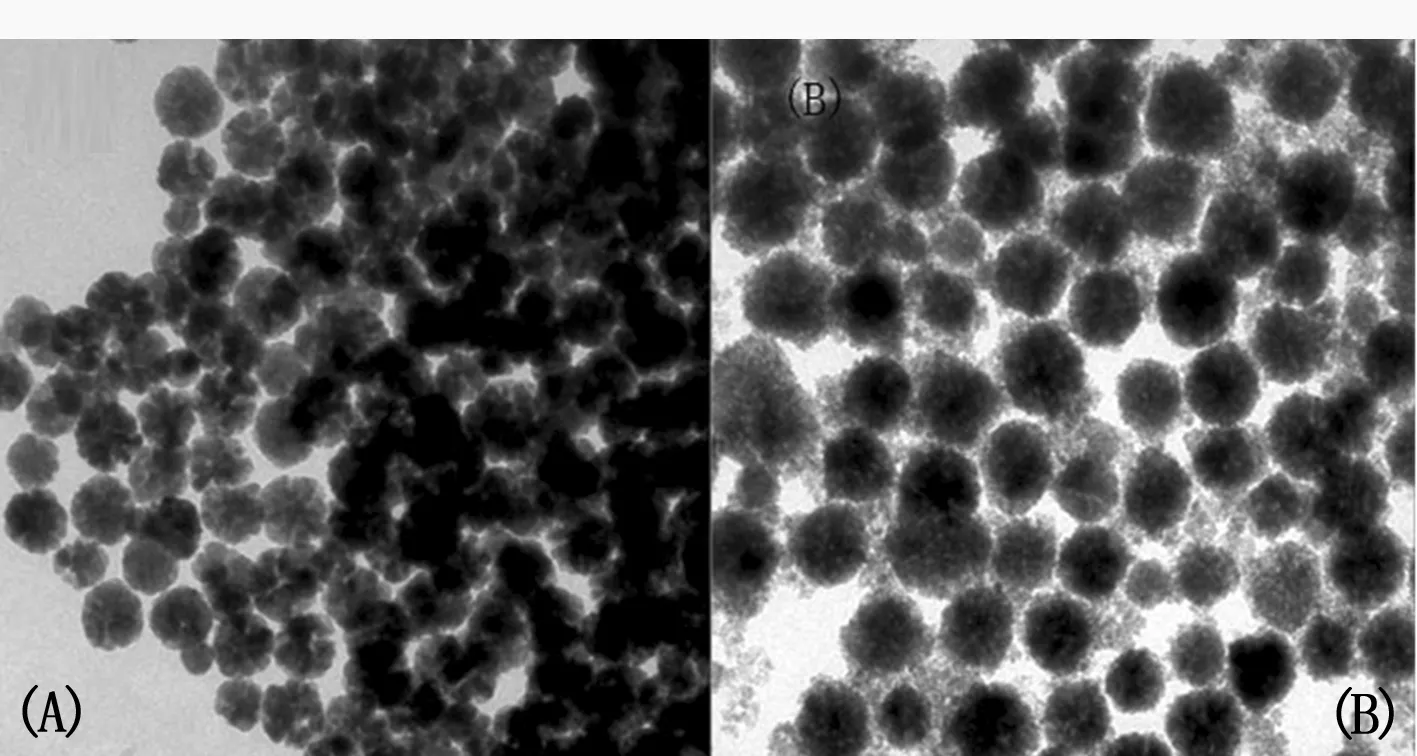
图2 Fe3O4和Fe3O4@TiO2的TEM图
2.3 Fe3O4@TiO2微球的磁性测试
图3(A)为合成的黑色Fe3O4溶液,图3(B)为黄色的Fe3O4@TiO2壳核结构材料溶液。图3(C)为在外磁场作用下Fe3O4溶液的分离照片,从图中可以看出Fe3O4很容易分离,这对于回收利用很方便。图3(D)为在外磁场作用下 Fe3O4@TiO2与水溶液的分离照片,从图可以看出合成出的Fe3O4@TiO2具有很好的磁性,方便了对颗粒的回收利用。

图3

图4 MB溶液在加入Fe3O4@TiO2后光降解过程的紫外-可见光谱图
2.4 Fe3O4@TiO2光降解MB溶液
为了分析Fe3O4@TiO2磁性材料的光催化性能,用紫外可见分光光度计来检测MB特征吸收峰强度随时间变化的规律。在一般情况下,MB溶液很稳定,特征吸收峰在664 nm处。图4是MB在Fe3O4@TiO2作用下随紫外照射而脱色降解过程的紫外-可见光谱图。随着时间的增加,MB在664 nm处的特征吸收峰强度逐渐下降,表明MB溶液逐渐被降解。15 min后MB溶液降解率是93%,表明在紫外光照射下,Fe3O4@TiO2有很好的光催化效果。由于TiO2的禁带宽为3.2 e V,它在吸收一定波长的光后激发,价带上的电子被激发,越过禁带进入导带,同时在价带上产生相应的空穴。在紫外光照射下,这些电子和空穴带有一定的能量,可以自由迁移到TiO2表面,分布在TiO2表面上的与吸附在表面的OH-和H2O发生化学反应,产生大量的高活性自由基(·OH),这些自由基将MB分解。
2.5 Fe3O4@TiO2回收后的催化性能
图5为5次回收后Fe3O4@TiO2光催化剂的催化性能。从图中可以看出,经过5次的光催化后,Fe3O4@TiO2对MB溶液的降解率仍在87%以上,从而证实Fe3O4@TiO2具有较好的光催化稳定性能。

3 结束语
本实验成功地合成了Fe3O4@TiO2微球磁性材料,TEM图显示TiO2均匀地包覆在Fe3O4颗粒表面,形成独特的Fe3O4@TiO2壳核结构微球。在紫外光照射下,制备的样品作为光催化剂,降解MB溶液。结果表明:紫外光照射下,MB溶液在15 min时降解率约为93%,同时Fe3O4@TiO2重复利用5次后MB的降解率仍能达到87%。
[1]Gao Y,Chen B,Li H,et al.Preparation and characterization of a magnetically separated photocatalyst and its catalytic properties[J].Materials Chemistry and Physics,2003,80(1):348-355
[2]Xu S,Shangguan W,Yuan J,et al.Preparations and photocatalytic properties of magnetically separable nitrogen-doped TiO2supported on nickel ferrite[J].Applied Catalysis B:Environmental,2007,71(3):177-184
[3]宋海南,李国喜,周建庆.Fe3O4/TiO2磁性催化剂的制备及在污水治理中的应用[J].分子催化,2011,25(6):557-562
[4]栾江月,张秀芳,董晓丽,等.Fe3O4-TiO2磁性光催化剂的制备与性能[J].大连工业大学学报,2013,32(1):51-54
[5]Wang C,Yin L,Zhang L,et al.Magnetic(γ-Fe2O3@SiO2) n@ TiO2functional hybrid nanoparticles with actived photocatalytic ability[J].The Journal of Physical Chemistry C,2009,113(10):4008-4011
[6]寇生中,胡聪丽.纳米光催化剂TiO2/Fe3O4的制备及表征[J].应用化工,2008,37(1):67-70
[7]Zhang Y,Yu X,Jia Y,et al.A Facile Approach for the Synthesis of Ag Coated Fe3O4@TiO2Core/Shell Microspheres as Highly Efficient and Recyclable Photocatalysts[J].European Journal of Inorganic Chemistry,2011,33:5096-5104
[8]Chen F,Xie Y,Zhao J,et al.Photocatalytic degradation of dyes on a magnetically separated photocatalyst under visible and UV irradiation[J].Chemosphere,2001,44(5):1159-1168
[9]Gao Y,Chen B,Li H,et al.Preparation and characterization of a magnetically separated photocatalyst and its catalytic properties[J].Materials Chemistry and Physics,2003,80(1):348-355
[10]Cheng G,Wang Z G,Liu Y L,et al.Magnetic Affinity Microspheres with Meso-Macroporous Shells for Selective Enrichment and Fast Separation of Phosphorylated Biomolecules[J].ACS applied materials & interfaces,2013,5(8):3182-3190
(责任编辑:汪材印)
Preparation and Photocatalytic Performance of Fe3O4@TiO2Microsphere with Core-shell Structure
WU Zheng1,2,WANG Bing2,ZHU Guang2, ZHANG Li2
1.School of Chemical Engineering,Anhui University of Science and Technology,Huainan Anhui,2320012.Anhui Key Laboratory of Spin Electron Nanomaterials,Suzhou University,Suzhou Anhui,234000
The magnetic photocatalyst Fe3O4@TiO2was prepared by the hydrothermal reaction with magnetic Fe3O4which was obtained by hydrothermal reaction.The as-prepared samples were characterized by transmission electron microscopy (TEM),X-ray diffraction (XRD) and UV-visible spectroscopy (UV-vis). SEM pictures showed that Fe3O4was evenly coated by TiO2nanoparticle to form a core-shell structure. Photocatalytic performance was evaluated by degradation of methylene blue (MB) solution under UV light irradiation over Fe3O4@TiO2.Results show that the degradation rate of MB solution under UV light irradiation in 15 min is about 93%,and the degradation rate is still able to reach 87% after recycling 5 times.
Fe3O4@TiO2;Photodegradation;Methylene Blue
10.3969/j.issn.1673-2006.2015.01.022
2014-10-15
国家自然科学基金“无机纳米微粒的层层自组装薄膜的制备及应用研究”(20871089);“高灵敏高选择磁性核壳纳米SERS探针的构筑及其对农药残留的检测研究”(21271136);宿州学院创新团队建设计划(2013kytd02)。
吴正(1988-),安徽安庆人,硕士研究生,主要研究方向:纳米复合材料研究。
*通讯作者:张莉(1967-),女,安徽宿州人,博士,教授,主要研究方向:纳米材料。
O643.32
A
1673-2006(2015)01-0079-03

