维生素E治疗迟发性运动障碍的效果及可能机制
李艳丽 谭云龙 张向阳 曹连元 邹义壮 苏建民 杨甫德 韩笑乐 周东丰
论著·临床
维生素E治疗迟发性运动障碍的效果及可能机制
李艳丽 谭云龙 张向阳 曹连元 邹义壮 苏建民 杨甫德 韩笑乐 周东丰
目的 观察维生素E(Vit E)治疗精神分裂症伴随的迟发性运动障碍(TD)的效果及可能的机制。方法 将80例TD患者随机分成两组,每组40例,分别采用安慰剂(对照组)、Vit E(治疗组,剂量为1200IU/d)治疗12周。在治疗始末分别进行阳性和阴性症状量表(PANSS)、异常不自主运动量表(AIMS)评定;并予分光光度法测定治疗前后血浆超氧化物歧化酶(SOD)、谷胱苷肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性及丙二醛(MDA)水平。结果 ①对照组治疗前后AIMS单项分及总评分比较,差异无统计学意义(P>0.05);治疗组AIMS除表情肌、全身单项评分外,其余各项分值及总评分均下降(P<0.05)。②Vit E可升高SOD活性[治疗前(85.8±18.3)U/ml、治疗后(101.5±25.1)U/ml]、CAT活性[治疗前(1.8±1.1)U/ml、治疗后(3.1±2.1) U/ml]、GSH-Px活性[治疗前(106.8±28.3)U/ml、治疗后(133.1±31.0)U/ml],降低MDA水平[治疗前(13.2±6.7)nmol/ml、治疗后(8.6±5.5) nmol/ml](P<0.05);安慰剂则对上述指标无明显影响(P>0.05)。结论 Vit E能有效改善TD症状,氧化应激可能是TD发病与演进的重要因素。
运动障碍;药物性;氧化应激;维生素E
迟发性运动障碍(Tardive dyskinesia,TD)是一种运动系统副反应,源于抗精神病药物的长期应用,平均发生率逾20%,在50岁以上的患者中发生率高达50%[1-2]。近年来,诸多学者对其发病机理进行了探索,由于多巴胺(Dopamine,DA)超敏假说对TD延迟出现、停药后不能自行缓解等现象不能给予合理解释,因此神经元变性假说受到的关注渐增。既往研究显示,TD发生的病理基础可能在于基底节神经元变性,而氧化应激与自由基代谢障碍在TD的发生及演进的过程中发挥着重要作用[3]。已有研究[4]采用抗氧化剂褪黑素治疗TD模型大鼠,结果支持抗氧化剂可有效缓解TD症状这一理论;临床研究结果则提示,6~8倍于常规剂量的褪黑素疗效更为显著[5]。本课题组前期研究运用抗氧化剂维生素E(VitE)治疗TD模型大鼠,提示Vit E可明显缓解TD模型大鼠的运动异常[6]。因此本研究采用大剂量Vit E对TD患者进行干预,探索其疗效及可能机制。
1 对象和方法
1.1 对象 受试者均为2012年9月-2013年12月在北京回龙观医院的住院患者,入组标准:①符合《国际疾病分类(第10版)》(International Classification of Diseases,tenth edition,ICD-10)精神分裂症诊断标准;②年龄18~60岁,性别不限;③异常不自主运动量表(Abnormal Involuntary Movement Scale,AIMS)总评分≥2分。排除标准:①脑器质性疾病及严重躯体疾患;②入组前12周内曾服用免疫调节剂、抗氧化剂;③精神症状明显波动,服药不合作。符合入组标准排除标准的TD患者共80例,采用Excel随机程序将患者分为对照组和治疗组各40例,分别采用安慰剂、Vit E(剂量1 200IU/d)治疗。经12周治疗,对照组脱落2例,治疗组脱落1例。纳入分析对照组38例(男性:28,女性:10),治疗组39例(男性:29,女性:10)。对照组年龄(52.9±7.7)岁,发病年龄(23.2±5.0)岁,总病程(28.7±8.8)年,第一次住院年龄(25.9±6.1)岁,住院次数(4.3±3.4)次,本次病程(14.1±7.8)年,目前运用抗精神病药物折合氯丙嗪剂量(359.0±234.0)mg/d;治疗组年龄(54.5±7.1)岁,发病年龄(25.9±7.1)岁,总病程(29.4±7.8)年,第一次住院年龄(27.7±9.0)岁,住院次数为(3.5±2.2)次,本次病程(12.9±6.7)年,目前运用抗精神病药物折合氯丙嗪剂量(341.0±192.0)mg/d。两组性别、年龄、发病年龄、第一次住院年龄、总病程、本次病程、住院次数、抗精神病药物折合氯丙嗪剂量比较,差异无统计学意义(P>0.05)。此外,本研究还纳入了性别、年龄匹配的44例正常健康组,其中男性35例,女性9例,年龄(46.0±6.1)岁,均为北京回龙观医院职工或昌平、通州区社区的健康居民,无精神疾病家族史,检测相关生化指标的正常值。本研究获得北京回龙观医院伦理委员会批准,受试者知情同意并签署知情同意书。
1.2 方法
1.2.1 TD诊断工具及评分标准 依照Schooler等[7]的TD研究诊断标准,对全院13个病区的住院患者运用AIMS进行筛选(总分≥2分),对TD的严重程度进行评估。根据AIMS总分减分率对两组患者进行分层:减分率≥50%,30%<减分率<50%、减分率≤30%[8],比较Vit E、安慰剂对TD的疗效。减分率=(治疗后总分-治疗前总分)/治疗前总分×100%。
1.2.2 精神状况评定 所有入组患者的精神状况采用PANSS评定,评价指标为阳性症状评分、阴性症状评分以及PANSS总评分。
1.2.3 生化指标测定 于6:30-7:00am.取空腹静脉血5ml,肝素抗凝,离心分离血浆备用;按照超氧化物歧化酶(SOD)、谷胱苷肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所)提供的方法进行各项生化指标的测定,吸光度采用比色法测定, SOD、GSH-Px、CAT活性以及MDA水平均依照公式换算而成。上述指标由同一人进行双点测定并取平均值。
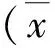
2 结 果
2.1 治疗组和对照组治疗前后PANSS、AIMS评分比较 治疗前,两组间PANSS、AIMS各项评分比较,差异无统计学意义(P>0.05);治疗后,两组PANSS阴性症状评分均较治疗前低,差异有统计学意义(P<0.05),组间比较差异无统计学意义(P>0.05)。治疗组在治疗前后AIMS除表情肌、全身评分外,其余各项评分均下降(P<0.05),对照组治疗前后AIMS各项评分比较,差异无统计学意义(P>0.05)。见表1。
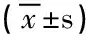
表1 治疗组与对照组PANSS、AIMS评分比较或M(Q1,Q3)
2.2 治疗组与对照组AIMS总评分减分率比较 根据AIMS总评分不同的减分率对两组患者进行分层,比较Vit E、安慰剂对TD的疗效。研究结果显示,治疗组减分率≥50%的14例,对照组2例;30%<减分率<50%,治疗组10例,对照组1例;TD症状缓解不明显的,治疗组与对照组分别为2例和11例。两组比较,差异有统计学意义(P<0.05)。
2.3 两组治疗前后以及两组治疗前与正常组各项生化指标比较 治疗组、对照组治疗前SOD、GSH-Px活性明显低于正常组(P<0.05),MDA 浓度明显高于正常组(P<0.05),未发现三组间的CAT活性存在差别(P>0.05);治疗前治疗组、对照组两组间血浆SOD、GSH-Px、CAT活性、MDA水平比较,差异无统计学意义(P>0.05);治疗后,SOD、GSH-Px、CAT活性升高,MDA水平下降,差异有统计学意义(P<0.05)。见表2。
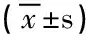
表2 正常组、治疗前后血浆SOD、GSH-Px、CAT活性及MDA浓度
注:与正常组比较,aP<0.05;与治疗前比较,bP<0.05
3 讨 论
DA受体拮抗剂的长期使用可导致DA代谢加快及释放增加,有研究表明,DA代谢率增加可通过生成的羟自由基、多巴醌等自由基的中介作用导致神经元的变性与凋亡[9-10]。自由基破坏细胞膜的脂质双分子层以影响其稳定性,使重要的功能蛋白质氧化,导致细胞的变性或者死亡。TD的发生可能与长期使用抗精神病药物所致的DA功能活动亢进、自由基生成增加,并由此导致某些脑区的神经元的病理改变有关[11]。Vit E为脂溶性自由基俘获剂,可插入质膜,阻断脂质过氧化级链反应,使自由基、脂质过氧化物生成减少,可能对TD有防治作用[12]。有学者运用脑神经瘤Neuro-2a细胞开展研究,结果提示自由基导致神经元变性、死亡前,可使轴突变性,其机制可能为质膜的脂质过氧化,而Vit E可通过俘获过氧化和烷自由基以缓解这一变性过程[13]。
本研究显示,经Vit E系统治疗12周,TD患者AIMS总评分及各分项评分(除表情肌、全身单项分外)均下降,差异有统计学意义(P<0.05);治疗前后对照组各分值则无显著变化。重复测量方差分析结果显示,Vit E的疗效显著优于安慰剂。诸多学者也有类似发现,采用Vit E治疗8~12周,AIMS总评分减分率为19%~55%[12,14]。Adler等[15]采用Vit E(1 600IU/d)和安慰剂干预,开展了随机双盲对照研究,经过10周的治疗,TD症状显著缓解;而进一步延长治疗周期,患者异常不自主运动症状评分并不能随之下降,由此推测,10周可能是Vit E治疗TD的最佳疗程。本研究只设计了基线及重点随访,尚不能推断该结论。
本项目组前期研究显示,自由基代谢异常在TD发生、发展过程中起关键作用[6],导致抗氧化酶如SOD、GSH-Px、CAT等活性下降,脂质过氧化物如血浆MDA生成增加[16]。本研究的结果显示,治疗组、对照组SOD、GSH-Px活性低于正常组(P<0.05),MDA 浓度高于正常组(P<0.05);Vit E治疗能够有效提高患者SOD、GSH-Px、CAT的活性,降低血浆MDA的水平(P<0.05);安慰剂对SOD、GSH-Px、CAT活性,MDA浓度无显著影响。本结果未显示治疗组、对照组治疗前与正常组三组间的CAT活性存在差别,这可能与该酶的活性不够稳定有关。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,对机体产生的自由基进行清除,保护机体免遭损伤。SOD是自由基代谢关键酶,在机体尤其是大脑组织中分布广泛,对缺血、谷氨酸毒性导致的神经元损伤有良好的保护作用,这种保护作用可能通过促进自由基代谢来实现[17-18]。MDA则是脂质过氧化的终产物。本研究结果显示,治疗组、对照组血浆MDA 浓度高于正常组(P<0.05),既往的动物实验也得到相同结果[6]。原因在于体内自由基浓度的增加,且其代谢酶系统出现障碍,从而导致细胞质膜过氧化,此时MDA 浓度的增加提示了细胞损伤程度的加剧。既往研究也显示,老龄大鼠海马神经元基础培养或暴露于去极化剂中,突触小体通过改变K+、Na+浓度升高膜电位,同时,突触小体内Ca2+浓度升高,导致神经元的变性和凋亡,而Vit E可通过提高抗氧化酶的活性逆转这一改变,同时改善老龄大鼠的认知功能[19]。不仅如此,Vit E的长期干预可缓解脑白质变性的进程[20]。由此推测,Vit E的治疗作用可能是通过抗氧化、减少自由基的损伤来实现的。
综上所述,Vit E可能是通过缓解自由基损伤而对TD发挥治疗作用,证实了研究假设。但是由于本研究样本较小,设计的随访点较少,要明确Vit E治疗的适宜剂量、最佳疗程及安全性等还需进一步探索。而TD作为较严重的药物不良反应,其病理生理机制至今尚未阐明,也缺乏有效干预手段,进一步探讨神经元损伤和保护因素的失衡在TD发病机制中的作用,开发具有自由基俘获和神经营养效应的药物,或者某些非药物治疗方法对TD进行预防与治疗,是课题组未来的研究方向。
[1] Glazer WM, Morgenstern H, Schooler N, et al. Predictors of improvement in tardive dyskinesia following discontinuation of neuroleptic medication[J]. Br J Psychiatry,1990,157:585-592.
[2] Yassa R, Jeste DV. Gender differences in tardive dyskinesia: a critical review of the literature[J]. Schizophr Bull, 1992,18(4):701-715.
[3] 谭云龙,周东丰,曹连元,等.抗精神病药所致迟发性运动障碍患者血浆超氧化物歧化酶、过氧化化氢酶、谷胱苷肽过氧化物酶活性及丙二醛水平的改变[J].中华精神科杂志,2005,38(3):142-145.
[4] Abilio V,Vera J,Ferreira L, et al. Effects of melatonin on orofacial movements in rats[J]. Psychopharmacolog,2002,161(4):340-347.

[6] 谭云龙, 周东丰, 邹义壮, 等.维生素E对迟发性运动障碍模型大鼠的影响[J].中华精神科杂志, 2004, 37(3):179-181.
[7] Schooler NR, Kane JM. Research diagnoses for tardive dyskinesia[J]. Arch Gen Psychiatry,1982,39(4):486-487.
[8] 张兴理,谭云龙,苏建民,等.柴胡桃仁汤对迟发性运动障碍的治疗及可能机制[J].中国新药杂志,2009,18(14):1312-1315.
[9] Bishnoi M, Chopra K, Kulkarmi SK. Possible anti-oxidant and neuroprotective mechanisms of zolpidem in attenuating typical anti-psychotic-induced orofacial dyskinesia: a biochemical and neurochemical study[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2007, 31(5):1130-1138.
[10] Andreassen OA, Jrgensen HA. Neurotoxicity associated with neuroleptic-induced oral dyskinesia in rats. Implication for tardive dyskinesia[J]. Progress in Neurobiology,2000,61(5):525-541.
[12] Elkashef AM, Wyatt RJ.Tardive dyskinesia: possible involvement of free radicals and treatment with vitamin E[J]. Schizophr Bull, 1999, 25(4):731-740.
[13] Fukui K, Sekiguchi H, Takatsu H, et al. Tocotrienol prevents AAPH-induced neurite degeneration in neuro2a cells[J]. Redox Rep,2013,18(6):238-244.
[14] Ricciarelli R,Argellati F,Pronzato MA, et al.Vitamin E and neurodegenerative diseases[J]. Mol Aspects Med,2007,28(5-6):591-606.
[15] Adler LA, Edson R, Lavori P, et al. Long-term treatment effects of vitamin E for tardive dyskinesia[J]. Biol Psychiatry,1998,43(12):868-872.
[16] Zhang XY, Tan YL, Zhou DF, et al. Disrupted antioxidant enzyme activity and elevated lipid peroxidation products in schizophrenic patients with tardive dyskinesia[J]. J Clin Psychiatry,2007,68(5):754-760.
[17] Lohr JB. Oxygen radicals and neuropsychiatric illness[J]. Arch Gen Psychiatry,1991,48(12):1097-1106.
[18] Cho CH, Lee HJ. Oxidative stress and tardive dyskinesia: pharmacogenetic evidence[J]. Prog Neuropsychopharmacol Biol Psychiatry,2013,46:207-213.
[19] Thakurta IG, Banerjee P, Bagh MB, et al. Combination of N-acetylcysteine, α-lipoic acid and α-tocopherol substantially prevents the brain synaptosomal alterations and memory and learning deficits of aged rats[J]. Exp Gerontol,2014,50:19-25.
[20] Gopalan Y, Shuaib IL, Magosso E, et al. Clinical investigation of the protective effects of palm vitamin E tocotrienols on brain white matter [J]. Stroke,2014,45(5):1422-1428.
Treatment of vitamin E on the patients with tardive dyskinesia and possible mechanisms
LIYan-li1,TANYun-long1*,ZHANGXiang-yang1,CAOLian-yuan1,ZOUYi-zhuang1,SUJian-min1,YANGFu-de1,HANXiao-le1,ZHOUDong-feng2
1PsychiatryResearchCenter,BeijingHuilongguanHospital,PekingUniversityTeachingHospital,Beijing100096,China2TheSixthHospital,PekingUniversity,KeyLaboratoryofMentalHealth,MinistryofHealth,Beijing100191,China*Correspondingauthor:TANYun-long,E-mail:yltan21@126.com
Objective To evaluate the therapeutic effects of vitamin E (Vit E) on the AIMS scores in schizophrenic patients with tardive dyskinesia(TD) and possible therapeutic mechanisms. Methods Eligible patients(n=80) would be randomized to receive vitamin E(1 200U/d)or placebo. The present study would be double blinded and last for 12 weeks. The symptoms of TD and psychopathology were assessed by using Abnormal Involuntary Movement Scale(AIMS) and Positive and Negative Symptoms Scale(PANSS) respectively, the plasma superoxide dismutase(SOD),catalase(CAT),glutathione peroxidase(GSH-Px)activities and maleicdialdehyde(MDA)levels were assayed.Results ①Vit E could be markedly effective in reducing the severities of dyskinesia in patients of TD, but the placebo could not improve the AIMS scores. ②The Vit E might increase the activities of SOD [baseline (85.8±18.3)U/ml, after treatment (101.5±25.1)U/ml], CAT[baseline (1.8±1.1)U/ml, after treatment (3.1±2.1) U/ml], GSH-Px [ baseline (106.8±28.3)U/ml, after treatment (133.1±31.0) U/ml] and decrease the levels of MDA[baseline (13.2±6.7)nmol/ml, after treatmDent (8.6±5.5)nmol/ml] significantly (P<0.05), however, the placebo could not effect on the biochemistry measures.Conclusion Vit E is markedly effective on reducing the severity of dyskinesia in TD, and oxidative damages might be key pathophysiological factor of TD.
Dyskinesia, Drug-induced;Oxidative stress;Vitamin E
首都临床特色应用研究基金资助项目(Z121107001012035)
100096 北京大学教学医院北京回龙观医院精神医学研究中心(李艳丽,谭云龙,张向阳,曹连元,邹义壮,苏建民,杨甫德,韩笑乐);100191 北京大学第六医院,卫生部精神卫生学重点实验室(周东丰)
谭云龙,E-mail:yltan21@126.com
R749
A
10.11886/j.issn.1007-3256.2015.05.006
2015-06-01)

