表达US3基因腺病毒载体下调CTL和NK细胞对其转染肝细胞杀伤活性的影响
王 鹏,李 玲,阚全程,潘 雪,余祖江,张振香,冯 婷
(1.郑州大学护理学院基础教研室,河南郑州 450052;2.郑州市第九人民医院姑息治疗暨安宁疗护病区,河南郑州 450052;3.郑州大学第一附属医院感染科,河南郑州 450052)
表达US3基因腺病毒载体下调CTL和NK细胞对其转染肝细胞杀伤活性的影响
王 鹏1,李 玲2,阚全程3,潘 雪1,余祖江3,张振香1,冯 婷1
(1.郑州大学护理学院基础教研室,河南郑州 450052;2.郑州市第九人民医院姑息治疗暨安宁疗护病区,河南郑州 450052;3.郑州大学第一附属医院感染科,河南郑州 450052)
目的 研究表达US3基因重组腺病毒载体对其转染肝细胞介导的免疫逃逸活性。方法 首先构建表达US3基因腺病毒载体,扩增纯化后转染HL-7702肝细胞,利用细胞毒性T细胞(CTL)杀伤实验和自然杀伤细胞(NK)杀伤实验,检测表达US3基因重组腺病毒载体的免疫活性。结果 表达US3基因的重组腺病毒r-US3成功构建,r-US3能够明显降低CTL和NK细胞对转染肝细胞的杀伤活性。结论 表达US3基因腺病毒载体在一定程度上能够介导转染肝细胞的免疫逃逸,降低机体免疫系统对转染肝细胞的排斥反应。
免疫逃逸;重组腺病毒;US3;细胞毒性T淋巴细胞(CTL);自然杀伤细胞(NK)
肝细胞移植(hepatocyte transplantation,HT)是从20世纪70年代开始发展起来的一项细胞工程技术,是将正常成年的或不同发育阶段的肝细胞、肝潜能细胞、基因修饰型肝细胞以及相关的肝脏生长刺激因子,在一定条件下通过不同途径,将其移植到受体适当的靶位,使之在相应的部位定居、存活、增殖、修复或重建肝组织结构,发挥正常肝脏功能,用以治疗急、慢性肝功能衰竭或某些代谢性疾病造成的各种终末期肝病的一种肝脏组织工程学手段[1]。相对于原位肝移植(orthotopic liver transplantation,OLT),HT可一肝多用,重复移植,在一定程度上能够缓解供肝短缺的问题,也可起到临时过渡作用,为肝脏移植争取时间,且创伤小、操作安全简单、费用低廉。因此,近年来HT越来越受到国内外学者的广泛重视,具有广阔的临床应用前景,但免疫排斥问题仍是HT面临的一个主要问题。
随着高效转染基因工程的发展,基因治疗被系统地引入器官移植[2],并渗入到器官移植领域的各个分支,肝细胞具有了基因修饰的可能性[3-4]。将治疗基因导入肝细胞后移植于受体,既能满足移植的需要,又能通过转染、基因干扰或敲除等技术使肝细胞获得所需的特性,达到防治肝脏疾病的目的。通过基因修饰使移植肝细胞获得免疫逃逸的活性已成为目前国内外HT的研究热点。
研究发现,人类巨细胞病毒(human cytomegalovirus,HCMV)编码的具有免疫调控基因片段US3基因与HCMV病毒的免疫逃逸活性关系密切[5]。本研究构建表达US3基因的腺病毒载体,转染HL-7720肝细胞,通过细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)杀伤实验和自然杀伤细胞(natural killer,NK)杀伤实验,研究表达US3基因腺病毒载体介导转染肝细胞的免疫逃逸活性,为肝细胞移植和基因治疗提供新的探索方向。
1 材料与方法
1.1 细胞株293T细胞株,HL-7702肝细胞株购自中国科学院细胞库。
1.2 试剂琼脂糖、胰蛋白胨、酵母提取物、琼脂粉购自英国OXOID公司。DMEM高糖培养基、RPMI 1640培养基和胎牛血清购于美国GIBCO公司。限制性内切酶、T4DNA连接酶购自New England Biolab公司,高保真Pfu DNA Polymerase酶购自美国Promega公司。质粒提取试剂盒、PCR清洁试剂盒、胶回收试剂盒购自北京transgen公司。其余试剂购自Sigma公司。
1.3 US3-His-tag融合基因的扩增临床采集HCMV型阳性标本,提取病毒DNA,PCR扩增US3基因,上游引物含有Hin dⅢ酶切位点,下游引物含有Eco RⅤ:sense:5'-CCGAAGCTTATGAAGCCGGTGTTGGTGCTCGC-3',antisense:5'-GCCGATATCAATAAATCGCAGACGGGCGCTCAC-3',依照说明书要求,依次加入模板DNA、上下游引物、Pfu DNA Polymerase、d NTPs、10×PCR Buffer及适量的dd H2O,建立50μL PCR反应体系,95℃预变性2 min后,95℃30 s,60℃30 s,72℃2 min,进行35个循环后,72℃延伸5 min。用10 g/L琼脂糖凝胶电泳鉴定PCR扩增产物并测序。
测序正确的序列通过PCR扩增,链接His-tag序列,得到US3-His-tag融合基因。引物为:sense:5'-CCGAAGCTTATGAAGCCGGTGTTGGTGCTCGC-3',antisense:5'-GCCGATATCTTAATGATGATGATGATGATGAAT-3'。用10 g/L琼脂糖凝胶电泳鉴定PCR扩增产物,测序鉴定。
1.4 重组腺病毒r-US3载体的构建扩增好的US3-His-tag融合基因与提取的p Ad Track-CMV质粒的酶切片段用T4DNA Ligase酶连接,转化感受态DH5α,筛选阳性克隆,酶切鉴定后,测序鉴定。测序正确的克隆命名为p Ad Track-US3载体。
p Ad Track-US3载体PmeⅠ单酶切线性化后,加入含p AdEasy-1质粒的感受态BJ5183细菌中同源重组,进行酶切鉴定和测序,构建成功的重组腺病毒载体命名为p AdEasy-US3。PacⅠ单酶切后,采用脂质体转染法在293T细胞中进行包装,构建重组腺病毒r-US3,并进行CsCl梯度纯化和滴度测定。同样的方法构建空载体重组腺病毒r-Track,作为生物活性鉴定实验的对照。
1.5 重组腺病毒对HL-7720肝细胞的感染效率培养生长状况良好的HL-7702细胞计数后接种于12孔板,每孔接种细胞105个,50 m L/L CO2,37℃培养。24 h后用MOI分别为50、100和200的重组腺病毒液r-US3感染各孔细胞,每个浓度接种3个平行孔。培养6 h换液后,继续培养至48 h,荧光显微镜下计数荧光细胞数和细胞总数,计算感染效率,相同实验重复3次。以同样的方法,测定重组腺病毒r-Track的感染效率。
1.6 重组腺病毒对肝细胞HL-7702生长活性的影响培养生长状况良好的HL-7702细胞分别转染r-Track和r-US3重组腺病毒(MOI为100)后,分别在0、24、48、72 h加入5 mg/m L MTT溶液,37℃孵育4 h,小心吸取孵育液后,加入1 m L DMSO混合均匀,10 min后,测定吸光度(A)值。每组细胞测定3个平行孔,相同实验重复3次。
1.7 重组腺病毒对淋巴细胞特异性CTL杀伤活性的影响将培养生长状况良好的HL-7702细胞,接种于12孔板,每孔106个,50 m L/L CO2,37℃培养24 h。细胞分为3个组,分别为r-US3组、r-Track组和正常对照组。各组细胞分别加入MOI为100的重组腺病毒r-H-ICP47、r-Track和RPMI 1640培养液,培养6 h换液后,继续培养至48 h。各组加入终质量浓度为50μg/m L的丝裂霉素C,培养45 min,弃上清,PBS清洗,调整细胞浓度作为靶细胞。
采集健康人志愿者外周抗凝血,梯度密度沉淀法分离外周血单核细胞(peripheral blood mononuclear cells,PBMCs),调整细胞密度为5×106个/m L,接种于6孔培养板,培养4 h。吸出未贴壁细胞(富含大量的T淋巴细胞)作为效应细胞。按照效靶比20∶1混合效应细胞与各组靶细胞。另以效应细胞自身为空白对照。每组均做3个平行孔,MTT法测定CTL杀伤活性。将正常对照组CTL杀伤活性设为100%调整各组结果,相同实验重复3次。
1.8 NK细胞杀伤活性的影响梯度密度沉淀法常规分离PBMCs,PBS洗涤后计数,每107个细胞加入80μL缓冲液和20μL抗CD56免疫磁珠,4℃孵育15 min,加入1 m L的缓冲液,1 500 r/min离心10 min,弃上清,缓冲液重悬后加入Mini MACS磁场中,进行磁珠分离,分选的CD56+细胞即为NK细胞,培养24 h后作为效应细胞。培养生长状况良好的HL-7702细胞接种于12孔板,分为r-US3组、r-Track组和正常对照组,各组分别加入MOI为100的重组腺病毒r-H-ICP47、r-Track和RPMI 1640培养液培养48 h后作为靶细胞。按照效靶比20∶1混合效应细胞和靶细胞,另以效应细胞自身为空白对照。每组均做3个平行孔,NK细胞杀伤活性采用乳酸脱氢酶释放法测定。将正常对照组CTL杀伤活性设为100%调整各组结果,相同实验重复3次。
1.9 统计学方法结果以均数±标准差(±s)表示,数据分析采用SPSS 10.0统计软件进行,多组间比较进行正态性检验和方差齐性检验后,采用单因素方差分析(One-way ANOVA),P<0.05为差异具有统计学意义。
2 结 果
2.1 pAdTrack-US3酶切鉴定结果载体p Ad Track-US3用Hin dⅢ和Eco RⅤ双酶切后,约在590 bp处有一明显条带,而单酶切时未见此条带(图1),证明U3-His-tag融合基因成功连接于p Ad Track-CMV载体。
2.2 重组腺病毒载体p Ad Easy-US3载体的测序结果表达US3-His-tag融合基因的腺病毒载体测序结果见图2,与NCBI数据库比对,证明成功构建了表达US3-His-tag融合基因的腺病毒载体。

图1 p Ad Track-US3载体酶切鉴定结果Eig.1 Analysis of p Track-ICP47 with Hin dⅢand Eco RV l:p Track-US3/Hin dⅢ;2:p Track-US3/Eco RV;3:p Track-US3/ Hin dⅢ和Eco RV;4:DNA Marker DL15000。
2.3 重组腺病毒载体对肝细胞HL-7702的转染效率随着MOI的加大,重组腺病毒r-US3和r-Track对HL-7702细胞的感染效率逐渐增加(图3)。当MOI为100时,重组腺病毒载体r-US3和r-Track对HL-7702细胞的感染效率分别为(87.35±3.22)%和(85.46±2.42)%,均明显高于MOI为50时的感染效率即(32.55±5.02)%和(28.17±2.32)%(P<0.05),而与MOI为200时的感染效率即(93.56± 3.35)%和(88.86±3.86)%差异无统计学意义(P>0.05)。为了尽可能降低重组腺病毒对转染细胞的毒性,本研究在随后的实验过程中采用了MOI为100的感染剂量。
2.4 重组腺病毒对肝细胞HL-7702生长活性的影响MOI为100的重组腺病毒转染HL-7702肝细胞后,采用MTT法测定肝细胞HL-7702生长活性的结果(图4)显示,与正常对照组相比,r-Track组和r-US3组对转染肝细胞的生长活性没有明显影响,3组间差异无统计学意义(P>0.05)。
2.5 重组腺病毒对特异性CTL杀伤活性的影响MOI为100的重组腺病毒转染HL-7702肝细胞后,进行CTL杀伤活性实验,将正常对照组CTL杀伤活性设为100%调整各组的结果(图5)显示,r-US3组能明显降低CTL对转染肝细胞的特异性杀伤活性[(90.33 ±4.04)%],与正常对照组[(100.00±0.00)%]和r-Track组[(105.00±2.65)%]相比差异有统计学意义(P<0.05),而正常对照组和r-Track组之间差异无统计学意义(P>0.05)。
2.6 重组腺病毒对NK细胞杀伤活性的影响MOI为100转染HL-7702肝细胞后,进行NK细胞杀伤活性实验,将正常对照组CTL杀伤活性设为100%调整各组的结果(图6)显示,r-US3组能明显降低NK细胞对转染肝细胞的特异性杀伤活性[(88.63± 2.06)%],与正常对照组[(100.00±0.00)%]和r-Track组[(101.27±1.62)%]相比差异有统计学意义(P<0.05),而正常对照组和r-Track组之间差异无统计学意义(P>0.05)。

图2 重组腺病毒载体p AdEasy-US3载体的测序结果Eig.2 The sequencing identification of p Ad Easy-US3

图3 重组腺病毒载体对肝细胞HL-7702的转染效率Eig.3 Efficiency of transfection with r-US3/r-Track in HL-7702 cells(n=9)

图4 重组腺病毒对肝细胞HL-7702生长活性的影响Eig.4 Effects of transfection with r-US3/r-Track on cell viability(n=9)
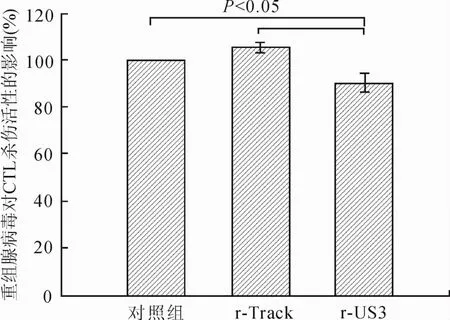
图5 重组腺病毒对CTL杀伤活性的影响Eig.5 Cytotoxicity of CTL activated by HL-7702 cells transfected with r-US3/r-Track(n=9)
3 讨 论

图6 重组腺病毒对NK细胞杀伤活性的影响Eig.6 Cytotoxicity of NK cells activated by HL-7702 cells transfected with r-H-ICP47/r-Track(n=9)
免疫排斥问题仍是目前器官移植和基因治疗有待解决的一个主要问题[6-7]。随着高效转染基因工程的发展,通过基因修饰使移植器官、组织或细胞获得免疫逃逸的活性成为研究热点。过去曾一度认为主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子仅能递呈内源性抗原肽,即引起CD8+T细胞活化的APCs(antigen presenting cells)只是能产生内源性抗原的靶细胞,然而,越来越多的证据表明,MHC-Ⅰ类分子也能够递呈外源性抗原诱导反应,具有吞噬功能的APC在激活CTL的应答过程中发挥着关键性作用。因此,MHC-Ⅰ类抗原呈递途径在器官移植免疫排斥方面的研究中越来越引起人们的关注[8]。
病毒是典型的胞内感染,干扰感染细胞表面MHC-Ⅰ类分子抗原呈递途径来逃避免疫清除的策略被许多病毒所利用。病毒可运用各种机制干扰MHC-Ⅰ类分子的成熟、组装和输出,作用于MHC-Ⅰ类抗原肽复合物形成的各环节,在其生活周期的不同阶段均可以干扰MHC-Ⅰ类抗原呈递,从而产生病毒逃逸,减少机体对病毒的清除。有研究表明,表达E3-gp19k基因的腺病毒载体可加强外源基因的表达活性和延长外源基因表达的持续时间,而不需要免疫抑制剂[9]。例如,艾伦·P·埃舍尔等[10]研究构建了可以编码E3-gp19k基因的质粒并给NOD小鼠接种,可导致糖尿病的发病延迟,发病率降低,用于预防或治疗包括Ⅰ型糖尿病在内的多种自身免疫性疾病。
单纯疱疹病毒Ⅰ型基因序列编码的立即早期感染性细胞蛋白47(infected cell protein 47,ICP47)能与抗原多肽竞争抗原加工相关转运子(transporter associated with antigen presentation,TAP)的肽结合位点,阻碍了抗原多肽和MHC-Ⅰ类分子在内质网内的结合,有效地降低CTL的识别和杀伤活性,逃逸宿主的免疫清除[11]。作者前期将ICP47基因连接于腺病毒载体,构建了表达ICP47的重组腺病毒[12-13],分别转染了HL-7702肝细胞株、DCs和淋巴细胞,结果发现,表达ICP47基因的重组腺病毒能够降低CTL对转染HL-7702肝细胞的特异性杀伤活性,降低DCs刺激淋巴细胞增殖的能力。这些结果在一定程度上提示:表达ICP47基因的腺病毒载体能够介导其转染细胞的免疫逃逸,降低CTL对转染细胞和腺病毒载体的识别和杀伤,达到外源基因长期表达的目的。
但是,病毒感染细胞表面MHC-Ⅰ类分子的表达与其对NK细胞的敏感性成反比。病毒感染细胞在破坏或下调MHC-Ⅰ类分子的同时,却成了NK细胞的攻击目标。因此,单纯降低病毒感染细胞表面MHC-Ⅰ类分子表达达不到理想的免疫逃逸效果。研究报道,HCMV病毒编码的具有免疫调控的基因片段US3基因,既可以选择性下调NK细胞兴奋性受体的优势配体MHC-Ⅰ-A和MHC-Ⅰ-B,又可对NK细胞抑制性受体的优势配体MHC-Ⅰ-C和MHC-Ⅰ-E不产生影响,在逃逸CTL杀伤的同时,还可避免NK细胞的免疫杀伤,能够更有效地逃逸宿主的免疫清除[5]。
本研究在已有的理论依据和前期实验的基础上,在腺病毒载体上连接US3-His-tag融合基因,构建可介导免疫逃逸的腺病毒载体,转染HL-7702肝细胞株,通过CTL杀伤试验和NK细胞杀伤实验,研究表达US3基因腺病毒载体的免疫逃逸活性。结果成功构建了表达US3基因的腺病毒载体,并在转染HL-7702细胞后,重组腺病毒载体r-US3能明显地降低CTL和NK细胞对转染肝细胞的杀伤活性。这些结果在一定程度上提示表达US3基因的腺病毒载体能够介导转染细胞的免疫逃逸,降低机体免疫系统对基因转染细胞的排斥反应。本研究为基因治疗、细胞移植或器官组织移植提供一种新的探索方向,拓展了病毒免疫学的研究领域,为器官衰竭甚至自身免疫性疾病的预防和治疗带来广阔的前景。
[1]NAKAMURA Y,MIZUGUCHI T,TANIMIZU N,et al.Preoperative hepatocyte transplantation improves the survival of rats with nonalcoholic steatohepatitis-related cirrhosis after partial hepatectomy[J].Cell Transplant,2014,23(10):1243-1254.
[2]郭峰,卢永刚,何建平.肝细胞移植研究进展[J].中国普通外科杂志,2007,16(8):803-805.
[3]刘世呈,李靖.肝细胞移植的研究进展[J].中国普外基础与临床杂志,2008,15(2):109-111.
[4]MURASAWA S,ASAHARA T.Gene modified cell transplantation for vascular regeneration[J].Curr Gene Ther,2007,7(1):1-6.
[5]O'CONNELL KA,HAN YF,THOMAS M,et al.Role of natural killer cells in a cohort of elite suppressors:Low frequency of the protective KIR3DS1 allele and limited inhibition of human immunodeficiency virus type 1 replication in vitro[J].J Virol,2009,83(10):5028-5034.
[6]MATSUMOTO S.Clinical allogeneic and autologous islet cell transplantation:update[J].Diabetes Metab J,2011,35(3):199-206.
[7]CANDIELLO JE,JARAMILLO M,GOH SK,et al.Role of substrates in diabetes therapy:stem cell differentiation and islet transplantation[J].Crit Rev Biomed Eng,2011,39(6):535-555.
[8]AISENBREY C,SIZUN C,KOCH J,et al.Structure and dynamics of membrane-associated ICP47,a viral inhibitor of the MHC I antigen-processing machinery[J].J Biol Chem,2006,281(41):30365-30372.
[9]HOLST PJ,ØRSKOV C,THOMSEN AR,et al.Quality of the transgene-specific CD8+T cell response induced by adenoviral vector immunization is critically influenced by virus dose and route of vaccination[J].J Immunol,2010,184(8):4431-4439.
[10]艾伦·P·埃舍尔,李逢春.预防与治疗自身免疫性疾病的物质:中国.CN200710097957.2[P].2007-10-24
[11]LAMPEN MH,VERWEIJ MC,QUERIDO B,et al.CD8+T cell responses against TAP-inhibited cells are readily detected in the human population[J].J Immunol,2010,185(11):6508-6517.
[12]WANG P,KAN QC,YU ZJ,et al.Construction and identification of a recombinant adenovirus vector expressing His-tag-ICP47 fusion gene[J].Life Sci J,2012,9(1):756-763.
[13]WANG P,KAN QC,YU ZJ,et al.Recombinant adenovirus expressing ICP47 gene suppresses the ability of dendritic cells by restricting specific T cell responses[J].Cellular Immunol,2013,282(2013):129-135.
(编辑 国 荣)
Attenuation on cytotoxic activities of T lymphocytes and NK cells against transgened hepatic cells by a recombinant adenovirus
vector expressing US3 gene
WANG Peng1,LI Ling2,KAN Quan-cheng2,PAN Xue1,YU Zu-jiang2,ZHANG Zhen-xiang1,EENG Ting1
(1.Basic Department,Nursing School of Zhengzhou University,Zhengzhou 450052;2.Department of Palliative Care and Hospice Care,the Ninth People's Hospital of Zhengzhou,Zhengzhou 450052;3.Department of Infection,the Eirst Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China)
Objective To investigate the activity of immune evasion induced by a recombinant adenovirus vector expressing US3 gene in HL-7702 hepatic cells with transferred gene.Methods We first constructed an adenovirus vector expressing US3 gene and transferred it into HL7702 hepatic cells.Then immunological activities of US3 were determined by testing outivities of T lymphocytes(CTL)and natural killer(NK)cells.Results r-US3 and r-Track were successfully constructed.r-US3 could attenuate the activities of CTL and NK cells to HL-7720 cells with transferred gene.Conclusion The adenovirus vector expressing US3 gene might induce the activity of immune evasion in cells with transferred gene,attenuating immune rejection of host against transgened hepatic cells.
immune evasion;recombinant adenovirus vector;US3;cytotoxic T lymphocyte;natural killer cell
Q812
A
10.7652/jdyxb201505016
2014-11-03
2015-03-30
河南省科技厅项目(No.122300410338,132102310138);河南省教育厅自然科学基金项目(No.12A310010);河南省卫生厅“5451”项目(No.201201065);国家留学基金委项目(No.201207045015);河南省骨干教师项目(No.2011GGJS-013);郑州市科技局项目(No. 10PTGS484-7,121PPTGG507-22)
Supported by the Eoundation of Science and Technology Planning Project of Henan Province(No.122300410338,132102310138),the Natural Science Eoundation of Henan Education Department(No.12A310010),“5451”Project of Henan Health Department(No.201201065),the Eoundation from China Scholarship Council(No.201207045015),the Eoundation for University Key Teachers of Henan Province(No.2011GGJS-013),and the Project of Science and Technology Planning Bureau of Zhengzhou(No.10PTGS484-7,121PPTGG507-22)
阚全程.E-mail:kanqczzu@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150803.1047.002.html(2015-08-03)

