MCM5和P16INK4A在宫颈鳞癌组织中的表达及其临床意义
刘丽娜,李 瑶,杨永秀,3,王慧君,赵静妮
(1.甘肃省妇幼保健院妇产科,甘肃兰州 730050;2.兰州大学第一临床医学院妇产科学,甘肃兰州 730000;3.兰州大学第一医院妇产科,甘肃兰州 730000)
◇临床研究◇
MCM5和P16INK4A在宫颈鳞癌组织中的表达及其临床意义
刘丽娜1,2,李 瑶1,杨永秀1,3,王慧君2,赵静妮2
(1.甘肃省妇幼保健院妇产科,甘肃兰州 730050;2.兰州大学第一临床医学院妇产科学,甘肃兰州 730000;3.兰州大学第一医院妇产科,甘肃兰州 730000)
目的探讨微小染色体维持蛋白-5(MCM5)与P16INK4A在宫颈癌组织、宫颈上皮内瘤变和正常宫颈组织中的表达及其意义。方法采用实时荧光定量PCR(Real-time PCR)和免疫组化法,分别检测MCM5和P16INK4Am RNA及蛋白在40例宫颈癌组织、11例低度宫颈上皮内瘤变(CINⅠ)、15例高度宫颈上皮内瘤变(CINⅡ~Ⅲ)和15例正常宫颈组织中的表达。结果①各不同宫颈组织中MCM5和P16INK4AmRNA及蛋白的表达趋势一致。宫颈癌组织中MCM5和P16INK4AmRNA的表达量和蛋白表达率均高于CINⅠ、CINⅡ~Ⅲ和正常宫颈组织。MCM5基因和蛋白在宫颈癌组织中的表达均比正常宫颈组织、CINⅠ、CINⅡ~Ⅲ高,差异均具有统计学意义(P<0.05);P16INK4A基因和蛋白在宫颈癌中的表达比正常宫颈组织、CINⅠ高,差异均有统计学意义(P<0.01),而与CINⅡ~Ⅲ间差异无统计学意义(P>0.05)。②MCM5 m RNA表达量和蛋白表达率与临床期别、分化程度相关,差异有统计学意义(P<0.01),与年龄无关(P>0.05);P16INK4Am RNA和蛋白表达与临床期别、年龄无关(P>0.05),而与分化程度相关,差异有统计学意义(P<0.01)。③在宫颈癌组织中MCM5和P16INK4A表达呈正相关(r=0.538,P<0.01)。结论MCM5和P16INK4A的高表达可能与宫颈癌的发生发展有关。MCM5可能成为宫颈癌肿瘤增生的新标志物;其与P16INK4A联合检测有助于进行CIN的分级和转归判断,有望提高宫颈癌的筛查率。
微小染色体维持蛋白5(MCM5);P16INK4A;宫颈鳞癌;免疫组化;实时荧光定量PCR
宫颈癌是全球女性最常见的第3大恶性肿瘤,也是导致女性癌症死亡的第4大原因[1]。统计显示,每年全球约有新发病例529 800人,而275 100人死于宫颈癌[2]。癌前病变中出现生物分子水平的异常,有助于在分子水平寻找新的有效生物标志物,进一步完善宫颈癌筛查,降低宫颈癌的发病率和死亡率。微小染色体维持蛋白-5(minichromosom maintenance proteins 5,MCM5)是微小染色体维持蛋白家族的成员之一,是近年肿瘤研究中新的细胞增殖生物指标,可作为增殖细胞的特殊生物标记物。DNA复制的调节紊乱可使基因变得不稳定,从而引起细胞异常增殖导致肿瘤的发生。MCM5在DNA复制的起始、延伸过程中发挥重要的作用,是影响微染色体有丝分裂稳定性的主要基因[3]。肿瘤的发生与细胞周期的调节失控有关,P16INK4A作为抑癌基因直接参与细胞周期调控,可能参与肿瘤的发生和发展。本研究采用Real-time PCR和免疫组化法检测不同宫颈组织中MCM5和P16INK4A的表达,探讨其与宫颈鳞癌临床病理特征间的关系及临床意义。
1 材料与方法
1.1 标本来源及一般情况收集2012年8月至2013年5月在兰州大学第一医院妇产科住院经宫颈活检及手术切除的66例患者的新鲜宫颈组织标本,其中11例CINⅠ,15例CINⅡ-Ⅲ,40例宫颈鳞癌。鳞癌患者平均年龄41岁(≤40岁16例,>40岁24例)。病理分级:高分化鳞癌(G1)9例,中分化鳞癌(G2)23例,低分化鳞癌(G3)8例。临床分期(按国际妇产科联盟FIGO 2009年标准):Ⅰa期5例,Ⅰb期10例,Ⅱa期9例,Ⅱb期16例。所有病例均未进行过化疗、放疗。切除的宫颈标本均经术后病理证实诊断。另取同期因子宫肌瘤或子宫脱垂行全子宫切除术患者的新鲜宫颈组织标本15例作为对照组。所有组织标本离体后分2份,一份迅速放入液氮冻存,另外一份置于100 mL/L的甲醛溶液固定,常规石蜡包埋。
1.2 主要试剂及仪器RNAiso Plus RNA提取试剂、PrimeScriptTMRT Master Mix(Perfect Real Time)逆转录试剂盒、SYBR Premix EX TaqTMⅡ荧光Real-time PCR试剂盒均购自大连宝生物公司。Real-time PCR仪(LightCycler480);兔抗人MCM5单克隆抗体、鼠抗人P16INK4A单克隆抗体、SABC免疫组化试剂盒及DAB显色试剂盒均购自博士德生物技术有限公司。
1.3 引物设计MCM5和P16INK4A引物由大连宝生物公司设计并合成,内参β-actin由上海生物工程公司设计合成。MCM5上游引物:5′-GAGATGCCCAGACACATGCAG-3′,下游引物:5′-ATGGAGTAGATGCCCATGATGGTA-3′,产物大小95 bp;P16INK4A上游引物:5′-CCCCACTACCGTAAATGTCCA-3′,下游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,产物大小114 bp;β-actin上游引物:5′-TCGTGCGTGACATTAAGG-3′,下游引物:5′-AGGAAGGAAGGCTGGAAG-3′。
1.4 Real-time PCR法检测MCM5和P16INK4AmRNA的表达
1.4.1 组织总RNA提取和cDNA合成 取50 mg待测样本组织,应用Plus RNA提取液,提取组织总RNA,用紫外分光光度仪测定其纯度,A(260)/A(280)值在1.8~2.1之间,之后立即进行反转录,每20μL反应体系中加入500 ng总RNA,反应体系为20μL,反转录条件:37℃15 min,85℃5 s,4℃。反应后cDNA置于-20℃冰箱保存备用。
1.4.2 SYBR实时荧光定量PCR及数据处理 应用LightCycler480实时荧光定量PCR仪检测MCM5和P16INK4AmRNA的相对表达量,按照TaKaRa荧光定量PCR反转录试剂盒操作说明进行。20μL PCR反应体系:其中cDNA含量为2μL,反应条件为95℃预变性30 s;PCR反应40个循环,95℃5 s,60℃20 s。循环结束后,绘制溶解曲线95℃1 min,65℃15 s;降温37℃30 s。由LightCycle Real-Time PCR软件自动记录荧光曲线并分析计算出Ct值。采用相对定量2-ΔΔct法计算目的基因的相对表达量,按以下公式计算:ΔΔCt =(目的基因Ct值-对应内参Ct值)病例组-(目的基因的Ct-内参Ct)对照组的均值,以β-actin作为内参,以正常对照作为基准,以2-ΔΔct表示实验组宫颈组织中mRNA的表达量相对于对照组的变化倍数[4]。
1.5 免疫组化SABC法检测MCM5和P16INK4A蛋白的表达常规石蜡切片脱蜡、水化,微薄修复后进行SABC法免疫组织化学染色,严格按照SABC试剂盒说明书进行操作,磷酸盐缓冲液替代一抗作为阴性对照。结果判断:MCM5以细胞核呈棕黄色染色为阳性标志。染色判断参考BUKHOLM等[5]提出的标准。计数≥500个肿瘤细胞,计算阳性细胞比率:<10%为(-),10%~30%为(+),31%~70%为(++),>70%为(+++)。P16INK4A阳性染色主要位于细胞核或细胞质内,阳性表达为棕黄色染色。观察有10个代表性视野,计数500个细胞中的阳性细胞数,取平均值,根据阳性细胞百分率和染色程度判断结果[6]。阴性:阳性细胞百分率<10%或染色强度与背景颜色无明显差异;弱阳性(+):阳性细胞百分率10%~30%,染色强度较弱;中度阳性(++):阳性细胞百分率31%~60%;强阳性(+++):阳性细胞百分率>60%。
1.6 统计学处理应用SPSS 16.0软件行统计学处理。荧光定量PCR结果以均数±标准差()表示;两组间比较,当方差齐时采用t检验,方差不齐时采用Mann-Whitney U秩和检验;多组间比较采用Kruskal-Wallis H秩和检验。免疫组化为计数资料,采用χ2检验或Fisher确切概率法,等级资料采用非参数秩和检验,相关性检验采用Spearman秩相关性分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 PCR扩增产物的特异性MCM5、P16INK4A基因的溶解曲线均显示为锐利的单一峰集中,无其他非特异峰形,说明扩增产物特异性较好。
2.2 MCM5和P16INK4A的mRNA在不同宫颈组织中的表达以正常宫颈组织中MCM5和P16INK4AmRNA的表达量作为标准。从正常宫颈组织、CINⅠ、CINⅡ~Ⅲ到宫颈癌,MCM5 mRNA的表达量呈渐进性增高,采用Kruskal-Wallis检验,4组间差异有统计学意义(χ2=55.03,P<0.001)。宫颈鳞癌组织中MCM5 mRNA的表达量分别高于正常宫颈组织、CINⅠ、CINⅡ~Ⅲ,差异均有统计学意义(P<0.05)。MCM5 mRNA在CINⅠ与CINⅡ~Ⅲ间表达量差异无统计学意义(P=0.911,表1)。
P16INK4AmRNA从正常组织、CINⅠ、CINⅡ~Ⅲ到宫颈癌组织,其表达量呈渐进增高。采用Kruskal-Wallis检验,4组间差异有统计学意义(χ2=44.147,P<0.01)。P16INK4AmRNA在宫颈癌中的表达量高于正常宫颈组织、CINⅠ,差异有统计学意义(P<0.01),其表达量亦高于CINⅡ~Ⅲ,但差异无统计学意义(P=0.100)。正常宫颈组织与CINⅠ之间,其表达量的差异无统计学意义(P=0.194,表1)。

表1 不同宫颈组织中MCM5和P16INK4AmRNA的相对表达量Tab.1 Expressions of MCM5 and P16INK4Am RNA in different cervical tissues
2.3 MCM5和P16INK4A mRNA表达水平与宫颈鳞癌临床病理特征的关系不同年龄组宫颈癌组织中MCM5 mRNA表达量的差异无统计学意义(P>0.05)。其与临床分期有关,MCM5 mRAN的表达量Ⅱa~Ⅱb期高于Ⅰa~Ⅰb期(P<0.05)。癌组织的病理学分级中,MCM5 m RNA的表达量随分级的升高而增高,其中G1中的表达低于G2、G3,均有统计学差异(P<0.05),而G2与G3间MCM5 mRNA表达量无统计学差异(P=0.857,表2)。
P16INK4AmRNA在宫颈癌组织中的表达量与年龄无相关性(P>0.05)。而在宫颈癌临床分期中,P16INK4AmRNA的表达量Ⅰa~Ⅰb期高于Ⅱa~Ⅱb期,但差异无统计学意义(P>0.05)。P16INK4AmRNA在癌组织分化程度中,从G1、G2到G3其表达量呈下降趋势,G1高于G2、G3,差异均有统计学意义(P<0.05),而P16INK4AmRNA在G2与G3的表达量无统计学差异(P=0.114,表2)。
2.4 MCM5和P16INK4A蛋白在宫颈鳞癌中的表达MCM5在正常宫颈组织内为弱表达,且仅限于基底层。CIN随着级别的进展,其阳性细胞从基底层上移,阳性细胞数量增多(图1)。MCM5在宫颈鳞癌组织中阳性呈弥漫分布,且染色增强(图1)。从正常宫颈组织、CINⅠ、CINⅡ~Ⅲ到宫颈鳞癌,MCM5阳性表达率逐渐升高,宫颈鳞癌中MCM5表达率分别高于正常宫颈组织、CINI、CINⅡ~Ⅲ,差异均有统计学意义(P<0.05),而CINI与CINⅡ~Ⅲ之间差异无统计学意义(P>0.05,表3)。

表2 宫颈癌组织中MCM5和P16INK4AmRNA的相对表达量与临床病理的关系Tab.2 Relationship of MCM5 and P16INK4AmRNA expressions in cervical cancer tissues with clinicopathological features
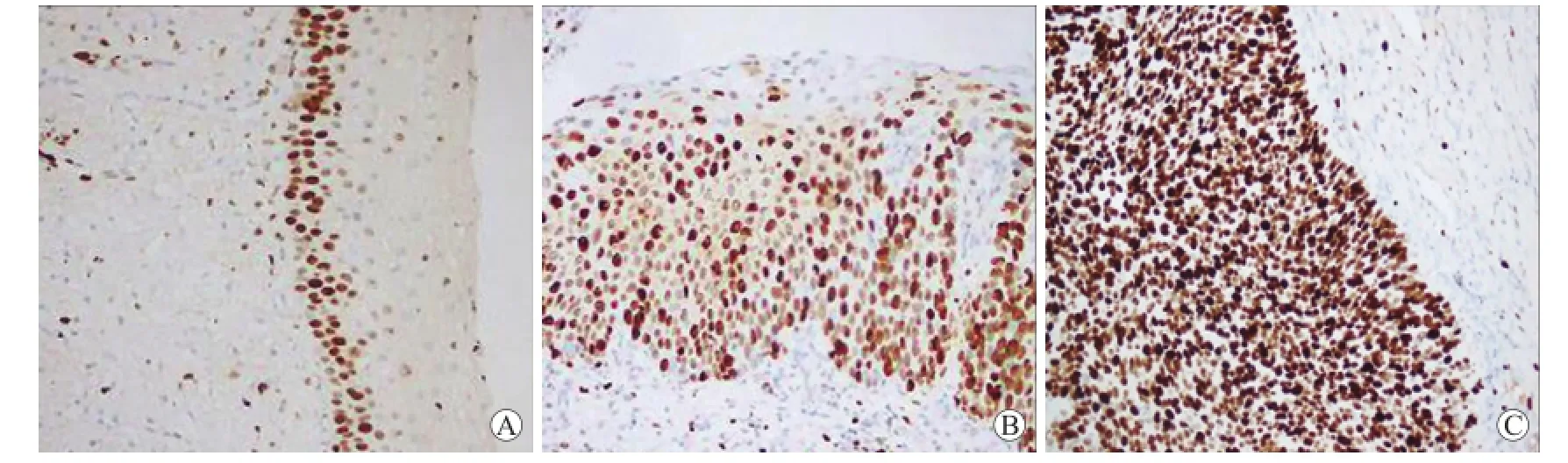
图1 MCM5在CINⅠ、CINⅢ、宫颈癌组织中的表达Fig.1 MCM5 protein expression in CINⅠ,CINⅢand cervical cancer tissues(SABC,×200)
P16INK4A的阳性表达呈棕黄色,定位于细胞核或细胞质(图2)。P16INK4A在正常宫颈组织、CINⅠ、CINⅡ~Ⅲ和宫颈癌组织中的阳性表达率分别为0%、27.3%、86.7%、97.5%。在正常宫颈组织与CINI之间、宫颈癌组织与CINⅡ~Ⅲ之间,表达差异无统计学意义(P>0.05),但宫颈癌组织与正常宫颈组织、CINⅠ之间,正常宫颈组织与CINⅡ~Ⅲ之间,CINⅠ与CINⅡ~Ⅲ之间,P16INK4A阳性表达差异均有统计学意义(P<0.05,表3)。
2.5 MCM5和P16INK4A蛋白表达与临床病理特征的关系及二者的相关性MCM5蛋白的表达与年龄无关(P>0.05),而与临床分期和病理分化程度有关。P16INK4A蛋白的表达与年龄、临床分期均无关(P>0.05),而与病理学分级有关,差异具有统计学意义(P<0.05,表4)。在宫颈癌组织中MCM5与P16INK4A的表达呈正相关(r=0.538,P<0.01,表5)。
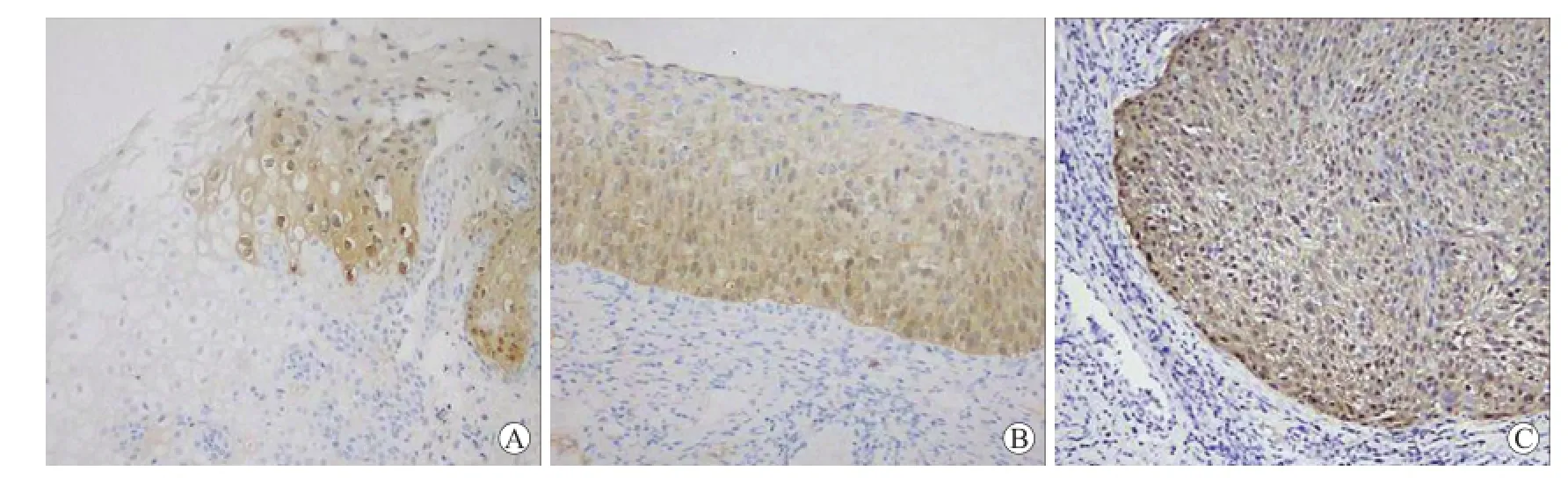
图2 P16INK4A在CINⅠ、CINⅢ、宫颈癌组织中的表达Fig.2 P16INK4Aprotein expression in of CINⅠ,CINⅢand cervical cancer tissues(SABC,×200)
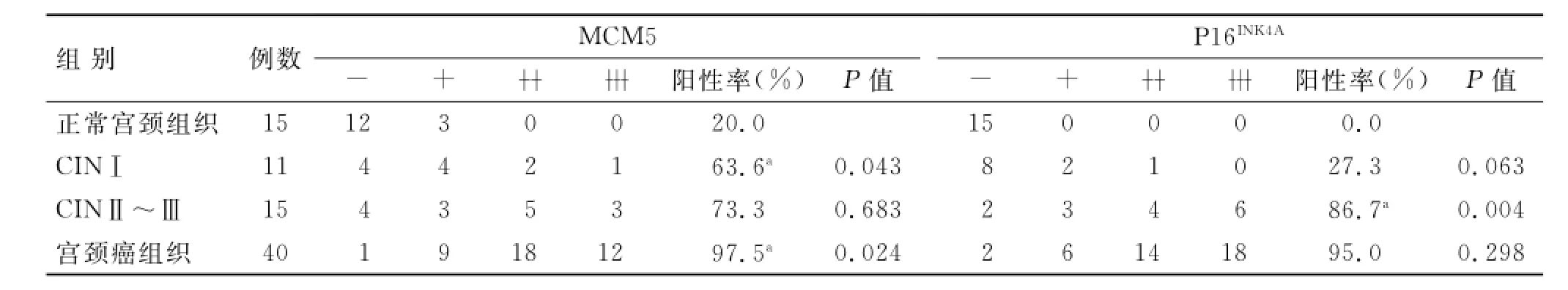
表3 MCM5和P16INK4A在不同组宫颈组织中的阳性表达Tab.3 MCM5 and P16INK4Aprotein expressions in different cervical tissues

表4 宫颈癌组织中MCM5和P16INK4A蛋白表达与临床病理的关系Tab.4 Relationship of MCM5 and P16INK4Aprotein expressions in cervical cancer tissues with clinicopathological features

表5 宫颈癌组织中MCM5和P16INK4A蛋白表达的相关性Tab.5 Correlation between expressions of MCM5 and P16INK4Aprotein in cervical cancer
3 讨 论
肿瘤的形成与细胞周期调控失常和细胞的增殖调控异常有关。DNA复制是细胞周期中不可或缺的一部分,MCM家族是启动DNA复制的重要部分且与细胞的增殖有关[7]。MCM蛋白在G1/S期达到峰值,进入静止期(G0期)或分化、衰老时,其表达下降或不表达,MCM5是MCM蛋白家族的成员,故可作为反映细胞增殖活性的特异分子标记物[8-9]。本研究结果显示,MCM5 mRNA和蛋白的表达变化从低级宫颈内瘤变开始,且阳性细胞随着病变程度不同,累积上皮范围亦不同,故可认为MCM5是宫颈癌发生的早期事件,可能与宫颈癌的发生发展有关。MURPHY等[10]研究显示,MCM5 mRNA在正常宫颈、CIN、宫颈鳞癌中的表达呈线性升高。本实验结果显示,MCM5 mRNA和蛋白在宫颈癌组织中的表达均明显高于正常组、CINⅠ、CINⅡ~Ⅲ,且其蛋白和基因表达趋势一致。本实验结果与之相似,提示MCM5的高表达与宫颈病变本身增殖活性程度一致。MCM蛋白是一种更理想的细胞增殖标志物,与增殖细胞抗原PCNA、Ki-67传统细胞增殖标志物相比,全面且准确反映细胞增殖活性[11-13]。MCM5的检测可以代表MCM蛋白家族,因此MCM5的表达可以反映宫颈不同增殖阶段中细胞的增殖活性,可作为宫颈病变细胞增殖特异性相关因子。本实验结果显示,MCM5的表达随着宫颈病变程度升高而增加,MCM5蛋白和mRNA的表达在正常宫颈组织与CINⅠ、CINⅡ~Ⅲ与宫颈癌比较,差异具有统计学意义;而CINⅠ与CINⅡ~Ⅲ比较无统计差异。因此,可以推断MCM5的高表达不但标志着恶性细胞的增殖,且标志着非典型性细胞和潜在恶性细胞的增生,故MCM5可能成为区分宫颈正常黏膜、宫颈上皮内瘤变及宫颈鳞癌的细胞增殖标记物,并且是恶性肿瘤和不典型增生的重要标记物,有望成为宫颈癌前病变及宫颈癌辅助诊断的指标。其与HA等[14]在人体多种肿瘤中对MCM蛋白测定结果和意义相近。WILLIAMS等[15]提出,将MCM5抗体检测应用于宫颈涂片来诊断异常的有恶变潜能的细胞具有高度的特异性和敏感性。本研究中MCM5的表达在CINⅠ与CINⅡ~Ⅲ之间差异无统计学意义,故推测不能依据MCM5的基因和蛋白表达变化判断CIN的分级,但可根据其在宫颈内瘤变组织和细胞中的表达水平,预测CIN是否具有潜在的恶变增殖能力、发展为恶性肿瘤的危险性大小及转归。本实验结果显示,在宫颈癌组织中随着肿瘤恶性程度的增加,MCM5基因和蛋白表达水平升高,与宫颈恶性肿瘤的分化程度呈反比,而与临床分期呈正比,即恶性程度越高,细胞的增殖也越旺盛,MCM5的表达水平也就越高。提示,MCM5与细胞的增殖密切相关,能够反映肿瘤中增生细胞的状况,与肿瘤的恶性程度有关。故检测MCM5的表达水平可能有助于判断宫颈癌的恶性程度。
P16INK4A基因又称多种肿瘤抑制基因(MTS1),参与细胞周期调控。P16INK4A基因及其产物的失活引起细胞周期调节失控,细胞过度增殖导致肿瘤的形成[16-17]。有研究显示,在大多数恶性肿瘤中P16INK4A基因表达缺失,但国内外对宫颈癌P16INK4A的研究结果不尽相同,多报道为过表达[18]。一般在病变早期形态学改变未被观察到时,已经可以在基因水平观察和检测到分子生物标志物的改变,故本研究完成P16INK4A从基因到蛋白水平在不同宫颈病变组织中的检测。本研究发现,P16INK4Am RNA表达量随宫颈病变程度的增加而升高;P16INK4A蛋白在正常组织中表达为阴性,而在CINⅠ、CINⅡ~Ⅲ和宫颈癌中均有表达,且随着病变的进展其阳性表达率和染色程度呈上升趋势,与MULVANY等[19]和杨君等[20]的研究结果一致。故可推断,P16INK4A高表达可能是宫颈癌发生的早期事件,P16INK4A参与宫颈病变的演变过程。本实验中P16INK4A在低级内瘤变和高级内瘤变中阳性表达率有显著性差异,但其在CINⅡ~Ⅲ和宫颈癌之间的表达无差异。有研究显示,P16INK4A在低级内瘤变中表达阳性者比阴性者更容易向高级宫颈病变发展[21-25],故推测P16INK4A可能成为宫颈上皮内瘤变低、高分级的可靠指标,可以预测CIN的转归,但不能预测高级内瘤变是否进展为宫颈恶性肿瘤。检测P16INK4A作为诊断宫颈癌前病变的辅助分子标志物,有望提高宫颈癌前病变筛查的准确性。ELEUTERIO[26]的研究显示,在CIN辅助诊断中P16INK4A蛋白表达检测比HR-HPV更敏感。故将P16INK4A与MCM5联合检测有助于区分低、高度宫颈上皮内瘤变及发现具有潜在恶变增殖力的宫颈内瘤变,尤其对预测CIN转归及合理治疗有着重要的临床意义。SAHEBALI等[27]的研究显示,联合P16INK4A检测应用于宫颈癌的筛查有助于提高HPV检测的特异性和细胞学检查的敏感性。提示P16INK4A可作为CIN分级的辅助诊断、预测病情进展及早期筛查的生物学指标,有助于提高宫颈癌前病变的诊断率。
综上所述,MCM5及P16INK4A均为宫颈癌的早期事件。MCM5是反应细胞增殖状态的可靠标志物,并根据增殖状况来判断CIN是否具有潜在的恶变增殖能力及进展为宫颈癌的危险性,且能反映宫颈癌的恶性程度;而P16INK4A有助于CIN的分级及预测转归,所以二者联合检测,可以补充HPV对高级别内瘤变阳性预测率低和细胞学敏感性差的缺点,可能有助于发现具有恶性潜能的CIN并判断宫颈内瘤变的程度,可成为CIN的诊断、分级及判断其转归的有效指标。故二者与HPV等联合检测可以完善宫颈癌及癌前病变的筛查,提高筛查率。
[1]JEMAL A,BRAY F,CENTER MM,et al.Globa cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]FERLAY J,SHIN HR,BRAY F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[3]YU Z,FENG D,LIANG C.Pairwise interactions of the six human MCM protein subunits[J].J Mol Biol,2004,340(5):1197-1206.
[4]LIVAK KJ,SCHMITTGEN TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[5]BUKHOLM IR,BUKHOLM G,HOLM R,et al.Association between histology grade,expression of HsMCM2,and cyclin A in human invasive breast carcinomas[J].J Clin Pathol,2003,56(5):368-373.
[6]KLAES R,BENNER A,FRIEDRICH T,et al.p16INK4a immunohistochemistry improves interobserver agreement in the diagnosis of cervical intraepithelial neoplasia[J].Am J Surg Pathol,2002,26(11):1389-1399.
[7]BAILIS JM,LUCHE DD,HUNTER T,et al.Minichromosome maintenance proteins interact with checkpoint and recombination proteins to promote s-phase genome stability[J].Mol Cell Biol,2008,28(5):1724-1738.
[8]SUZUKI S,KURATA M,ABE S,et al.Overexpression of MCM2 in myelodysplastic syndromes:association with bone marrow cell apoptosis and peripheral cytopenia[J].Exp Mol Pathol,2012,92(1):160-166.
[9]GIAGINIS C,GIAGINI A,TSOUROUFLIS G,et al.MCM-2 and MCM-5 expression in gastric adenocarcinoma:clinical significance and comparison with Ki-67 proliferative marker[J]. Dig Dis Sci,2011,56(3):777-785.
[10]MURPHY N,RING M,HEFFRON CC,et al.Quantitation of CDC6 and MCM5 mRNA in cervical intraepithelial neoplasia and invasive squamous cell carcinoma of the cervix[J].Mod Pathol,2005,18(6):844-849.
[11]SZAJERKA A,DZIEGIEL P,SZAJERKA T,et al.Immuno-histochemical evaluation of metallothionein,Mcm-2 and Ki-67 antigen expression in tumors of the adrenal cortex[J].Anticancer Res,2008,28(5B):2959-2965.
[12]NISHIHARA K,SHOMORI K,FUJIOKA S,et al.Minichromosome maintenance protein 7 in colorectal cancer:implication of prognostic significance[J].Int J Oncol,2008,33(2):245-251.
[13]FUJIOKA S,SHOMORI K,NISHIHARA K,et al.Expression of minichromosome maintenance 7(MCM7)in small lung adenocarcinomas(p T1):Prognostic implication[J].Lung Cancer,2009,65(2):223-229.
[14]HA SA,SHIN SM,NAMKOONG H,et al.Cancer-associated expression of minichromosome maintenance 3 gene in several human cancers and its involvement in tumorigenesis[J].Clin Cancer Res,2004,10(24):8386-8395.
[15]WILLIAMS GH,ROMANOWSKI P,MORRIS L,et al.Improved cervical smear assessment using antibodies against proteins that regulate DNA replication[J].Proc Natl Acad Sci U S A,1998,95(25):14932-14937.
[16]KHOO CM,CARRASCO DR,BOSENBERG MW,et al. Ink4a/Arf tumor suppressor does not modulate the degenerative conditions or tumor spectrum of the telomerase-deficient mouse[J].Proc Natl Acad Sci U S A,2007,104(10):3931-3936.
[17]NEMTSOVA MV,ZEMLIAKOVA VV,KUZNETSOVA EV,et al.Correlation of p16/INK4a gene damages and protein expression in the tumor tissue of sporadic breast cancer[J].Arkh Patol,2008,70(4):6-9.
[18]CHEW I,POST MD,CARINELLI SG,et al.p16 expression in squamous and trophoblastic lesions of the upper female genital tract[J].Int J Gynecol Pathol,2010,29(6):513-522.
[19]MULVANY NJ,ALLEN DG,WILSON SM.Diagnostic utility of p16INK4a:a reappraisal of its use in cervical biopsies[J]. Pathology,2008,40(4):335-344.
[20]BRAGANCA JF,SARIAN LO,PITTA DR,et al.Expression of p16 and cervical infection with high-risk human papillomavirus are not related to p53 activity in cervical intraepithelial neoplasia[J].Int J Gynecol Cancer,2008,18(5):1060-1064.
[21]SMEDTS F,RAMAEKERS FC,HOPMAN AH.CK17 and p16 expression patterns distinguish(atypical)immature squamous metaplasia from high-grade cervical intraepithelial neoplasia[J].Histopathology,2008,52(4):515-516.
[22]MEYER JL,HANLON DW,ANDERSEN BT,et al.Evaluation of p16INK4a expression in ThinPrep cervical specimens with the CINtec p16INK4a assay:correlation with biopsy follow-up results[J].Cancer,2007,111(2):83-92.
[23]GUO M,BARUCH AC,SILVA EG,et al.Ef ficacy of p16 and ProEx C immunostaining in the detection of high-grade cervical intraepithelial neoplasia and cervical carcinoma[J].Am J Clin Pathol,2011,135(2):212-220.
[24]TOSUN G,SENDAG F,ZEYBEK B,et al.Immunohistochemical expressions of p16 and p53 proteins in cervical intraepithelial neoplasia and in benign cervical tissue[J].Eur J Gynaecol Oncol,2010,31(6):627-631.
[25]DIJKSTRA MG,HEIDEMAN DA,DE ROY SC,et al.p16(INK4a)immunostaining as an alternative to histology review for reliable grading of cervical intraepithelial lesions[J].J Clin Pathol,2010,63(11):972-977.
[26]ELEUTERIO J Jr,GIRALDO PC,GONCALVES AK,et al. Prognostic markers of high-grade squamous intraepithelial lesions:the role of p16INK4a and high-risk human papillomavirus[J].Acta Obstet Gynecol Scand,2007,86(1):94-98.
[27]SAHEBALI S,DEPUYDT CE,BOULET GA,et al.Immunocytochemistry in liquid-based cervical cytology:analysis of clinical use following a cross-sectional study[J].Int J Cancer,2006,118(5):1254-1260.
(编辑 卓选鹏)
Expressions of MCM5 and P16INK4Ain cervical squamous cell carcinoma
LIU Li-na1,2,LI Yao1,YANG Yong-xiu1,3,WANG Hui-jun2,ZHAO Jing-ni2
(1.Department of Gynecology and Obstetrics,Gansu Provincial Maternity and Child-care Hospital,Lanzhou 730050;2.Department of Gynecology and Obstetrics,the First Clinical Medicine College of Lanzhou University,Lanzhou 730000;3.Department of Gynecology and Obstetrics,the First Hospital of Lanzhou University,Lanzhou 730000,China)
ObjectiveTo investigate the expressions of minichromosome maintenance protein 5(MCM5)and P16INK4Agene and protein in cervical squamous cell cancer(SCC),cervical intraepithelial neoplasia(CIN)and normal tissues.MethodsReal-time PCR and immunohistochemistry were used respectively to detect the expression levels of m RNA and protein of MCM5 and P16INK4Ain 40 cases of cervical cancer,11 cases of CIN I,15 cases of CINⅡ-Ⅲand 15 cases of normal cervical tissues.Results①The expression levels of mRNA and protein of MCM5 and P16INK4Ain tissues of cervical squamous cell cancer were significantly higher than those in normal cervical tissues,CIN I and CINⅡ-Ⅲtissues(P<0.05).The expression level of P16INK4Awas significantly higher in tissues of cervical squamous cell cancer than in normal cervical tissues and CIN I tissues(P<0.01). However,it did not differ from that in CINⅡ-Ⅲtissues(P>0.05).②The high expression of MCM5 m RNA and protein in cervical squamous cell carcinoma was positively correlated with clinical stage and differentiation grade of cervical cancer(P<0.01),but not correlated with age(P>0.05).P16INK4Aexpression exhibited no correlation with clinical stage or age of patients(P>0.05),but positive correlation with dif ferentiation grade(P<0.01).③A positive correlation was found between MCM5 and P16INK4Aexpressions in cervical cancer(r=0.538,P<0.01).ConclusionThe over-expressions of MCM5 and P16INK4Amay play an important role in the carcinogenesis and progression of cervical cancer.MCM5 may be used as a new marker of the proliferation of cervical cancer. Detection of P16INK4Aand MCM5 is of great significance to studying the grade and outcome of CIN,which may improve the rate of cervical cancer screening.
minichromosom maintenance protein 5(MCM5);P16INK4A;cervical cancer;immunohistochemistry;real-time PCR
R711.74
A
10.7652/jdyxb201506023
2015-01-12
2015-02-08
杨永秀.E-mail:yongxiuyang@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150527.1500.011.html(2015-05-27)

