AQP5在结直肠癌中的表达及其与临床预后的关系
单 涛,郑 波,陈 熹,吴 涛,季尔丽,白育花,王继欣,肖小玲
(西安交通大学医学部第二附属医院:1.普通外科;2.手术室,陕西西安 710004)
◇临床研究◇
AQP5在结直肠癌中的表达及其与临床预后的关系
单 涛1,郑 波1,陈 熹1,吴 涛1,季尔丽1,白育花1,王继欣1,肖小玲2
(西安交通大学医学部第二附属医院:1.普通外科;2.手术室,陕西西安 710004)
目的探讨水通道蛋白5(AQP5)的表达与结直肠癌临床病理及预后关系。方法收集术前未予任何治疗的临床病例资料齐全的原发性结直肠癌病例45例,采用免疫组化法检测AQP5的表达。比较AQP5表达与年龄、肿瘤大小、临床分期、肿瘤部位、淋巴结、病理类型之间的关系,并结合随访资料分析AQP5表达与否和预后的关系。结果45个肿瘤标本中,14例(31.1%)高表达AQP5,29例(64.4%)中度表达,2例(4.4%)无AQP5染色。癌旁和正常组织中AQP5表达率分别为3例(6.67%)和3例(6.67%)。AQP5的表达还与TNM分期(P=0.002)、淋巴结转移(P=0.016)、远处转移(P=0.000)呈正相关。在年龄、性别、组织学分级和肿瘤大小中其表达没有统计学差异(P>0.05)。结论AQP5可能被用作预测结直肠癌预后的良好指标。
结直肠癌;水通道蛋白5(AQP5);预后
目前,结直肠癌仍是肿瘤相关死亡的第二大常见原因[1]。尽管在诊断和治疗中取得一定进展,结直肠癌仍严重影响生命健康[2]。因此,寻找干预治疗的新靶向非常重要。
近年来,越来越多的研究表明,肿瘤的生长、进展、侵袭和转移依赖于肿瘤微环境和肿瘤代谢[3]。水分子在肿瘤的进展中发挥显著的作用,这一认识对于制订抗肿瘤治疗方案非常重要[4]。水通道蛋白(aquaporins,AQPs)是具有分泌和吸收功能的上皮细胞运输水的一类水膜通道,某些亚型也参与其他分子的运输,如甘油和尿素。目前,在哺乳动物中有13种AQP成员,其中,AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8主要是水选择性,而AQP3、AQP7、AQP9、AQP10、AQP11、AQP12也可以输送甘油和其他小分子溶质[5]。AQPs基于其特定的组织定位在几种类型肿瘤中表达有所不同,AQP1的表达通常与脑肿瘤相关[6]。王璐等[7]研究发现,AQP3表达与皮肤鳞状细胞癌的分化程度相关,在AQP3敲除小鼠的研究中,AQP3基因缺失诱导对致癌物诱导的皮肤肿瘤的抵抗。通过AQP3进行的甘油转运有助于细胞增殖和肿瘤发生中ATP(adenosine triphosphate)的生成[8]。AQP5可能参与细胞增殖而广泛过表达于胰腺癌中[9]。
AQP5在结肠癌组织中的表达与肿瘤转移有关,这表明,AQP5过表达在肿瘤进展中发挥一定作用[10]。有资料提出RAS信号转导可以提高AQP5过表达的NIH3T3细胞增殖[11]。此外,一项分子研究发现,AQP5与SH3结构域c-Src蛋白结合,这一蛋白是与各种肿瘤侵袭和转移表型相关的非受体胞质酪氨酸激酶[12]。然而,AQP5在结直肠癌中的表达和临床意义尚未完全阐明。为了评估AQP5作为结直肠癌的一种新型预后标志物的潜力,我们使用免疫组织化学方法检测结直肠癌临床样本中AQP5的表达,进一步分析AQP5的表达与结直肠癌临床病理特征及预后的关系。
1 材料与方法
1.1 材料选取西安交通大学医学部第二附属医院普外科2012年1月至2013年12月的45例结直肠癌患(结肠25例,直肠20例)者的肿瘤组织,40 m L/L的甲醛固定。其中,男性24例,女性21例,手术时的中位年龄为58.3岁(40~78岁)。样本的组织学类型均为结直肠腺癌,肿瘤分期和组织学分级均根据国际抗癌协会的分类记录。45例标本中,Ⅰ期3例、Ⅱ期11例、Ⅲ期27例、Ⅳ期4例。病理分级如下:7例Ⅰ级、20例Ⅱ级、18例Ⅲ级。对所有的患者进行随访,随访中位时间为23个月(5~53个月)。所有的研究均经西安交通大学人体试验委员会批准,受试人员均签署由中国西安交通大学人体试验会员会伦理审查委员会批准的知情同意书。
1.2 免疫组化检测AQP5蛋白的免疫组化采用标准化的链霉亲和过氧化物酶的方法,组织切片(4μm)在适当浓度的一抗中孵育过夜,次日,切片在生物素标记的羊抗兔IgG中孵育30 min,随后在过氧化酶标记的链霉亲和素室温孵育20 min。用0.2 g/L的3,3′-二氨基联苯胺在50 mmol/L Tris-HCL缓冲液(p H 7.6)中染色5~7 min,经苏木精复染、水冲洗、脱水、清除、封片。免疫染色的阴性对照用非免疫山羊或兔血清替代一抗,显微镜观察,抗AQP5和βactin抗体购自美国Santa Cruz生物公司。
1.3 结果判断标准使用DA KO Hercept Test评分方法:(-)无细胞染色或少于30%的肿瘤细胞细胞膜(质)较弱染色;(+)大于30%的肿瘤细胞细胞膜(质)部分较弱染色;(■)大于30%的肿瘤细胞细胞膜(质)完全较弱到中等染色;(■)大于30%的肿瘤细胞细胞膜完全强染色。(-)和(+)的判为AQP5表达阴性,而评分为(■)和(■)的判为AQP5表达阳性。
1.4 统计学分析采用χ2检验或双侧Fisher精确检验分析方法。Pearson相关系数用来衡量关联强度。采用Kaplan-meier计算生存率、Log-rank检验进行差异性检验。选择有显著性的因素逐步建立Cox多元比例风险模型,以确定其预后价值。P<0.05认为差异有统计学意义。所有的统计学分析采用SPSS13(SPSS,Chicago)软件。
2 结 果
2.1 结直肠癌中AQP5蛋白的表达为确定AQP5在结直肠癌中的表达状态,首先用免疫组化评估结直肠癌患者的肿瘤标本、癌旁组织和正常组织。研究结果显示,AQP5在病例组中14/45(31.1%)强表达,29/45(64.4%)中度表达,仅偶尔在癌旁组织[(3/ 45),6.67%]和正常组织[(3/45),6.67%]中检测到(图1)。
2.2 AQP5表达与临床病理特征之间的关系AQP5蛋白表达和临床病理间的关系总结如下:AQP5在Ⅰ~Ⅱ期病例[7.1%(1/14)]中强表达,显著低于Ⅲ期[33.3%(9/27)]和Ⅳ期[100%(4/4)]中的表达水平(P=0.002),与淋巴结(P=0.016)和远处转移(P=0.000)呈正相关,与年龄(P=0.848)、性别(P=1.000)、组织学分级(P=0.913)和肿瘤大小(P=0.263)差异无统计学意义(表1)。
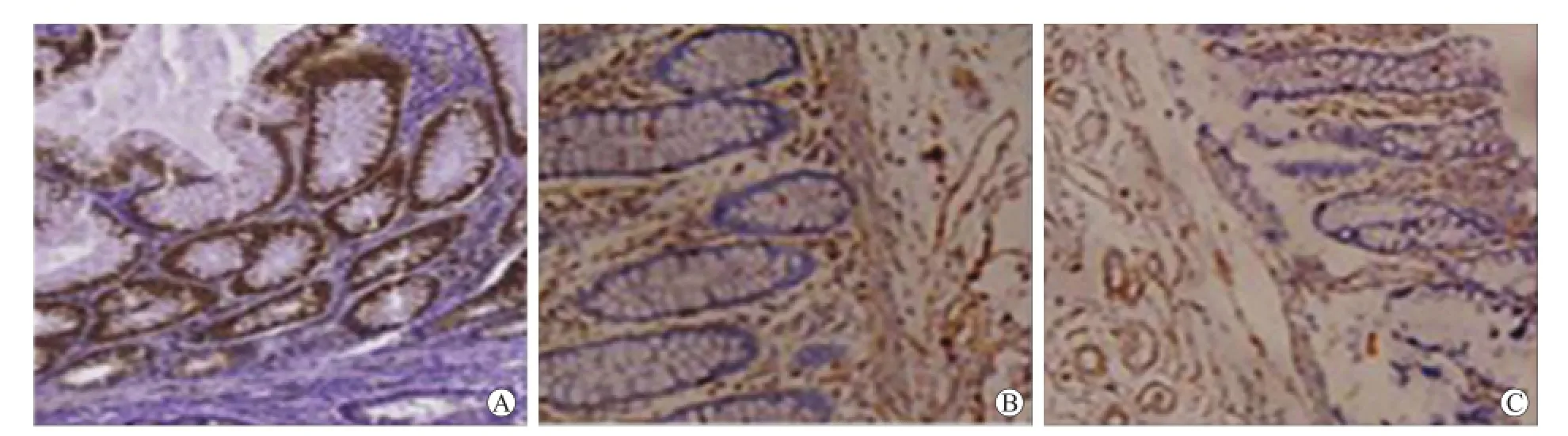
图1 结直肠癌、癌旁和正常组织中AQP5的表达水平Fig.1 Expression of AQP5 in colorectal cancer,para-neoplastic and normal tissues(×400)
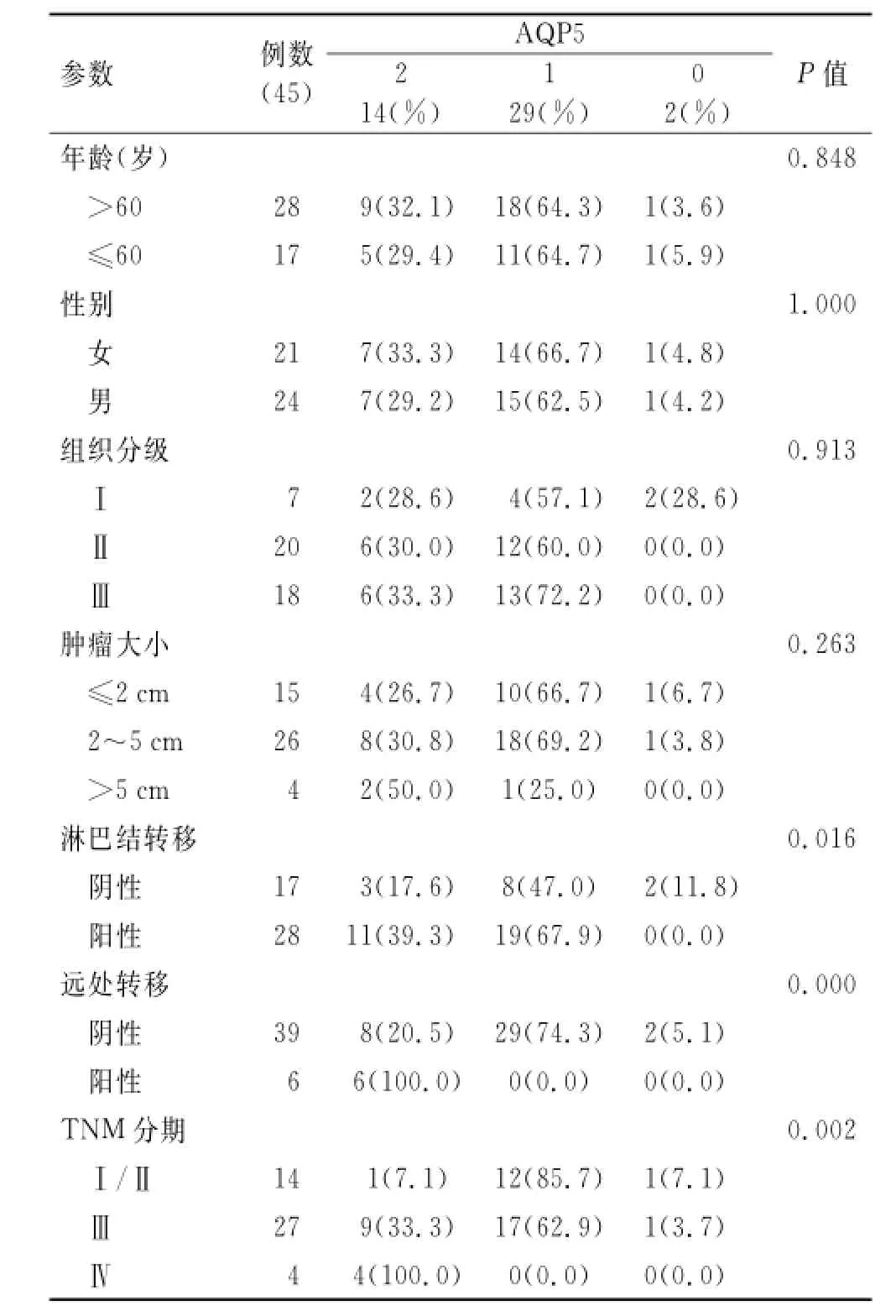
表1 结直肠癌组织中AQP5表达与临床病理因素的关系Tab.1 Association between AQP5 expression and clinicopathologic factors in colorectal cancer
2.3 AQP5与结直肠癌预后的关系为了确定AQP5与结直肠癌预后的关系,我们对基于AQP5表达状态的患者累积生存率进行了分析(图2)。将AQP5弱染色和无染色定为阴性,强染色定为阳性。AQP5阴性患者(n=31)3年累积生存率为24.3%(中位时间,21.2个月);相反地,AQP5阳性患者(n=14)的累积生存率为7.4%(中位时间,7.7个月),有统计学差异(P=0.011)。

图2 结直肠癌组织中AQP5表达阳性组和阴性组的生存曲线图Fig.2 The postoperative survival curves of colorectal cancer patients with positive or negative AQP5 expression
多因素分析显示,淋巴结转移(P=0.018)和TNM分期(P=0.031)是结直肠癌患者总生存期的独立预后因素;肿瘤大小等其他临床参数不是独立的预后因素(表2)。
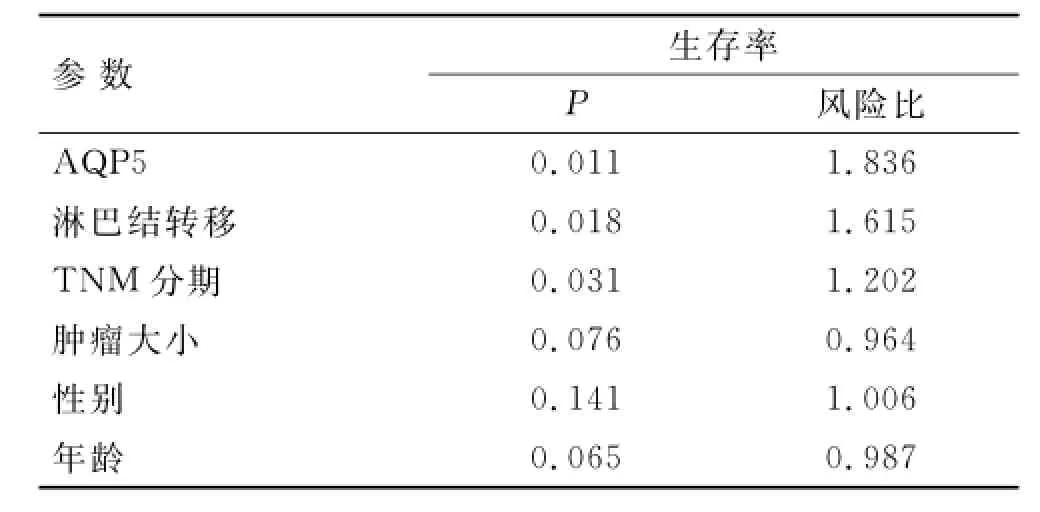
表2 Cox多元比例风险预后模型Tab.2 Prognostic factors in Cox multivariate analyses
3 讨 论
AQPs是广泛存在于原核和真核生物细胞膜、高效选择性转运水分子的特异通道。肿瘤是机体在各种致瘤因素的作用下,细胞在基因水平上失去其生长的正常调控,导致新生物生成的过程。肿瘤所依赖的各种代谢都需要水分子的参与,而水通道蛋白可以快速特异的转运水分子。到目前为止,在哺乳动物中有13种AQP成员,其中,AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8主要是水选择性,而AQP3、AQP7、AQP9、AQP10、AQP11、AQP12也可以输送甘油和其他小分子溶质[5]。它参与肾脏对水的重吸收、腺体的分泌、小肠脂肪吸收,参与气血屏障[13]、血脑屏障、脑脊液形成,参与应激反应、组织损伤、感染及肿瘤形成过程等。AQPs基于其特定的组织定位在几种类型肿瘤中表达有所不同,AQP1的表达通常与脑肿瘤相关[6]。在AQP3敲除小鼠的研究中,AQP3基因缺失可以诱导致癌物所致的皮肤肿瘤的抵抗。通过AQP3进行的甘油转运有助于细胞增殖和肿瘤发生中ATP的生成[8]。AQP5可能参与细胞增殖而广泛过表达于胰腺癌中[9]。本研究结果显示,与癌旁组织和正常组织相比,结直肠肿瘤中AQP5表达上调。此外,AQP5与高TNM分期和不良预后密切相关。显然,AQP5过表达的患者被证实更易转移。这些研究结果扩展了我们对AQP5作为诊断指标意义的理解。
水通道蛋白在维持水平衡和调节多种病理生理过程中发挥关键的作用[14]。AQP5,21~24ku蛋白,最初被认为是位于细胞膜小窝的主要结构蛋白、参与致癌转化和恶性进展的关键分子[15-16]。AQP5促进肿瘤进展具体作用机制还不完全明确。有研究认为AQP5可能通过促血管生成机制起作用[17]:其一,新生血管可以提供营养和氧气;其二,新生血管内皮细胞可以分泌多种多肽生长因子促进肿瘤生长。研究发现[18]AQP1表达于肿瘤新生血管并且可促进肿瘤血管生成。另外,细胞凋亡是在各种生理或病理因素的作用下,由基因控制的细胞自主有序的死亡,是机体为适应生存环境而主动自杀的过程。AQP8和AQP9表达于正常肝脏。AQP8主要定位于细胞内,而AQP9主要定位于细胞膜,肝癌细胞上AQP8和AQP9表达下降。并且这些细胞对渗透压和凋亡刺激的反应性下降。肝癌细胞对凋亡刺激的反应减少,则肿瘤细胞死亡数量减少,意味着肿瘤生长分数与丢失分数之比增加,肿瘤可以不断长大。上述的AQP5改变肿瘤生物学行为可能是在几条导致细胞转化的信号通路中起调节作用,包括由Src家族酪氨酸激酶、表皮生长因子受体、Wnt信号和Erk1/2介导的信号转导[11,17-18]。最近,LEE等[12]报道,AQP5与乳腺癌患者淋巴结转移和不良预后显著相关,提示AQP5作为乳腺癌预后指标的价值。HUANG等[19]证实,AQP5促进胃癌细胞增殖、迁移。王巍等[20]进行的一项研究表明,AQP5主要表达于结直肠癌细胞,在癌旁组织中几乎不表达。结直肠癌中AQP5的临床意义尚未有定论。我们的研究结果表明,AQP5主要表达于结直肠癌细胞中,在癌旁组织和正常组织中呈低表达。本研究中检测到的结直肠组织中AQP5表达谱与以前研究结果相一致。此外,我们分析了AQP5与结直肠癌临床病理特征的相关性,结果表明,AQP5与患者的年龄、性别无显著性相关性,而与肿瘤分化、TNM分期和远处淋巴结转移相关。本研究初步证实了AQP5在结直肠癌中可能的作用部位,具体AQP5通过何种机制影响结直肠癌进展,有必要在细胞分子生物学及动物实验中进一步探讨,这也是本课题组下一步的方向。
总之,本阶段研究提示AQP5蛋白在结直肠癌中表达上调,与高TNM分期、淋巴结转移和不良预后紧密相关。因此,AQP5可作为结直肠癌侵袭和转移的新的生物标志物。
[1]American Cancer Society.Cancer facts and figures[J/OL].http://acs.org.2004.
[2]KINZLER KW,VOGELSTEIN B.Lessons from hereditary colorectal cancer[J].Cell,1996,87(2):159-170.
[3]KOONTONGKAEW S.The tumor microenvironment contribution to development,growth,invasion and metastasis of head and neck squamous cell carcinomas[J].J Cancer,2013,4(1):66-83.
[4]SEKINE S,SHIMADA Y,NAGATA T,et al.Prognostic significance of aquaporins in human biliary tract carcinoma[J]. Oncol Rep,2012,27(6):1741-1747.
[5]MOON C,SORIA JC,JANQ SJ,et al.Involvement of aquaporins in colorectal carcinogenesis[J].Oncogene,2003,22(43):6699-6703.
[6]WANG D,OWLER BK.Expression of AQP1 and AQP4 in paediatric brain tumours[J].J Clin Neurosci,2011,18(1):122-127.
[7]王璐,朱莹,袁耀东,等.皮肤鳞状细胞癌组织中埃兹蛋白和水通道蛋白3的表达[J].郑州大学学报:医学版,2012,47(1):23-26.
[8]HARA-CHIKUMA M,VERKMAN AS.Prevention of skin tumorigenesis and impairment of epidermal cell proliferation by targeted aquaporin-3 gene disruption[J].Mol Cell Biol,2008,28(1):326-332.
[9]BURGHARDT B,ELKAER ML,KWON TH,et al.Distribution of aquapor in water channels AQP1 and AQP5 in the ductal system of the human pancreas[J].Gut,2003,52(7):1008-1016.
[10]KANG SK,CHAE YK,WOO J,et al.Role of human aquaporin5 in colorectal carcinogenesis[J].Am J Pathol,2008,173(2):518-525.
[11]WOO J,LEE JM,KIM MS,et al.The effect of aquapor in 5 overexpression on the Ras signaling pathway[J].Biochem Biophys Res Commun,2008,367(2):291-298.
[12]LEE SJ,CHAE YS,KIM JG,et al.AQP5 expression predicts survival in patients with early breast cancer[J].Ann Surg Oncol,2014,21(2):375-383.
[13]刘笑玎,原铭贞,王司仪,等.水通道蛋白1、3、4和5与急性肺损伤关系的研究进展[J].吉林大学学报:医学版,2014,40(5):1119-1122.
[14]MCCOY E,SONTHEIMER H.Expression and function of water channels(aquaporins)in migrating malignant astrocytes[J]. Glia,2007,55(10):1034-1043.
[15]JUNG HJ,PARK JY,JEON HS,et al.Aquaporin-5:a marker protein for proliferation and migration of human breast cancer cells[J].PLoS One,2011,6(12):e28492.
[16]ZHANG ZQ,CHEN ZH,SONG YB,et al.Expression of aquaporin 5 increases proliferation and metastasis potential of lung cancer[J].J Pathol,2010,221(2):210-220.
[17]陈学军,杨建华,郑伟.拓扑替康对卵巢癌SKOV3细胞水通道蛋白5级NK-κB表达的影响[J].癌症,2009,28(8):856-860.
[18]CHOI JH,WU HG,JUNG KC,et al.Apoptosis and expression of AQP5 and TGF-beta in the irradiated rat submandibular gland[J].Cancer Res,2009,41(3):145-154.
[19]HUANG YH,ZHOU XY,WANG HM,et al.Aquaporin 5 promotes the proliferation and migration of human gastric carcinoma cells[J].Tumor Biol,2013,34(3):1743-1751.
[20]王巍,李晴,杨涛,等.AQP5和AQP8在人结肠癌组织中的表达及其意义[J].中国医学工程,2012,(20)5:7-9.
(编辑 韩维栋)
Expression of AQP5 in colorectal cancer and its relationship with clinical outcome
SHAN Tao1,ZHENG Bo1,CHEN Xi1,WU Tao1,JI Er-li1,BAI Yu-hua1,WANG Ji-xin1,XIAO Xiao-ling2
(1.Department of General Surgery;2.Operation Room,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004,China)
ObjectiveTo determine the relationship of the expression of aquaporin 5(AQP5)with clinicopathology and prognosis of colorectal cancer.MethodsWe collected data from 45 patients with primary colorectal cancer without any adjuvant therapy before operation.The expression of AQP5 was measured by immunohistochemistry(IHC).Then we analyzed the correlation between AQP5 expression and clinicopathological parameters(including age,tumor size,clinical staging,tumor location,lymph node and pathological type)and the connection between AQP5 expression and prognosis based on follow-up data.ResultsOf the 45 tumor specimens,14(31.1%)had a high level of AQP5 expression,29(64.4%)exhibited a moderate level of staining,and 2(4.4%)had an absence of AQP5 staining.AQP5 was only occasionally detected in para-neoplastic[3/45(6.67%)]and normal tissues[3/45(6.67%)].The overexpression of AQP5 was also positively associated with TNM stage(P=0.002),lymph node metastasis(P=0.016),and distant metastasis(P=0.000).However,it had no significant association with age,gender,histologic grade or tumor size(P>0.05).ConclusionAQP5 may be used as a novel biomarker for predicting the prognosis of colorectal cancer.
colorectal cancer;aquaporin 5(AQP5);prognosis
R735.3
A
10.7652/jdyxb201506020
2015-03-03
2015-04-10
国家自然科学基金资助项目(No.81402583);陕西省自然科学基金资助项目(No.2014JQ4165)
Supported by the National Natural Science Foundation of China(No.81402583)and the Natural Science Foundation of Shaanxi Province(No.2014JQ4165)
陈熹.E-mail:Chenxi@163.com.郑波同为第一作者.
优先出版:http://w ww.cnki.net/kcms/detail/61.1399.R.20150928.1505.006.html(2015-09-28)

