低温纤维素降解菌分离鉴定及产酶条件优化
李春艳,于琦,冯露,成毅,成小松,王雪,张平根(.东北农业大学资源与环境学院,哈尔滨50030;.哈尔滨医科大学第一临床医学院,哈尔滨5000)
低温纤维素降解菌分离鉴定及产酶条件优化
李春艳1,于琦1,冯露1,成毅1,成小松2,王雪1,张平根1
(1.东北农业大学资源与环境学院,哈尔滨150030;2.哈尔滨医科大学第一临床医学院,哈尔滨150001)
采用富集培养方法在低温条件下从生活垃圾土壤中分离得到1株能够降解纤维素细菌,命名为FLX-1。经形态学、生理生化学和分子生物学16S rDNA序列分析,将菌株FLX-1鉴定为节杆菌属(Arthrobacter sp.)细菌。为探索菌株FLX-1生长特性和最佳产酶条件,利用响应面分析方法考查培养时间、温度、pH和接种量对菌株FLX-1产羧甲基纤维素(Carboxymethylcellulose,CMC)酶活特性影响情况。结果表明,菌株FLX-1最佳产酶条件为培养时间74.1 h,温度10.5℃,pH 7.1,接种量2.1%。在最佳条件下,菌株FLX-1产CMC酶活值为14.12 U·mL-1。
纤维素;低温降解菌;Arthrobacter sp.;CMC酶;响应面分析法
我国北方严寒地区农村有机生活垃圾种类和数量逐年增加。由于严寒地区冬季水量少、气温低、持续时间长,因此不适宜采用堆肥法处理有机生活垃圾,目前主要以单纯填埋或野外堆放焚烧等方法处理,不仅效率低,且对大气、河流和土壤等环境造成严重污染[1]。探索高效处理严寒地区农村有机生活垃圾的新方法,是亟待解决问题。
86.8 %有机生活垃圾由餐厨垃圾、水果、蔬菜等组成,主要成分为难降解多糖纤维[2]。目前,已筛选出较多能够降解纤维素的真菌和放线菌,如青霉属(Penicillium sp.)[3]、链霉菌属(Streptomyces sp.)[4]和漆斑霉属(Myrothecium sp.)[5]等;对纤维素降解细菌研究相对较少,且主要集中在筛选高温和中温纤维素降解菌,廖青等从发酵床垫料中分离出1株纤维素降解细菌(Streptomyces sp.)F21,30°C培养4 d,CMC酶活值为72.5 U·mL-1[6]。朱军莉等从袋装降解笋干中分离出1株纤维素降解细菌(Bacillus subtilis)BSX5,50℃培养12 h,CMC酶活值为54.5 U·mL-1[7]。低温纤维素降解细菌研究鲜见报道。
本文从生活垃圾土壤中筛选分离得到1株低温条件下高效降解纤维素细菌,结合形态学、生理生化特性和16S rDNA序列分析等对其鉴定,并对该菌株产CMC酶条件优化。该菌株筛选获得可充实低温降解纤维素的菌种资源,为探索严寒地区有机生活垃圾处理新方法奠定基础。
1 材料与方法
1.1 样品来源
土壤样品源自黑龙江省哈尔滨市南岗区王岗镇后兴隆村垃圾站。
1.2 培养基
依姆歇涅茨基纤维素分解菌培养基[8]。
纤维素降解菌分离培养基:CMC-Na 5 g,(NH4)H2PO40.5 g,MnSO4·H2O 2.5 g,K2HPO42 g,FeSO4·7H2O 7.5 mg,MgSO42 g,NaCl 0.3 g,蒸馏水100 mL,pH 7.0。
纤维素降解菌鉴别培养基:CMC-Na 20 g,K2HPO40.5 g,MgSO40.25 g,(NH4)2SO41.4 g,蒸馏水1 000 mL,pH 7.0。
无机盐纤维素琼脂平板培养基:CMC-Na 20 g,MgSO4·7H2O 0.3 g,CaCl20.3 g,FeSO4·7H2O 0.005 g,MnSO4·H2O 0.004 g,ZnCl20.007 g,CoCl20.002 g,(NH4)2SO41.4 g,K2HPO42.0 g,蒸馏水1 000 mL,pH 7.0。
细菌液体发酵培养基:MgSO4·7H2O 0.3 g,酵母膏0.5 g,CaC12·2H2O 0.3 g,蛋白胨3.0 g,KH2PO4
4.0 g,CMC-Na 5.0 g,蒸馏水1 000 mL,pH 7.0。
以上培养基均在121℃灭菌20 min,在配制固体培养基时按2%添加琼脂粉。
1.3 低温纤维素降解菌富集与分离
取土壤样品10.0 g加入100 mL LB液体培养基,25℃、160 r·min-1摇床培养24 h,取上清液梯度稀释,分别取10-1~10-9稀释液1 mL接种在10 mL依姆歇涅茨基纤维素分解菌培养基中,从滤纸条降解程度高的地方挑取菌落接种到分离培养基上,反复划线纯化直至获得纯菌。将分离纯化得到的纯菌在无机盐纤维素琼脂平板培养基上划线培养3~5 d,从25℃起始以5℃为梯度降温,最终获得能在低温条件下生长的菌株。将低温菌株点种到纤维素鉴别培养基上,10℃倒置培养3~5 d,倒入1 mg·mL-1刚果红染液染色1 h后[9],用1 mol·L-1NaCl浸泡1 h脱色,观察菌落周围透明圈产生情况。
1.4 低温纤维素降解菌的鉴定
将低温纤维素降解菌采用平板划线法接种于牛肉膏蛋白胨固体培养基,10℃恒温培养48 h后观察菌落形态,参照《常见细菌系统鉴定手册》进行生理生化鉴定[10]。采用分子生物学16S rDNA序列分析方法[11]对菌株种属鉴定,引物为通用引物,由大连宝生物有限公司合成,反应体系及条件参考文献[12]。测序结果用BLAST软件在GenBank中同源性比较,采用MEGA 4.0软件构建系统发育树[13]。
1.5 低温纤维素降解菌酶活测定
将产生透明圈的菌株接种于100 mL液体发酵培养基中,以不接菌液体发酵培养基作为阴性对照。10℃、160 r·min-1条件下培养72 h,取5 mL发酵液,4℃、3 000 r·min-1条件下离心15 min,取上清液,测定发酵液中CMC酶活力[14-15]。
1.6 低温纤维素降解菌产酶活性研究
1.6.1 单因素试验
分别以1%、2%、3%、4%、5%作为菌体接种量试验组;分别以5、10、15、20和25℃作为温度试验组;分别以24、48、72、96、120 h作为培养时间试验组;分别以5.0、6.0、7.0、8.0、9.0作为pH试验组。以上各试验组均在液体发酵培养基中恒温摇床160 r·min-1振荡培养,以不加菌作为阴性对照,以蒸馏水作为空白对照,每隔24 h测定其CMC酶活和OD600。
1.6.2 响应面试验设计
根据单因素试验结果,利用Design-Expert 8.0.6软件中的Box-Behnken design(BBD)模型设计四因素三水平试验,以接种量(A)、温度(B)、培养时间(C)、pH(D)为自变量,以CMC酶活为唯一响应值,其中试验设计因素水平见表1。二次回归方程用以拟合自变量和响应值之间函数关系[16],公式如下:

式中,Y-预期响应值;A-常数;Aj-单因素直线系数;Ajj-单因素平方系数;Aij-两个因素的交互系数。

表1 菌株FLX-1响应面试验因素及水平Table 1 Factors and levels of response surface experiments ofstrain FLX-1
2 结果与分析

图1 菌株FLX-1菌落及菌体形态Fig.1 Colony and thallus morphologicalcharacteristics of strain FLX-1

表2 菌株FLX-1形态特征Table 2 Morphologicalcharacteristics of strain FLX-1
2.1 低温菌株分离纯化
经分离和纯化获得1株低温高效纤维素降解细菌,命名为FLX-1。菌株FLX-1菌落培养特征、革兰氏染色照片和透射电镜照片如图1所示。菌株FLX-1菌落和菌体形态特征分别见表2,生理生化指标见表3。
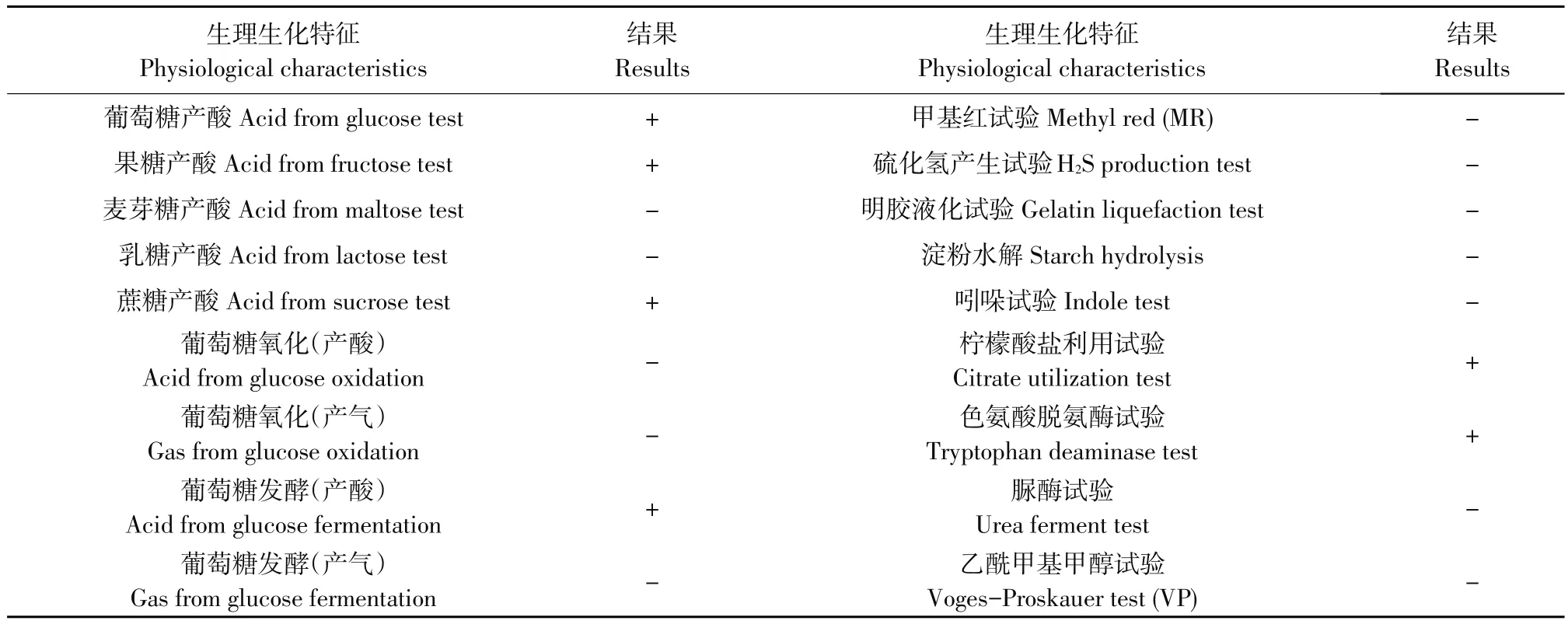
表3 菌株FLX-1生理生化特征Table 3 Physiologicaland biochemicalcharacteristics of strain FLX-1
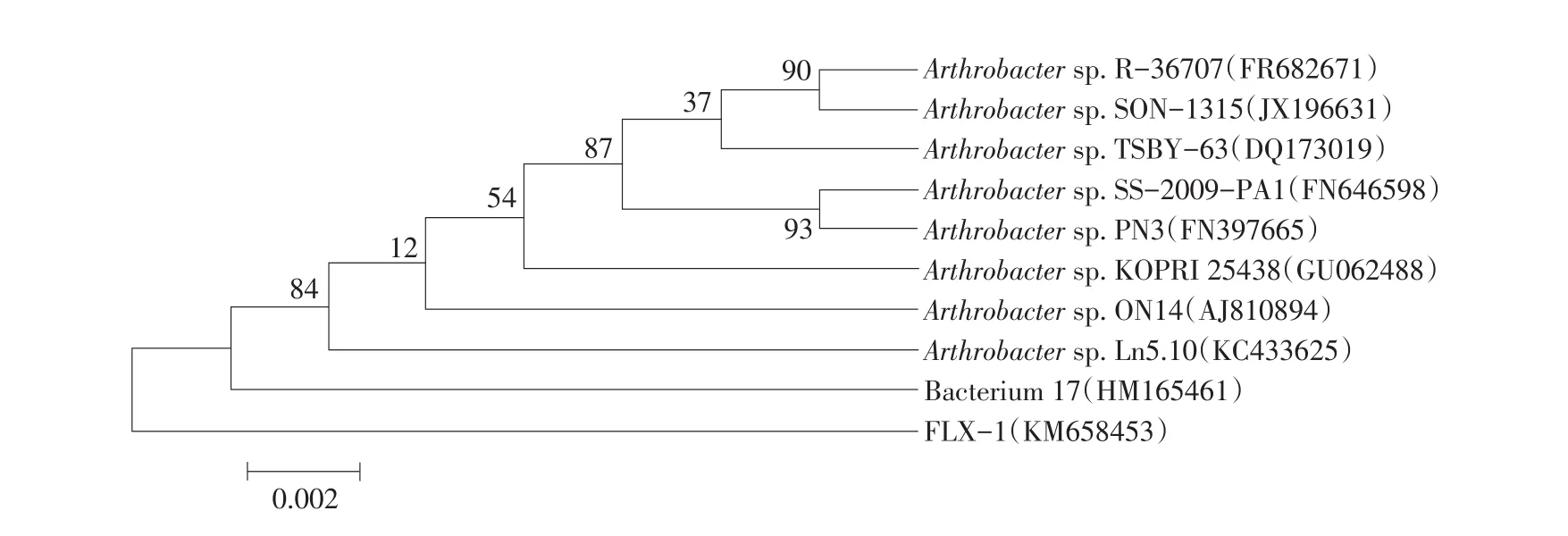
图2 降解菌FLX-1系统发育树Fig.2 Phylogenetic tree ofstrain FLX-1
2.2 基于16S rDNA基因序列的系统发育分析
菌株FLX-1序列已在GenBank中注册,登录号为KM658453。菌株FLX-1与数据库中同源性较高的9个细菌模式株比较,菌株FLX-1的16S rDNA序列与Arthrobacter sp.的9个种均有较高序列同源性,其系统发育关系见图2。由图2可知,菌株FLX-1与Arthrobacter sp.SS-2009-PA1(FN646598)及Arthrobacter sp.TSBY-63(DQ173019)相似性均为99. 0%。目前,细菌分类学家的共识是,当两个细菌的16S rDNA相似性大于95%时,可将其归为同一属。从系统发育树分析可知,菌株FLX-1属于Arthrobacter sp.。
2.3 单因素试验结果
由图3可以看出,不同因素对菌株FLX-1生长量及产CMC酶活力影响情况。如图3a所示,接种量为2%时,菌株FLX-1生长量和产CMC酶活力均达最大值,分别为1.63和13.22 U·mL-1,可知2%为最佳接种量。由图3b可知,当温度为10℃时,菌株FLX-1生长量和产CMC酶活力均达最高点,产CMC酶活力最大值为13.67 U·mL-1。图3c显示,菌株FLX-1生长量及产CMC酶活力随培养时间延长呈现先升高后下降趋势,当培养时间为72 h,菌株FLX-1产CMC酶活力达最大值,为13.66 U·mL-1。由图3d可知,菌株FLX-1生长量随pH增加无明显变化,当pH 7.0~8.0时,菌株FLX-1生长量最佳,说明菌株FLX-1适合在中性偏碱性环境中生长。菌株FLX-1产CMC酶活力随pH增加先增大后减小,当pH 7.0时,菌株FLX-1产CMC酶活力达最大值,为13.64 U·mL-1。
综上所述,影响菌株FLX-1生长量和产CMC酶活力最适条件为接种量2%、温度10℃、培养时间72 h、pH 7.0。
2.4 响应面优化结果
菌株FLX-1响应面试验设计方案及结果见表4。利用Design-Expert8.0.6软件,对BBD模型试验数据进行多项回归分析得到二次拟合模型为:Y= 13.57-0.052A-0.54B-0.50C-0.43D+0.12AB-0.44AC+ 0.097A D-0.87BC+0.42BD+0.45C D-0.34 A2-1.50B2-1.58C2+0.087D2
此回归方程中,Y为菌株FLX-1产CMC酶活;A、B、C、D分别为接种量、温度、培养时间和pH的编码值。
表5是利用Design-Expert8.0.6软件分析得出菌株FLX-1产CMC酶活力响应分析试验的回归分析结果。表中偏差平方和表示样本值与平均值之间偏离量;均方差表示样本值与平均值之间偏离程度;F值表示一个服从F分布的统计量,F值越大说明模型越显著;P值为显著性概率,当P>0.05时,表明变量对响应值没有显著影响;当P<0.05时,表明变量对响应值具有显著影响;当P<0.01时,说明变量对响应值有极显著影响[15]。
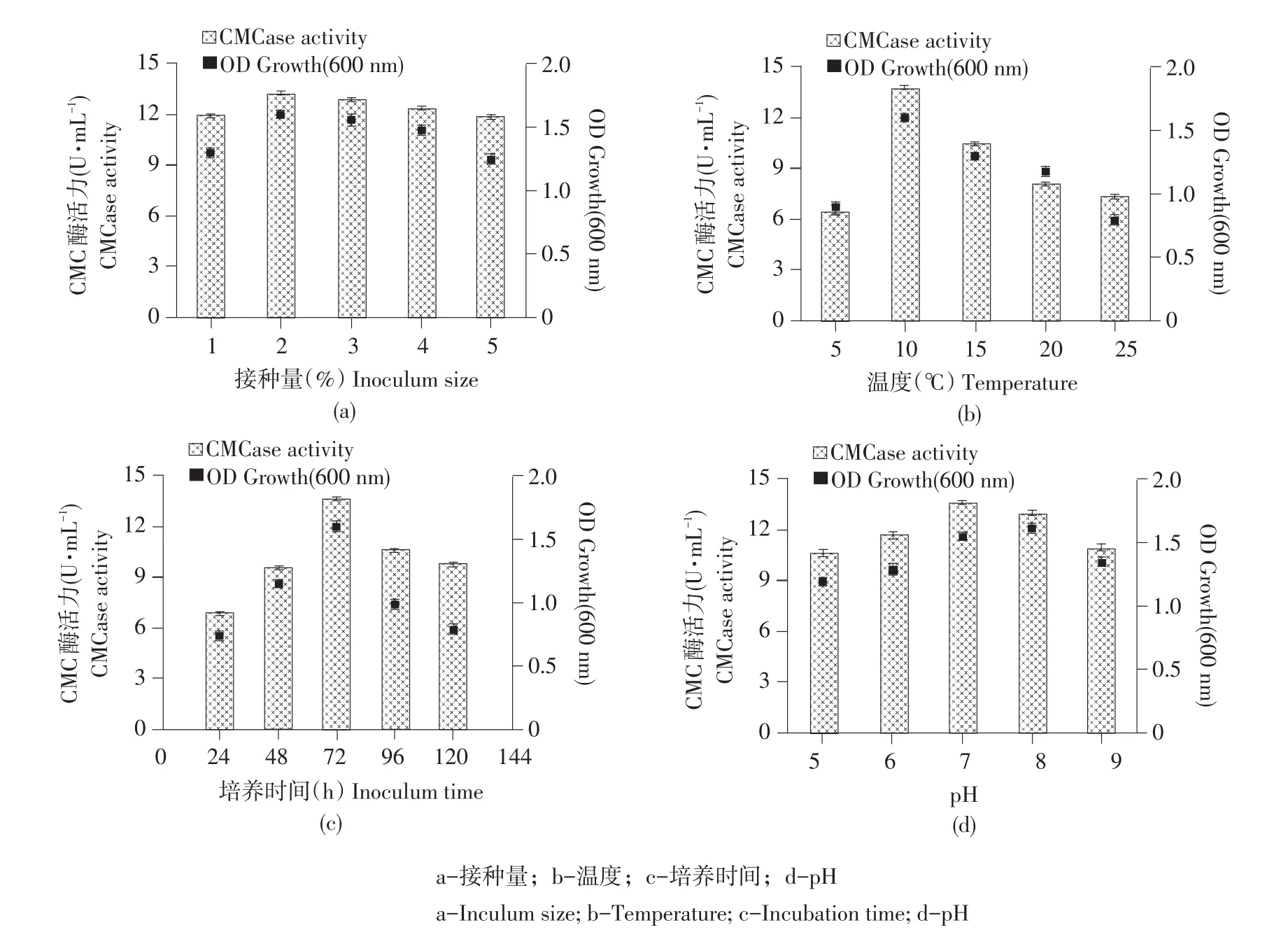
图3 各因素对菌株FLX-1生长量及产酶的影响Fig.3 Effects of differentfactors on growth and enzyme production ofstrain FLX-1
由菌株FLX-1回归分析结果可知,菌株FLX-1产CMC酶活模型P<0.0001、F=50.84、失拟P= 0.3014、R2=0.9807,表明该模型与实际情况拟合良好[17]。B、C、D、AC、BC、BD、CD、A2、B2和C2的P<0.05,说明这些独立变量和交互组合对菌株FLX-1产CMC酶活影响显著。在独立变量中,B、C和D的P<0.0001,但B的F值最大,即P值最小,说明在独立变量中B对菌株FLX-1产CMC酶活发挥作用最显著。在交互组合中,BC组合P值最小,说明BC对菌株FLX-1产CMC酶活发挥作用极显著。
由上述结果可知,在产CMC酶活响应曲面分析试验中,各变量对CMC酶活影响作用由大到小依次为:温度>培养时间>pH>接种量。
不同交互组合对菌株FLX-1产CMC酶活影响的响应曲面见图4。响应曲面图是一个开口向下的曲面图,通过观察曲面倾斜度可确定交互组合对响应值的影响程度,倾斜度越高,即坡度越陡,说明两个独立变量交互作用越显著。结合等高线图
和响应曲面图能够很好分析交互组合对响应值影响情况。
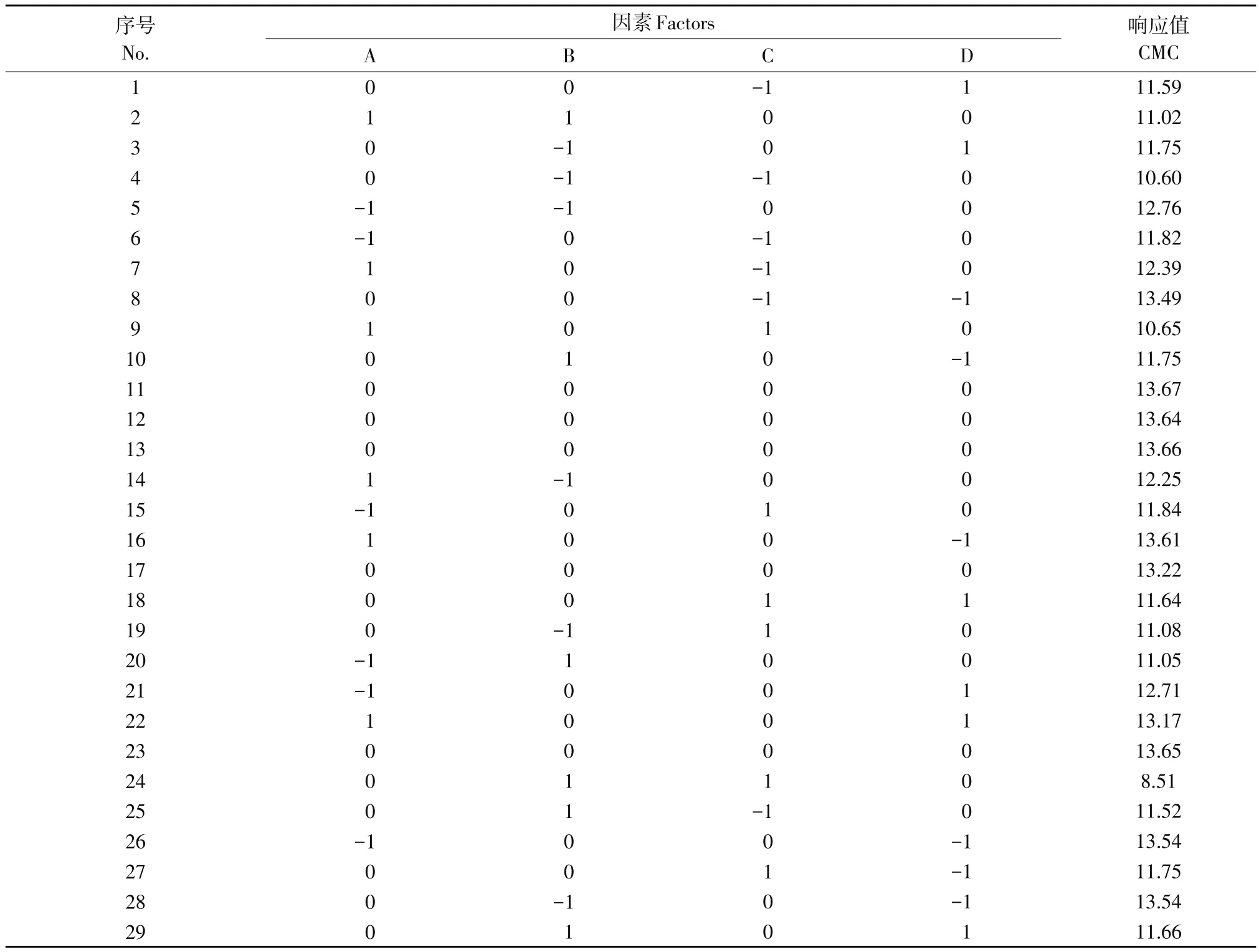
表4 菌株FLX-1响应面试验设计与结果Table 4 Experimentaldesign and results of RSMof strain FLX-1
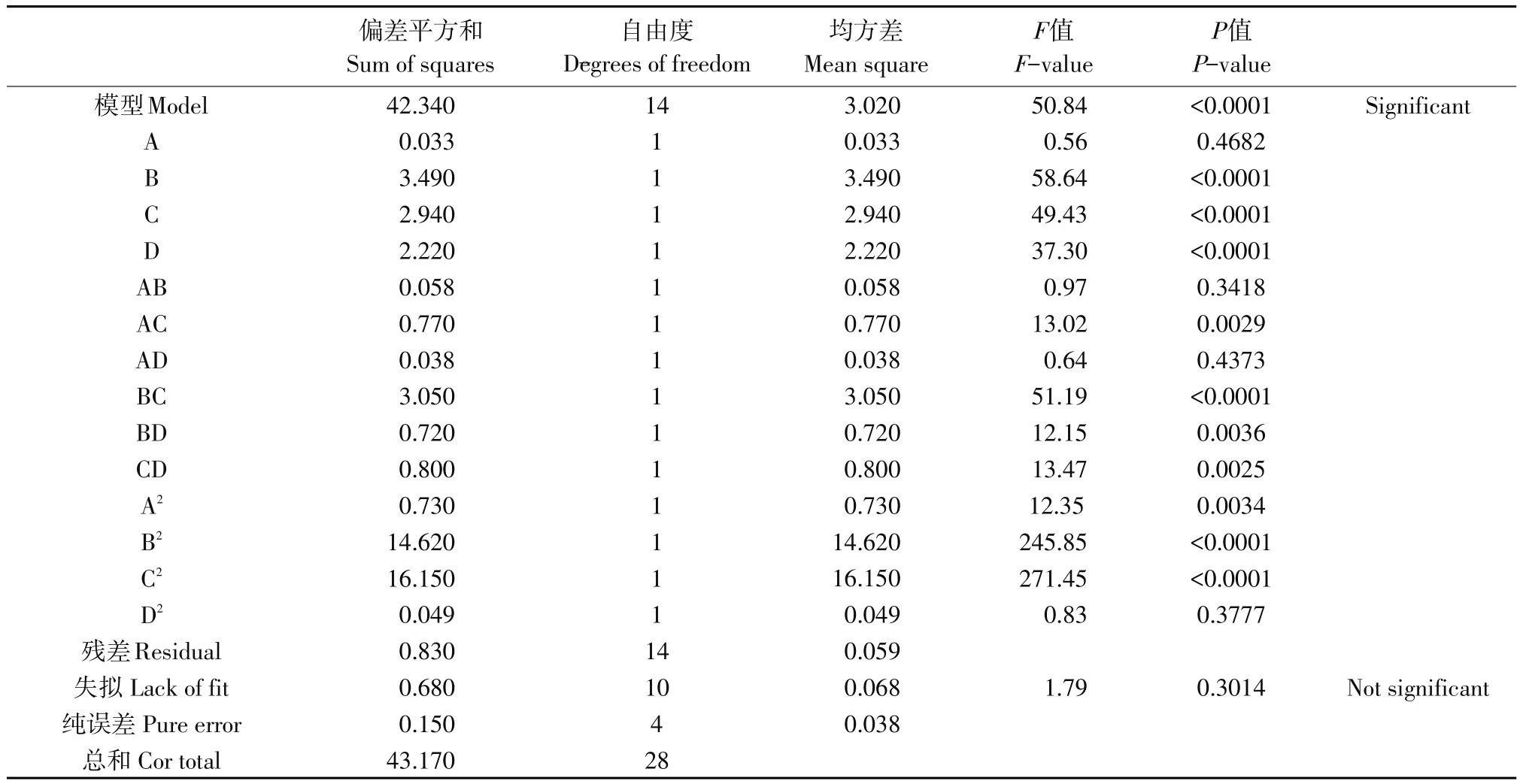
表5 菌株FLX-1响应分析试验回归分析结果Table 5 Results of the regression analysis of RSA ofstrain FLX-1
由图4(a)可知,当pH和培养时间固定在零水平(7.0,72 h)时,菌株FLX-1产CMC酶活较大值在接种量1.5%~2.5%和温度9~11℃范围内获得。图4(b)为接种量-培养时间交互组合对CMC酶活影响情况。当pH和温度维持在零水平(7.0,10℃)时,菌株FLX-1产CMC酶活较大值在接种量1.5%~2.5%和培养时间64~80 h范围内获得。图4(c)为温度-培养时间交互组合对CMC酶活的影响情况。图4(a)和图4(b)相比可知,温度-培养时间交互组合的曲面图最陡峭,说明温度-培养时间交互组合对CMC酶活作用显著。
由上述分析结果可知,当各因素固定在零水平时,较大的CMC酶活集中在曲面中心区域,并且在此区域内均存在CMC酶活极值点。经Design-Expert8.0.6软件分析可得菌株FLX-1高产CMC酶活最优条件为:接种量2.1%,温度10.5℃,培养时间74.1 h,pH 7.1。
为验证菌株FLX-1高产CMC酶活性响应模型预测CMC酶活的准确性和可靠性,在最佳条件下进行3组平行验证试验,所得结果为(14.12± 0.055)U·mL-1,与模型预测值(14.24 U·mL-1)非常接近,表明该模型可预测试验结果。
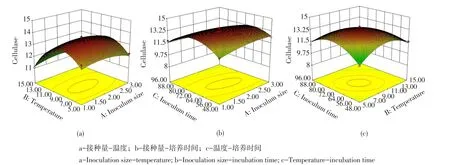
图4 不同因素对菌株FLX-1的CMC酶活产生交互影响的响应曲面图Fig.4 Response surface plot of the mutualeffecton CMC ofstrain FLX-1
3 讨论与结论
目前已筛选出较多能降解纤维素的真菌和放线菌,对纤维素降解细菌研究相对较少,但由于细菌繁殖快、发酵周期短,细菌产纤维素降解酶研究已引起关注[6-8]。按常规方法筛选获得的纤维素降解细菌产CMC酶最适温度多为45~65℃,而目前筛选到的低温纤维素降解菌产CMC酶最适温度为20℃,黄玉兰等从若尔盖高寒湿地距表层80 cm处土壤中筛选出1株低温纤维素酶高产菌株(Brevundimonas sp.)XW-1,20℃培养3 d最高酶活为15.6 U·mL-1[18];侯进慧等从农田、农产品果实表面分离获得1株低温纤维素降解菌株(Bacillus sp.)T34,20℃培养48 h最高酶活为1.43 U·mL-1[19]。这种温度条件无法达到北方有机生活垃圾降解处理要求。因此,筛选出低温条件下具有高效产CMC酶能力的细菌对严寒地区有机生活垃圾处理尤为重要。
本试验从生活垃圾土壤中筛选分离获得1株低温纤维素高效降解细菌Arthrobacter sp.FLX-1,pH 7.0、10℃、接种量2%条件下培养72 h,最高酶活为13.64 U·mL-1。同时,对菌株FLX-1产CMC酶条件优化[20-21]。本试验采用响应面分析方法对菌株FLX-1产CMC酶条件优化,优化结果为温度10.5℃,培养时间74.1 h,pH 7.1,接种量2.1%,最高酶活值达到14.12 U·mL-1,经响应面优化后产CMC酶活力比优化前提高0.45 U·mL-1,优化率为3.29%。
后续研究将进一步探索菌株FLX-1发酵条件及优化发酵培养基,以获得更高酶活性的细菌发酵液。探究多株低温纤维素降解菌的复配并研究复配菌剂对生活垃圾的处理效果,为严寒地区有效降解农村有机生活垃圾提供技术支持。
[1]Demirbilek D,Önal AÖ,Demir V,et al.Characterization and pollution potential assessment of Tunceli,Turkey municipal solid waste open dumping site leachates[J].Environmental Monitoring and Assessment,2013,185(11):9435-9449.
[2]Jilani,G,Akram,A,Ali R M,et al.Enhancing crop growth, nutrients availability,economics and beneficial rhizosphere microflora through organic and biofertilizers[J].Annals of Microbiology, 2007,57(2):177-184.
[3]Ikeda Y,Park E Y,Okuda N.Bioconversion ofwaste office paper to gluconic acid in a turbine blade reactor by the filamentous fungus Aspergillus niger[J].Bioresource Technology,2006,97(8): 1030-1035.
[4]Soloveva I V,Okunev O N,Velkov V V,et al.Theselection and properties of Penicillium verruculosum mutants with enhanced production of cellulases and xylanases[J].Microbiology,2005,74 (2):172-178.
[5]陈阿娜,汤斌.纤维素酶高产菌株选育研究进展[J].安徽农学通报,2006,12(10):64-65.
[6]廖青,江泽普,邢颖,等.发酵床中纤维素降解菌的分离以鉴定[J].生物技术通报,2014(3):106-110.
[7]朱军莉,韩剑众,励建荣.纤维素分解菌BSX5的分离、鉴定及产酶条件[J].食品与生物技术学报,2006,25(3):15-18.
[8]张丹.低温降解纤维素菌的筛选[D].哈尔滨:东北农业大学, 2007.
[9]刘洁,李宪臻,高培基.纤维素酶测定方法评述[J].工业微生物, 1994,24(4):27-32.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001:2.
[11]Karen M K,Sherry L H,Douglas C N.Novel,attached,sulfuroxidizing bacteria at shallow hydrothermal vents possess vacuoles not involved in respiratory nitrate accumulation[J].Appl Environ Microbiol,2004,70:7487-7496
[12]Li C Y,Xu C H,Pan J B,et al.Isolation of a chlorimuron-ethyl degradation bacterium and its bioremediation in contamination soil [C].Bioinformatics and Biomedical Engineering(iCBBE)InternationalConference,2011.
[13]Kumar S,Nei M,Dudley J,et al.MEGA:A biologist-centric software for evolutionary analysis of DNA and protein sequences [J].Briefings in Bioinformatics,2008,9(4):299-306.
[14]伍时华,徐雅飞,黄翠姬.降解纤维素菌株的筛选[J].食品科技, 2006(8):50-52.
[15]沈德龙,武晓森,李术娜,等.低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J].微生物学通报,2013,40(7):1193-1201.
[16]Ruan Z Y,Zhou S,Jiang S H,etal.Isolation and characterization of a novel cinosulfuron degrading Kurthia sp.from a methanogenic microbial consortium[J].Bioresour Technol,2013,147:477-483.
[17]Hou N,Feng F Z,Shi Y,et al.Characterization of the extracellular biodemulsifiers secreted by Bacillus cereus LH-6 and the enhancementofdemulsifying efficiency by optimizing the cultivation conditions[J].Environ Sci Pollut R,2014,21:10386-10398.
[18]黄玉兰,李征,刘晓宁,等.一株耐低温纤维素酶高产菌株的筛选、鉴定和产酶的初步试验[J].微生物学通报,2010,37(5): 637-644.
[19]侯进慧,孙会刚,郑宝刚,等.一株产低温纤维素酶细菌的初步分析[J].生物学通报,2010,45(8):44-46.
[20]曾茂贵,李颖.正交设计与响应面优化法对瓜蒌桂枝解痉颗粒提取工艺的比较[J].福建中医药大学学报,2014,24(3):32-36.
[21]Suhaila Y N,Ramanan R N,Rosfarizan M,et al.Optimization of parameters for improvement of phenol degradation by Rhodococcus UKMP-5M using response surface methodology[J].Ann
Isolation and identification of low-temperature cellulose-degrading bacterium and optimization of enzyme production conditions
/
LI Chunyan1, YU Qi1,FENG Lu1,CHENG Yi1,CHENG Xiaosong2,WANG Xue1,ZHANG Pinggen1
(1.School of Resources and Environmental Sciences,Northeast Agricultural University,Harbin 150030,China; 2.SchoolofFirstClinicalMedicine,Harbin MedicalUniversity,Harbin 15001,China)
A cellulose-degrading strain FLX-1 was isolated from domestic waste soil samples at low temperature by enrichment culture.According to morphologic and physiological-biochemical characteristics as well as 16S rDNA sequence analysis,strain FLX-1 was identified as Arthrobacter sp. The effects of culture time,temperature,pH and inoculation size on the carboxymethyl cellulose enzyme activity by strain FLX-1 were optimized using a response surface methodology(RSM).The results showed that the optimal enzyme production conditions were culture time 74.1 h,temperature 10.5℃,pH 7.1 and inoculation size 2.1%.At the best conditions,the carboxymethylcellulose enzyme activity ofstrain FLX-1 was 14.12 U·mL-1.
cellulose;low-temperature degradation bacterium;Arthrobacter sp.;carboxymethyl cellulose enzyme;response surface methodology
S789;S182
A
1005-9369(2015)10-0074-08
时间2015-10-29 13:40:55[URL]http://www.cnki.net/kcms/detail/23.1391.S.20151029.1340.008.html
李春艳,于琦,冯露,等.低温纤维素降解菌分离鉴定及产酶条件优化[J].东北农业大学学报,2015,46(10):74-81.
Li Chunyan,Yu Qi,Feng Lu,et al.Isolation and identification of low-temperature cellulose-degrading bacterium and optimization of enzyme production conditions[J].Journal of Northeast Agricultural University,2015,46(10):74-81.(in Chinese with English abstract)
2015-03-19
“十二五”国家科技支撑计划项目(2013BAJ12B02-4)
李春艳(1970-),女,教授,博士,博士生导师,研究方向为环境微生物。E-mail:chunyanli@neau.edu.cn

