重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白联合甲氨蝶呤治疗类风湿关节炎50例临床观察
张 杰,邓文郁,陈 芍,肖 岚,李江涛
(四川省宜宾市第一人民医院风湿免疫科,四川 宜宾 644000)
重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白联合甲氨蝶呤治疗类风湿关节炎50例临床观察
张 杰,邓文郁,陈 芍,肖 岚,李江涛
(四川省宜宾市第一人民医院风湿免疫科,四川 宜宾 644000)
目的 观察重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白(rhTNFR:Fc)联合甲氨蝶呤(MTX)治疗类风湿关节炎(rheumatoid arthritis,RA)的临床疗效及安全性。方法 100例活动期RA患者采用抽签随机法分为两组各50例,MTX组采用MTX 15 mg/w治疗;联合治疗组采用MTX 15 mg/w加rhTNFR:Fc每次50 mg治疗。观察用药前及用药后2、4、8、12、24周患者肿胀关节数、疼痛关节数、压痛关节数、晨僵时间、医生和患者评价、疾病活动分数评分及血沉(ESR)、超敏C反应蛋白(CRP)、类风湿因子 、抗环瓜氨酸太抗体水平。结果 治疗24周后,联合治疗组的ACR改善率明显优于对照组(P< 0.05);两组不良反应发生率比较差异无统计学意义(P> 0.05)。结论 MTX联合rhTNFR:Fc治疗RA疗效显著,不良反应发生率也不高。
甲氨蝶呤;重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白;关节炎,类风湿;
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性、进行性、侵袭性关节炎为主要临床表现的全身性自身免疫疾病,具有很高的致残率[1]。许多患者经过传统免疫抑制剂的联合治疗病情仍不能很好的控制,生物制剂是20世纪90年代末开始在风湿病中使用的具有明确靶点的新型药物。本研究通过观察甲氨蝶呤(MTX)联合重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白(rhTNFR:Fc)及单用MTX治疗RA,评价两种方法的临床疗效和安全性。
1 资料与方法
1.1 一般资料 选取2009年7月至2013年12月在我院院明确诊断的RA患者100例,其中男22例,女78例,年龄20~72岁[(48.3±11.8)岁],病程7月至23年[(6.0±3.8)年]。所有患者均符合美国风湿病学会(ACR)1987年修订的分类标准,病情处于活动期,并排除有严重心、肝、肾等重要脏器病变、合并有感染、肿瘤、其他结缔组织病及三月内使用过其它任何生物制剂的患者。疾病活动性的评价采用ACR推荐的疾病活动性评价核心测量指标,疾病活动需满足以下4条:①休息时中等程度的疼痛;②≥3个关节肿胀;③≥6个关节触痛;④符合下面任意三条中的两条:晨僵时间≥30 min,红细胞沉降率(ESR)≥28 mm/h,C反应蛋白(CRP)≥正常值上限的1.5倍。均遵循知情同意的原则,采用抽签随机法将患者分为两组各50例,两组基线资料比较差异均无统计学意义(P> 0.05),见表1。
1.2 治疗方法 两组均每周给予MTX 15 mg,联合治疗组在此基础上加用rhTNFR:Fc 每次50 mg,前8周每周皮下注射一次,8周后改为两周注射一次,16周后改为每月皮下注射一次,观察时间为24周。

表1 两组基线资料比较
1.3 观察指标 观察并记录两组治疗前及治疗后2、4、8、12、24周的各项指标,包括①临床指标:关节肿胀个数、关节压痛个数、疼痛程度、晨僵时间、健康评估问卷、患者对疾病总体状况的评估、医生对患者疾病总体情况的评估。②实验室指标:ESR、CRP、RF、CCP。③不良反应发生情况。
1.4 疗效判定 采用ACR定义的标准(ACR20、ACR50、ACR70)评价治疗效果。ACR20是指患者压痛和肿胀关节数目(28个)有20%的改善,以下五项中至少三项有20%的改善:①健康评估问卷评分;②受试者评估的疼痛VAS评分;③受试者评估的疾病总体状况VAS评分;④研究者评估的疾病总体情况VAS评分;⑤急性期反应物(ESR或CRP)。ACR50、ACR70采用相同的标准定义为50%及70%的改善。
1.5 统计学方法 应用SPSS 19.0统计软件处理数据。计量资料服从正态分布时,采用t检验,不服从正态分布时,采用Wilcoxon秩和检验;计数资料比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
在治疗过程中,联合治疗组有2例,对照组有3例患者退出试验,主要原因为肝功能损害、白细胞减少等不良反应。其余所有患者均完成治疗过程。
2.1 两组治疗效果比较 治疗24周后,联合治疗组ACR20改善率为95.8%、ACR70改善率为66.8%,对照组ACR20改善率为70.2%、ACR70改善率为17.0%,联合治疗组均优于对照组(P< 0.05)。治疗过程中,除用药2周时两组ACR50差异无统计学意义(P> 0.05),其余各时间点两组的ACR疗效比较,差异均有统计学意义(P< 0.05),见表2。
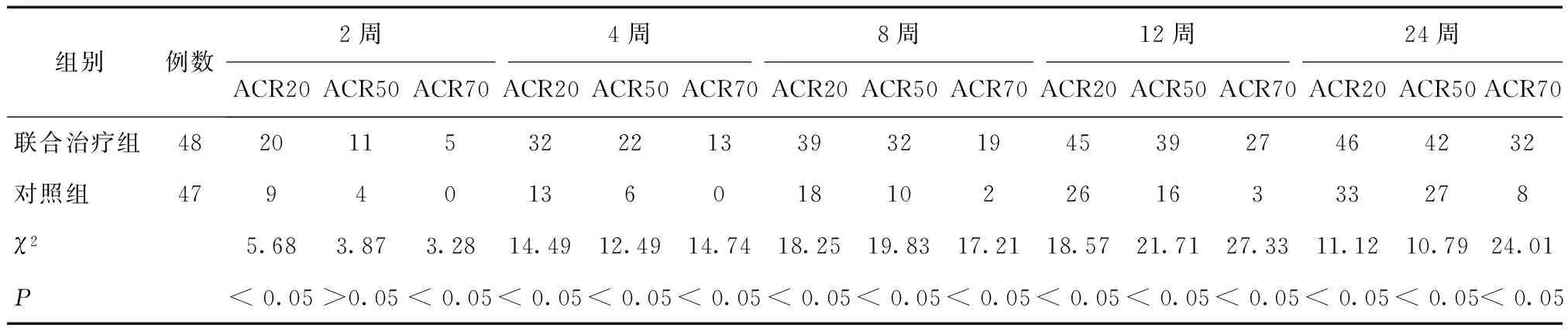
表2 两组各时间点ACR20、ACR50、ACR70情况比较 (n)
2.2 两组临床及实验室指标比较 治疗后8、12、24周两组ESR、CRP、类风湿因子比较,差异均有统计学意义(P< 0.05),CCP比较,差异无统计学意义(P> 0.05)。见表3。

表3 两组各时间点临床及实验室指标比较
※与对照组比较,P< 0.05
2.3 不良反应 联合治疗组有5例患者出现注射部位局部瘙痒、皮肤发红反应,均自行缓解;2例出现白细胞下降,停药予以升白细胞治疗后白细胞回复正常,未发生严重不良反应。对照组出现1例白细胞减少,2例肝功能损害,停药予以保肝治疗后肝功能恢复正常。两组不良反应发生率比较差异无统计学意义(P> 0.05)。
3 讨论
RA是一种慢性炎性疾病,以手、足的小关节受累为主,并可累及全身其他系统。多数患者表现为慢性或快速进行性骨关节破坏,出现关节畸形并导致生活不能自理和劳动力丧失。目前RA的治疗以药物为主,其中最重要的是缓解病情的抗风湿药(DMARDs)。尽管足够剂量和疗程的DMARDs对RA患者的病情有一定效果,但仍有不少患者因治疗效果欠佳和药物不良反应而停药[2]。MTX目前普遍认为是最有效的慢作用药物,可以减慢骨破坏的进展,在RA治疗中的价值越来越受到重视,是治疗RA的一线药物[3]。
生物制剂在RA的治疗史上具有里程碑式的意义,近十年来,多种生物制剂在RA治疗中的应用改变了疾病的预后[4],并且取得了很好的治疗效果[5~8],肿瘤坏死因子-α(TNF-α)是一种重要的炎症细胞因子,在RA的发病以及骨质破坏过程中起重要作用,rhRNFR:Fc是一种采用重组DNA技术生产的生物制剂,通过与TNF受体结合从而特异地阻断TNF-α与其细胞表面受体的相互作用,降低其活性。本研究发现,rhTNFR:Fc联合MTX组较单用MTX组起效快,治疗后8、12、24周联合治疗组ESR、CRP、RF与对照组比较,差异均有统计学意义(P< 0.05),治疗24周后,联合治疗组的ACR20、ACR50、ACR70改善率优于对照组,rhTNFR:Fc联合MTX治疗RA能够较快、更好地控制病情,两组之间不良反应发生率无明显差异。
目前,关于应用生物制剂过程中如何减量没有明确的意见,Kavanaugh等研究表明,在RA治疗中,当疾病活动度较低或症状消失时可以停用生物制剂[9],一项关于依那昔普、阿达木单抗、英夫利昔单抗的多中心、回顾性的研究表明,在控制RA患者的病情时生物制剂是可以减量的,并且依那西普的计量明显低于阿达木单抗和英夫利昔单抗[10]。Yuasa等通过对98例RA患者应用依那西普、阿达木单抗、英夫利昔单抗、托珠单抗的对比研究表明,依那西普具有最好的治疗效果、缓解率及药效持续时间[11]。
生物制剂治疗对改善RA患者预后具有重要意义,当一种TNF-α抑制剂治疗无效时,可选用另一种TNF-α抑制剂或其他类别的生物DMARD可能有效,目前尚不断言哪种生物制剂疗效更佳或为首选[12]。在使用生物制剂治疗RA时,主张联合使用非生物制剂DMARDS(尤其是MTX)以达到更有效地延缓骨质破坏,但并不主张生物制剂之间的联合使用[13]。
在安全性方面,Moiseev等通过对包括RA、系统性红斑狼疮等风湿性疾病在内的107例患者6个月的观察发现,22例出现轻度的不良反应,6例出现严重的不良反应,2例为明显白细胞减少(应用利托西单抗后),2例为严重输液反应(应用英夫利昔单抗后),2例为全身性感染(应用英夫利昔单抗后),严重不良反应发生率相对较低[14]。在不良反应方面以感染和肿瘤发生报道较多,因此在使用这些生物制剂,尤其是TNF拮抗剂的时候需注意筛查排除结核、活动性肝炎等一些高危人群。另有研究报道,在应用生物制剂治疗的RA患者间质性肺炎的发生率为0.5%~3%,但生物制剂是否增加或降低间质性肺炎是有争论的[15]。
生物制剂对改善RA患者的病情具有较好疗效,但由于临床应用时间相对较短,还需要进一步观察更多病例,积累治疗经验,以探索适宜的治疗方案。
[1] 栗占国,张奉春,鲍春德.类风湿关节炎[M].北京:人民卫生出版社,2009:6.
[2] 栗占国.生物制剂在类风湿关节炎治疗中的地位及展望[J].临床药物治疗杂志,2008,6(4):10-12.
[3] Londono J,Santos AM,Santos PI,et al.Therapeutic efficacy and safety of methotrexate + leflunomide in Colombian patients with active rheumatoid arthritis refractory to conventional treatment[J].Rev Bras Reumatol,2012,52(6):837-845.
[4] Sanmartí R,Ruiz-Esquide V,Hernández MV.Rheumatoid arthritis:a clinical overview of new diagnostic and treatment approaches[J].Curr Top Med Chem,2013,13(6):698-704.
[5] Der Heijde Dv,Klareskog L,Rodriguez-Valverde V,et al.Comparison of etanercept and methotrexate,alone and combined,in the treatment of rheumatoid arthritis:two-year clinical and radiographic results from the TEMPO study,a double-blind,randomized trial[J].Arthritis Rheum,2006,54(4):1063-1074.
[6] Haugeberg G,Conaghan PG,Quinn M,et al.Bone loss in patients with active early rheumatoid arthritis:infliximab and methotrexate compared with methotrexate treatment alone.Explorative analysis from a 12-month randomised,double-blind,placebo-controlled study[J].Ann Rheum Dis,2009,68(12):1898-1901.
[7] Yount S,Sorensen MV,Cella D,et al.Adalimumab plus methotrexate or standard therapy is more effective than methotrexate or standard therapies alone in the treatment of fatigue in patients with active,inadequately treated rheumatoid arthritis[J].Clin Exp Rheumatol,2007,25(6):838-846.
[8] 朱勇,吴旭强,刘怡,等.重组人肿瘤坏死因子受体-抗体融合蛋白治疗类风湿关节炎65例的疗效与安全性观察[J].实用医院临床杂志,2012,9(2):97-99.
[9] Kavanaugh A,Smolen JS.The when and how of biologic agent withdrawal in rheumatoid arthritis:learning from large randomised controlled trials[J].Clin Exp Rheumatol,2013,31(4 Suppl 78):S19-21.
[10]Ramirez-Herraiz E,Escudero-Vilaplana V,Alanon-Plaza E,et al.Efficiency of adalimumab,etanercept and infliximab in rheumatoid arthritis patients:dosing patterns and effectiveness in daily clinical practice[J].Clin Exp Rheumatol,2013,31(4):559-565.
[11]Yuasa S,Yamaguchi H,Nakanishi Y,et al.Treatment responses and their predictors in patients with rheumatoid arthritis treated with biological agents[J].J Med Invest,2013,60(1-2):77-90.
[12]凃巍,胡绍先.生物制剂治疗类风湿关节炎的应用策略[J].内科急危重症杂志,2010,16(6):293-294.
[13]陈龙,袁国华.类风湿关节炎的生物制剂治疗[J].实用医院临床杂志,2011,8(2):10-13.
[14]Moiseev SV,Novikov PI,Semenkova EN,et al.Severe adverse events from treatment with genetically engineered biological agents in patients with rheumatic diseases[J].Ter Arkh,2013,85(5):37-43.
[15]Atzeni F,Boiardi L,Salli S,et al.Lung involvement and drug-induced lung disease in patients with rheumatoid arthritis[J].Expert Rev Clin Immunol,2013,9(7):649-657.
The clinical observation of 50 patients with rheumatoid arthritis treated with a recombinant human tumor necrosis factor-α receptorⅡ:IgG-Fc fusion protein combined with methotrexate
ZHANG Jie,DENG Wen-yu,CHEN Shao,XIAO Lan,LI Jiang-tao
(Department of Rheumatology and Immunology,The First People’s Hospital of Yibin,Yibin 644000,China)
LIJiang-tao
Objective To observe the clinical efficacy and safety of recombinant human tumor necrosis factor-α receptorⅡ(rhTNFR):IgG-Fc fusion protein for injection combined with methotrexate(MTX)in the treatment of rheumatoid arthritis(RA).Methods One hundred patients with active rheumatoid arthritis were randomly divided into MTX and combined therapy groups,50 in each group.The MTX group was treated with MTX 15 mg/w while the combined therapy group was treated with MTX 15 mg/w plus subcutaneous injection of rhTNFR:Fc fusion protein 50 mg/w.The number of swollen joints,painful joints,tender joint count,duration of morning stiffness,doctor and patient evaluation,disease activity score(DAS28),erythrocyte sedimentation rate(ESR),ultra-sensitivity C-reactive protein(CRP),rheumatoid factors(RF)and anti-cyclic citrullinated peptide antibody level were observed before and after 2,4,8,12 and 24 weeks of treatment.Results After 24 weeks of treatment,the improvement of ACR in the combined therapy group was significantly better than that in the control group(P< 0.05).There was no statistical difference in the incidence of adverse reactions between the two groups.Conclusion It is effective of MTX combined with rhTNFR:Fc in the treatment of RA while adverse reactions rate is not high..
Methotrexate;rhTNFR:Fc;Arthritis,rheumatoid
李江涛
R593.22
A
1672-6170(2015)05-0180-04
2015-01-21;
2015-05-05)

