耧斗菜花芽分化及发育的初步研究
杨阳,亢秀萍
(1.吕梁学院 生命科学系 ,山西 吕梁 033000;2.山西农业大学 园艺学院,山西 太谷 030801)
耧斗菜花芽分化及发育的初步研究
杨阳1,亢秀萍2*
(1.吕梁学院 生命科学系 ,山西 吕梁 033000;2.山西农业大学 园艺学院,山西 太谷 030801)
试验采用常规实体解剖石蜡切片法,显微观察耧斗菜低温春化后花芽分化及发育的过程。结果表明:耧斗菜植株在结束低温春化处理自然条件下生长15~20d,茎端分生组织开始向花序分生组织转化;20d左右,顶生花花分生组织两侧对称出现萼片原基;20~30d顶生花花分生组织高度隆起,两侧基部对称向外生出雄蕊原基;自然条件下生长30d,雌蕊原基开始分化,随即在雌蕊原基边缘形成数个突起,突起逐渐长大成为心皮原基。
耧斗菜;低温春化;花芽分化
耧斗菜于(AquilegiavulgarisL.)毛茛科耧斗菜属。原产于欧洲、西伯利亚,自然分布于北半球温带,大约有70~120种。耧斗菜为多年生草本,基生叶2~3回三出复叶。单歧或二歧聚伞花序,萼片5枚花瓣状,花瓣与萼片近等大,同色或异色,下延成距,距直或末端弯曲呈钩状,稀呈囊状或无距。雄蕊多数,内轮常退化而无花药,白色膜质。雌蕊由5~10个离生心皮组成,胚珠多数。
毛茛科植物大多保持着离生的雄蕊和雌蕊螺旋状排列在膨大花托上的特点,Corner曾发现毛茛科耧斗菜属的离生雄蕊群属于向心发育式样。Kosuge等在Aquilegia buergeriana花瓣个体发育研究中,发现其雄蕊群花丝伸长的顺序是离心的。傅德志等在耧斗菜属花部形态发生的研究中指出对耧斗菜花芽分化及发育过程的研究,特别是雄蕊群原基的发生顺序与雄蕊的发育过程,对于揭示雄蕊群离心发育的形态学本质有着重要的意义[1]。我国有丰富而珍贵的耧斗菜野生质资源,特别是山西有丰富的华北耧斗菜资源,掌握耧斗菜的开花习性,花芽分化及发育过程,对今后的新品种选育,种子、种苗、盆花和鲜切花的规模化生产意义重大。
1 材料与方法
AquilegiaCaerulea(大花耧斗菜天鹅系列)。试验对15片叶龄的耧斗菜植株进行35d的低温处理,并对花芽分化进程跟踪观察。
低温春化处理35d结束后,将0d(对照)和35 d处理植株放置在日均温20℃的自然条件下生长。每5日取材一次,每次随机取样5株。剥去外层莲座叶,露出小叶包裹的茎尖,立即放于FAA固定液中固定并保存。常规石蜡切片,采用番红-固绿双重染色法。固定-脱水-透明-浸蜡-包埋-切片-粘片-脱蜡-番红、固绿染色-封藏-镜检拍照。切片厚度为7.5μm,加拿大中性树胶封片。
耧斗菜茎尖石蜡切片制片染色观察的具体方法:
(1)取材、固定。剥去外层莲座叶,露出叶鞘包裹的茎尖,放入FAA固定液中固定,用针管抽气,使材料沉底,使固定液充分进入组织,可长期保存。贴标签注明取材日期。
(2)脱水、透明。按乙醇浓度梯度为(50%、70%、80%、95%、100%、100%),1/2 100%乙醇+1/2二甲苯,二甲苯两次的顺序脱水、透明。同时为了使材料充分脱水,分别在80%乙醇和1/2 100%乙醇+1/2二甲苯中过夜。1/2 100%乙醇+1/2二甲苯混合液中加入少许番红粉末,以便以后切片中材料与石蜡容易辨别。
(3)浸蜡、包埋。材料从二甲苯Ⅱ中取出放入1/2二甲苯+1/2石蜡混合液中放入36℃烘箱2h后,将烘箱调至40℃过夜。次日烘箱调至52~62℃保持2h,浸蜡。然后用纸盒常规包埋。
(4)切片、粘片、展片、烘片。修正蜡块,将其固定在小木块上。调整好切片机进行切片,切片厚度7.5μm。选择干净的载玻片,滴一滴粘片剂并用手指抹开,选择蜡带光面朝下黏贴在载玻片上。滴展片剂数滴后放在40℃左右的水浴锅上展片。(水浴锅水面铺平保鲜膜,载玻片放在上面展片效果更好)。最后放入40℃烘箱中烘片,48h最佳。
(5)脱蜡、染色、封片、观察。切片先经二甲苯两次、1/2 100%乙 醇 +1/2 二 甲 苯、乙 醇(100%、100%、95%、85%、70%、50%)、蒸馏水的顺序逐级脱蜡,复水。然后用番红溶液染色24h。再经蒸馏水、1%HCl溶液、乙醇(50%、70%、80%)、固绿溶液复染,100%乙醇、1/2 100%乙醇+1/2二甲苯、二甲苯顺序分色,透明。完成上述过程后用加拿大中性树胶封片。
(6)观察、拍照、分析。
2 结果与分析
对照组未经过低温处理,耧斗菜植株不进行花序原基分化;在低温处理阶段,花序原基并不发生,只有将植株转移到适宜的环境条件下,营养茎端分生组织才向花序分生组织转化。完成成花诱导的耧斗菜植株在适宜的环境条件下生长就会进入花芽分化阶段,未完成成花诱导的植株则不会进入花芽分化阶段。研究发现,耧斗菜花芽分化分为未分化期、分化始期和花器官形成期。
2.1 未分化期
即营养茎端分生组织分化期(图1):低温处理结束后耧斗菜植株的茎端分生组织均处于营养茎端分生组织阶段。此时的茎尖生长锥被最小的叶片原基包裹,茎端分生组织的原套-原体结构成三角锥状略有隆起,两侧对称分化两个互生叶原基。

图1 营养茎端分生组织分化期Fig.1 Predifferentiation Stage
2.2 分化始期
即花序分生组织分化始期(图2):耧斗菜植株在结束35d的低温春化处理自然条件下生长15~20d后,茎端分生组织开始向花序分生组织转化。此时茎端分生组织停止分化基生莲座叶的叶原基,其三角锥状突起的顶端开始变宽平,分生组织右侧出现突起。
2.3 花器官形成期
(1)花被分化期:此分化期可分为花萼分化和花瓣分化。花萼分化期(图3):低温春化处理的耧斗菜植株自然条件下生长20d左右,顶生花花分生组织两侧对称出现两个较大的突起即萼片原基。萼片原基进一步发育形成萼片。萼片原基外侧是两枚茎生叶的叶原基和由花序分生组织分化的侧花序原基。在花萼原基形成后,在萼片内侧花分生组织基部产生突起即花瓣原基。花瓣原基(图4)进一步发育形成花瓣。

图2 花序分生组织分化始期Fig.2 Initial stage of flower buds

图3 花萼分化期Fig.3 Sepal Primordial
(2)雄蕊分化期(图5):低温春化处理的耧斗菜植株自然条件下生长20~30d,顶生花花分生组织的原套-原体结构高度隆起,两侧基部对称向外生出突起即雄蕊原基。雄蕊群原基发生的顺序是由基部向顶端螺旋状进行。即基部雄蕊原基最早发生,发生方式是螺旋状依次向顶端发生出其它雄蕊原基;雄蕊原基的大小基部最大依次直至顶端雄蕊原基逐渐变小,雄蕊发育过程花药的发育早于花丝的发育;退化雄蕊出现在雄蕊群顶部最内层,其花丝结构不完整,膜质化。

图5 雄蕊分化期Fig.5 Stamens primordial differentiation stage

图6 雌蕊分化期Fig.6 Pistils primordial differentitiation stage
(3)雌蕊分化期(图6):低温春化处理的耧斗菜植株自然条件下生长30d,待花芽中的雄蕊原基全部形成后,花分生组织顶端渐渐变平坦,随即在雌蕊原基边缘形成数个突起,突起逐渐长大成为心皮原基。
待耧斗菜能肉眼判断抽薹(低温处理后40d左右)时,对顶花芽进行石蜡切片观察,这时雌蕊心皮内壁向内产生突起,这些突起随着植株生长,发育成胚珠(图7)。切片观察发现,心皮两侧胎座对称形成胚珠。
3 讨论与结论
本试验通过石蜡切片对完成成花诱导的耧斗菜植株茎端分生组织显微观察,研究发现并证实了在低温下,花序原基并不发生,只有将植物转移到适宜的环境条件下,营养茎端分生组织才向花序分生组织转化,即低温只起诱导作用。
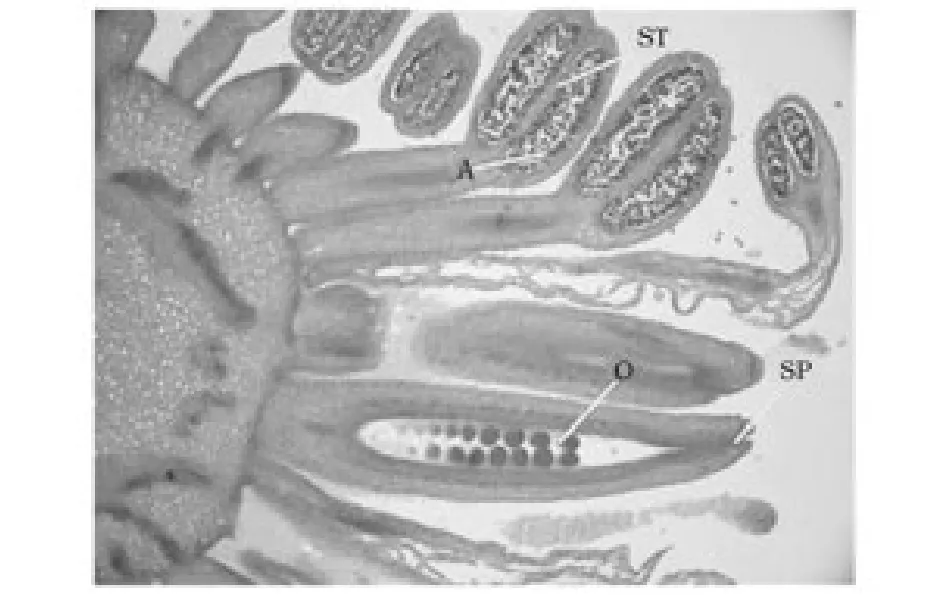
图7 胚珠形成期Fig.7 Ovary wall and ovule
耧斗菜茎端分生组织在不同的发育阶段产生不同的器官,发育早期,茎端分生组织形成莲座状基生叶,此时的茎端分生组织为营养茎端分生组织。但当植株向开花过渡时,茎端分生组织转化成初生花序分生组织,后者可直接产生花芽。此后叶原基产生一些茎出叶,在茎出叶叶腋下在形成次级花序分生组织。在花序分生组织形成后,再特化为花分生组织。因此在从营养生长往生殖生长过渡的进程中,经历了营养茎端分生组织——花序分生组织——花分生组织——花器官形成4个阶段。
耧斗菜是单歧或二歧聚伞花序,顶生花发生先于侧生花序,切片观察结果当顶生花分生组织分化萼片原基时,侧生花序分生组织略微隆起,当顶生花进入雄蕊分化期时,侧生花分生组织才高度呈球型隆起。切片同时观察到,当顶生花开始进入雄蕊分化期后,花茎高度随之增加。试验中观察到花萼分化期开始后很快就开始花瓣分化期,两个时期几乎是同时发生,依次发育。
耧斗菜雄蕊群在原基发生阶段为向心发生,如图5、图6,雄蕊群在原基早期发生是由外向中心发育,及所谓的向心发生。在其后的发育过程,最内侧的雄蕊原基发育强烈,最后形成退化雄蕊,图7可观察到。而有最内轮退化雄蕊原基发育引发的雄蕊群离心式发育未能在本试验中充分证明。
[1]傅德志,梁汉兴,路安民,等.耧斗菜属花部形态发生[J].植物学报,1995,37(10):791-794.
[2]予茜,郭友好,黄双全.三种耧斗菜属植物柱头的特征[J].植物分类学报,2005,43(6):513-516.
[3]Billie Gould,Elena M Kramer.Virus-induced gene silencing as a tool for functional analyses in the emerging model plantAquilegia(columbine,Ranunculaceae)[J].Plant Methods,2007(3):6.
[4]郭蕊,赵祥云,王文和,等.百合花芽分化的形态学观察[J].沈阳农业大学学报,2006,37(1):31-34.
[5]李晓梅.大豆茎顶端分生组织石蜡切片的制备[J].大豆科学,2008,27(4):708-710.
[6]徐青.植物石蜡切片双重染色技术的改进[J].宁夏农学院学报,1999,20(2):89-90.
[7]郭丽荣.植物组织制片的研究方法[J].中学生物学,2004,2:36-37.
[8]王金平,张俊梅.白头翁花的石蜡切片制作[J].信阳师范学院学报,2008,21(4):573-576.
[9]郑燕璇,王晓鸿,苟新敏.石蜡切片脱蜡方式的比较[J].中国实用医药,2009,4(l4):211-212.
[10]陈丹,陈进明,王勇,等.宽叶泽苔草的花器官发生[J].植物分类学报,2003,41(3):229-234.
Preliminary Study of the Flower Bud Differentiation and Development of theAquilegiaL.
Yang Yang1,Kang Xiuping2*
(1.LifeScienceLvliangUniversity,LvliangShanxi033000,China;2.CollegeofHorticulture,ShanxiAgricultural University,TaiguShanxi030801,China)
Test by routine dissection of paraffin sectioning,flower bud differentiation and development ofAquilegiaafter low temperature vernalization was observed by the microtechnique.The results showed that:the stem apical meristem of theAquilegiabegan to transform to inflorescence meristem after 15~20days low-temperature vernalization under natural condition.about 20d,sepal primordia symmetrically appeared bilaterally the apical meristem.20~30days,the apical meristem uplifted,staminate primodium symmetrically grew on both sides of the base;after 30dunder natural conditions,pistil primordia began to differentiate,then several protuberance formed on the edge of the pistillate primodium,and became a carpel primordia.
Aquilegia;Vernalization under low temperature;Flower bud differentiation
S682.21
A
1671-8151(2015)05-0474-05
10.13842/j.cnki.issn1671-8151.2015.05.005
2015-01-12
2015-03-25
杨阳(1983-),女(汉),甘肃兰州人,硕士,研究方向:观赏植物引种驯化及开花生理
*通讯作者:亢秀萍,副教授,硕士生导师。Tel: 15803588106;E-mail:xingguoming@163.com
(编辑:马荣博)

