发酵-渗透汽化-蒸汽分离集成工艺生产乙醇
邓情,姚佩娜,樊森清,张燕,李伟佳,肖泽仪,陈春燕
(1.四川大学化工学院,四川成都610065;2.西南石油大学化学化工学院,四川成都610500)
发酵-渗透汽化-蒸汽分离集成工艺生产乙醇
邓情1,姚佩娜1,樊森清1,张燕1,李伟佳1,肖泽仪1,陈春燕2
(1.四川大学化工学院,四川成都610065;2.西南石油大学化学化工学院,四川成都610500)
发酵的低效率和产物分离的高能耗是目前燃料乙醇生产的主要技术瓶颈。采用发酵-PDMS膜渗透汽化-乙醇蒸汽二次分离集成工艺进行乙醇的发酵实验。发酵与渗透汽化膜分离操作连续耦合,用常温水对膜下游的渗透蒸汽进行部分冷凝,未冷凝的高浓度乙醇蒸汽经真空泵输送到大气条件下自然冷凝,实现了渗透蒸汽的二次分离。发酵实验持续264 h,得到细胞的平均浓度为19.8 g/L,葡萄糖的平均消耗速率为6.09 g/(L·h),乙醇的平均体积产率为2.31 g/(L·h),乙醇的得率系数为0.38,发酵液的乙醇累积产量达610 g/L。能耗分析表明,采用这种集成工艺生产乙醇的蒸汽输送段能耗仅为传统低温冷凝段能耗的26%。
发酵;乙醇;膜分离;渗透汽化;自然冷凝;二次分离
生物发酵产乙醇已成为生物质燃料和原料的主要发展领域之一[1⁃5],而发酵工艺则是重要的研究课题。在目前采用批发酵生产燃料乙醇的工艺中,发酵液中不断累积的乙醇会对微生物细胞产生严重的抑制作用,导致发酵效率低、产物提纯能耗大和废液处理量大等缺点[6⁃8]。为消除乙醇的抑制作用、提高乙醇产率和降低生产成本,将乙醇从发酵液中原位分离并与发酵过程耦合被认为是最有效的解决方案,这已成为现阶段生物乙醇发酵工艺的研究热点。目前所采用的分离技术有气提、萃取、吸附、蒸馏以及渗透汽化等[9],其中发酵与渗透汽化耦合操作的工艺被认为是最具前景的。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜生物反应器是目前研究最多的发酵-渗透汽化耦合生产乙醇的系统[10⁃11]。PDMS渗透汽化膜用于发酵-分离耦合工艺,可以实现发酵产物的同步原位分离,有效避免或减轻发酵产物的抑制作用,使发酵工艺系统能够连续、稳定和高效率操作;透过膜的分离产物是浓度较高的乙醇粗产品,有利于后续工艺中产品的浓缩和精制。O'Brien证明了PDMS膜生物反应器系统在发酵过程的优越性,但也指出由于在渗透汽化工艺系统中使用低温制冷设备收集膜下游的低浓度乙醇蒸汽,使得采用传统的渗透汽化工艺系统生产乙醇的能源费用高于传统的批发酵[12]。
在前期工作中,采用间断的发酵-渗透汽化耦合方式实现了500 h连续发酵操作,但因产物分离的间断同步使得乙醇的发酵性能在渗透汽化膜生物反应器中波动大,导致整个发酵过程的平均产率低,未能全面体现渗透汽化膜生物反应器用于乙醇发酵的优势[13]。本文改进了渗透汽化分离的工艺,采用常温自来水冷凝膜下游的部分
渗透蒸汽,未冷凝的高浓度乙醇蒸汽采用真空泵输送至大气环境下的冷凝器中使其自然冷凝为液体,成功实现了PDMS膜生物反应器系统中发酵-渗透汽化操作的连续耦合,显著提高系统的发酵性能、能量效率和运行稳定性。
1 实验材料和方法
1.1 实验菌株和培养基
菌株:湖北安琪酵母公司生产的工业用耐高温活性干酵母(TH⁃AADY),取5 g活性干酵母在温度为35~40℃的自来水中溶解并复活15~20 min,然后将其投入发酵罐中进行发酵,无需对其进行纯培养过程。
培养基组成:葡萄糖100 g/L、CaCl20.15 g/L、酵母膏8 g/L、MgSO4·7H2O0.55 g/L、KH2P041.5 g/L、(NH4)2S045.0 g/L,自来水补充至1 L。其中除葡萄糖为工业级外,其余试剂均为分析纯。培养基在温度为115℃的高压灭菌锅灭菌30 min后冷却至室温备用。
1.2 膜和膜组件
本实验采用的是自制的聚二甲基硅氧烷(PDMS)复合平板膜[14],单张有效膜面积为0.08 m2,膜器结构为板框式,尺寸为300 mm×300 mm,共2张膜。
1.3 实验流程
PDMS膜生物反应器封闭循环系统生产乙醇的流程如图1所示。这个系统与以前所采用的系统[11,13]最主要区别是在渗透蒸汽冷凝回收段省去了低温制冷装置。在发酵开始前,使用75%的乙醇溶液将管路、发酵罐3、循环泵4和膜组件6组成的循环系统(流程中虚线所围部分)清洗灭菌,然后用蒸馏水反复冲洗以消除残留乙醇。初始培养液和种子液混合形成6 L发酵液,装入发酵罐3中启动发酵操作;发酵液温度由恒温槽1控制在35±1℃;发酵液PH值,用氨水控制在3.5±0.5。在发酵初期的4 h向发酵罐内通入空气进行有氧发酵,使酵母细胞快速生长。当系统运行24 h后,发酵液中的乙醇浓度达到约70 g/L时,开启循环泵4,进行乙醇的渗透汽化原位分离,循环泵的流量为80 L/h。发酵液在发酵罐、循环泵和膜组件之间进行封闭循环,膜下游得到乙醇-水混合蒸汽,大部分水和少部分乙醇蒸汽在自来水循环冷凝器7中冷凝并收集于锥形瓶8中,剩余部分含高浓度乙醇的蒸汽被真空泵9吸入并压缩输送到大气环境中自然冷凝为液体并收集于圆形瓶10中。
从24~264 h进行了240 h的发酵与渗透汽化的连续耦合操作,在系统连续运行至264 h(12 d)时,细胞存活率降至25%,发酵液中的乙醇浓度降至23.5 g/L,葡萄糖消耗率也明显下降,整个发酵过程结束。

图1 PDMS膜生物反应器集成系统流程Fig.1 The PDMS membrane bioreactor integration process
1.4 分析方法
细胞的存活率使用血球计数板,通过荧光显微镜(BI~220ASCMOTIC)数数并计算获得,活细胞通过吕氏碱性美蓝液染色判定。细胞浓度通过电子天平称量细胞干重获得。冷凝收集的乙醇溶液浓度通过密度仪DMA4500测定。由于乙醇的挥发性很大,发酵罐中乙醇浓度的测量采用蒸馏方法将其蒸出,冷凝并加蒸馏水至原体积,使用密度仪测定。发酵液中糖浓度采用Somogyi⁃Nelson比色法测定[15]。
真空泵(PC201,德国)的抽气能耗采用气体压缩过程的能耗分析办法[16]:
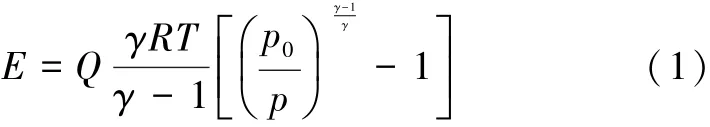
式中:E为能耗,Q为总摩尔流量,T为温度,R为理想气体常数,γ为下游混合物的绝热膨胀系数,P0为真空泵的出口压力,P为膜下游压力。
2 结果与讨论
2.1 细胞的生长情况
图2所示是发酵液中乙醇浓度和细胞浓度的时间过程曲线。由图2可以看出,在整个发酵过程中细胞生长可分为以下5个不同的阶段:快速生长期、抑制期、二次生长期、稳定期和衰亡期。在发酵过程中只有葡萄糖、蒸馏水的添加和产物乙醇的分离,产物乙醇的及时分离使发酵液中的乙醇浓度处于较低水平。在整个过程中细胞的平均浓度为19.8 g/L。
在0~12 h时间段细胞处于快速生长期,由于发酵液中低浓度的乙醇和充足的营养物质,细胞快速生长。当发酵液中乙醇浓度到达一定值时,细胞生长趋势减缓。
在12~36 h时间段细胞处于抑制期,发酵液中乙醇浓度达到70 g/L,使得细胞生长受到产物乙醇的抑制作用,细胞浓度约为9.21 g/L。在24 h时启动循环泵,开始渗透汽化分离的连续操作。在渗透汽化分离开启的最初12 h,细胞生长惯性减缓;若此时刻后为传统批发酵,细胞生长受到乙醇的强抑制作用,细胞浓度一直下降(图2中短虚线所示),发酵过程将难以长期运行下去。
在36~156 h时间段细胞处于二次生长期,由于产物乙醇的渗透汽化持续分离,对细胞的抑制作用明显减弱,细胞发生了二次生长,最高浓度达到26.8 g/L,约为传统批发酵的3倍。
在156~204 h时间段细胞处于稳定期,由于细胞的适应性生长,此阶段的新生细胞量与死亡并溶解的细胞量达到平衡。在发酵的中后期,发酵的次级代谢产物和死细胞持续累积,发酵液环境状况恶化,成为抑制细胞生长的主要因素。
在204~264 h时间段细胞处于衰亡期,细胞总浓度呈下降趋势,表明死亡并溶解的细胞量超过新生的量。
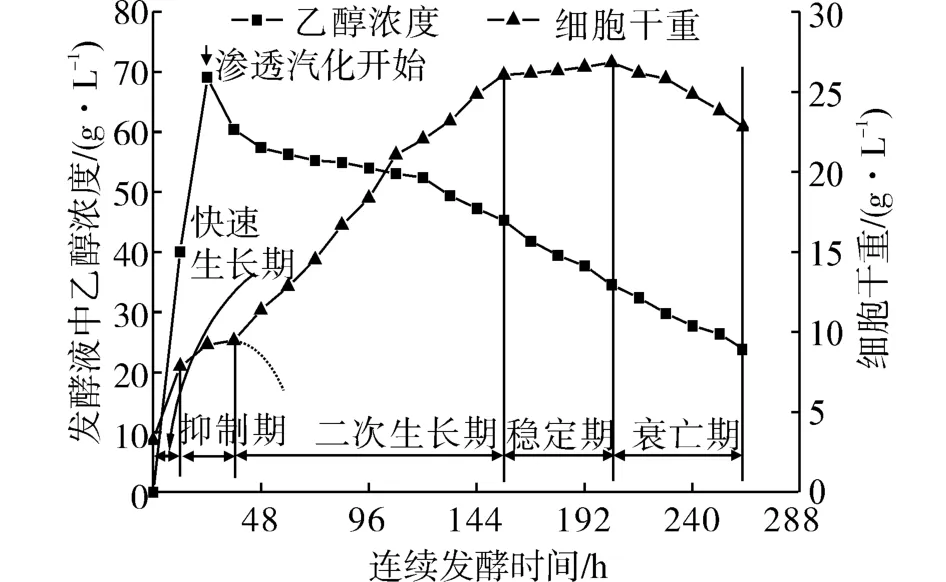
图2 发酵液中乙醇浓度和细胞浓度的时间过程曲线Fig.2 The time process curves of ethanol concentra⁃tion and cell concentration in the fermentation broth
2.2 葡萄糖消耗和乙醇生产
葡萄糖消耗速率和乙醇体积产率的时间过程曲线如图3所示。从图中可以看出,在整个发酵过程中,葡萄糖消耗速率和乙醇体积产率均有2个上升阶段和2个下降阶段。
在0~12 h时间段内细胞快速生长,葡萄糖消耗率和乙醇产率迅速上升,并分别达到最大值9.78 g/(L· h)和3.48 g/(L·h)。当发酵液中乙醇含量达到一定值,细胞生长受到抑制,葡萄糖消耗速率迅速下降,乙醇产率也随之下降。在24 h时开启渗透汽化操作,糖耗速率的下降趋势减缓,当发酵液中乙醇含量降至抑制浓度范围外时,细胞又开始迅速生长,糖耗速率和乙醇产率再次上升并达到二次峰值,分别为9.29 g/(L· h)和3.26 g/(L·h)。由于发酵液中环境的变化,二次峰值较一次峰值低,且在此时刻后虽然总体发酵性能往减弱方向发展,但整体维持在较高水平。在84 h后,糖耗速率和乙醇产率持续下降直至发酵过程结束。
在264 h发酵过程中,不计发酵液中葡萄糖的基质抑制效应,葡萄糖平均消耗速率为6.09 g/(L·h),乙醇平均体积产率为2.31 g/(L·h);此外,糖耗速率曲线变化趋势和乙醇的体积产率曲线变化趋势保持一致,表明葡萄糖的转化率保持一定水平并相对稳定,乙醇的生产速率与葡萄糖的消耗速率密切相关。
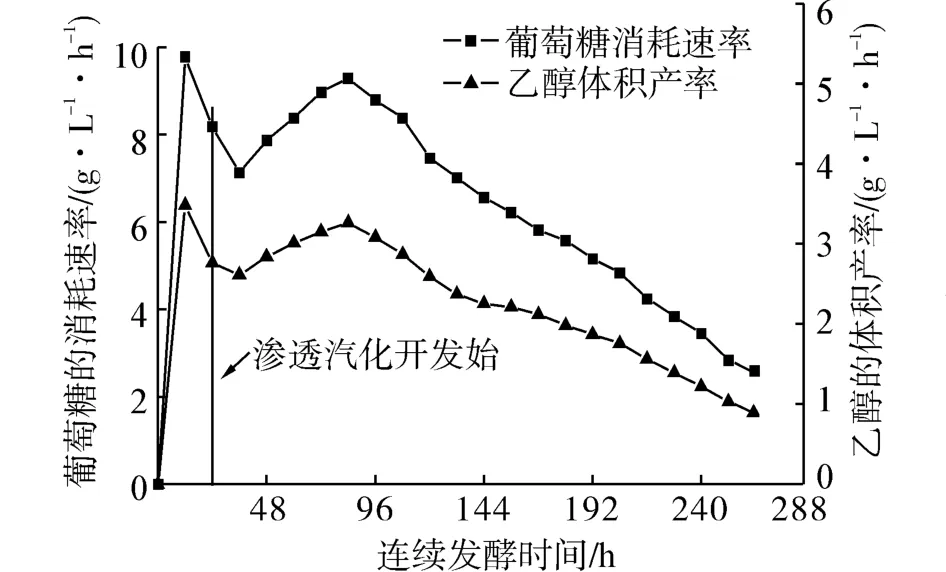
图3 葡萄糖消耗速率和乙醇体积产率的时间过程曲线Fig.3 The time process curves of glucose consumption rate and ethanol volume production rate
2.3 渗透蒸汽的二次分离
如图4所示是渗透蒸汽的二次分离时间过程曲线。一次分离的乙醇溶液收集于锥形瓶中,二次分离的乙醇溶液收集于圆形瓶中,平均乙醇浓度为锥形瓶和圆形瓶中乙醇溶液的浓度平均值。经过前期工作的反复验证,在膜下游的乙醇渗透蒸汽经过冷凝可收集完全。
从图中可以看出,下游乙醇浓度随着发酵时间的延长而降低,其浓度变化趋势与发酵液中浓度变化趋势一致,表明在耦合操作过程中乙醇的生产速率和渗透汽化速率处于动态平衡状态。在24~264 h时间段,发酵液中乙醇浓度在60~23 g/L,而二次分离后的乙醇浓度在517~338 g/L,相应上游乙醇浓度浓缩了至少9倍;下游平均乙醇浓度在382.91~188.52 g/L,相应于上游浓缩了约7倍。二次分离后乙醇溶液浓度最高值达到517 g/L,一次分离的乙醇溶液浓度的最高值只有81 g/L,仅为二次分离乙醇浓度的1/6,表明在真空泵出口通过空气自然冷凝可收集到大部分高浓度乙醇溶液,这体现了PDMS膜生物反应器与渗透汽化连续耦合操作在发酵工艺中产物分离部分的巨大优势。
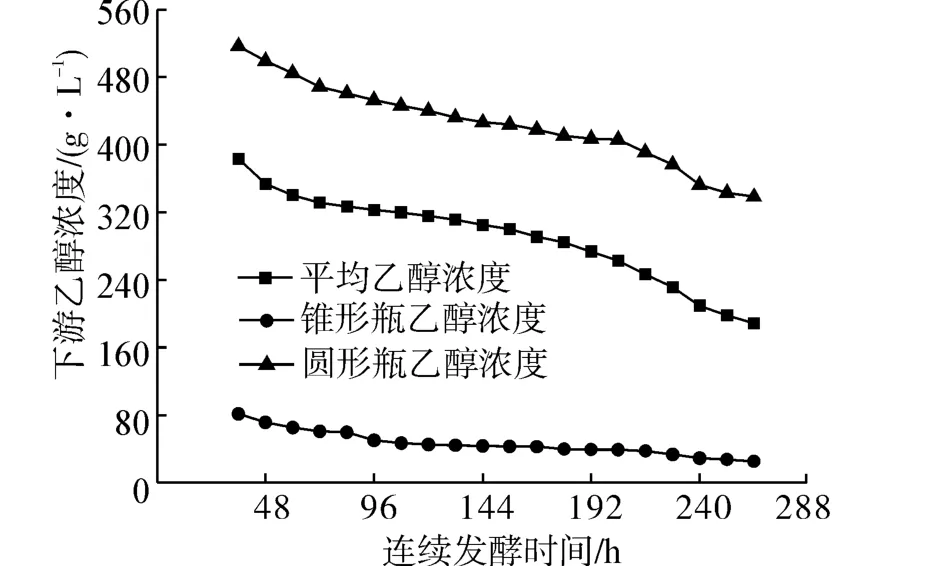
图4 渗透蒸汽的二次分离时间过程曲线Fig.4 The time process curves of permeated vapor refinement
2.4 3种乙醇发酵工艺的比较
渗透汽化发酵间歇耦合过程的糖耗速率和乙醇产率时间过程曲线绘制如图5所示。锯齿形的曲线反映了渗透汽化操作开与关对发酵的影响,这种形态与渗透汽化发酵连续耦合相比(图3),其差别极为明显。
由图5可以看出,间歇耦合发酵过程前期,糖耗和乙醇产率的来回波动极大,这反映了发酵与分离的非稳定性和非连续性;而在发酵过程的中后期,渗透汽化操作的开与关对糖耗和乙醇产率的影响不明显,这两者导致了乙醇的平均产率低且难以更好体现发酵与渗透汽化耦合生产乙醇的优势。由图3可以看出,在连续耦合渗透汽化发酵过程中,平滑的糖耗曲线和乙醇产率曲线反映了发酵过程的稳定和连续性,有利于发酵过程的进行。传统批发酵、发酵-渗透汽化间歇耦合和发酵-渗透汽化连续耦合3种工艺生产乙醇的主要性能参数如表1所示。
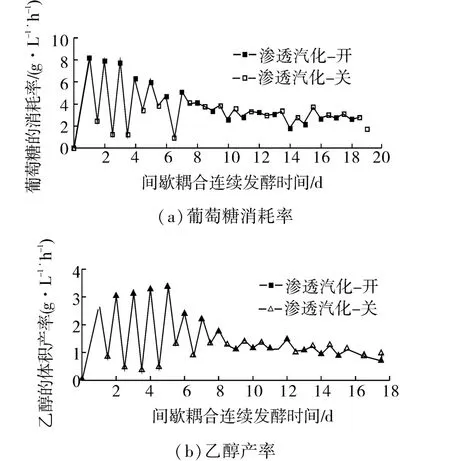
图5 间歇耦合发酵过程中糖耗速率和乙醇产率图Fig.5 The glucose consumption rate and ethanol production
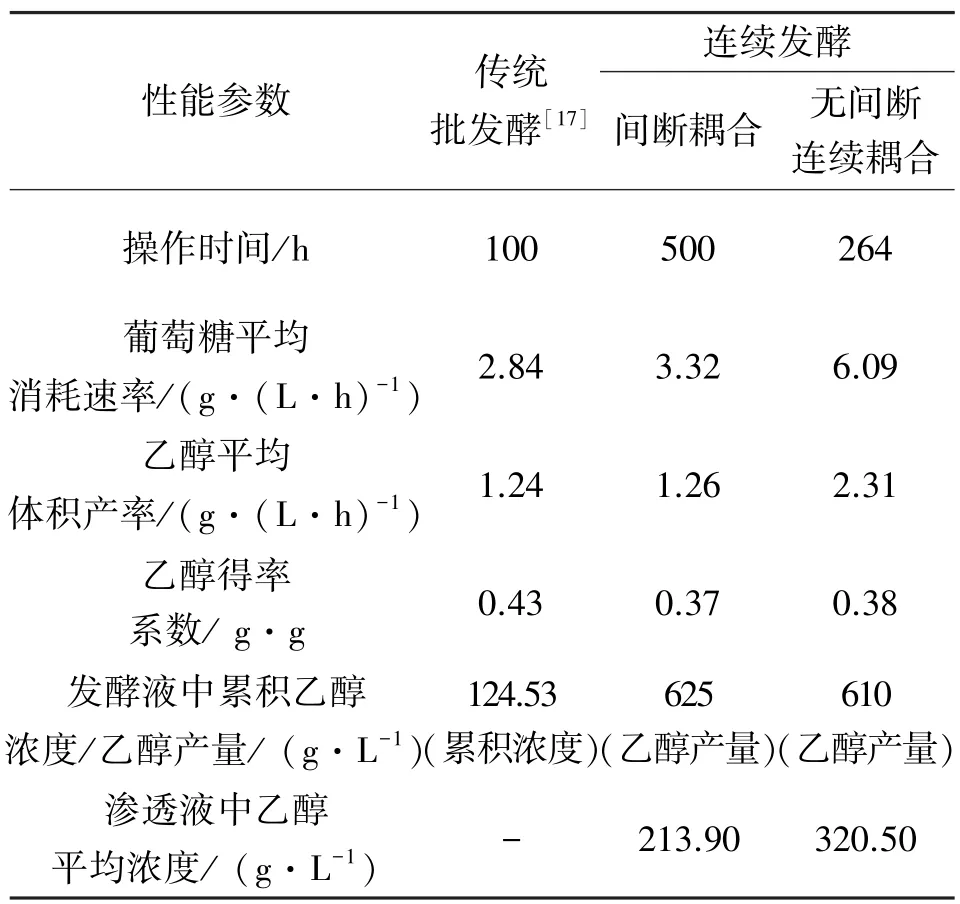
表1 3种乙醇发酵工艺性能参数的比较Table1 The comparison of three kinds of ethanol fermen⁃tation performance parameters
由表1中可以出,在连续耦合过程中乙醇的平均体积产率为2.31 g/L,约为传统批发酵和间歇耦合发酵的2倍;葡萄糖消耗率为传统批发酵的2倍,间歇耦合的1.8倍。表明发酵液中乙醇的及时分离大大提高了葡萄糖消耗率和乙醇体积产率;此外,与传统批发酵相比可大大减少废液的排放量,减少资源浪费且节约成本。
在连续耦合过程中,渗透液中乙醇平均浓度较间歇耦合提高了49%,表明采用新的下游冷凝分离工艺有利于产品的分离浓缩,这再次证明了发酵-渗透汽化连续耦合生产工艺大大优于传统批发酵工艺,同时也证明连续耦合操作较间歇耦合操作的生产效率要高。2.5 能耗评价
在之前研究的发酵-渗透汽化间歇耦合工艺中,乙醇的渗透蒸汽在真空条件下露点低,需要在-10℃~-30℃的冷阱中冷凝[13],能耗大。而在本实验中,通过使用真空泵将大部分高浓度的乙醇渗透蒸汽输送至大气环境中时压力增大,露点升高,这便使得渗透蒸汽在常压下实现冷凝。改进后的下游冷凝工艺中以真空泵输送并压缩渗透蒸汽为能耗的主要部分。以水蒸气的冷凝为例,传统的渗透蒸汽冷凝过程中所消耗的能量主要是水蒸气冷凝时释放的潜热和显热,而显热值远小于潜热,估算时可忽略,以潜热表示主要能量消耗。在改进后的下游产品回收工艺中,以温度为40℃,绝对压力为35 mmHg的水蒸气在真空泵中绝热压缩后冷凝估算其能量消耗。在此条件下,水蒸气的潜热为2 422.8 kJ/kg,绝热压缩系数γ为1.3。由式(1)计算可得,压缩单位质量水蒸气真空泵所消耗的能量为632.2 kJ/kg,仅仅是传统低温冷凝能耗的26%,节能显著。
3 结束语
采用发酵-渗透汽化-渗透蒸汽二次分离集成工艺可连续进行乙醇发酵实验,且结果表明该系统具有高效、简约、节能的优点。乙醇的原位连续分离,消除了产物乙醇对细胞的抑制,延长了发酵时间并增强了发酵性能。采用真空泵将膜下游未冷凝的蒸汽输送至大气环境中冷凝,省去了制冷单元,简化了工艺系统和设备,降低了过程能耗。渗透蒸汽的二次分离,膜下游乙醇得到进一步的浓缩,对乙醇的后续分离有利。
[1]BALAT M,BALAT H.Recent trends in global production and utilization of bio⁃ethanol fuel[J].Applied Energy,2009,86(11):2273⁃2282.
[2]CHANG Chun,WANG Duo,WANG Linfeng,et al.Com⁃parative study on process of simultaneous saccharification and fermentation with high solid concentration cellulosic eth⁃anol production[J].CIESC Journal,2012,63(3):935⁃940.
[3]YANG Jie,DING Mingzhu,LI Bingzhi,et al.Phospholipi⁃dome alteration of saccharomyces cerevisiae in bioethanol fermentation process[J].CIESC Journal,2012,63(6):1830⁃1835.
[4]ZHOU H,KORELSKIY D,LEPPÄJÄRVI T,et al.Ultra⁃thin zeolite X membranes for pervaporation dehydration of ethanol[J].Journal of Membrane Science,2012,399:106⁃111.
[5]张文彬,蔡葆,徐艳丽.我国生物燃料乙醇产业的发展[J].中国糖料,2010,3:58⁃67.ZHANG Wenbin,CAI Bao,XU Yanli.Development of bio⁃logical fuel ethanol industry in China[J].Sugar Corps of China,2010,3:58⁃67
[6]叶立,童正明,苏文献,等.硅橡胶膜生物反应器乙醇连续发酵性能研究[J].上海理工大学学报,2005,27(6):507⁃511.YE Li,TONG Zhengming,SU Wenxian,et al.Performance of continuous ethanol fermentation in a silicone rubber mem⁃brane bioreactor[J].Journal of Shanghai University of Sci⁃ence and Technology,2005,27(6):507⁃511.
[7]杨斌,邓子新,谭字榴,等.乙醇连续发酵与膜分离耦合过程研究进展[J].膜科学与技术,1997,17(1):9⁃17.YANG Bin,DENG Zixin.TAN Ziliu,et al.The progress of studies on the process of ethanol continuous fermentation coupling with separation by membrane[J].Membrane Sci⁃ence and Technology,1997,17(1):9⁃17.
[8]JIN H,LIU R,He Y.Kinetics of batch fermentations for ethanol production with immobilized saccharomyces cerevisi⁃ae growing on sweet sorghum stalk juice[J].Procedia Envi⁃ronmental Sciences,2012,12:137⁃145.
[9]VANE L M.Separation technologies for the recovery and de⁃hydration of alcohols from fermentation broths[J].Biofuels,Bioproducts and Biorefining,2008,2(6):553⁃588.
[10]DING W W,WU Y T,TANG X Y,et al.Continuous etha⁃nol fermentation in a closed⁃circulating system using an im⁃mobilized cell coupled with PDMS membrane pervaporation[J].Journal of Chemical Technology and Biotechnology,2011,86(1):82⁃87.
[11]黄卫星,钟月华,肖泽仪.硅橡胶膜生物反应器及其用于乙醇连续发酵的研究[J].四川大学学报:工程科学版,2003,35(1):1⁃7.HUANG Weixing,ZHONG Yuehua,XIAO Zeyi,et al.Re⁃search on silicone rubber membrane bioreactor and its ap⁃plication to ethanol production with continuous fermentation[J].Journal of Sichuan University:Engineering Science E⁃dition,2003,35(1):1⁃7.
[12]O'BRIEN D J,CRAIG J C.Ethanol production in a contin⁃uous fermentation/membrane pervaporation system[J].Ap⁃plied Microbiology and Biotechnology,1996,44(6):699⁃704.
[13]CHEN C Y,TANG X Y,XIAO Z Y,et al.Ethanol fer⁃mentation kinetics in a continuous and closed⁃circulating fermentation system with a pervaporation membrane biore⁃actor[J].Bioresource Technology,2012,114:707⁃710.
[14]石尔,肖泽仪,黄卫星,等.硅橡胶膜生物反应器封闭循环连续发酵制造乙醇放大实验及该发酵系统的基本性能[J].高校化学工程学报,2007,21(2):280⁃285.SHI Er,XIAO Zeyi,HUANG Weixing,et al.Scale⁃up of continuous ethanol fermentation in a silicone rubber mem⁃brane bioreactor and study on its fermentation system per⁃formance[J].Journal of Chemical Engineering Colleges and Universities,2007,21(2):280⁃285.
[15]BREUIL C,SADDLER J N.Comparison of the 3,5⁃dinitro⁃salicylic acid and Nelson⁃Somogyi methods of assaying for reducing sugars and determining cellulase activity[J].En⁃zyme and Microbial Technology,1985,7(7):327⁃332.
[16]VALLIERES C,FAVRE E.Vacuum versus sweeping gas operation for binary mixtures separation by dense membrane processes[J].Journal of Membrane Science,2004,244(1):17⁃23.
[17]张丽君.乙醇发酵-循环气提耦合工艺的研究[D].长安:长安大学,2007:76.ZHANG Lijun.Improvement of ethanol fermentation with cycle gas stripping[D].Chang'an:Chang'an University,2007:76.
Ethanol production with fermentation⁃pervaporation⁃permeated vapor recovery and refinement
DENG Qing1,YAO Peina1,FAN Senqing1,ZHANG Yan1,LI Weijia1,XIAO Zeyi1,CHEN Chunyan2
(1.School of Chemical Engineering,Sichuan University,Chengdu 610065,China;2.School of Chemistry and Chemical Engineering,Southwest Petroleum University,Chengdu 610500,China)
The low efficiency of fermentation and high energy consumption of product separation are the main techni⁃cal bottlenecks of fuel ethanol production.An integrated process system for ethanol production with fermentation⁃PDMS membrane pervaporation⁃permeated vapor secondary refinement was proposed and an ethanol fermentation experiment was carried out.In the system,fermentation was continuously coupled with pervaporation and membrane separation,the permeated vapor was partially condensed by water at room temperature,and the remaining vapor mixed with enriched ethanol was sucked and transported to a position in the atmospheric conditions by a vacuum pump,where it became liquid naturally.It realizes the second refinement of the permeated vapor.The fermentation experiment lasted 264 hours and achieved the average cell concentration of 19.8 g/L,average glucose consumption rate of 6.09 g/(L·h),average ethanol productivity of 2.31 g/(L·h),ethanol yield coefficient of 0.38 and total ethanol production of 610 g/L.An energy consumption evaluation showed that the energy consumption of integrated process for ethanol production was only 26%of that involved with a refrigerating unit.
fermentation;ethanol;membrane separation technology;pervaporation;natural condensation;seconda⁃ry refinement
10.3969/j.issn.1006⁃7043.201311031
http://www.cnki.net/kcms/detail/23.1390.U.20150109.1529.015.html
TQ920.6
A
1006⁃7043(2015)03⁃0418⁃05
2013⁃11⁃11.网络出版时间:2015⁃01⁃09.
国家自然科学基金资助项目(20776088).
邓情(1989⁃),女,硕士研究生;肖泽仪(1960⁃),男,教授,博士生导师.
肖泽仪,E⁃mail:mgch@scu.edu.cn.

