施磷量对不同品种红小豆形态和生理特性的影响
连慧达, 裴红宾*, 张永清, 秦 成, 吴晓薇
(1 山西师范大学生命科学学院,山西临汾 041004; 2 山西师范大学城市与环境科学学院,山西临汾 041004; 3 山西省临汾市环境监测站,山西临汾 041004)
施磷量对不同品种红小豆形态和生理特性的影响
连慧达1, 裴红宾1*, 张永清2, 秦 成1, 吴晓薇3
(1 山西师范大学生命科学学院,山西临汾 041004; 2 山西师范大学城市与环境科学学院,山西临汾 041004; 3 山西省临汾市环境监测站,山西临汾 041004)
【目的】研究不同施磷量下作物根系形态、生理适应性及对磷的积累量,不仅可以挖掘作物自身利用磷的潜力,还可筛选出耐磷能力强的品种,提高磷肥的利用率。【方法】以晋红小豆1号、保红小豆8824/17和东北大红袍3个红小豆品种为试材,采用盆栽试验进行试验。设施用P2O50(P1)、50(P2)、100(P3)和200 mg/kg(P4)4个水平,2013年5月18日播种,每盆播种15粒种子,第一片真叶露出后每盆定苗8株,红小豆生长至30 d时,对其植株进行有关指标测定。【结果】对3个红小豆品种进行方差分析和Duncan多重比较,结果为: 1)随着供磷量的增加,晋红小豆1号的叶面积升高,株高先升高后降低,而其他两个品种的叶面积和株高都呈现先增高后降低的趋势;红小豆根冠比改变,总根长增加及根面积增大,影响了地上部和总根干物质量。2)随着供磷量的增加,3个品种的红小豆根系活力呈现先增加后降低的趋势,根系磷酸酶呈现下降的趋势,而磷积累量都表现出增加的趋势。3)随着供磷量的增加,SOD、POD活性呈现出先升后降的趋势、MDA含量在低磷和高磷水平下较高,晋红小豆1号的SOD、POD活性低于其他两个品种,MDA含量高于其他两个品种。4)在低磷和高磷水平下叶绿素相对含量较其他水平为低,但差异不显著,最大荧光(Fm)、最大光化学效率(Fv/Fm)上升,初始荧光(Fo)下降。【结论】红小豆可以通过生理反应和改变根系构型来适应不同的磷素养分水平。本研究中红小豆通过伸长根长、增大根面积导致根冠比明显增加,显著改变了干物质在地上部和根系之间的分配来适应不同的磷营养水平。3个品种红小豆从植株形态和生理等指标上均有差异,其中,晋红小豆1号的耐低磷、高磷胁迫能力高于另外两个品种。
红小豆; 施磷量; 形态指标; 生理特性
红小豆(Vignaangularis)为豆科,菜豆属的一年生草本植物,含多种蛋白质、钙、磷、钾、维生素,营养价值极高,并且抗旱耐脊适应性强,在我国干旱、半干旱地区有明显的区位和生产优势。研究表明,影响红小豆产量的第一要素是土壤速效磷[1],但对红小豆在不同磷营养条件下根系形态、生理适应性及对磷积累量的研究尚不多见,对于不同品种间的差异更是鲜有报道。为此,本试验研究了不同施磷量对3个品种红小豆植株的形态和生理特性的影响,探索红小豆植株形态与磷积累量之间的相关性,明确不同红小豆品种对磷积累量的差异及其生理特性,进而为提高土壤磷素利用效率和红小豆的育种与栽培提供科学的理论依据。
1 材料和方法
1.1 供试材料
供试红小豆品种为晋红小豆1号,保红小豆8824/17和东北大红袍,由山西省农业科学院作物所提供。供试土壤取自石灰性褐土下层,其营养成分含量为:全氮99mg/kg,速效磷3.5 mg/kg,速效钾92.04 mg/kg,风干后备用。试验所用塑料盆底部直径21.0 cm,上部直径29.0 cm,盆深27.0 cm,每盆装风干土14.0 kg。
1.2 试验设计

1.3 测定指标与方法
1.3.1 形态指标 随机选取各处理红小豆全株,洗净后分为根和地上两部分,取3株采用根系分析扫描仪(EPsonexPression1680) 进行根表面积、总根长和侧根数的测定;叶面积用叶面仪测定。分别称量植株根和地上两部分鲜重后,在105℃杀青30 min,75℃烘干至恒重后称取干物质重量。
1.3.2 生理指标 随机选取各处理长势相同的红小豆幼苗3株,洗净后用滤纸擦干。根系活力采用TTC法,根系酸性磷酸酶活性采用对硝基苯磷酸二钠法,叶绿素相对含量采用CM1000叶绿素测量仪直接测定,荧光诱导参数采用便携式光合测定仪LI-COR6400配备的荧光叶室测定相同叶位的叶绿素荧光参数,植株全磷含量采用钼蓝比色法,丙二醛(MDA)含量、POD活性及SOD活性分别采用硫代巴比妥酸法、愈创木酚比色法和核黄素法[2]。
1.4 数据处理
试验数据采用Microsoft Excel和DPS 6.5统计软件进行分析
2 结果与分析
2.1 不同施磷量对红小豆植株形态指标的影响
2.1.1 对株高、叶面积的影响 由表1可知,3个品种红小豆植株的株高均表现出随着磷浓度的增加,呈现出先增加后降低的趋势,但变化幅度各不相同。其中以晋红小豆1号的变化幅度大,当磷浓度达到100 mg/kg 时,比对照(0 mg/kg)增加了31.3%且达到了最高值,和50 mg/kg处理也达到差异显著水平。3个品种中,以东北大红袍株高变幅最小,在4个磷供应水平下株高差异均不显著。
随着磷供应水平的增加,晋红小豆1号的叶面积呈逐渐增加,当磷供应水平达到200 mg/kg时,叶面积达到最高值,比对照浓度增加了37.4%,且不同磷供应水平下叶面积间差异显著。保红8824/17、东北大红袍叶面积先增加后减小,当磷供应水平为100 mg/kg时,叶面积达到最大值,在低磷和高磷胁迫时叶面积均减小。不同施磷量对不同红小豆品种的株高、叶面积的变化存在显著差异,其中晋红小豆1号最为敏感。
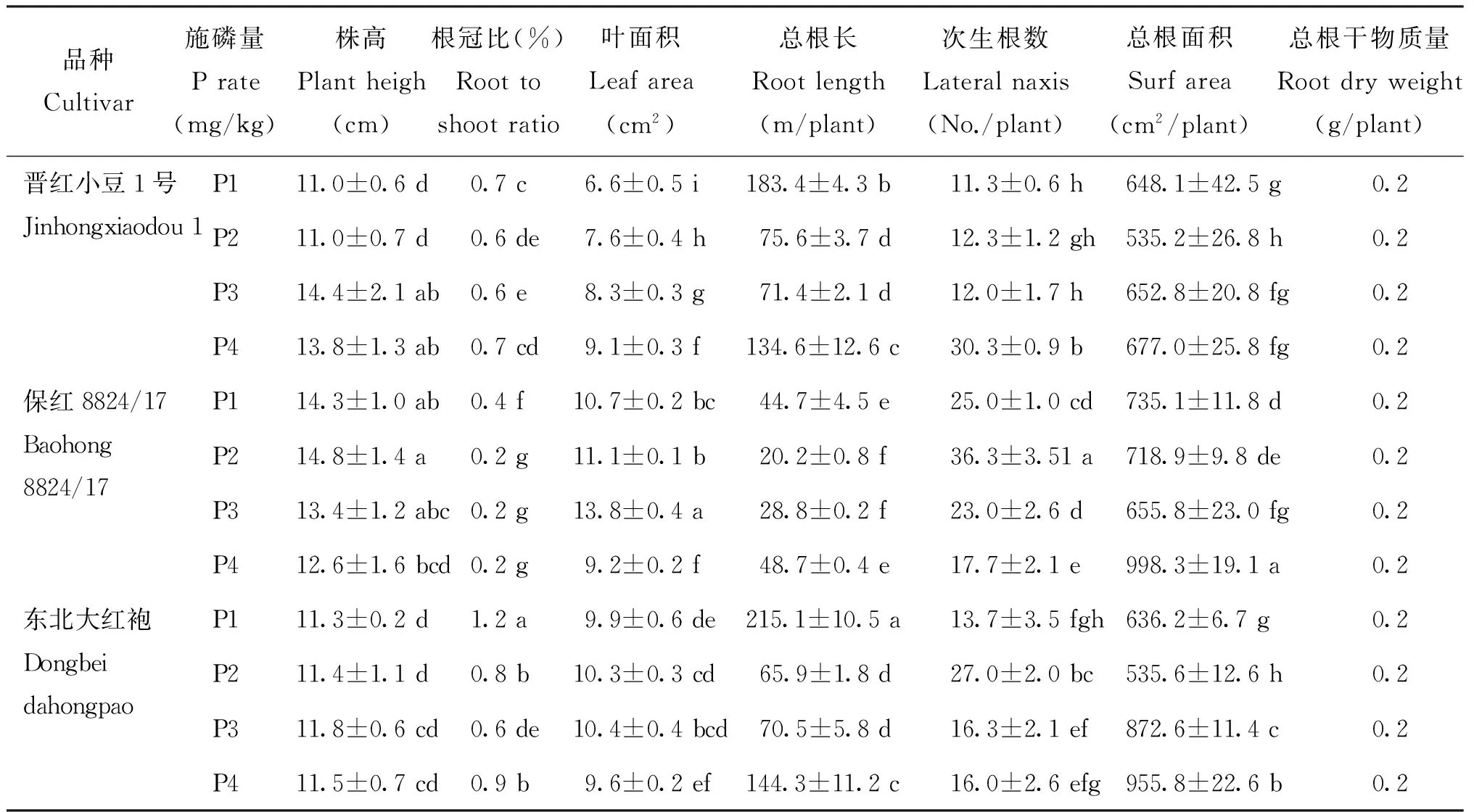
表1 不同施磷量对红小豆植株形态指标的影响
注(Note): 同列数值后不同字母表示处理间差异显著(P<0.05)Values followed by different letters in the same column mean significant differences among the treatments at the 0.05 level.
2.1.2 对不同品种红小豆根系形态的影响 由表1还可以看出,不同品种红小豆次生根数随着磷浓度的变化呈现出不同的变化规律:晋红小豆1号次生根数随着施磷量的增大呈现波动变化,而保8824/17和东北大红袍品种次生根数的变化规律一致,均为先增后减,在浓度为50 mg/kg时,次生根数达到最多;3个品种的总根长都表现出在低磷(0 mg/kg)高磷(200 mg/kg)数值大,且与磷浓度为50 mg/kg、100 mg/kg时差异显著;3个品种的总根面积和总根干物质量均表现为先降后升,中间供磷水平下均较低。磷胁迫下植物的根冠比增大是其耐磷的机制之一,3个红小豆品种在高磷和低磷胁迫下根冠比明显增加,其中保红8824/17的根冠比小于东北大红袍和晋红小豆1号。
2.2 不同施磷量对不同品种红小豆植株根系生理指标的影响
2.2.1 对根系活力指标的影响 根系的活力与根的生长情况有密切的联系,它们的状况直接影响地上部分生长和营养状况及产量水平。由图1可知,随着磷浓度的增大,3个品种红小豆根系的TTC还原强度,均呈现先升后降的趋势,最大值出现在磷浓度为100mg/kg时。比较不同品种的根系活力可以发现,此时的晋红小豆1号的TTC还原强度最大,比东北大红袍高出28.9%,而增加最多的是保红8824/17,比不供磷时增高了111.6%。在所有磷供应水平下,晋红小豆1号的TTC还原强度均大于另外两个红小豆品种,在不供应磷时比保红8824/17和东北大红袍的TTC还原强度分别高52.8%和48.9%,显示晋红小豆1号的根系活力较其它两个品种强,晋红小豆1号的TTC不同磷条件下差异不显著,有较好的耐低磷胁迫能力。
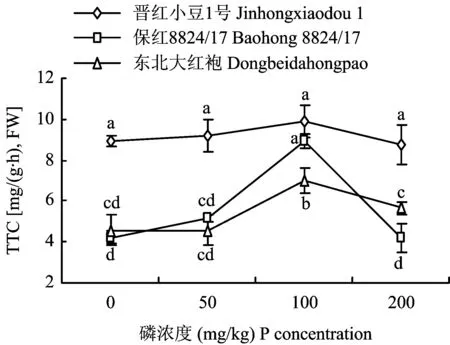
图1 不同施磷量对红小豆TTC的影响Fig.1 Effect of P rates on TTC of adzuki bean[注(Note): 图中不同字母表示不同处理间在P<0.05水平差异显著 Different letters indicate a significant difference among treatments(P<0.05).]
2.2.2 对根系酸性磷酸酶的影响 酸性磷酸酶是一种在酸性条件下的水解酶,也是一种诱导酶,其活性受植物供磷量的影响,当受到磷胁迫时,植物体内的酸性磷酸酶的活性增加,以此来缓解磷供应的不足,促进植物生长[3-5]。低磷胁迫下不同品种红小豆根系酸性磷酸酶的活性达到最大值,随着磷浓度的增加,根系酸性磷酸酶活性呈减小的趋势,如图2,在3个品种间,在不供磷时,晋红小豆1号根系酸性磷酸酶活性最大,比保红8824/17和东北大红袍的活性分别高7.5%和5.12%。
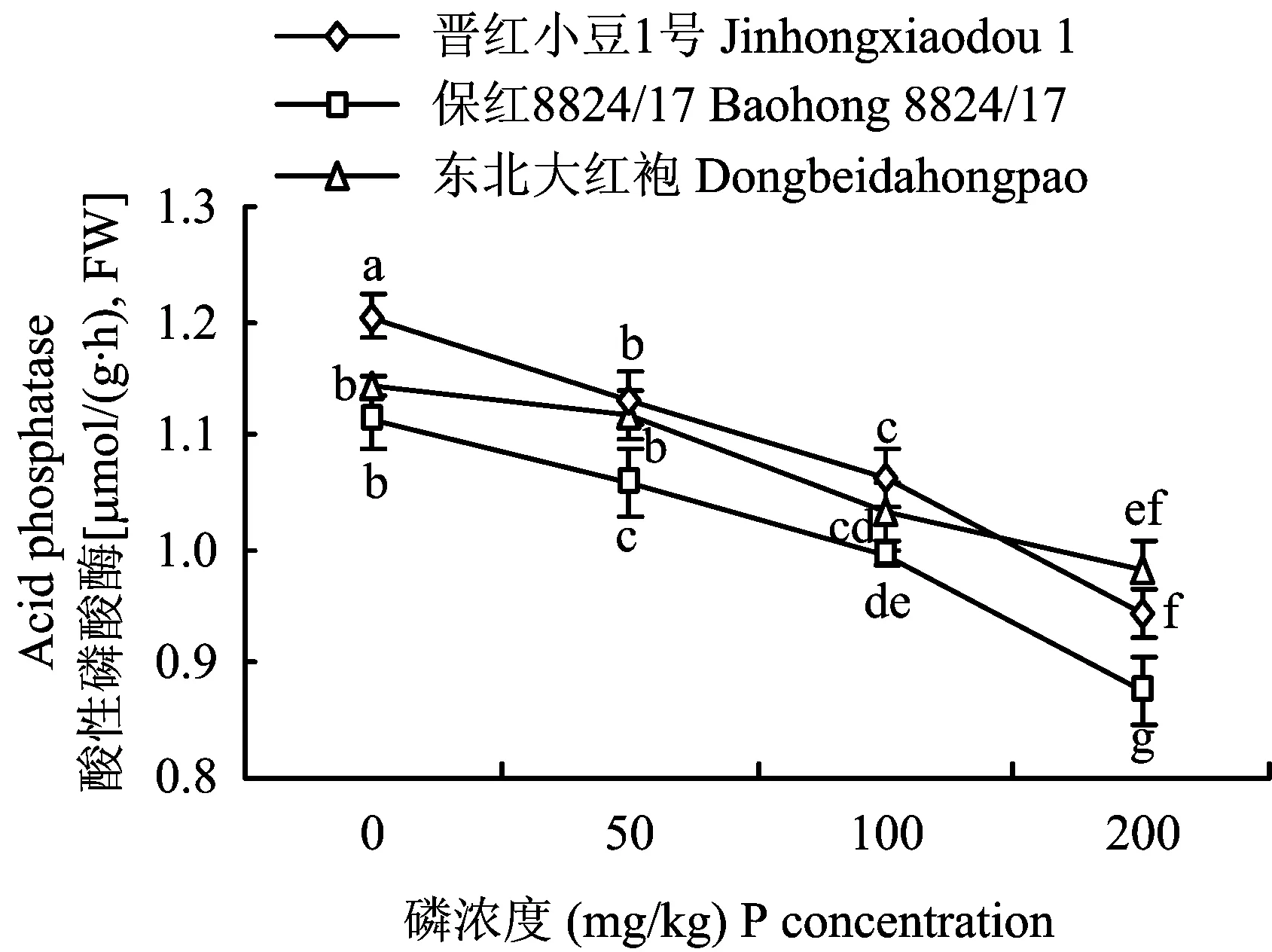
图2 不同施磷量对红小豆酸性磷酸酶活性的影响Fig.2 Effect of P rates on acid phosphatase of adzuki bean[注(Note): 图中不同字母表示不同处理间在P<0.05水平差异显著 Different letters indicate a significant difference among treatments (P<0.05).]
2.2.3 不同施磷量对红小豆根系SOD、POD活性和MDA含量的影响 不同磷浓度下对不同红小豆SOD活性的变化比较一致,都呈先增高后降低的趋势。保红8824/17的SOD活性总体水平高于晋红小豆1号和东北大红袍,而且在施用量为50 mg/kg时达到最大值,与晋红小豆1号和东北大红袍相比,分别增加了1.57倍和0.78倍。随着磷施用量的增加,东北大红袍SOD变化幅度较为平稳,在不供磷时达到最小值,在100 mg/kg时达到最大值。在高、低磷条件下SOD活性总体显著低于其他磷浓度处理。
由图3可知,随着磷浓度的增加,晋红小豆1号、东北大红袍POD活性均呈先增后降的趋势。晋红小豆1号、东北大红袍在磷施用量100 mg/kg时POD活性达到最大,然后减小。保红8824/17对磷施用量变化的响应幅度较大,施用量为50 mg/kg时POD活性与对照相比增加了15.3%。在整个试验周期内,高低磷处理的POD活性总体显著低于其他磷浓度处理。
随着磷浓度的增加,MDA的变化趋势为先降后增,在高磷(200 mg/kg)、低磷(0 mg/kg)胁迫下,MDA含量上升,晋红小豆1号和东北大红袍在浓度为100 mg/kg时,MDA活性降至最低,比不供磷时降低了16.29%和16.70%。保红8824/17在浓度为50 mg/kg时降到最低,比不供磷降低了12.82%,各浓度之间差异显著。在整个试验周期内,各磷浓度处理下晋红小豆1号MDA含量都明显高于东北大红袍、保红8824/17。
2.3 不同施磷量对红小豆植株叶片的叶绿素相对含量及叶绿素荧光的影响

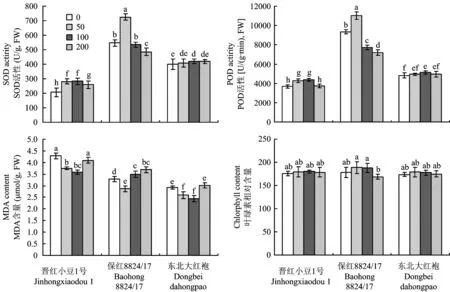
图3 不同施磷量对红小豆根系生理的影响Fig.3 Root physiological indexes of adzuki bean plants under different phosphorous rates[注(Note): 图中不同字母表示不同处理间在P<0.05水平差异显著 Different letters indicate a significant difference among treatments(P<0.05).]
由表2可知,随着磷施用量的增大,初始荧光Fo先减小后增大,不供磷时晋红小豆1号有最大初始荧光,比东北大红袍和保红8824/17分别增加5.17%和2.23%,而3个品种红小豆的最大荧光Fm和Fv/Fm比值,随着磷施用量的增大均表现出逐渐上升,其中保证8824/17的最大荧光Fm在不供磷时最小,说明其在PSII反应中心的电子传递遭受了破坏,使电子传递能力下降
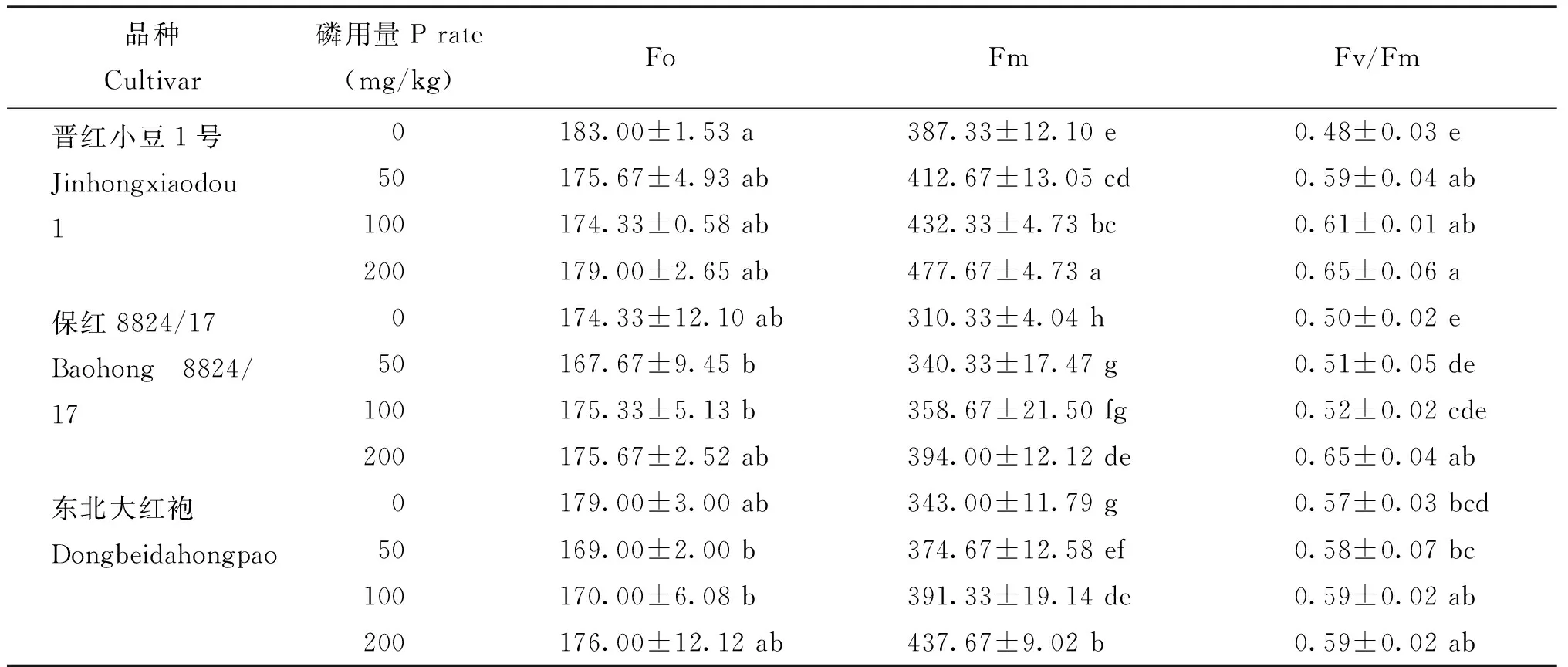
表2 不同施磷量对不同红小豆植株叶绿素荧光参数的影响
注(Note): 同列数值后不同字母表示处理间差异显著(P<0.05)Values followed by different letters in the same column mean significant differences among the treatments at the 0.05 level.
2.4 不同施磷量对不同品种红小豆植株磷素积累量的影响
植物磷素积累量与施用磷的量有密切的关联,由表3可知,随着施磷量的增加,3个品种磷积累量都表现出增加的趋势,在3种营养器官中的分布表现为叶>根>茎,说明磷素水平供给的提高对红小豆生育前期的生长有促进作用。随着磷浓度的增加,3个品种红小豆吸收磷素后,主要是将其运输到叶片中同化或者贮藏。其中晋红小豆1号要高于其他两个品种,在0 mg/kg的浓度下,晋红小豆1号的磷积累量比东北大红袍和保红8824/17高15.35%和3.54%,表明晋红小豆1号的磷积累量要高于其它两个品种。
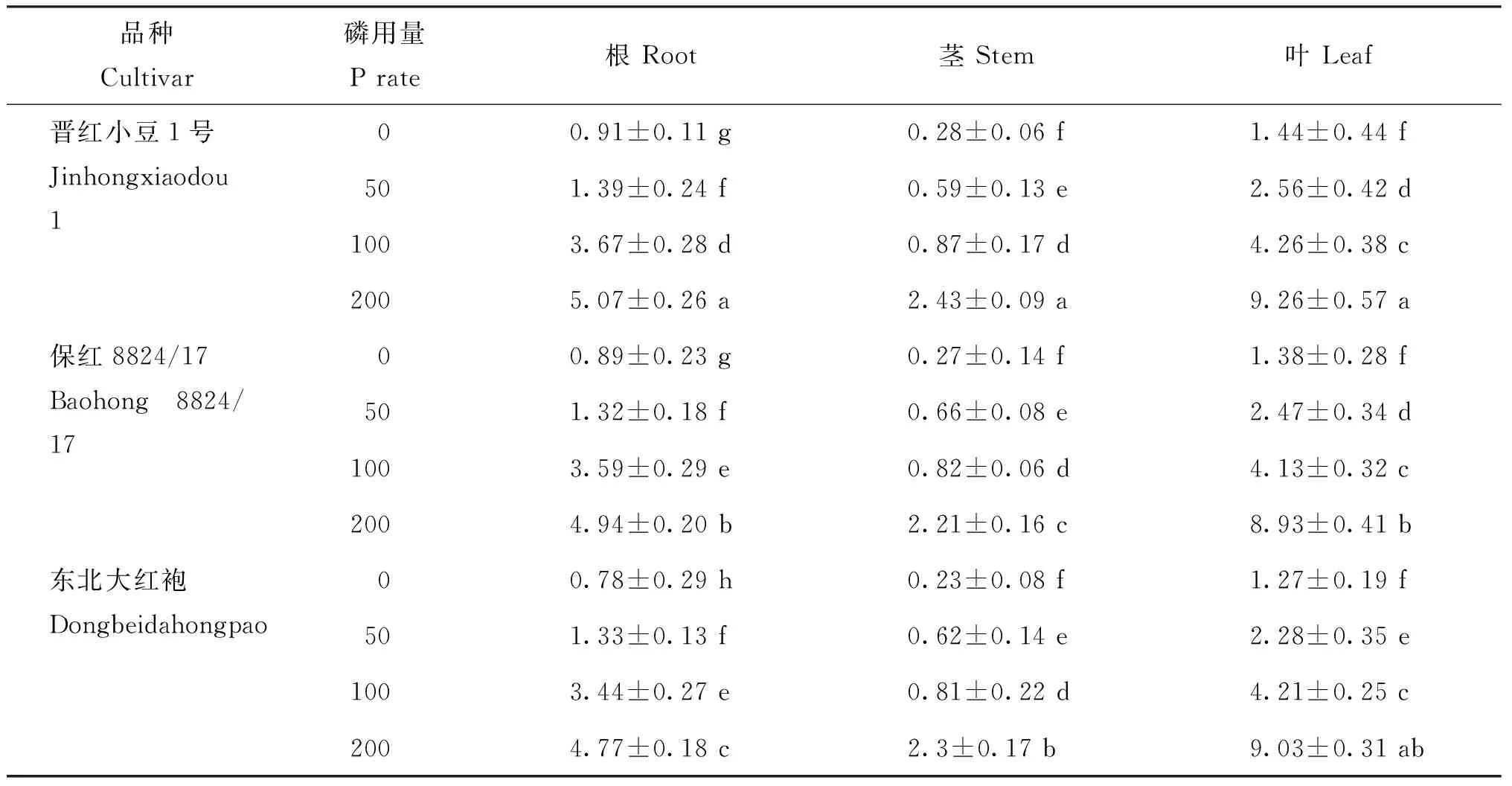
表3 不同施磷量对红小豆植株磷素积累量的影响(mg/kg)
注(Note): 同列数值后不同字母表示处理间差异显著(P<0.05)Values followed by different letters in the same column mean significant differences among the treatments at the 0.05 level.
3 结论与讨论
研究表明,植物的生长发育和磷素养分吸收有着非常密切的关系[6],土壤缺磷是制约红小豆生长的关键因素。在生长阶段,通常以相对生物量作为衡量植物磷敏感程度的指标[7],而根系生长发育具有很大的可塑性[8]。本试验研究表明,低磷、高磷胁迫下各品种红小豆的叶面积普遍较小,根冠比明显增大,显著改变了干物质在地上部和根系之间的分配以及次生根数,红小豆通过增加总根长及增大根面积来做出适应磷胁迫生长的应答反应[9],而次生根数的反应与其它研究表现出不同[10、11];磷胁迫下植物的根冠比增大是其耐磷的机制之一,三个红小豆品种在高磷和低磷胁迫下根冠比明显增加,总根长及总根面积的变化也是根冠比变化的主要原因之一。
已有报道,根系活力、植株磷积累量、酸性磷酸酶等可分别作为筛选红小豆耐磷的指标。随着磷浓度的提高,红小豆各品种根系活力先上升后下降,如低磷胁迫对豇豆幼苗叶片光合特性及根系生理特性的影响[12]和低磷胁迫对晒红烟内源激素和根系活力的影响[13],根系活力的提高为根系吸收磷素提供了能量保障,低磷条件下,红小豆根、茎、叶中磷积累量均低于高磷条件。不同红小豆品种间根系酸性磷酸酶活性明显不同,随着磷浓度的提高,磷酸酶活性显著下降。这说明根系中酸性磷酸酶活性直接受磷浓度调节[14]。这与前人在其它植物如小麦[15]、熊猫豆[16],番茄[14]等的研究结果相同。
在逆境胁迫下,植物体内 SOD、 POD 等保护酶活性和 MDA 含量会发生相应变化,这些变化量目前已被作为评价逆境伤害程度和植物适应性的指标而广泛应用。本试验表明,不同磷浓度下红小豆SOD、POD活性的变化趋势一致,在低磷、高磷浓度时SOD、POD活性会降低。这说明,在低磷和高磷胁迫下,红小豆的生理代谢受到抑制,SOD、POD活性无法保持在较高水平上。红小豆各品种的MDA含量随胁迫的加大而上升,表明磷胁迫引起了红小豆体内活性氧的积累,显著加剧了根系膜脂过氧化作用。整个保护酶系统和磷胁迫之间构成 1 个动态平衡系统,是红小豆适应磷胁迫的重要的主动适应性机制之一[17]。
在不同施磷量下不同红小豆品种的光合特性差异不同,可从植株的叶绿素相对含量及叶绿素荧光参数等指标上得以综合体现。叶绿素作为光合色素中的重要色素分子,参与光合作用中光能的吸收、传递和转换等过程,在光合作用中占有重要地位[18]。本试验表明:在低磷、高磷胁迫时,晋红小豆1号、东北大红袍、保红8824/17叶绿素相对含量均降低,与Cao等[19]、周建朝等[20]的研究一致。在受到低磷胁迫时,红小豆各品种的叶绿素荧光参数Fo升高,可能是因为随胁迫程度加剧红小豆叶片的PSII反应中心受到破坏或可逆失活,导致Fo值增加;最大荧光Fm以及Fv/Fm降低,表明磷胁迫抑制了PSII的光化学活性,使植物潜在活性、原初光能转化效率受到抑制[21]。
本试验结果表明:不同红小豆品种在磷胁迫时存在明显差异,可从植株的形态和生理等指标上得以综合体现,其中晋红小豆1号的耐低磷、高磷胁迫能力高于另外两个品种。在磷胁迫下,植物可以通过改变根系的构型和生理反应来提高吸收磷素养分能力,而发掘红小豆磷高效利用的遗传潜能,选育耐磷的红小豆品种,就是解决缺磷的有效途径之一[22]。因此应进一步探讨在土壤缺磷的情况下,对红小豆植株的生长发育和产量的影响,从而筛选出耐磷的红小豆品种,用于指导红小豆的育种与栽培。
[1] 赵婷婷, 冯光明, 刘树欣. 施磷肥对红小豆吸磷及产量的影响[J]. 中国生态农业学报, 2001, 9(2): 70-71. Zhao T T, Feng G M, Liu S X.Effects of phosphate application on phosphorus content and yield of Adzuki bean[J]. Chinese Journal Eco-Agriculture, 2001, 9(2): 70-71.
[2] 高俊凤.植物生理学实验指导[M].北京:科学出版社,2006. Gao J F, Plant physiology experiment instruction[M].Beijing: Science Press,2006.
[3] 黄宇, 张海伟, 徐芳森. 植物酸性磷酸酶的研究进展[J]. 华中农业大学学报, 2008, 27(1): 148-154. Huang Y, Zhang H W, Xu F S. Research progress on plant acid phosphatase[J]. Journal of Huazhong Agricultural University, 2008, 27(1): 148-154.
[4] 梁霞,刘爱琴,马祥庆,等.磷胁迫对不同杉木无性系酸性磷酸酶活性的影响[J]. 植物生态学报, 2005,29(1): 54-59. Liang X, Liu A Q, Ma X Q,etal. The effect of phosphorus deficiency stress on activities of acid phosphatase in different clones of Chinese fir[J]. Acta Phytoecologica Sinica., 2005, 29(1): 54-59.
[5] ASCENCIO J. Growth strategies and utilization of phosphorus inCajanuscajan(L.) Millsp andDesmodiumtortuosum(SW.) DC under deficiency[J]. Communications in Soil Science and Plant Analysis, 1996,27: 1971-1993.
[6] 高彬, 曹翠玲, 李涛. 乙烯对低磷胁迫下大豆根形态和生理特性的影响[J]. 大豆科学, 2012, 31(1): 58-63. Gao B, Cao C L, Li T. Effect of ethylene on morphology and physiological characteristic of soybean root under low-phosphorus stress[J]. Soybean Science, 2012, 31(1): 58-63.
[7] 李德华, 向春雷, 姜益泉, 等. 低磷胁迫下不同水稻品种根系生理特性的研究[J]. 华中农业大学学报, 2006, 25(6): 626-629. Li D H, Xiang C L, Jiang Y Q,etal. Physiological characteristic of roots of different rice variety under the stress of low phosphorus[J]. Journal of Huazhong Agricultural University, 2006, 25(6): 626-629.
[8] Williamson L C, Ribrioux S P C P, Fitter A H, Leyser H M O. Phosphate availability regulates root system architecture in Arbidopsis[J]. Plant Physiology, 2001,126,875-882
[9] 李鹏, 张永清, 闫江艳, 等. 不同基因型黍子幼苗对低磷胁迫的生理响应[J]. 江苏农业学报, 2012, 28(6): 1306-1311. Li P, Zhong Y Q, Yan J Y,etal. Physiological response of broomcorn millet seedling of different genotypes to low phosp horus stress[J].Jiansu Journal of Agricultural Science, 2012, 28(6): 1306-1311.
[10] 王聪, 刘玉平, 李秀辉, 等. 磷胁迫下不同基因型大豆苗期根系形态及生物量的差异[J]. 中国农学通报, 2005, 21(2): 155-159. Wang C, Liu Y P, Li X H,etal.Study on variation in charactetistics of root morphology and biomass among different soybean genotypes at seedling stage under phosphorus stress[J]. Chinese Agricultural Science Bulletin, 2005, 21(2): 155-159.
[11] 曹翠玲, 毛圆辉, 曹朋涛, 等. 低磷胁迫对豇豆幼苗叶片光合特性及根系生理特性的影响[J]. 植物营养与肥料学报, 2010, 16(6): 1373-1378. Cao C L, Mao Y H, Cao P Tetal. Effect of phosphorous stress on photosynthesis rate and root physiological characteristic of cowpea seedlings[J]. Plant Nutrition and Fertilizer Science, 2010, 16(6): 1373-1378.
[12] 李锋,潘晓华,刘水英,等. 低磷胁迫对不同水稻品种根系形态和养分吸收的影响[J]. 作物学报, 2004, 30(5): 438-442. Li F, Pan X H, Liu S Yetal. Effect of phosphorus deficiency stress on root morphology and nutrient absorption of rice cultivars[J]. Acta Agronomica Sinica, 2004, 30(5): 438-442.
[13] 符云鹏, 杨燕, 薛剑波. 低磷胁迫对晒红烟内源激素和根系活力的影响[J]. 中国农学通报, 2005, 21(6): 227-229 Fu Y P, Yang Y, Xue J B. Influence under low p-deficient stress on endo genous hormone and root activities of dark sun-cured tobacco[J]. Chinese Agricultural Science Bulletin, 2005, 21(6): 227-229
[14] 王晶, 韩晓日, 宫亮, 等. 低磷胁迫下不同番茄品种苗期根系生理适应性研究[J]. 沈阳农业大学学报, 2005, 36(5): 615-618. Wang J, Han X R, Gong Letal.Physiological adaptability of seedling root system of tomato cutivars under low-phosphorus stress[J]. Journal of Shenyang Agricultural University, 2005, 36(5): 615-618
[15] 孙海国, 张福锁. 缺磷条件下的小麦根系酸性磷酸酶活性研究[J]. 应用生态学报, 2002, 13(3): 379-381. Sun H G and Zhang F S. Effect of phosphorus deficiency on activity of acid phosphatase exuded by wheat roots[J]. Chinese Journal of Applied Ecology, 2002, 13(3): 379-381
[16] 李君, 田霄鸿, 曹翠玲. 低磷胁迫对熊猫豆生殖生长及某些生理特性的影响[J]. 干旱地区农业研究, 2013,31(2): 191-195. Li J,Tian X H,Cao C L.Effects of P deficiency on reproductive growth and some physiological characteristics of phaseolus coccineus L. seedlings[J]. Agricultural Research in Arid Areas, 2013,31(2): 191-195.
[17] 何鹏, 高乐, 韦家少, 等. 低磷胁迫对巴西橡胶树幼苗保护酶活性的影响[J]. 热带作物学报, 2012, 33(12): 2225-2229. He P, Gao L, Wei J Setal. Study on the protective enzyme activity of theheveaseedling under low phosphorus stress[J]. Chinese Journal of Tropical Crops, 2012, 33(12): 2225-2229.
[18] 李鹏, 张永清. 低磷胁迫对不同黍稷品种光合特性的影响[J]. 黑龙江农业科学, 2012(7): 35-39. Li P, Zhang Y Q. Effect of low phosphorous stress on photosynthesis properties of different broomcorn millet varieties[J].Heilongjiang Agricultural Science, 2012(7): 35-39.
[19] Cao L M, Pan X H. A preliminary study on the tolerant mechanism of rice(OryzasativaL.)[J]. Acta Agronomica Sinica, 2002, 28(2): 260-264.
[20] 周建朝, 范晶, 王孝纯, 等. 磷胁迫下不同基因型甜菜的光合特征[J]. 植物营养与肥料学报, 2009, 15(4): 910-916. Zhou J C, Fan J, Wang X C,etal. Photosynthetic properties of different sugar beet genotypes under phosphorus deficiency[J]. Plant Nutrition and Fertilizer Science, 2009, 15(4): 910-916.
[21] 原慧芳, 岳海, 倪书邦, 田耀华. 磷胁迫对澳洲坚果幼苗叶片光合特性和荧光参数的影响[J]. 江苏林业科技, 2008, 35(1): 6-10. Yuan H F, Yue H, Ni S B, Tian Y H. Effects of phosphorus stress on photosynthetic characteristics and chlorophyll fluorescence of macadam in seedling leaves[J]. Journal of Jiangsu Forestry Science & Technology, 2008, 35(1): 6-10.
[22] 李春艳, 马龙, 张宏, 李诚. 新疆冬小麦苗期耐低磷指标的筛选[J]. 麦类作物学报, 2013,33(1): 137-140. Li C Y, Ma L, Zhang H, Li C. Screening on indexes for tolerance to low phosphorus stress at seedling stage of winter wheat[J]. Journal of Triticeae Crops, 2013,33(1): 137-140.
Effect of phosphorus fertilization on morphological and physiological characteristics of adzuki beans
LIAN Hui-da1, PEI Hong-bin1*, ZHANG Yong-qing2, QIN Cheng1, WU Xiao-wei3
(1CollegeofLifeSciences,ShanxiNormalUniversity,Linfen,Shanxi041004,China;2CollegeofUrbanandEnvironmentalSciences,ShanxiNormalUniversity,Linfen,Shanxi041004,China;3LinfenCityEnvironmentalMonitorStationofShanxiProvince,Linfen,Shanxi041004,China)
【Objectives】The study on the root morphology, the physiological adaptation and accumulation of phosphorus of plants under different phosphorus nutrition levels will be able to explore the P use potential, and help the screening of cultivars with high phosphorus use ability. 【Methods】 Three adzuki beans cultivars, Jin NO.1, adzuki bean Baohong 8824/17 and the Dongbeidahongpao, were chosen as test materials, and a pot experiment was conducted. Four levels of P2O5, 0(P1), 50(P2), 100(P3) and 200 mg/kg(P4) were designed. The beans were sown on May 18, 2013. Each basin was sown 15 seeds and eight seedlings were kept in each plastic basin after the first main leaf came out. When the adzuki bean grew to 30 d, the indexes related to physiological characters and the growth of plants were measured. 【Results】 1) Until the day of measurement, the leaf areas of Jin NO.1 are increased, the plant height increases first and then decreases with the increase of P2O5rates,while the leaf areas and the heights of the other two cultivars are increased first and declined later. The total lengths and areas of roots are keep increased, affecting the shoot biomass and the total dry weights of roots. 2) With the increase of P2O5, the root activities present increases at first and then decrease, and the activities of acid phosphatase of the roots are decreased, while the accumulation of P in all the three cultivars show an increasing trend. 3) With the increase of the P2O5, the activities of SOD and POD present a trend that increase at first and then decrease. The MDA contents are higher under the levels of low and high P2O5, levels the SOD and POD activities in Jin NO.1 are lower, and the MDA content is higher than those in the other two cultivars. 4) Under the levels of low and high phosphorus, the chlorophyll relative contents are low, but the difference is not significant, the maximum fluorescence(Fm) and the maximal photochemical efficiency(Fv/Fm) are increased, and the initial fluorescence(Fo) is decreased. 【Conclusions】 Adzuki beans response to different phosphorus nutrition levels by physiological characters and changes in root architecture.In this study, there are obvious differences in the index of the plant morphology and physiology in the adzuki beans under different P supply levels. The shoot to root ratios of the three cultivars are evidently increased by elongating root length and increasing root area. There are obvious differences among the three adzuki beans to the phosphorus nutrition. The ability of tolerance to low and high phosphorus stress is stronger in cultivar Jin NO.1 than in the other two.
adzuki bean; phosphorus fertilization; morphological index; physiological characteristic
2014-03-12 接受日期: 2014-09-09 网络出版日期: 2015-05-14
山西自然基金项目(2013011030-1)资助。
连慧达(1986—),男,山西长治人,硕士研究生,主要从事生理生态的研究。E-mail: lianboliwawa@163.com * 通信作者 E-mail:bbpei65110@163.com
S521;S143.2
A
1008-505X(2015)03-0792-08

