CD4+CD25+调节性T细胞对ox-LDL诱导的小鼠巨噬细胞焦亡的影响
林 静,酉鹏华,程 功,王 毅,陈海潮,杨 征,郭 敏
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病[1]。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是一类具有负向调节功能的T细胞亚群。研究证实,Treg具有抗AS作用。AS患者循环与AS模型动物Treg数量显著减少,功能明显受损[2];体内诱导和过继转输Treg均可明显抑制apoE-/-小鼠动脉粥样硬化斑块的发生[3,4]。进一步研究证实Treg抗AS的机制与其内皮保护及抗巨噬细胞泡沫化有关[5,6],但是Treg是否对AS斑块细胞死亡有影响目前尚无研究。本实验以小鼠巨噬细胞为研究对象,观察Treg对小鼠巨噬细胞死亡的影响,并对其可能机制进行探讨。
1 材料与方法
1.1 实验动物 C57B小鼠,SPF级,购自中国科学院上海实验动物中心,雌雄不限,8周~12周龄。
1.2 主要试剂 淋巴细胞分离液购自上海试剂二厂。小鼠CD4+CD25+T细胞磁珠分离试剂盒,MiDiMACS、分选器,LD和MS分选柱购自德国Miltenyi Biotec公司;抗小鼠CD3单克隆抗体为BD Pharmingen公司产品;RPMI1640及胎牛血清为Gibco公司产品。Cyto-Tox 96细胞毒性检测试剂盒购自Promega公司。TUNEL细胞凋亡检测试剂盒购自Roche公司。Calcein/EthDⅢ染色试剂盒购自Biotium公司。小鼠白细胞介素 (IL)-18、IL-β1ELISA 试 剂 盒 购 自 eBiosience 公司。
1.3 方法
1.3.1 细胞分离与培养
1.3.1.1 CD4+CD25+T细胞及CD4+CD25-T细胞的分离 断颈处死小鼠,取脾脏,Ficoll分离获得单个核细胞;通过小鼠CD4+T细胞磁珠分离试剂盒,阴性选择获得CD4+T细胞;加入PE标记抗小鼠CD25单克隆抗体,再加入磁珠标记抗PE,阳性选择获得CD4+CD25+T细胞,阴性选择获得CD4+CD25-T细胞,通过流式细胞仪(BD FACS Calibur)分析细胞纯度。
1.3.1.2 巨噬细胞的分离 断颈处死小鼠,75%乙醇浸泡10 min,剖腹收集腹腔内液,800 r/min离心5 min后收集细胞,用含10%胎牛血清的RPMI 1640培养液调整细胞浓度至1×106/mL,加入培养板中,置5%CO2、37℃孵箱培养4 h后去上清液,用PBS洗去未贴壁细胞。
1.3.2 实验分组 CD4+CD25+T细胞、CD4+CD25-T细胞(均为5×1 05细胞/孔)与抗小鼠CD3 mAb(5 0 ng/mL)孵育40 h后,分别加入已有贴壁巨噬细胞(3×106/孔~4×106/孔)的培养板,在终浓度均为50 mg/L的氧化型低密度脂蛋白(ox-LDL)共培养48 h,分为4组。对照组:巨噬细胞+PBS;ox-LDL组:巨噬细胞+100 mg/L ox-LDL;CD25+T细胞组(CD25+组):巨噬细胞+CD4+CD25+T 细 胞 +100 mg/L ox-LDL;CD4+CD25-T细胞组(CD25-组):巨噬细胞+CD4+CD25-T细胞+100 mg/L ox-LDL。各组细胞均置5%CO2、37℃孵箱,培养24 h后收获。
1.3.3 LDH流出检测 上述各组细胞培养后,收集上清,按照CytoTox 96非放射性细胞毒性检测试剂盒说明进行操作,于490 nm记录吸光值并测定乳酸脱氢酶(LDH)含量。
1.3.4 Calcein AM/EthD-Ⅱ细胞活性/毒性检测 上述各组细胞培养后,去除培养基,清洗2次~3次。加入Calcein-AM/EthD-Ⅲ溶液,37 ℃培养细胞15 min。激光荧光显微镜490 nm±10 nm下观察黄绿色活细胞,然后545 nm再观察红色的死细胞。每皿随机取至少3视野计数,试验重复3次。细胞死亡率=红色计数细胞/绿色计数细胞+红色技术细胞×100%。
1.3.5 TUNEL染色 4%多聚甲醛固定细胞。按照TUNEL染色试剂盒说明进行操作。TUNEL阳性率=绿色计数细胞/蓝色计数细胞×100%。
1.3.6 caspase-1 活 性 检 测 收 集 细 胞,根 据caspase-1试剂盒说明测定各组细胞caspase-1活性。
1.3.7 ELISA检测细胞因子IL-1β及IL-18浓度 将各组细胞培养结束后,收集培养上清,按照人IL-1β及IL-18试剂盒的操作步骤检测培养上清中IL-1β及IL-18浓度。实验设双复孔,重复3次。
1.4 统计学处理 采用SPSS15.0统计软件处理。实验数据以均数±标准差(x±s)表示,根据方差齐性分析的结果,进一步使用S-N-K检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Treg抑制小鼠巨噬细胞表达活化型caspase-1与对照组比较,ox-LDL组巨噬细胞caspase-1活性明 显 增 加 (P<0.001);与 ox-LDL 组 和 CD25-组比较,CD25+组细胞caspase-1活性显著性减少(P<0.001)。详见图1。
2.2 Treg抑制ox-LDL诱导巨噬细胞死亡 与对照组比较,ox-LDL组巨噬细胞LDH流出及Calcein-AM/EthD-Ⅲ明显增加(P<0.001);与ox-LDL组和 CD25-组比较,CD25+组细胞LDH流出及 Calcein-AM/EthD-Ⅲ阳性细胞数量显著性减少(P<0.001)。详见图2。
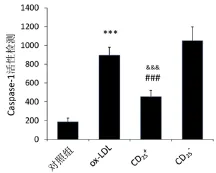
图1 Treg对小鼠巨噬细胞caspase-1活性的影响
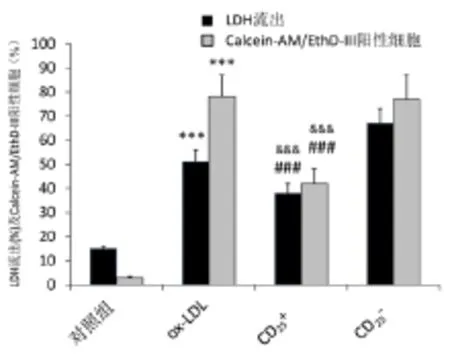
图2 Treg对小鼠巨噬细胞LDH流出及Calcein-AM/EthD-Ⅲ阳性细胞的影响
2.3 Treg抑制ox-LDL诱导的小鼠巨噬细胞TUNEL阳性表达 TUNEL染色表明:与对照组TUNEL阳性细胞 (4.28±0.59)% 比 较,100 μg/mL ox-LDL 组TUNEL阳性细胞(1 6.6 9±1.3 1)%显著增加(P<0.05);与ox-LDL组和 CD25-组(25.53±2.28)%比较,CD25+组细胞TUNEL阳性细胞(10.02±1.03)%明显减少(P<0.01)。
2.4 Treg抑制ox-LDL诱导的小鼠巨噬细胞IL-1β、IL-1 8分泌 与对照组比较,ox-LDL组巨噬细胞IL-1β、IL-18水平明显增加(P<0.001);与ox-LDL组和CD25-组比较,CD25+组细胞IL-1β、IL-18水平显著减少(P<0.001)。详见表1。

表1 各组IL-1β及IL-18水平比较(x±s) ng/L
3 讨 论
细胞焦亡(pyroptosis)是近年来发现并证实的新的细胞死亡方式,其发生依赖于天冬半胱酶-1(caspase-1)激 活,伴 随IL-1β、IL-18 等 炎 症 因 子 分泌[7]。焦亡形态学特征表现为细胞膜破裂,细胞内容物释放以及caspase-1作用于骨架蛋白DNA致使形态学表现为TUNEL阳性。目前研究已证实,焦亡在人类免疫缺陷病毒(HIV)等病原菌及胆固醇结晶等非生物性刺激原介导的细胞死亡中发挥重要作用[7],但其是否参与AS细胞死亡目前尚无研究。
ox-LDL大量存在于AS斑块局部,是促AS作用最强的刺激原之一。研究表明ox-LDL可诱导巨噬细胞发生死亡,大多学者认为ox-LDL诱导的巨噬细胞死亡方式为凋亡,其依据为TUNEL染色阳性增加[7]。但是,细胞膜破裂、细胞内容物释放以及胞内微器官破坏等非凋亡形态学特征同样可见于ox-LDL诱导的巨噬细胞报道中[8]。尽管有学者提出“凋亡后坏死”,但是体外研究表明给予凋亡关键酶阻断剂及其他凋亡途径蛋白酶阻断剂并不能抑制ox-LDL诱导的巨噬细胞死亡[9,10]。上述研究提示细胞其他死亡方式可能参与ox-LDL诱导的巨噬细胞死亡。本研究发现,与对照组比较,ox-LDL组巨噬细胞caspase-1的活性显著增高,LDH流出及Calcein-AM/EthDⅢ染色阳性细胞显著增加;TUNEL阳性细胞显著增高;同时细胞因子检测IL-1β和IL-18明显增高。以上结果表明ox-LDL可诱导小鼠巨噬细胞发生焦亡细胞死亡方式,其作用机制尚待进一步研究。
Treg在调控动脉粥样硬化炎症反应和发生发展中起重要作用。研究已证实Treg可以抑制ox-LDL诱导的巨噬细胞泡沫化[6,10],但是 Treg对 ox-LDL诱导巨噬细胞死亡的影响及机制研究甚少。本实验中,与单独氧化型低密度脂蛋白刺激比较,与Treg共培养巨噬细胞caspase-1活性明显受抑制;其细胞死亡也明显减少,表现为LDH流出减少以及Calcein-AM/EthDⅢ染色阳性数量减少;同时细胞因子检测表明Treg也可抑制ox-LDL导致的巨噬细胞IL-1β和IL-18分泌,相反,CD4+CD25-效应性T细胞无上述作用。上述结果提示Treg可抑制氧化型低密度脂蛋白导致的巨噬细胞焦亡,此作用可能是Tregs抗AS机制之一。
综上所述,本研究证实ox-LDL可诱导小鼠巨噬细胞发生焦亡;Treg可抑制ox-LDL导致的小鼠巨噬细胞焦亡。上述发现不仅有助于进一步明确AS细胞死亡机制,还有助于阐明Treg在AS发生发展的调控作用,而且为AS的防治提供新的干预靶点。
[1] Hansson GK.Inflammation,atherosclerosis,and coronary artery disease[J].N Engl J Med,2005,352:1685-1695.
[2] Yuhua L,Xiang C,Xiao Y.The Th17/Treg imbalance in patients with acute coronary syndrome[J].Clin Immunol,2009,133(3):447.
[3] Dazhu L,Keping Y,Luo M.Generation of HSP60-specific regulatory T cell and effect on atherosclerosis [J].Cellular Immunology,2006,243(2):90-95.
[4] Mor A,Planer D,Luboshits G,etal.Role of naturally occurring CD4+CD25+regulatory T cells in experimental atherosclerosis[J].Arterioscler Thromb Vasc Biol,2007,27:893-900.
[5] Shaolin H,Ming L,Xuming M,etal.CD4+CD25+Foxp3+regulatory T cells protect the proinflammatory activation of human umbilical vein endothelial cells[J].Arterioscler Thromb Vasc Biol,2010,30(12):2621-2630.
[6] Jing L,Ming L,Zhixiao W,etal.The role of CD4+CD25+regulatory T cells in macrophage-derived foam cells formation[J].J Lipid Res,2010,51(5):1208-1217.
[7] Duprez L,Wirawan E,Berghe TV,etal.Major cell death pathways at a glance[J].Microbes and Infection,2009,11:1050-1062.
[8] Hakamata H,Miyazaki A,Sakai M,etal.Cytotoxic effect of oxidized low density lipoprotein on macrophages[J].J Atheroscler Thromb,1998,5:66-75.
[9] Asmis R.Oxidized ldl promotes peroxide-mediated mitochondrial dysfunction and cell death in human macrophages:A caspase-3-independent pathway[J].Circ Res,2002,92:20-29.
[10] Moore KJ,Tabas I.Macrophages in the pathogenesis of atherosclerosis[J].Cell,2011,145:341-355.

