拉莫三嗪对小鼠脊髓背侧半横断损伤的保护作用
付强 王兆涛 张茂营 徐如祥
·基础研究·
拉莫三嗪对小鼠脊髓背侧半横断损伤的保护作用
付强1王兆涛2张茂营2徐如祥2
目的探讨拉莫三嗪在小鼠脊髓损伤修复中的作用。方法雌性C57BL/6小鼠80只采用脊髓背侧半横断损伤模型,随机分为模型组:单纯脊髓损伤;治疗组:脊髓损伤后每天给予腹腔注射拉莫三嗪,按照25 mg/kg的计量,连续7 d;对照组:脊髓损伤后每天给予腹腔注射0.9%生理盐水,按照25 mg/kg的计量,连续7 d。术后分别在1 d、7 d、14 d对各组小鼠行BBB评分,并分别在1 d、7 d、14 d在各组随机抽取6只小鼠,进行免疫荧光染色观察胶质细胞变化,并在术后第7天各组取6只小鼠组织行ELISA检测,观察炎症因子表达情况。结果损伤后7、14 d治疗组小鼠BBB评分明显高于模型组和对照组,差异有统计学意义(P<0.05);脊髓损伤后矢状切面损伤灶下游的GFAP+(星形胶质细胞的标记)细胞的免疫荧光面积百分比,发现术后7 d和14 d治疗组(9.87± 0.96,4.79±1.02)的明显低于模型组(12.34±1.72,7.46±1.28)和对照组(11.89±1.70,7.53±1.70),差异均有统计学意义(P<0.05)。ELISA检测术后7 d小鼠T9~T11的IL-1、IL-10、TNF-α表达情况,IL-1、IL-10的表达治疗组明显低于模型组和对照组,差异有统计学意义(P<0.05)。结论拉莫三嗪可以改善脊髓损伤小鼠的运动功能,通过前期减少炎症因子的分泌降低胶质细胞的活化来实现的。
脊髓损伤;拉莫三嗪;胶质细胞;炎症因子
脊髓损伤(spinal cord injury,SCI)常常会导致不可逆转的感觉、运动、反射及括约肌功能障碍。脊髓损伤早期的炎症反应以及胶质瘢痕的形成影响了中枢神经系统内抑制神经元再生的微环境,从而很大程度上延缓了脊髓损伤的恢复[1],胶质细胞(星形胶质细胞和小胶质细胞)被证明会导致损伤后神经性疼痛[2-4],而神经性疼痛会通过疼痛传导的物质进一步激活胶质细胞[5-6]。拉莫三嗪(lamotrigine,LTG)作为抗癫痫药物,是一种封闭电压应用-依从性的钠离子高通道阻滞剂,同时也被发现它的止痛作用被用来各种神经性疼痛的止痛剂,而鞘内注射和腹腔内注射LTG被证明可以减弱神经性疼痛[7],而神经性疼痛的减弱可以抑制神经胶质细胞的激活,或许可以促进损伤的修复。本实验应用TLG治疗小鼠脊髓背侧半横断损伤模型,观察小鼠脊髓损伤后运动功能和组织形态的变化,探讨TLG对脊髓损伤的修复作用,为临床治疗提供依据。
材料与方法
一、实验动物
健康雌性SPF级8周龄C57BL/6小鼠80只(购自北京维通利华实验动物技术有限公司)。体质量20~22 g。
二、试剂与仪器
拉莫三嗪(Sigma公司),二亚基亚砜(DMSO) (Amresco公司);0.9%生理盐水(石家庄四药有限公司),注射用青霉素钠,80万单位/支;Mouse-anti-GFAP(Abcam公司),Rabbit-anti-Iba1(Wako公司),Alexa Fluor 488-conjugated donkey anti-mouse (invitrogen公司),Alexa Fluor 555-conjugated donkey anti-rabbit(invitrogen公司),DAPI(invitrogen公司),ELISA试剂盒(北京博奥通科科技有限公司);手术显微镜(Leica公司),恒冷冰冻切片机(Leica公司),共聚焦显微镜(Leica公司)。
三、实验方法
1.脊髓背侧半横断模型的制作和分组:小鼠用3.6%水合氯醛腹腔注射麻醉,无菌条件下俯卧固定,行T10切除术。切口以T10为中点,行长的背部正中切口,钝性分离皮下组织和肌肉,显露T9~T11棘突和椎板,用蚊式钳咬除除T10棘突和椎板,用虹膜剪横断脊髓背侧半0.8mm(剪刀刃上提前标记),术后小鼠双下肢瘫痪,下肢关节不能自主活动,提示造模成功。造模后观察到79只造模成功,按照随机数字表法分为3组:模型组(SCI)、治疗组(SCI+ LTG)、对照组(SCI+0.9%saline)。
2.小鼠给药及管理:小鼠造模后给予给药处理,拉莫三嗪用DMSO助溶,用0.9%生理盐水制备成10µg/µl的浓度[8]。分组给药:模型组(SCI组):脊髓损伤后不予特殊其他处理;治疗组(SCI+LTG组):术后1天起给予腹腔注射拉莫三嗪,按照25 mg/kg的计量,连续7 d[9];对照组(SCI+0.9%saline):术后1天起给予腹腔注射0.9%生理盐水,按照25 mg/kg的计量,连续注射7 d。术后每天腹腔注射青霉素钠,并于每天两次膀胱区按摩,防止泌尿系感染。
3.行为学评分:于术后1 d、7 d、14 d将各组小鼠置于边长为2 m的方形桌面上自由爬行3 min,由两名观察者分别按照BBB评分标准,分别观察小鼠的臀、膝、踝关节的行走情况、躯干运动及其协调情况,为小鼠运动功能评分,评分从0~21分,0分表示无可见后肢运动,21分表示后肢运动功能正常,将二人的评分求平均值得到该小鼠的BBB评分[10]。
4.制作冰冻切片:脊髓组织切片造模后分别在术后1 d、7 d、14 d行为学评价结束后,各组分别随机取6只小鼠,腹腔注射3.6%水合氯醛麻醉后,开胸并经左心室心脏插管,用200 ml 0.9%生理盐水快速灌注,右心耳流出透明液体后用4˚C 4%多聚甲醛(pH7.2~7.4)300 ml灌注用以固定。解剖T9~T11的脊椎椎管,取出损伤的脊髓,并于4˚C条件下依次置于4%多聚甲醛(pH7.2~7.4)固定24 h、20%蔗糖溶液中脱水24 h、30%蔗糖溶液中脱水24 h,至组织沉入容器底部。取距离横断损伤处头、尾端各0.5 cm范围的脊髓并用OCT包埋,用恒冷冰冻切片机矢状位连续切片,贴于粘附在玻片上,标注头端和尾端,片厚10µm,每份标本制作20套切片,按照顺序依次编号为1~20,存放于-80˚C冰箱里。
5.免疫荧光染色及拍摄:取各组的6只小鼠的相同编号的切片,5张用于星形胶质细胞的染色,取出切片后,在室温下自然干燥10 min,在组织上滴加0.3%Triton-X100室温下30 min,再滴加10%BSA室温下60 min,之后在组织上滴加Mouse-anti-GFAP (1:500稀释)在4˚C条件下孵育过夜(12~18 h),在室温下复温30 min后用PBS缓冲液(pH7.2~7.4)洗涤3次X10min,再用Donkey-anti-Mouse488(1:1000稀释)在室温下孵育2 h后,用PBS缓冲液洗涤3次X 10 min,用在组织上滴加DAPI,用盖玻片封片,4˚C条件下保存。再取5张用于小胶质细胞的染色,在室温下自然干燥10 min,在组织上滴加0.3% Triton-X100室温下30 min,再滴加10%BSA室温下60 min,之后在组织上滴加Rabbit-anti-Iba1(1:500稀释)在4˚C条件下孵育过夜(12~18 h),在室温下复温30 min后用PBS缓冲液(pH7.2~7.4)洗涤3次× 10 min,再用Donkey-anti-Rabbit555(1:1 000稀释)在室温下孵育2 h后,用PBS缓冲液洗涤3次×10 min,用在组织上滴加DAPI,用盖玻片封片,4˚C条件下保存。用Leica显微镜放大20倍拍摄损伤灶尾端的星形胶质细胞和小胶质细胞的图像[11]。
5.细胞计数:将术后1 d、7 d、14 d每组6只小鼠,每只小鼠选择相同编号的4个组织,将所拍的荧光图片用Image J(National Institutes of Health, Bethesda,MD,USA)软件进行分析GFAP+细胞在图片中所占的荧光面积百分比[12];人工计数Iba1+细胞,计算相对面积下的Iba1+细胞数量[13]。
6.ELISA检测:各组取术后7 d小鼠各6只,取T9-T11节段的组织,迅速置于速冻管内,称重后,按照1 g对应9 ml的比例用PBS(PH7.4)缓冲液加入组织中,用匀浆器将标本匀浆充分,仔细收集上清,储存于离心管内。用ELISA方法分别检测各组的IL-1、IL-10、TNF-α的表达水平。
四、统计学处理
采用SPSS13.0统计软件进行分析,BBB评分及Iba1+数目等计量资料,采用均数±标准差(x±s)的形式表示,模型组、治疗组及对照组组间比较行重复测量的是用方差分析,两两比较则采用LSD-t检验,P<0.05为差异有统计学意义。
结果
一、动物功能评分(Basso Beattie Bresnahan,BBB)结果
为了证实拉莫三嗪是否会在小鼠脊髓损伤后的病理反应中起到的的影响,我们首先观察了在运动功能的恢复方面各组小鼠在不同时间点拉莫三嗪所起的作用,损伤后第1天所有小鼠的BBB评分各组间几乎无差异(P>0.05);术后7 d,治疗组的小鼠的评分(5.17±0.41)高于模型组的的小鼠(4.00±0.63)和对照组的小鼠(3.83±0.41),而后两组间无明显差异;至术后14 d,治疗组的小鼠的BBB评分(6.50±0.55)仍然高于模型组(5.50±0.55)和对照组(5.33±0.52),差异有统计学意义(P<0.05),即拉莫三嗪处理后的小鼠运动功能恢复更好(表1)。

图1 免疫荧光染色三组小鼠GFAP+(星形胶质细胞)数量变化
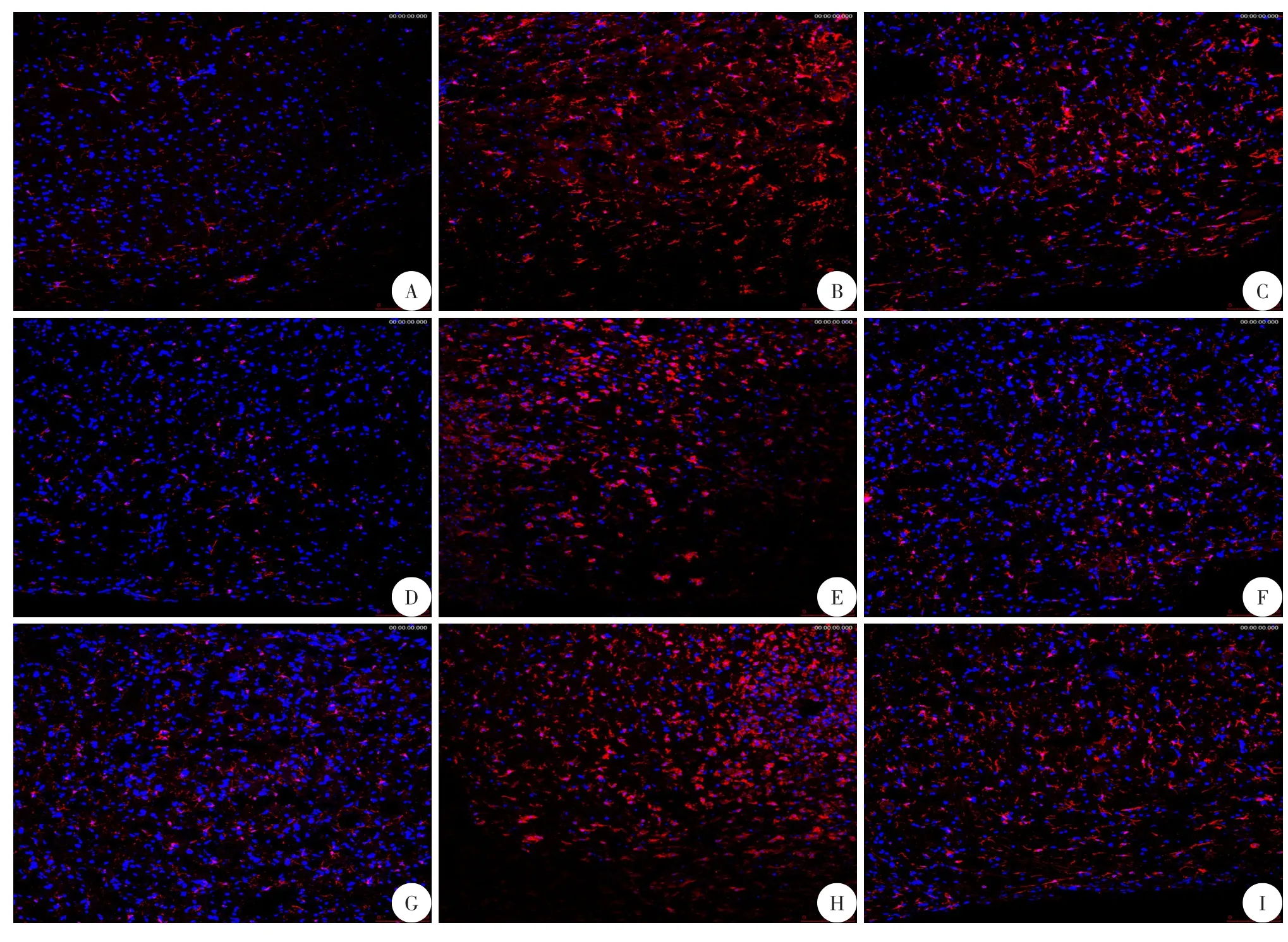
图2 免疫荧光染色三组小鼠Iba1+(小胶质细胞)数量变化
表1 各组小鼠不同时间点BBB评分(
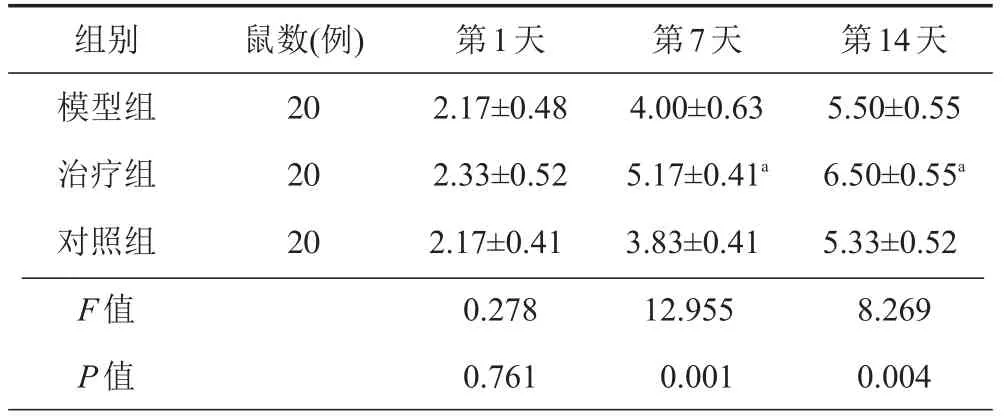
表1 各组小鼠不同时间点BBB评分(
与模型组和对照组相比较,aP<0.05
组别模型组治疗组对照组F值P值鼠数(例) 20 20 20第1天2.17±0.48 2.33±0.52 2.17±0.41 0.278 0.761第7天4.00±0.63 5.17±0.41a3.83±0.41 12.955 0.001第14天5.50±0.55 6.50±0.55a5.33±0.52 8.269 0.004
二、星形胶质细胞和小胶质细胞的计数结果
活性星形胶质细胞和小胶质细胞可以分泌炎性因子和趋化因子,从而导致神经和突触的机能障碍、细胞凋亡、继发性神经退行性变,早期对炎症反应的治疗可以明显促进脊髓损伤病情的恢复。因此,我们对各组小鼠在各时间点的炎症细胞的表达做了计数,验证拉莫三嗪是否会抑制炎症细胞的增殖。我们计算了脊髓损伤后矢状切面损伤灶下游的GFAP+(星形胶质细胞的标记)细胞的免疫荧光面积百分比,发现术后7 d和14 d治疗组(9.87±0.96,4.79±1.02)的统计明显低于模型组(12.34±1.72,7.46±1.28)和对照组(11.89±1.70,7.53±1.70),而后两者差异不明显(表2)(图1);而计算相同位置的Iba1+(小胶质细胞的标记)细胞的相对面积下的数量,发现治疗组的统计数量(285.68±25.90,152.86±12.77)明显低于模型组(355.47±23.94,172.92±21.12)和对照组(379.17±52.73,178.91±21.08),而后两者差异不明显(表3)(图2)。即拉莫三嗪处理后小鼠的炎症反应明显减弱。
表2 各组小鼠不同时间点GFAP+荧光面积百分比(%)
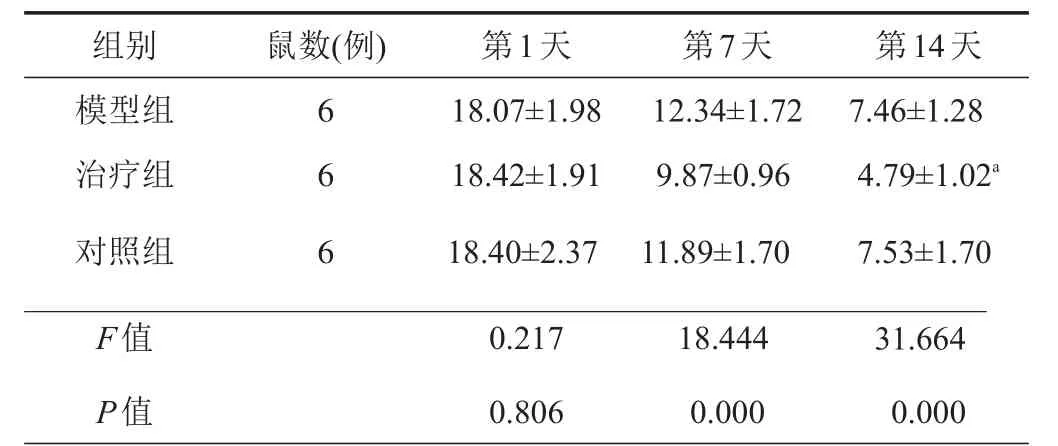
表2 各组小鼠不同时间点GFAP+荧光面积百分比(%)
与模型组和对照组相比较,aP<0.05
第14天7.46±1.28 4.79±1.02a7.53±1.70 31.664 0.000组别模型组治疗组对照组F值P值鼠数(例) 6 6 6第1天18.07±1.98 18.42±1.91 18.40±2.37 0.217 0.806第7天12.34±1.72 9.87±0.96 11.89±1.70 18.444 0.000
三、ELISA结果
为了验证拉莫三嗪通过减少炎症因子的分泌而减少对胶质细胞的激活,对IL-1、IL-10、TNF-α进行检测,结果显示IL-1和IL-10在术后7 d表达治疗组(27.757±2.070,92.557±8.859)低于模型组(33.738± 0.642,120.791±6.238)和对照组(33.691±0.587,120.807±3.486),而模型组和对照组间无明显差异。TNF-α在三组中的表达无明显差异(P>0.05)(表4)。即拉莫三嗪有效地抑制炎症因子的表达和分泌。
讨论
急性脊髓损伤大多源于运动伤、暴力伤、交通伤,损伤后多会出现不可逆性的感觉及运动功能丧失,并且迄今没有确定的治疗方法。脊髓损伤恢复困难归因于轴突的有限的自身再生能力及周围胶质环境抑制了轴突的再生[9],其中胶质环境对神经再生的抑制作用在早期起着比较重要的作用。
拉莫三嗪是一种广泛应用的抗癫痫药物,近年来因为其对神经性疼痛的抑制作用而应用于糖尿病性神经疼痛、疱疹后神经痛、三叉神经痛、HIV相关的神经疼痛、术后或创伤后神经痛[12],但对于脊髓损伤的研究非常缺乏。如果可以将拉莫三嗪的抑制疼痛的作用应用于脊髓损伤,又可以起到抑制神经胶质细胞激活的作用,可以对损伤的恢复起到正向的作用。鉴于拉莫三嗪的这种作用,而疼痛和胶质细胞之间又有相互激活的作用,课题用脊髓半横断损伤后腹腔注射拉莫三嗪作为治疗组,同时腹腔注射同样计量的生理盐水作为对照组,不予任何处理作为模型组,探讨拉莫三嗪在脊髓损伤后对于行为学和早期病理学变化的影响。
机体神经损伤后,感觉末梢会分泌并释放神经传递物质,这些物质会激活星形胶质细胞和小胶质细胞,而激活的胶质细胞又可以产生并分泌IL-1、IL-10、前列腺素E2、三磷酸腺苷等,这些物质会通过调节突触前释放神经递质或者调节突触后的兴奋性而促进神经性疼痛[14]。拉莫三嗪作为一种电压依从性钠离子通道阻滞剂[15],在体内可以抑制GABA介导的神经传递[16],而这种抑制也可以降低谷氨酸盐和天冬氨酸在神经系统的表达[15],同时对细胞膜和突触前膜的稳定作用也可抑制神经炎症因子如谷氨酸盐、P物质、三磷酸腺苷和疼痛传递因子的释放,而IL-1、IL-6、IL-10、TNF-α被抑制也会对其他神经因子的释放起到抑制作用,其中对AMPA/ kainate受体和对疼痛相关传递体的抑制直接导致胶质细胞的活化被抑制[17-19]。也有很多文献报道拉莫三嗪在脊髓中可以抑制谷氨酸盐的释放和减弱神经易感状态,这种抑制作用可抑制胶质细胞的活化,实验中持续使用拉莫三嗪一周后星形胶质细胞和小胶质细胞在损伤灶下游的分布明显少于模型组和对照组,而模型组和对照组无明显差异,而术后两周治疗组星形胶质细胞和小胶质细胞的分布仍减少,而炎症因子IL-1和IL-10的表达同样在治疗组较少,说明使用拉莫三嗪有效地抑制了星形胶质细胞和小胶质细胞的活化和增殖。同时,在脊髓损伤后一周和两周的行为学评分中可以看得出使用拉莫三嗪后小鼠的BBB评分高于模型组和对照组,而模型组和对照组间无明显差异,说明拉莫三嗪在抑制胶质细胞活化增殖的基础上更好地促进了脊髓损伤的运动功能的恢复,从而增加了拉莫三嗪对脊髓损伤有效治疗的说服力。但对于拉莫三嗪是否促进轴突的再生及其机制有待进一步研究。
表3 各组小鼠不同时间点Iba1+相对面积下数目(cells/mm2)
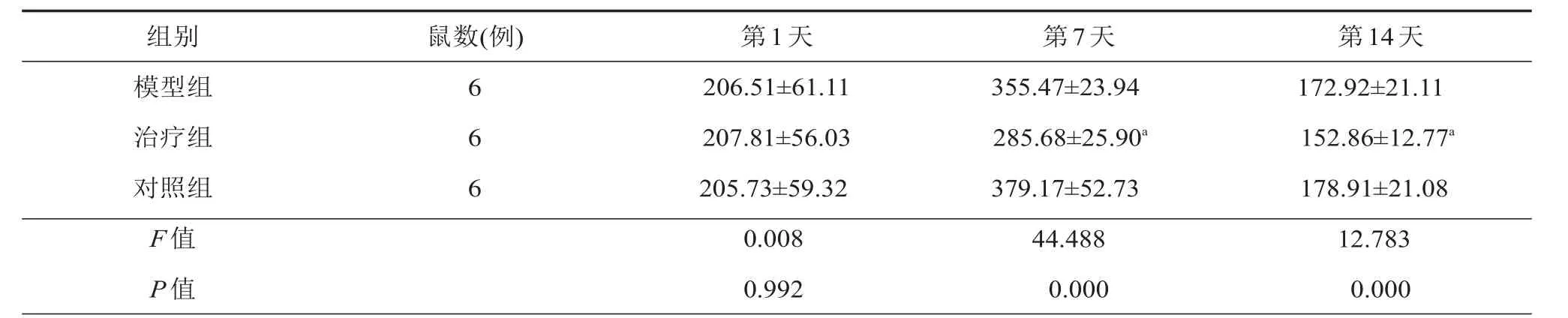
表3 各组小鼠不同时间点Iba1+相对面积下数目(cells/mm2)
与模型组和对照组相比较,aP<0.05
组别模型组治疗组对照组F值P值鼠数(例) 6 6 6第1天206.51±61.11 207.81±56.03 205.73±59.32 0.008 0.992第7天355.47±23.94 285.68±25.90a379.17±52.73 44.488 0.000第14天172.92±21.11 152.86±12.77a178.91±21.08 12.783 0.000
表4 第7天炎症因子在各组小鼠表达情况
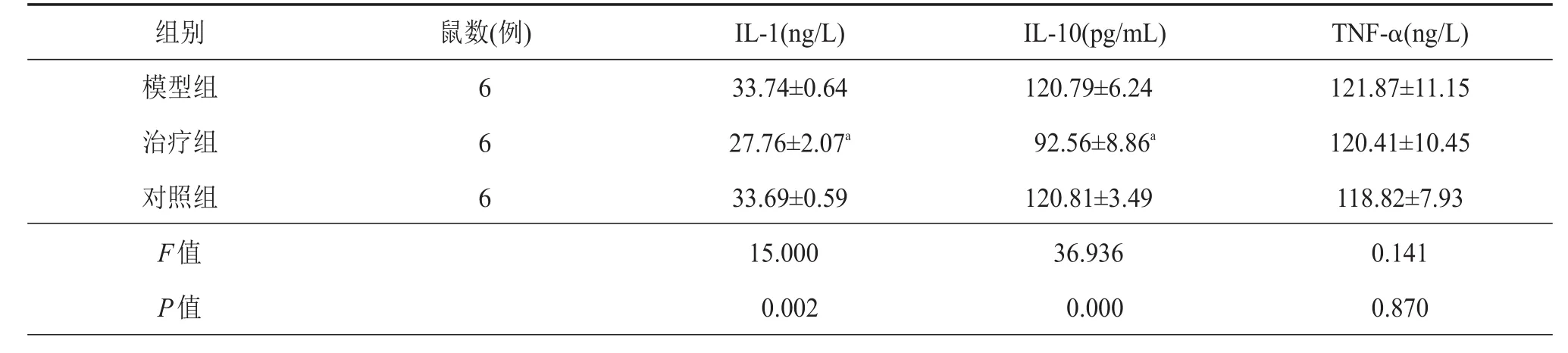
表4 第7天炎症因子在各组小鼠表达情况
与模型组和对照组相比较,aP<0.05
组别模型组治疗组对照组F值P值鼠数(例) 6 6 6 IL-1(ng/L) 33.74±0.64 27.76±2.07a33.69±0.59 15.000 0.002 IL-10(pg/mL) 120.79±6.24 92.56±8.86a120.81±3.49 36.936 0.000 TNF-α(ng/L) 121.87±11.15 120.41±10.45 118.82±7.93 0.141 0.870
[1]邹明明,薛兴森,朱海涛,等.姜黄素促进大鼠脊髓损伤恢复的病理及行为学研究[J].第三军医大学学报,2011,33(8): 765-770.
[2]Popiolek-Barczyk K,Kolosowska N,Piotrowska A,et al. Parthenolide Relieves Pain and Promotes M2 Microglia/Macrophage Polarization in Rat Model of Neuropathy[J].Neural Plasticity,2015,2015.
[3]Tsuda M.[Mechanisms underlying the pathogenesis of neuropathic pain revealing by the role of glial cells][J].Nihon shinkei seishin yakurigaku zasshi=Japanese journal of psychopharmacology,2015,35(1):1-4.
[4]Clark AK,Gruber-Schoffnegger D,Drdla-Schutting R,et al. Selective Activation of Microglia Facilitates Synaptic Strength [J].The Journal of Neuroscience,2015,35(11):4552-4570.
[5]Berliocchi L,Maiarù M,Varano GP,et al.Spinal autophagy is differently modulated in distinct mouse models of neuropathic pain[J].Molecular pain,2015,11(1):3.
[6]Yin Q,Fan Q,Zhao Y,et al.Spinal NF-κB and Chemokine Ligand 5 Expression during Spinal Glial Cell Activation in a Neuropathic Pain Model[J].PloS one,2015,10(1):e0115120.
[7]Choi YS,Jun IG,Kim SH,et al.Intrathecal Lamotrigine Attenuates Mechanical Allodynia and Suppresses Microglial and Astrocytic Activation in a Rat Model of Spinal Nerve Ligation[J].Yonsei medical journal,2013,54(2):321-329.
[8]Dag E,Dag ZO,Baydas G,et al.Effects of lamotrigine and topiramate on brain maturation and cognitive functions in offspring of pregnant rats-preliminary study[J].Advances in clinical and experimental medicine:official organ Wroclaw Medical University,2014,23(5):691.
[9]Floriddia EM,Rathore KI,Tedeschi A,et al.p53 Regulates the neuronal intrinsic and extrinsic responses affecting the recovery of motor function following spinal cord injury[J].The Journal of Neuroscience,2012,32(40):13956-13970.
[10]Zhang MY,Zheng CY,Zou MM,et al.Lamotrigine attenuates deficits in synaptic plasticity and accumulation of amyloid plaques in APP/PS1 transgenic mice[J].Neurobiology of aging, 2014,35(12):2713-2725.
[11]张鸿日,彭静华,张茂营,等.2ME2对脊髓损伤大鼠运动功能及Tau蛋白磷酸化的影响[J].中华神经医学杂志,2014,13 (011):1127-1130.
[12]Nunes AF,Amaral JD,Lo AC,et al.TUDCA,a bile acid, attenuates amyloid precursor protein processing and amyloid-β deposition in APP/PS1 mice[J].Molecular neurobiology,2012, 45(3):440-454.
[13]Wiffen PJ,Derry S,Moore RA.Lamotrigine for acute and chronic pain[J].The Cochrane Library,2011.
[14]Marchand F,Perretti M,McMahon SB.Role of the immune system in chronic pain[J].Nature Reviews Neuroscience,2005, 6(7):521-532.
[15]Poonuru RR,Gonugunta CSR.Bimodal gastroretentive drug delivery systems of lamotrigine:Formulation and evaluation[J]. Indian journal of pharmaceutical sciences,2014,76(6):476.
[16]Kishimoto A,Goto Y,Hashimoto K.Post-traumatic Stress Disorder Symptoms in a Female Patient Following Repeated Teasing:Treatment with Gabapentin and Lamotrigine and the Possible Role of Sensitization[J].Clinical Psychopharmacology and Neuroscience,2014,12(3):240-242.
[17]Jun IG,Kim SH,Yoon YI,et al.Intrathecal lamotrigine attenuates antinociceptive morphine tolerance and suppresses spinal glial cell activation in morphine-tolerant rats[J].Journal of Korean medical science,2013,28(2):300-307.
[18]Perisic T,Zimmermann N,Kirmeier T,et al.Valproate and amitriptyline exert common and divergent influences on global and gene promoter-specific chromatin modifications in rat primary astrocytes[J].Neuropsychopharmacology,2010,35(3): 792-805.
[19]Guizzo R,Paques MW,Anhezini L,et al.Neuroprotective effects of oral lamotrigine administration on rabbit retinas after pars plana vitrectomy and silicone oil injection[J].Retina, 2008,28(4):638-644.
Protective effect of lamotrigine on mouse dorsal spinal cord injury
Fu Qiang1,Wang Zhaotao2, Zhang Maoying2,Xu Ruxiang2.
1Medical School of Chinese PLA,Beijing 100853,China
Xu Ruxiang,Email:zjxuruxiang@163.com
ObjectiveTo investigate the effect of lamotrigine(LTG)on recovery after spinal cord injury(SCI).MethodsA total of 80 female C57BL/6 mouses were made the model of spinal cord hemisection,and all of these were randomly divided into 3 group:SCIgroup,SCI+LTG group and SCI+0.9%saline group;mouses in SCI+LTG grouop were given interperitoneal injection of lamotrigine (25 mg/kg)for 7days,and mouses in SCI+0.9%saline group were given the same volume of 0.9%saline. Basso,Beatti,Bresnahan(BBB)scale was perfomed 1,7,14days after SCI;the number of glial cell were observed by immunofluorescence and the express of inflammatory factors were obseverd by ELISA (enzyme linked immunosorbent assay).ResultsOn the 7th,14th days after injury,the BBB scale scores in the SCI+LTG group were significantly higher than those in the SCI group and in the SCI+ 0.9%saline group(P<0.05).On the 7th,14th days after injury,less percentage of GFAP+fluorenscent area and less number of Iba1+cells in the SCI+LTG group were distributed in the lesion area than those in the SCI group and in the SCI+0.9%saline group(P<0.05).On the 7th day after spinal cord injury,the IL-1 and IL-10 expression in SCI+LTG group were obviously lower than those in the SCI group and in the SCI+0.9%saline group(P<0.05).ConclusionLamotrigine improve the motor function after spinal cord injury by decrease the activation of the glial cells.
Spinal cord injury;Lamotrigine;Glialcell;Inflammatory factor
2015-04-23)
(本文编辑:杨艺)
10.3877/cma.j.issn.2095-9141.2015.03.009
军队十二五重大科技项目(BWS12J010)
100853北京,解放军医学院1;100700,北京军区总医院附属八一脑科医院2
徐如祥,Email:zjxuruxiang@163.com
付强,王兆涛,张茂营,等.拉莫三嗪对小鼠脊髓背侧横断损伤的保护作用[J/CD].中华神经创伤外科电子杂志,2015, 1(3):158-163.

