缺氧预处理对颅脑外伤大鼠皮层TrxR2、CHOP表达及神经元细胞超微结构改变的影响
刘光杰 刘家传 王金标 杨艳艳 张星 王春琳 汤宏 徐燊
缺氧预处理对颅脑外伤大鼠皮层TrxR2、CHOP表达及神经元细胞超微结构改变的影响
刘光杰 刘家传 王金标 杨艳艳 张星 王春琳 汤宏 徐燊
目的探讨缺氧预处理对颅脑外伤大鼠皮层TrxR2、CHOP表达及神经元细胞超微结构改变的影响。方法48只SD大鼠随机分成对照(Con)组、缺氧预处理(HPC)组、单纯外伤(TBI)组和缺氧预处理颅脑外伤(HPCT)组。采用改良的Feeney’s自由落体装置制作颅脑损伤大鼠模型,预先在低压氧舱内连续处理3 d(-50 kPa、3 h/d)制作缺氧预处理模型。采用HE染色法和新鲜标本制作超薄切片,分别在光镜和电镜下观察各组大鼠皮层脑组织的大体结构和神经元细胞超微结构改变。qRT-PCR和Western blotting法检测挫伤区周围皮层TrxR2、CHOP mRNA和蛋白的表达变化。结果Con组和HPC组病理改变无明显差异,HPCT组较TBI组大鼠病理改变轻,神经元细胞超微结构受损明显减轻。HPCT与TBI组比较,TrxR2 mRNA和蛋白表达显著上调,CHOP mRNA和蛋白表达显著下调,差异均具有统计学意义(均P<0.05);Con与HPC组比较,差异无统计学意义(P>0.05)。结论缺氧预处理可明显减轻颅脑外伤大鼠皮层神经元细胞形态学改变,这可能与上调TrxR2、下调CHOP的表达有密切关系,从而对神经元细胞起保护作用。
颅脑外伤;缺氧预处理;TrxR2;CHOP;超微结构
颅脑外伤(traumatic brain injury,TBI)是脑组织遭受直接或间接打击后伴随一系列复杂变化的动态过程[1]。越来越多的证据表明缺氧预处理(hypoxic preconditioning,HPC)对机体有明确的保护作用[2],然而缺氧预处理对颅脑外伤的保护作用,前期实验虽已做了大量工作,但其病理改变及对神经元细胞的作用机制仍需进一步阐述。线粒体硫氧还蛋白还原酶2(TrxR2)是线粒体中重要酶类,具有抗氧化应激能力,在颅脑外伤中对线粒体起重要保护作用[3]。生长停滞DNA损害可诱导基因153(C/ EBP homologousprotein/growth arrest and DNA damage inducible gene153,CHOP/GADD153)是内质网应激(ERS)的经典标志物,内质网受损时介导相关凋亡的发生,从而影响内质网功能[4]。本实验通过建立缺氧预处理与颅脑外伤大鼠模型,通过光镜和电镜下观察脑组织病理改变,并检测TrxR2和CHOP mRNA和蛋白的表达变化,探讨缺氧预处理对颅脑外伤后大鼠皮层神经元细胞的保护作用。
材料与方法
一、实验器材和试剂
兔抗鼠TrxR2抗体(美国Santa Cruz公司),兔抗鼠CHOP抗体(美国Santa Cruz公司),Feeney’s颅脑损伤打击器(淮北正华生物科技公司),低压氧仓(上海减压器厂),WDZ-2000微型磨钻(上海晶杰医疗器械有限公司),JEM-1230型透视电镜(日本产),LKBNOVA型切片机(瑞典产),戊二醛(美国SPI公司),环氧树脂(美国SPI公司),醋酸双氧铀(美国SPI公司),柠檬酸铅(北京达昱科仪公司),环氧丙烷(国药集团化学试剂有限公司),逆转录试剂盒(美国Fermentas公司),荧光定量PCR仪(美国ABI公司)。
二、实验动物与分组
48只SD雄性大鼠,体质量180~230 g,由安徽医科大学动物实验中心提供,随机分为对照(Con)组,缺氧预处理(HPC)组,单纯外伤(TBI)组和缺氧预处理颅脑外伤(HPCT)组,共4组,每组12只,TBI和HPCT组大鼠于伤后24 h处死。
三、动物模型制作和取材
缺氧预处理模型制作:将HPC组和HPCT组大鼠置于密封氧仓内,适应后连接真空泵,匀速减压至-50.47 kPa(设定标准大气压为0 Pa,模拟5 500 m高度),维持该压力恒定训练3 h,然后缓慢恢复正常,出仓。采用同样方法连续训练3 d,其余组不进行此处理。颅脑外伤模型制作经腹腔内注射10%水合氯醛对大鼠进行麻醉,麻醉效果满意后,固定于颅脑外伤打击器,剪毛,消毒,延中线矢状位切开头皮,暴露左顶骨骨膜,剥离骨膜,暴露颅骨,用微型磨钻于前正中线左侧旁开3 mm,前囟门后3 mm处钻一骨窗(直径5 mm),保持硬脑膜完整,将50 g砝码固定于25 cm高处自由落体打击骨窗,打击完毕后,随即做头皮清创缝合术。仅对TBI和HPCT组进行打击。取挫伤区周围新鲜皮质置于-80℃液氮罐中保存留做qRT-PCR和Western blotting检测。
四、实验方法
1.HE染色:造模完成后各组分别取3只大鼠,经麻醉,心脏灌注后,断头取脑,然后经浸蜡包埋等步骤处理后,制备成5 μm石蜡切片,常规行苏木素-伊红(HE)染色,操作严格按照染色方法步骤进行,光镜下观察并摄片。
2.神经元细胞电镜观察:造模完成后各组分别取6只大鼠,经麻醉,心脏灌注后,断头取脑,2.5%戊二醛磷酸盐缓冲液固定,取大小约1 mm3脑组织置于1 ml离心管内,其余标本置于液氮罐中保存,离心(2 000 r/min)10 min,固定于2.5%戊二醛中(4℃) 4~6h,随后固定于1%锇酸1h,30%、50%乙醇脱水各15 min,随后置于70%醋酸铀饱和液中浸泡6~12 h;80%、95%乙醇脱水各15 min,无水乙醇40 min,2次;浓度分别为1:1和1:2的环氧丙烷浸泡1 h和2 h;再浸泡环氧树脂中2 h,用环氧树脂包埋并置于45℃烤箱中12 h,增加烤箱温度至65℃继续烘烤48 h,取出包埋好的组织进行超薄切片(片厚70 nm),将切好的薄片置于醋酸铀饱和水溶液中30 min,进行双蒸水洗15 min/次,3次;枸橼酸铅液中浸泡15 min,取出继续双蒸水洗15 min/次,3次;用JEM-1230型透射电镜摄片观察。
3.qRT-PCR检测TrxR2、CHOP mRNA表达:取挫伤区周围皮层脑组织100 mg,提取总mRNA,紫外分光光度计OD260 nm定量完成后,取8 μl按逆转录试剂盒操作进行逆转录,取2 μl的cDNA产物进行PCR扩增,分别加入10 μl含Taq酶及4种dNTP混合物,0.4 μl TrxR2引物序列上游:5’-GGCTTCCTCACTGGTATTGG-3’下游:5’-AGTTGGTTAGTCGGGAGTTTT-3’(或0.4 μl CHOP引物序列上游:5’-AGCAGAGGTCACAAGCACCT-3’,下游:5’-CTTCTCCTTCATGCGCTGTT-3’);0.4μl β-actin引物序列上游:5’-GGGCTCTCTGCTCCTCCCTGT-3’,下游:5’-ACGGCCAAATCCGTTCACACC-3’,7.2 μl双蒸水共20 μl,充分混匀后置于PCR仪中,先95℃10 min预变性,然后依次经95℃15 s、60℃60 s、72℃60 s,共循环40次,获取TrxR2、CHOP和β-actin的Ct值,以β-actin为内参,算出TrxR2、CHOP mRNA的相对表达量,以2-△△Ct为指标。
4.Western blotting法检测TrxR2、CHOP蛋白表达:取挫伤区周围皮层100 mg,严格按Western blotting实验步骤及抗体说明书进行操作,经离心,留取上清,提取蛋白,SDS-PAGE电泳、转膜,滴加一、二抗免疫反应,化学发光、显影、定影,最后拍照。采用Quantity one4.6.2软件分析各条带积分灰度值,分别与β-actin蛋白产物条带灰度值之比,表示目的蛋白TrxR2、CHOP的相对表达量。
五、统计学分析
采用SPPS19.0软件进行统计处理,TrxR2、 CHOP mRNA和蛋白的表达以均数±标准差(x±s)表示,多组间比较用单因素方差分析检验,两独立样本比较采用t检验,P<0.05为差异有统计学意义。
结果
一、HE染色结果
光镜下观察,Con组与HPC组脑组织无明显改变;HPCT组较TBI组脑组织损伤明显减轻(图1)。
二、神经元细胞电镜下改变
电镜下观察发现Con组:神经元细胞形态、结构正常,细胞膜完整,尼氏体存在,线粒体结构完整、粗面内质网丰富;HPC组:神经元细胞形态、结构与Con组基本相似;TBI组:神经元细胞形态、结构异常,尼氏体消失,细胞膜结构不完整,基质内大量空泡变性,微细结构紊乱,线粒体严重受损、肿胀,粗面内质网受损严重;HPCT组:神经元细胞损伤较TBI组轻,尼氏体可见,细胞轮廓存在,细胞膜基本完整,基质内少量空泡变性,微细结构较完整,线粒体损伤轻、稍肿胀,粗面内质网膜肿胀、扩张(图2)。
三、qRT-PCR检测TrxR2、CHOP mRNA的结果
qRT-PCR结果显示TrxR2、CHOP mRNA表达,Con组与HPC组比较差异无统计学意义(P>0.05);TBI与Con组,HPCT与HPC组比较,TrxR2 mRNA表达显著上调,CHOP mRNA表达明显下调,差异均有统计学意义(P<0.05);其中,HPCT与TBI组比较,TrxR2 mRNA表达显著上调,CHOP mRNA表达明显下调,差异有统计学意义(P<0.05)(表1;图3)。
四、TrxR2、CHOP蛋白的表达变化
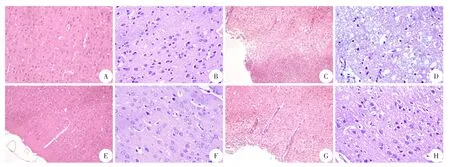
图1 各处理组大鼠HE染色(×400)
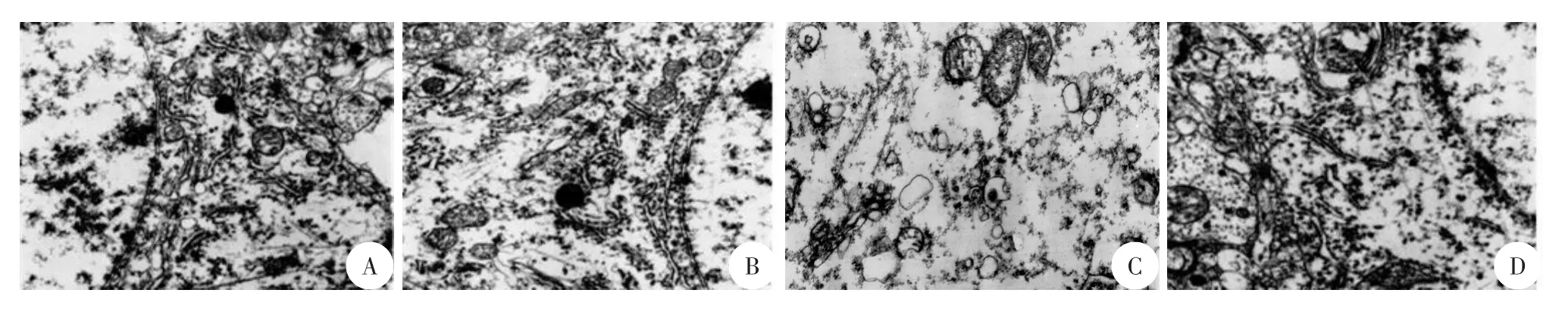
图2 各组大鼠挫伤区周围皮层神经元细胞电镜观察(×1万倍)
TrxR2、CHOP蛋白的表达结果,Con组与HPC组比差异无统计学意义(P>0.05);TBI与Con组,HPCT与HPC组比,差异有统计学意义(P<0.05);HPCT与TBI组比,TrxR2蛋白表达上调,CHOP蛋白表达下调,差异有统计学意义(P<0.05)(图4)。
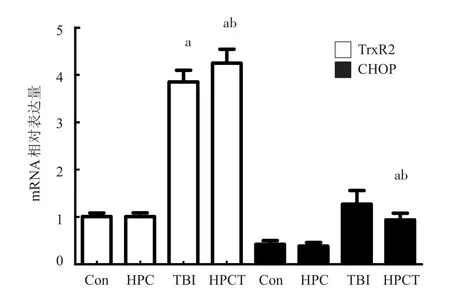
图3 qRT-PCR检测结果
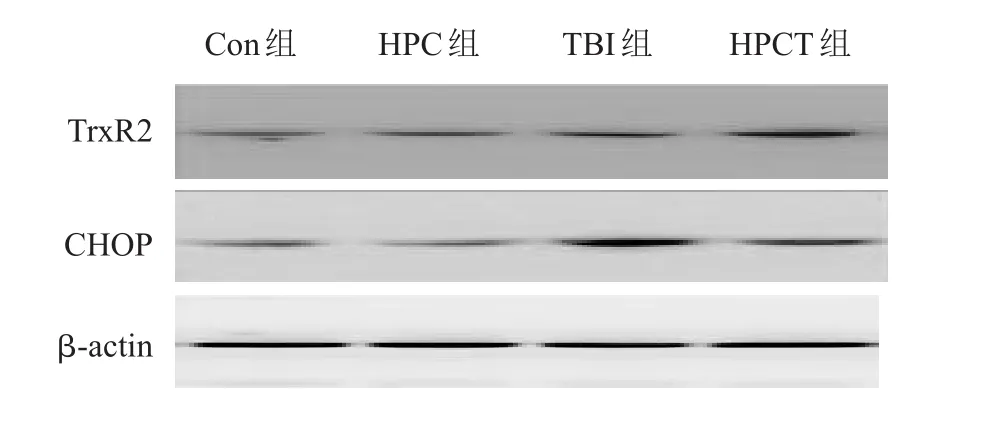
图4 TrxR2、CHOP蛋白电泳条带
讨论
颅脑外伤后脑组织损伤是一个复杂过程,其复杂原因一方面由力生物学作用引起,另一方面则有继发性应激反应引起[1],涉及炎性应激、氧化应激、内质网应激等。外伤后引起的神经元细胞微观结构的改变以及继发的细胞内应激反应,如氧化应激、内质网应激,严重影响细胞力传导、信号传导功能,导致神经元细胞微环境改变[2]。及时寻找一种能有效降低外伤后脑组织直接和间接应激损伤的方法,对于恢复神经元细胞功能具有重要意义。缺氧预处理是指预先予以短暂的(3 h/d)、重复性(连续3 d)的缺氧训练,可显著增强脑组织对随后发生的缺氧、缺血等的耐受力[5]。尽管诸多研究已证实缺氧预处理的神经保护作用,但其对神经元细胞超微结构改变的影响仍需更多证据。
神经元细胞超微结构稳定是维持细胞正常生理功能、信号转导、离子平衡等的重要前提[1]。其中最重要的是线粒体、内质网的稳定。线粒体是细胞氧化呼吸链的场所,TrxR2是线粒体中重要酶类,参与线粒体的氧化应激,提高缺氧等状态下线粒体提供ATP能力[3,6]。内质网是细胞内蛋白质加工、合成、钙离子储存的重要场所,当缺血缺氧、能量匮乏等条件下内质网正常功能被打破,诱发内质网应激(ERS)反应,CHOP是ERS经典标志物之一,在内质网功能严重受损时表达上调[4,7]。
表1 各组大鼠皮层TrxR2、CHOP mRNA和蛋白表达(n=6
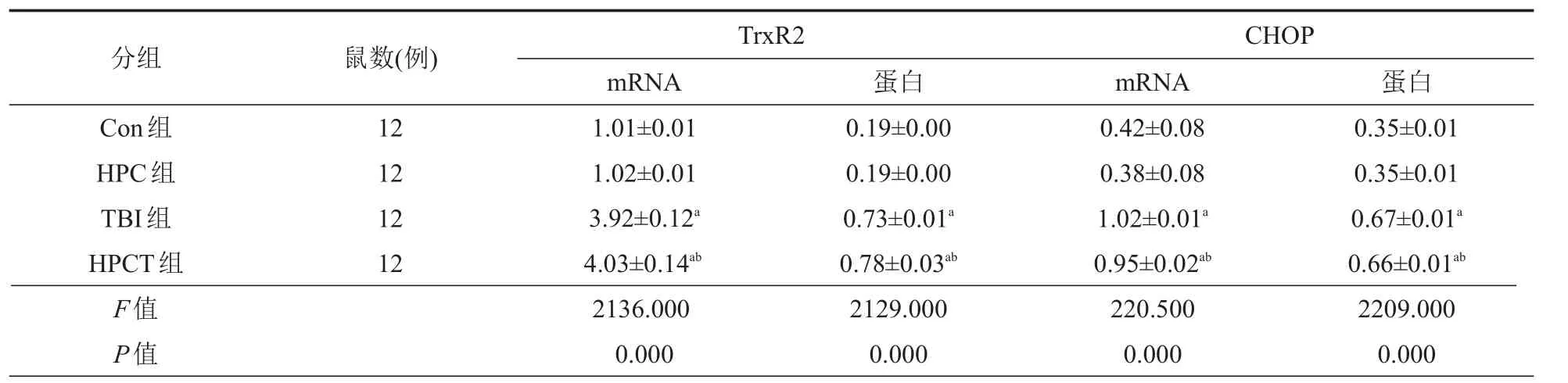
表1 各组大鼠皮层TrxR2、CHOP mRNA和蛋白表达(n=6
注:aP<0.05:TBI与Con组,HPCT与HPC组比较;bP<0.05:与TBI组比较。
分组Con组HPC组TBI组HPCT组F值P值鼠数(例) 12 12 12 12 TrxR2CHOP mRNA 1.01±0.01 1.02±0.01 3.92±0.12a4.03±0.14ab2136.000 0.000蛋白0.19±0.00 0.19±0.00 0.73±0.01a0.78±0.03ab2129.000 0.000 mRNA 0.42±0.08 0.38±0.08 1.02±0.01a0.95±0.02ab220.500 0.000蛋白0.35±0.01 0.35±0.01 0.67±0.01a0.66±0.01ab2209.000 0.000
本实验结果显示:通过HE染色和电镜观察发现,HPC与Con组脑组织形态结构均无异常。TBI组与HPCT组,光镜下脑组织形态结构紊乱,大量炎性细胞浸润;电镜下神经元细胞微细结构紊乱,线粒体、内质网等细胞器受损严重;然而,HPCT组与TBI组比较,脑组织受损较轻,神经元细胞超微结构具有较好的完整性。这与Liu等[8]缺氧预处理可保护神经细胞微观结构相一致。伤后24 h挫伤区周围皮层TrxR2、CHOP mRNA和蛋白表达,Con与HPC组无明显差异,HPCT组较TBI组TrxR2 mRNA和蛋白表达显著上调,CHOP mRNA和蛋白表达明显下调,提示缺氧预处理可显著诱导颅脑外伤大鼠TrxR2 mRNA和蛋白的表达,增强线粒体抗氧化应激能力,降低线粒体损伤;同时,下调CHOP mRNA和蛋白的表达,降低内质网应激性损伤。提示缺氧预处理可显著增强外伤后神经元细胞的神经保护作用,这与Galle等[9]的实验研究,缺氧预处理对缺氧缺血性脑损伤具有神经保护作用一致。然而,Liamina等[10]还提出,机体对缺氧、缺血的适应若更好的服务于临床,须提供更多有关细胞内部耐受机制的证据。
综上所述,缺氧预处理可显著减轻颅脑外伤大鼠病理损伤,较好的保持线粒体、内质网细胞器超微结构的完整性,这可能与上调TrxR2,同时下调CHOP的表达密切相关,降低线粒体、内质网细胞器损伤,促进神经元细胞功能恢复。然而对于功能较难恢复的细胞,最终将走向凋亡或死亡。缺氧预处理对这部分细胞的作用如何,也将在后期实验中进一步探讨。
[1]Hemphill MA,Dauth S,Yu CJ,et al.Traumatic Brain Injury and the Neuronal Microenvironment:A Potential Role for Neuropathological Mechanotransduction[J].Neuron,2015,85 (6):1177-1192.
[2]Yokobori S,Mazzeo AT,Hosein K,et al.Preconditioning for traumatic brain injury[J].Transl Stroke Res,2013,4(1):25-39.
[3]疏龙飞,刘家传,王金标,等.硫氧还蛋白还原酶TrxR2在颅脑损伤大鼠皮质的表达变化[J].中国微侵袭神经外科杂志, 2014,19(11):517-519.
[4]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death and Differentiation,2004,11:381-389.
[5]武孝刚,刘家传,杨艳艳,等.缺氧预处理对创伤性脑损伤大鼠缺氧诱导因子-1α、葡萄糖转运体3型及神经元核蛋白表达的影响[J].中华神经创伤外科电子杂志,2015,4(1):11-15.
[6]Meyer Y,Buchanan BB,Vignols F,et al.Thioredoxins and glutare-doxins:unifying elements in redox biology[J].Annual Review of Genetics,2009,43:335-367.
[7]Seiji Tajiria,Shigetoshi Yano,Motohiro Morioka,et al.CHOP is involved in neuronal apoptosis induced by neurotrophic factor deprivation[J].FEBS Letters,2006,580:3462-3468.
[8]Liu Y,Sun Z,Sun S,et al.Effects of hypoxic preconditioning on synaptic ultrastructure in mice[J].Synapse,2015,69(1): 7-14.
[9]Galle A,N.M.Jones.The neuroprotective actions of hypoxic preconditioning and postconditioning in a neonatal rat model of hypoxic-ischemic brain injury[J].brain Res,2013,1498:1-8.
[10]Liamina NP,Karpova ES,Kotel'nikova EV,et al.Adaptation to hypoxia and ischemic preconditioning:from basic research to clinical practice[J].Klin Med,2014,92(2):23-29.
Effects of hypoxic preconditioning on cortical expression of TrxR2 and CHOP of rats with craniocerebral injury and ultramicrostructural changes of neurons
Liu Guangjie, Liu Jiachuan,Wang Jinbiao,Yang Yanyan,Zhang Xing,Wang Chunlin,Tang Hong,Xu shen.
Department of Neurosurgery,the No.105 Hospital of PLA,Hefei 230031,China
Liu Jiachuan,Email:ljc571017@sina.com
ObjectiveTo investigate the effects of hypoxic preconditioning on the expression of TrxR2、CHOP and the ultra-structure of the neuronal cells of rats suffered traumatic brain injury.MethodsForty eight Sprague Dawley rats were randomly divided into control group(Con),hypoxic preconditioning group(HPC),traumatic brain injury group(TBI)and hypoxic preconditioning traumatic brain injury group(HPCT).The traumatic brain injury model of rats were made by the Feeney’s improved equipment and hypoxic preconditioning model were made by Hypobaric chamber for successive 3 days(-50 kPa、3 h/d).Staining HE and making ultra-thin slicing by fresh specimen to observe the potential change of general structure and ultra-structure of rats’brain tissue of each group respectively under light microscope and electron microscope.Expressions of TrxR2、CHOP mRNA and proteins were detected in the brain cortex around the contusion area by qRT-PCR and Western blotting.ResultsThe pathologic change has no difference between Con gourp and HPC group.HPCT group has a lighter pathologic change than the TBI group.The expressions of TrxR2 mRNA and protein was significantly higher in the brain cortex in the HPCT group than the TBI group,the difference between the two group was significant(P<0.05),the expressions of CHOP mRNA and protein was significantlylower in the brain cortex in the HPCT group than the TBI group,the difference between the two group was significant(P<0.05),while the difference between the Con group and the HPC group was not significant(P>0.05).ConclusionHypoxia preconditioning can obviously reduce the craniocerebral trauma rats cortex neuron cell morphology change,which has a close relationship with the upregulated expression of TrxR2 and the downregulated expression of CHOP,in order to protection of neurons.
Traumatic brain injury;Hypoxic preconditioning;TrxR2;CHOP; Ultra-structure
2015-04-25)
(本文编辑:杨艺)
10.3877/cma.j.issn.2095-9141.2015.03.010
全军医学科技“十二五”科研面上项目(编号:CWS11J262);2009年度南京军区医学科技创新重点课题(编号:09Z009)
230031合肥,解放军第105医院神经外科
刘家传,Email:ljc571017@sina.com
刘光杰,刘家传,王金标,等.缺氧预处理对颅脑外伤大鼠皮层TrxR2、CHOP表达及神经元细胞超微结构改变的影响[J/CD].中华神经创伤外科电子杂志,2015,1(3):164-168.

