产气荚膜梭菌β毒素单克隆抗体的研制
刘萌萌,樊 金,刘雪慧,秦贵平,张慧蓉,柴同杰
(山东农业大学动物科技与动物医学院,山东泰安271000)
产气荚膜梭菌(Clostridium perfringens,CP)又名魏氏梭菌,是革兰阳性产芽胞杆菌[1],在自然界分布广泛,可见于土壤、污水、饲料、食物、粪便以及人畜肠道中,是重要的人兽共患传染病病原[2]。本菌能产生多种外毒素,根据其主要致病外毒素α、β、ε及ι[3]可分为A、B、C、D、E 5种菌型[4]。产气荚膜梭菌β毒素是由产气荚膜梭菌B 型和C 型菌株产生的坏死、致死性毒素,具有强烈的细胞毒性、致死性和神经毒性[5],可 引 起 人 和 动 物 坏 死 性 肠 炎[6-7],具体表现为肠黏膜有出血性坏死,肠壁变薄,容易引起穿孔和破裂[8-10],还能诱发多种神经系统反应,对人体健康和畜牧业的发展产生严重影响。此类病发病急、病死率高,给各国畜牧业带来巨大经济损失[11-13]。因此,有效的检测出毒素类型并进行针对性的治疗极其重要。单克隆抗体具有质地均一、纯度高、特异性强、效价高等优点,故其可作为标准试剂用于疾病的诊断,同时也可用于疾病的治疗[14-15]。本试验拟建立分泌抗产气荚膜梭菌β毒素单克隆抗体杂交瘤细胞株,并鉴定其部分特性,为建立快速有效的临床检测奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物及其他材料 C 型产气荚膜梭菌(NCTC3180)由德国柏林大学提供,山东农业大学环境微生物实验室保存。6周龄~8周龄Balb/c雌性小鼠购于山东大学实验动物中心。pET-28a载体、重组大肠埃希菌BL21(DE3)-β、纯化的重组β毒素蛋白、天然粗提β毒素、骨髓瘤SP2/0 细胞等均由本实验室保存。
1.1.2 主要试剂 High Affinity Ni-changed Resin购于南京金斯瑞生物科技有限公司;羊抗鼠IgGHRP 购自南京生兴生物技术有限公司;RPMI-1640、HAT 选择培养基、NCTC生长因子、HT 培养基购自Gibco公司;胎牛血清购于杭州四季青生物制品公司;融合剂PEG1500购自德国Roche公司;卡那霉素、弗氏完全佐剂与弗氏不完全佐剂、单克隆抗体亚型鉴定试剂盒均购自美国Sigma公司;豆粉琼脂购自北京九州天瑞科技有限公司;ELISA Kit(Clostridium perfringens)购自Bio-X 公司;其他所用化学试剂均为分析纯。
1.2 方法
1.2.1 Balb/c小鼠的免疫 免疫方案:一免用山东农业大学环境微生物实验室制备的重组β毒素与等体积弗氏完全佐剂乳化后,腹腔注射100μg/只;二免、三免分别于首免后2周和5周将重组β毒素蛋白与等体积弗氏不完全佐剂乳化后,腹腔注射100μg/只;三免后3周腹腔注射不加佐剂的重组β毒素蛋白50μg/只~100μg/只。用间接ELISA 方法检测免疫小鼠血清的抗体效价,选取免疫效价检测值最高的小鼠的脾脏用于细胞融合。
1.2.2 杂交瘤细胞株的建立
1.2.2.1 骨髓瘤细胞(SP2/0)和脾细胞的准备于融合前两周复苏SP2/0,置于体积分数为5%CO2培养箱中37℃恒温传代培养。培养过程在培养液中加入8-氮鸟嘌吟,连续处理3次,使SP2/0细胞对HAT 培养液更加敏感。融合前1天传代1次,使融合当天的骨髓瘤细胞处于对数生长期。取免疫效价检测值最高的小鼠,无菌摘取脾脏,收集脾细胞悬液,脾细胞计数后备用。
1.2.2.2 饲养细胞的准备 细胞融合当天,取8周龄~10周龄健康Balb/c小鼠腹腔巨噬细胞作为饲养细胞,调整细胞浓度至1×105个/mL~5×105个/mL,按100μL/孔转入到96孔细胞培养板中。
1.2.2.3 细胞的融合 将SP2/0细胞和免疫脾细胞悬液混匀,使用PEG1500进行化学法融合细胞,然后转入96孔细胞培养板中,置体积分数为5%的CO2培养箱中37℃恒温培养。
1.2.2.4 杂交瘤细胞的筛选 融合后注意观察杂交瘤细胞生长状况,待细胞长到孔底的1/4~1/3时吸出上清进行间接ELISA 检测。以P/N≥2.5作为阳性判断标准,用未免疫小鼠血清作阴性对照,用抗体稀释液做空白对照。对检测为阳性的细胞进行扩大培养,同时进行克隆化培养。
1.2.2.5 杂交瘤细胞的克隆化培养 克隆化培养采用有限稀释法,待细胞长到孔底的1/4~1/3时,对细胞上清进行间接ELISA 检测。选择克隆数少、OD450nm 值高的阳性孔,将其再次克隆。经3 次~4次克隆操作,至所有克隆化细胞孔检测阳性率达100%时,即可确定获得分泌特异性单抗的杂交瘤细胞株,及时扩大培养并冻存。
1.2.2.6 杂交瘤细胞的扩大培养及冻存 单克隆细胞株经过几次克隆后,阳性率达到100%。将细胞从96孔培养板转入24孔培养板中,再由24孔板转入细胞培养瓶进行扩大培养。扩大培养后,部分进行小鼠的腹腔注射,体内生产腹水。另一部分可采用液氮冻存。
1.2.2.7 杂交瘤细胞株分泌单克隆抗体稳定性测定 将阳性杂交瘤细胞株连续培养两个月后,用已经建立的间接ELISA 方法检测细胞培养上清的抗体效价。
1.2.3 单克隆抗体亚类鉴定 细胞培养上清中的单克隆抗体亚类通过试剂盒进行鉴定,按照试剂盒说明操作。
1.2.4 单克隆抗体腹水制备 取状态良好的6周龄~8周龄Balb/c雌性小鼠,腹腔注射500μL弗氏不完全佐剂,7d后取生长旺盛的阳性杂交瘤细胞,腹腔注射0.5×106个/只~1×106个/只,注入细胞1周后,每天观察小鼠腹部,待小鼠腹部明显膨大时收集腹水,1 200r/min离心10min,收集上清置-80℃保存备用。
1.2.5 单克隆抗体的纯化 采用正辛酸-硫酸铵的方法纯化腹水[14],具体纯化过程如下:将制备的腹水1 000r/min离心15min后用0.45μm 滤器过滤,将滤液加入100mL烧杯中,用磁转子边搅拌边将4倍体积60mmol/L(pH4.5)的醋酸缓冲液慢慢加入;缓慢滴入正辛酸使其终浓度为33μL/mL,室温搅拌30min;8 000r/min离心30min后,收集上清;滤纸过滤,调pH 至7.4;边搅拌滤液边加入饱和(NH4)2SO4,待滤液呈现白色浑浊后,继续搅拌10min;于4℃静置5h后,4℃离心30min,弃上清;用10mmol Tris-HCl(pH9.0)重悬沉淀,装入处理好的透析袋后放入100 倍体积的10 mmol Tris-HCl(pH9.0)中,磁力搅拌透析36h(4℃),期间每12h换液1次;最后3 000r/min离心15min,上清便是纯化的单克隆抗体。取上清作SDS-PAGE 试验,分析单抗大小及纯化效果。
1.2.6 单克隆抗体的特性鉴定
1.2.6.1 腹水中单克隆抗体效价的测定 用重组β蛋白包被酶标板,采用间接ELISA 操作方法检测制备的单克隆抗体的效价,其中二抗为HRP 标记的羊抗鼠IgG。
1.2.6.2 单克隆抗体特异性鉴定 将重组β毒素蛋白、本实验室保存的粗提天然β毒素、重组α毒素蛋白和重组ε毒素蛋白分别包被96孔酶标板,用制备的各株单克隆抗体分别进行间接ELISA 方法的检测,鉴定各株单克隆抗体的特异性。
1.2.6.3 单克隆抗体反应原性测定 用Western blot分析各株单克隆抗体分别与重组β毒素蛋白的反应性。
2 结果
2.1 免疫小鼠抗体效价检测结果
前3次免疫后,用间接ELISA 方法检测小鼠血清抗β毒素的效价结果均在1∶25 600以上,在此条件下进行加强免疫后,挑选效价最高的小鼠于4d后摘除脾脏进行细胞融合。
2.2 融合细胞的筛选及克隆
细胞融合后,选择阳性孔OD 值高的,细胞集落数目较少,细胞生长状态良好的孔进行克隆,经过3次克隆,得到3株能稳定分泌β毒素单克隆抗体的杂交瘤细胞,分别命名为1E6E11C7、2C8A5E8、1E3G10G9D9。
2.3 杂交瘤细胞株的建立
经多次传代培养,杂交瘤细胞生长旺盛,形态良好(图1)。

图1 杂交瘤细胞的生长状态Fig.1 Growth state of the hybridoma
2.4 杂交瘤细胞株分泌单克隆抗体稳定性测定
将阳性杂交瘤细胞株连续培养3个月后,用已经建立的间接ELISA 方法检测一次各株细胞培养上清的抗体效价结果均为1∶25 600。说明经过多次传代后,各株杂交瘤细胞仍具有稳定的分泌能力。
2.5 单克隆抗体亚类鉴定
利用单克隆抗体亚类鉴定试剂盒检测结果见表1,可 知 单 抗1E6E11C7、2C8A5E8 为IgG1 型,1E3G10G9D9为IgG2a型。

表1 单克隆抗体亚类鉴定结果Table 1 Results of isotype identification of monoclonal antibodies
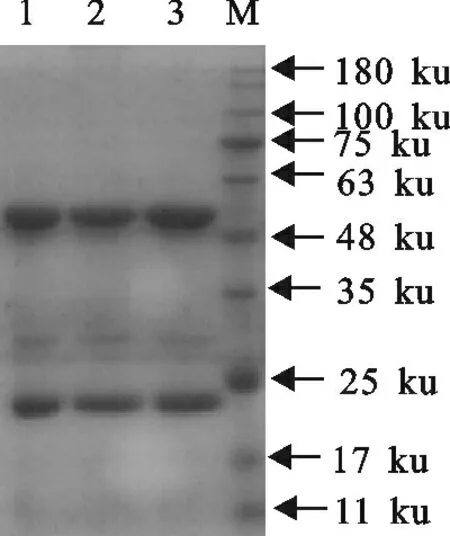
图2 腹水的SDS-PAGE分析Fig.2 SDS-PAGE analysis of ascitic fluids
2.6 单克隆抗体的纯化
腹水经正辛酸-硫酸铵法纯化后,经120g/L 的SDS-PAGE凝胶电泳试验分析,可见两条明显的蛋白条带,即53ku左右的重链和23ku左右的轻链,且无其他杂带,表明纯化效果好、纯度较高(图2)。
2.7 单克隆抗体的特性鉴定
2.7.1 腹水中单克隆抗体效价的测定 用间接ELISA 方法检测腹水中单克隆抗体效价,用重组的β毒素作为抗原包被酶标板,用HRP标记的羊抗鼠抗体作为二抗(表2)。
2.7.2 单克隆抗体特异性鉴定 用间接ELISA 方法分别检测各株单抗与重组β毒素蛋白、粗提天然β毒素、重组α毒素蛋白和重组ε毒素蛋白反应情况结果显示,各株单抗均能与重组β毒素蛋白、天然β毒素反应且有较高效价,而不与重组α毒素蛋白和重组ε毒素蛋白反应(表3)。
表2 腹水中单克隆抗体效价检测结果Table 2 The detection results of monoclonal antibody titers in ascites

表3 3株单克隆抗体特异性检测结果Table 3 3strains of monoclonal antibody specificity test results
2.7.3 Western blot试验结果 用Western blot方法分别检测了各株单克隆抗体与重组β毒素反应性,试验结果显示(图3),NC 膜上的条带出现在38 ku处,与重组β毒素大小一致,这表明,试验制得的单克隆抗体能特异性识别并结合重组β毒素。
3 讨论
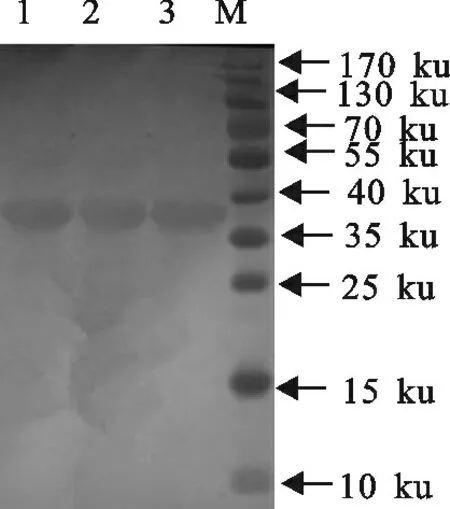
图3 单克隆抗体的Western blot分析Fig.3 Western blot analysis of monoclonal antibody
单克隆抗体对操作技术的要求比较苛刻,因此在制备过程中每一步都要严格认真,只有每个细节都没有失误才能保证成功。在选择抗原方面,要尽量选择纯度高、抗原性强的抗原来免疫动物,本研究经原核表达的β毒素完全符合此要求,用其免疫动物,后期试验才得以顺利进行。在制备过程中,为了防止细胞被污染,对于所有细胞进行培养的过程中一定要做到严格无菌操作,细胞间使用前一定要进行紫外灭菌,所需试验材料要提前进行高温消毒杀菌。在用超净工作台进行操作前一定要对工作者进行消毒。
本试验制备了3 株能稳定分泌产气荚膜梭菌β毒素单克隆抗体的杂交瘤细胞。经鉴定,单抗1E6、2C8为IgG1型,1E3为IgG2a型。对单抗进行亚类的鉴定是很重要的一步,就目前来说一般的制备技术制出的单抗大部分是IgG 类或IgM 类。IgG 类稳定性较高,效价一般不会下降,而IgM 类的抗体本身就不太稳定,效价随时间推移可能出现降低,因此研究中一般不用IgM 类抗体做功能学试验,只能简单做细胞的表形分析,因此关于单抗的制备,要尽量制得IgG亚类单抗。
单克隆抗体在畜牧领域的应用越来越广泛,而其纯度与活性是影响其质量的关键因素。当前实验室常用的小鼠IgG1、IgG2a、IgG2b类单克隆抗体纯化方法中,常用沉淀法和层析法[16]。本研究采用正辛酸-硫酸铵沉淀法进行腹水的纯化,试验证明此方法纯化效果良好。与层析法相比正辛酸-硫酸铵沉淀法操作简便,抗体回收率高,抗体活性高,生产成本较低。利用此方法纯化单克隆抗体,有一定的应用价值。
[1] Carman R J,Sayeed S,Li J,et al.Clostridium perfringens toxin genotypes in the feces of health North American[J].Anaerobe,2008,14(2):102-108.
[2] 李 璐,赵宝华.产气荚膜梭菌主要致死性毒素的研究进展[J].畜牧与饲料科学,2011,32(4):94-97.
[3] Garcia J P,Beingesser J,Fisher D J,et al.The effect of Clostridium perfringens type C strain CN3685and its isogenic beta toxin null mutant in goats[J].Vet Microbiol,2012,157:412-419.
[4] 王玉炯.产气荚膜梭菌β毒素研究进展[J].宁夏农学院学报,1999,3(20):74-78.
[5] Gurjar A,Li J,McClane B A.Characterization of toxin plasmind in Clostridium perfringens type C isolates[J].Immunity,2010,7(78):4860-4869.
[6] Rood J I,Cole S T.Moleclar genetics and pathogenesis of Clostridium perfringens[J].Microbiol Mol Biol Rev,1991,55:621-648.
[7] 柴同杰,马瑞华,常维山,等.产气荚膜梭状芽胞杆菌病的流行与致病机制[J].中国预防兽医学报,2001(1):71-73.
[8] Ahmed F E.Detection of genetically modified organisms in foods[J].Trend Biotechnol,2002,20(5):215-223.
[9] 柴同杰,刘文波.产气荚膜梭菌类毒素疫苗研制及其免疫家兔抗体消长规律[J].中国预防兽医学报,2006,28(1):101-104.
[10] Coursodon C F,Trinh H T,Mallozzi M.Clostridium perfringens alpha toxin is produced in the intestines of broiler chicks inoculated with an alpha toxin mutant[J].Anaerobe,2010,16(6):614-617.
[11] Bacciarini L N,Boerlin P,Straub R,et al.Immuno-histochemical localization of Clostridium perfringens β2-toxinin the gastrointestinal tract of horses[J].Vet Pathol,2003,40(4):376-381.
[12] Gharaibeh S,Rifai R,Majali A.Molecular typing and antimicrobial susceptibility of Clostridium perfringens from broiler chickens[J].Anaerobe,2010,16(6):586-589.
[13] Jolivet-Reynaud C.Entero pathogenicity of Clostridium perfringensβ-toxin and other clostridial toxins[J].Zentralbl Bacteriol Microbiol Hyg Abt,1986,15:145-151.
[14] 孙佳芝,王新桐,刘雪慧,等.产气荚膜梭菌α毒素双抗体夹心ELISA 检测方法的建立及初步应用[J].中国兽医学报,2014,34(6):930-941.
[15] Amimoto K,Noro T.A novel toxin homologous to large clostridial cytotoxins found in culture supernatant of Clostridium perfringens type C[J].Microbiology,2007,153:1198-1206.
[16] 肖增鸿,黄昭亮,林月霞,等.腹水型单克隆抗体纯化方法的研究[J].中国医药生物技术,2013,8(6):425-428.

