去卵巢致大鼠腰椎间盘退变模型初探*
冯帅华 吴官保 杨届 尹青 李勇敏 武海兵 刘泽庚
椎间盘退变引起的腰椎间盘突出、腰椎失稳、滑脱等均是临床上的常见病。国内外关于椎间盘退变的病因和发病机制尚无定论,构建能模拟人椎间盘退变的动物模型是研究的关键,既往多采用直接或间接对椎间盘进行损坏制作腰椎间盘退变模型,本研究改变既往造模方法,采用去卵巢方法,试图建立女性绝经后腰椎间盘退变的动物模型。
1 材料与方法
1.1 实验动物 SPF级8个月龄健康雌性SD大鼠(购于湖南斯莱克景达实验动物有限公司)30只,体重350~400 g。
1.2 实验方法
1.2.1 试验分组及动物模型的建立 30只大鼠按照随机数字表法分为三组:空白组(A组)、假手术组(B组)、模型组(C组),每组各10只。采用摘卵巢手术制造去势大鼠模型方法:C组用氯胺酮(50 mg/kg)行腹腔注射麻醉,在无菌条件下从距离大鼠第一胸腰椎外侧1 cm处纵向切开皮肤及两侧肌肉,摘除双侧卵巢[1],B组则切除等同于卵巢体积大小的脂肪,止血后分两层缝合,术后连续3 d大腿肌肉注射青霉素,每只大鼠10万U单位/d,A组不做任何处理。
1.2.2 模型成功的判断依据 阴道细胞涂片:术后24 h开始行阴道细胞涂片,连续5 d。用小滴管吸生理盐水少许,滴于大鼠阴道口内,吸出少量阴道分泌物,涂于载玻片上,立即置于95%的乙醇中固定30 min后取出晾干,做苏木精-伊红染色,光镜下观察。去卵巢后大鼠表现为动情间期,无或者有少量角化上皮细胞,表示去势成功。
1.2.3 观察指标与检测 第13周后处死所有大鼠,取出大鼠腰椎部分,剔除椎体周围软组织,经L5/6、L6/S1椎间隙取出椎间盘组织。L5/6椎间盘组织放入4%多聚甲醛溶液中固定,石蜡包埋切片,常规HE染色,显微镜下对其椎间盘组织进行观察,利用Wang等制定的椎间盘组织学评分系统对大鼠椎间盘髓核、纤维环及骨赘的形态学退变程度进行评分,根据退变程度的加剧其得分增加(髓核0~3分,纤维环0~2分,骨赘0~2分),一个椎间盘的得分为这3项得分的总和。同时每个标本随机1个400倍高倍标准视野,进行脊索细胞计数。将所取L6/S1椎间盘组织立即放入2.5%戊二醛溶液中固定24 h;2%的锇酸固定2 h,0.1M二甲砷酸钠冲洗3次,间隔2 h进行一次后过夜;0.1M二甲砷酸钠冲洗2次,间隔2 h进行一次;乙醇梯度脱水,环氧树脂-环氧丙烷混合液浸泡24 h,Epon 812包埋;切片、染色,LKB-Ⅲ超薄切片机进行超薄切片,厚度约500埃,醋酸铀、硝酸铅双重染色,透射电子显微镜观察、摄片:各标本在不同视野和放大倍数下进行观察椎间盘髓细胞数目和体积、胞浆内容物(细胞核、线粒体、内质网等)形态改变情况,并摄片,用MICROTEK3600 扫描仪扫描负片,图像输入计算机。
1.3 统计学处理 所有数据采用SPSS 17.0统计学软件进行处理,计量资料以(x-±s)表示,组间比较若方差齐时选择LSD法,方差不齐时选择Dunnett T3法进行方差分析和两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 光镜下椎间盘组织形态学表现及退变程度评分 空白组和假手术组腰椎间盘纤维环与髓核排列基本规则,软骨细胞单层排列与纤维胶原层交替分层,髓核中脊索细胞相对其他组丰富(见图1、2);模型组腰椎间盘纤维环胶原纤维层和软骨细胞多分布不规则,胶原纤维减少或有裂隙,软骨细胞增多,逐渐取代纤维成分或基本为软骨成分,髓核成分减少或消失,可见骨化,皱缩,脊索细胞明显减少或消失(见图3);喂养第13周后的退变程度评分比较:空白组(1.90±0.99)分,假手术组(2.10±1.10)分,模型组(5.00±1.10)分。假手术组与空白组比较差异无统计学意义(P=0.691);模型组与空白组比较差异有统计学意义(P=0.000)。
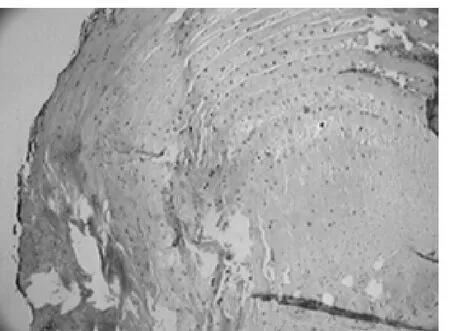
图1 空白组(HE染色×40)

图2 假手术组(HE染色×40)

图3 模型组(HE染色×40)
2.2 400倍光镜下脊索细胞计数 治疗第13周时随机1个400倍高倍标准视野下脊索细胞数量:空白组(16.80±4.04)个,假手术组(16.20±4.13)个,模型组(10.30±4.06)个。模型组脊索细胞计数较空白组及假手术组明显减少,差异有统计学意义(P<0.05);空白组与假手术组比较差异无统计学意义(P=0.720),表明去卵巢后加速了大鼠椎间盘内脊索细胞的消失,加速了椎间盘的退变。见图4、5。

图4 脊索细胞数量较少(HE染色×400)
2.3 髓核细胞超微结构观察 空白组和假手术组类软骨细胞少,细胞稍有退变,细胞核呈卵圆形或圆形,核膜完整、光滑,异染色质比较丰富,细胞质内粗面内质网比较丰富并且有小的线粒体,散在分布糖原颗粒及少量的脂肪滴,细胞外常见细突起,其外有基质包围,未有明显的巢样结构(见图6、7);模型组类软骨细胞更少见,退变程度明显加重,和空白组比较差异较为显著,周围有大量细胞周间质,形成鲜明的巢样结构。细胞内溶酶体明显增多,胞核扭曲变形,常染色质凝集成块,分布于核膜下或散在分布,胞浆基质密度加深、线粒体空泡化加重,整个细胞体积明显缩小,凋亡细胞核固缩成团或碎裂成多块,散在于胞质中,胞质模糊不清,在致密的无定形基质中见一些粗颗粒状物或空泡,胞膜缺如(见图8)。

图5 脊索细胞较多(HE染色×400)

图6 空白组(×4.0K)

图7 假手术组(×4.0K)

图8 模型组(×4.0K)
3 讨论
椎间盘由软骨、外层的纤维环和内部凝胶样的髓核构成,椎间盘细胞由髓核细胞及纤维环细胞组成,脊索细胞存在于椎间盘髓核组织内,起源于内胚层。相关研究表明脊索细胞随着人类年龄增长其数量会逐渐较少甚至消失,并逐步被软骨细胞代替[2-3]。Wang等[4-5]发现髓核内脊索细胞凋亡是椎间盘退变的起始点,是退变的主要病理基础。从Guehring等[6]认为,随年龄的增长,脊索细胞的消失甚至被取代可能原因是椎间盘失去血运所致。吴靖平等[7]发现增龄和应力都能加速大鼠脊索细胞减少,从而加速椎间盘退变,其变化规律与人类一致。椎间盘纤维环破裂、髓核突出的组织病理学基础是髓核细胞数量的减少以及其生理活性下降[8]。
椎间盘退变会导致一系列的脊柱类疾病,而其原因现未完全明确,从现有研究来看是多种因素作用的结果[9]。椎间盘退变始于髓核内部细胞的凋亡和基质的重建。外层纤维环随退变的发展改变了它正常的板层排列结构,降低了椎间盘承重的机械强度,随退变程度增加,内层纤维环出现放射状裂隙,并向外层延伸,致椎间盘完整性的丧失,并逐随之出现有椎间盘退变引起的腰椎间盘突出症、腰椎椎体不稳、腰椎侧弯、腰椎旋转畸形等疾病。椎间盘退变机制主要包括:家族遗传,椎间盘营养供应减少,细胞凋亡失衡,基质酶活性改变,生物力学机制的改变,细胞因子的作用及自身免疫反应等[10-11]。
目前常用于研究椎间盘退行性疾病的模型可分为体内、体外模型,体内椎间盘退变模型可分为诱发性和自发性两种,体外椎间盘退变模型可分为细胞培养模型和椎间盘组织培养模型[12]。诱发性椎间盘退变模型主要包括脊柱应力改变、破坏脊柱结构致脊柱失稳、直接破坏椎间盘组织等方法,其中手术损伤椎间盘突出模型也是目前在研究椎间盘退行性变疾病中常用的方法[13]。但目前尚无公认的能够完全模拟人类椎间盘退变的标准模型[14],因此临床实验研究中,应充分考虑各模型的适用性及局限性,以便选择合适的动物模型,为了能更好地为人类椎间盘退变研究提供支持,椎间盘退变动物模型的研究仍任重道远。
刘清华[15]研究发现,卵巢切除去势方法建立骨质疏松大动物模型可引起椎间盘退变。临床工作中发现绝经后妇女出现腰椎退行性疾病的不在少数,绝经这一因素是否加速了人类椎间盘退变目前尚无明确定论。本实验采用爬行类动物大鼠作为研究对象,此类动物在一定程度上减少了生物力学对椎间盘退变的影响,普通大鼠的平均寿命在2.0~3.5年,性成熟年龄在2~8个月之间,实验中选择8个月龄性成熟大鼠,再行造模手术,使去卵巢这一因素是否参与了椎间盘退变更具有可信度。
统计学结果显示,大鼠去卵巢后第13周腰椎间盘组织形态退变严重、脊索细胞数量减少,其退变评分和脊索细胞计数和空白组及假手术组比较差异有统计学意义(P<0.05),同时模型组髓核细胞超微结构退变较空白组及假手术组更为明显。
综上所述,去卵巢这一因素加速了大鼠椎间盘的退变,性成熟雌性大鼠通过去卵巢这一方法能初步建立腰椎间盘退变模型,这种模型模仿现实中绝经妇女椎间盘退变模型,为临床进一步研究如何防止绝经后妇女腰椎间盘退变提供初步动物模型。
[1]王烨明,陈统一,施德源.骨质疏松症动物模型的实验研究及意义[J].中华临床医学实践杂志,2002,1(1):1-4.
[2] Guehring T,Nerlich A ,Kroeber M, et al.Sensitivity of notochordal disc cells to mechanical loading:an experimental animal study[J].Eur Spine,2010,19(1):113-121.
[3] Mc Cann M R ,Bacher C A,Seguin C A.Exploiting notochord cells for stem cellbased regeneration of the intervertebral disc[J].Cell Commun Signal,2011,5(1):429-431.
[4] Wang W L,Abranson J H,Ganguly A,et al.The srugical pathology of notochordal remnants in adult intervertebral discs:a rport of 3 cases[J].Am J Surg Pathol,2008,32(8):1123-1129.
[5] Le Maitre C L,Freemont A J,Hoyland J A.Accelerated cellular senescence in degenerate intervertebral discs:a possible role in the pathogenesis of intervertebral disc degeneration [J].Arthritis Res Ther,2007,9(3):45.
[6] Guehring T,Wilde G ,Sumner M,et al.Notochordal intervertebral disc cells:sensitivity to nutrient deprivation [J].Arthritis Rheum,2009,60(4):1026-1034.
[7]吴靖平,陈统一,陈中伟.增龄和应力对大鼠髓核退变影响的超微结构观察[J].上海实验动物科学,2003,23(4):197-199.
[8] Fassett D R, Kurd M F,Vaccaro A R.Biologic solutions for degenerative disk disease[J].Spinal Disord Tech,2009,22(4):297-308.
[9]龙涛,李开南.白细胞介素8,血管内皮生长因子在椎间盘退变中作用的研究进展[J].中国医学创新,2013,10(23):153-156.
[10]石继祥,施杞,王拥军.椎间盘退变机制国内外研究进展[J].中国中医骨伤科杂志,2004,12(4):56-60.
[11]彭俊,徐建广.椎间退变与修复动物的体内模型和体外模型[J].中国组织工程研究与临床康复,2010,14(11):2035-2038.
[12]王凯,鲁厚根.椎间盘退变模型的研究进展[J].医学综述,2013,1(19):117-119.
[13]黄振超,夏建龙,陈刚,等.椎间盘退变模型技术进展[J].现代仪器与医疗,2014,20(3):9.
[14]朱洪勋,韩成龙.椎间盘退变机制及动物模型建立的研究进展[J].中国矫形外科杂志,2011,19(5):389-391.
[15]刘青华.去势山羊骨质疏松与椎间盘退变的相关性研究[D].广州:南方医科大学,2014.

