肿瘤-肾脏病学:肾脏病学的新领域
张 威 综述 袁伟杰 审校
·医学继续教育·
肿瘤-肾脏病学:肾脏病学的新领域
张 威 综述 袁伟杰 审校
恶性肿瘤可导致慢性肾脏病(CKD)的发生,此外,化疗药物的使用也可能对肾功能造成不良影响。因此,近年来出现的肿瘤-肾脏病学已逐渐被人们重视,其主要致力于探讨肿瘤患者肾脏功能受损的原因及伴肾功能不全肿瘤患者化疗药物的调整与使用。如不能充分认识肿瘤及抗肿瘤药物对肾脏的影响,则不仅降低肿瘤患者的生存质量和预期寿命,而且阻碍了新型抗肿瘤药物的研发与推广。本文结合当前的研究现状对这一领域的相关问题进行阐述,旨在引起肿瘤和肾脏病学医师对于肿瘤患者合并肾功能受损问题的重视,加深对于致病原因的认识,提高解决临床问题的能力,以期在肿瘤治疗中获得最优的临床疗效和预后。
肿瘤-肾脏病学 肿瘤 肾脏疾病 化疗药物
恶性肿瘤与肾脏疾病有互为因果关系,一方面肿瘤可继发于慢性肾脏病(CKD),并增加患者的死亡率;另一方面,化疗药物和放疗治疗既延长了肿瘤患者的预期寿命,同时又导致急性或慢性肾损伤的比例明显升高。肿瘤-肾脏病学则应运而生,其主要致力于探讨肿瘤患者肾脏功能受损的原因及伴肾功能不全肿瘤患者化疗药物及放疗治疗的调整与使用。它倡导肿瘤科和肾脏科医师的密切合作,以保证肿瘤患者能够得到最优化的治疗方案和更佳的临床预后。本文将结合目前研究现状对这一领域进行介绍。
肿瘤患者急性肾损伤(AKI)的发生
恶性肿瘤患者AKI的发生除与疾病本身有关外,还可继发于肿瘤化疗或其他并发症。丹麦一项研究发现肿瘤人群平均1年和5年内AKI的发生率分别为17.5% 和27.0%[1]。AKI的病因多样,临床常以肾前性、肾性和肾后性归类。
肾前性因素 主要原因是血容量不足,如肿瘤伴发的呕吐、腹泻、败血症及营养不良等,此外,去甲肾上腺素、垂体后叶素、利尿剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂、非甾体类抗炎药(NASIDs)等一些药物均可能引起肾脏灌注不足。临床治疗中对于AKI的高危人群是否长期应用以上药物应当仔细权衡利弊,此外,以下原因也需引起重视。
高钙血症 20%~30%的恶性肿瘤患者常合并高钙血症,它可通过促进血管收缩和排钠利尿效应导致肾前性损害。影响血钙升高的原因很多,如肿瘤合成和分泌甲状旁腺素相关蛋白(PTHrP)增多,可诱导骨转化和钙储存释放;恶性肿瘤的骨转移,促进骨溶解和钙动员;肿瘤细胞表达1α羟化酶增多激活维生素D。
肝窦闭塞综合征(SOS) SOS是造血干细胞移植(HCT)的并发症,主要由于高强度的放射治疗导致肝窦内皮细胞和3区肝小叶的肝细胞损伤,引起肝窦内血栓形成和门静脉高压,进而出现腹水、外周水肿和肾脏灌注不足,临床上肝静脉压力梯度(HVPG)>10 mmHg对诊断SOS具有较高特异度。尽管合理的支持治疗可使>70%患者病情逐渐缓解,然而重症患者预后仍较差。
钙调神经蛋白抑制剂的使用 钙调神经蛋白抑制剂环孢素或他克莫司常用于治疗同种异体HCT患者的移植物抗宿主病(GVHD),两者却可通过损伤血管内皮细胞引起AKI,并具有剂量依赖性。研究显示环孢素相关肾损伤在停药后常常可逆,但是长期应用仍可造成入球小动脉透明变性和间质纤维化[2]。
肾性因素 当一些危险因素影响肾小球、肾小管间质或肾小血管等肾脏实质,即可诱发AKI。GVHD可导致肾小球损害,肾组织改变以膜性肾病(MN)多见,激素或环孢素治疗后一般可缓解,但远期预后不详。恶性淋巴瘤可通过直接浸润肾脏造成组织受压,经皮肾穿刺可明确诊断。AKI发生时常合并大量蛋白尿。尽管多数患者对化疗药物治疗敏感,但较易反复且远期预后未知。多发性骨髓瘤(MM)患者中约15%~40%合并肾功能不全,严重者甚至需要透析治疗,病理类型以管型肾病多见,主要由于肿瘤产生的游离轻链(FLCs)超过肾小管的重吸收能力,其在远端小管逐渐聚集形成的Tamm-Horsfall蛋白可阻塞肾小管,脱水、酸中毒、高钙血症、NASIDs和呋塞米等因素还可加快此蛋白形成。诊断明确后充分水化和碱化尿液,尽早应用硼替佐米、地塞米松、沙利度胺等化疗药物可减少FLCs生成,改善预后。血浆置换的疗效仍有争议,一项纳入104例受试对象的随机对照研究并未发现血浆置换可改变死亡率、透析依赖性和GFR<30 ml/(min·1.73m2)的发生率。另一项系统性回顾研究也未发现血浆置换加化疗较单用化疗药物对改善死亡率和肾功能更有效[3]。高截留量透析(HCO-HD)最初用于清除脓毒症细胞因子,但疗效目前在骨髓瘤管型肾病中得到证实,体外和体内试验均显示HCO-HD能有效清除FLCs。Hutchison等[4]报告了67例继发于MM的AKI患者,经HCO-HD和化疗后,63%患者最终摆脱透析,认为早期积极有效的化疗联合HCO-HD可显著改善骨髓瘤管型肾病患者肾功能及预后。骨髓瘤管型肾病的最优治疗策略(MYRE)研究发现HCO-HD与传统透析相比,更有利于促进肾功能恢复和提高患者预期寿命[5]。肿瘤溶解综合征(TLS)常发生于放化疗之后,不仅见于实体肿瘤,还可见于急性白血病、侵袭性淋巴瘤等血液系统恶性肿瘤,以高尿酸、高血钾、高磷酸血症、低钙血症等内环境的紊乱为特点。其中,高尿酸是造成AKI的主要原因,目前研究认为,除了尿酸结晶在肾组织沉积诱发炎症反应造成间质损害外,可溶性尿酸通过刺激血管收缩、损伤肾脏自主调节功能、降低血流量等机制影响肾功能[6]。充分水化、碱化尿液和别嘌醇的使用可能有助于减少AKI,但是尿液碱化也会加剧磷酸钙晶体的沉积。肿瘤相关的血栓性微血管病(TMA)既可与恶性肿瘤本身相关,也可继发于HCT,常见于胃癌、直肠癌和乳腺癌等。其对血浆置换反应差,临床常以支持治疗为主。HCT相关TMA发生于HCT后1年内,发生比例为10%~25%[7],全身放疗所致的内皮细胞受损被认为是主要病因,TMA对血浆置换的总体反应性较特发性血栓性血小板减少性紫癜为差。有报道,64%的HCT相关TMA在停环孢素和接受血浆置换治疗后病情能得到控制,钙调神经蛋白抑制剂需尽早撤离,必要时可予皮质醇、霉酚酸酯或硫唑嘌呤等药物替代治疗。
肾后性因素 主要为尿路梗阻。除了膀胱、前列腺和子宫等的恶性肿瘤可阻塞尿道,腹膜后侵袭性淋巴瘤和放射治疗相关的腹膜纤维化等同样可以压迫尿路,从而诱发梗阻性肾病。治疗的根本是尽快手术解除梗阻,可采用经皮肾穿刺造瘘或输尿管支架置入等治疗。
肿瘤继发的肾小球损害
MN是实体恶性肿瘤最常见的病理类型,尤以肺癌和消化道肿瘤多见。但临床上,区分继发性或原发性MN常常需要结合病史、血清学标记物和肾组织活检。Beck等[8]于2009年发现了一种跨膜糖蛋白——抗M型磷脂酶2受体(PLA2R),它在多数成年人原发性MN中可作为足细胞的靶抗原,IgG4可作为抗PLA2R抗体的主要亚基与PLA2R结合成免疫复合物沉积于上皮下;而在肿瘤继发的MN中,常以IgG1和IgG2的上皮下沉积为主。总之,在肿瘤继发MN中抗PLA2R抗体缺失,而在原发性MN中表达增加。南京军区总医院肾脏病研究所刘志红院士等[9]2011年发表在JASN上的研究发现,60例原发性MN患者中有49例血清中可明显检出抗PLA2R抗体,另有10例尽管血清中滴度较低,但仍可检出,推断抗PLA2R抗体是中国人原发性肾病综合征的重要标志物。故即使MN患者同时伴恶性肿瘤,如果血清抗PLA2R抗体浓度升高或肾小球以IgG4沉积为主,仍考虑原发性MN可能性更大。
与实体恶性肿瘤不同,血液恶性肿瘤的肾脏病理以微小病变型肾病(MCD)多见。病因尚不明确,有观点认为与免疫细胞功能异常导致的肾小球通透因子表达增多有关,如霍奇金病患者白细胞介素13(IL-13)的过度表达[10]。另有研究发现,MCD患者的外周血单核细胞可分离出c-maf-inducing protein(CMIP)[11],并在霍奇金病合并MCD的患者的足细胞和R-S细胞中也有表达,但在不伴肾脏损害的单纯性霍奇金病中却未发现。现已明确,霍奇金淋巴瘤导致的肾脏病理类型还包括AA型淀粉样变或局灶节段性肾小球硬化(FSGS),而慢性淋巴细胞白血病或非霍奇金淋巴瘤可导致MN或膜性增生性肾小球肾炎(MPGN)。
化疗药物相关肾脏疾病
肿瘤化疗药物在取得抗肿瘤疗效的同时不可避免地会对机体造成一定损害,肝、肾是主要的受累器官。药物毒副作用影响的部位有所不同,其中以肾小管间质损害最为常见。顺铂主要通过肾脏排泄,其在肾小管药物浓度远高于血液,Miller等[12]报道称其所致的急性肾小管坏死(ATN)发生率在20%~30%,且呈剂量依赖性。最终引起肾小管不同程度的损害,如近端肾小管重吸收受损或范科尼综合征,甚至发生AKI。顺铂可通过被动扩散或主动转运(如转运蛋白OCT2、Ctr1等)的方式进入肾小管,还可作用于髓袢升支和远端小管影响镁的重吸收造成低镁血症,作用于集合管影响水的重吸收造成肾性尿崩症。另外动物实验还发现低镁血症可上调OCT2表达,促进顺铂重吸收进而加重AKI[13]。
甲氨蝶呤引起的AKI主要归因于药物本身及其难溶性代谢产物7-OH-甲氨蝶呤沉积阻塞肾小管,尿pH值减低和肾血流低灌注均促进沉淀物形成,同时甲氨蝶呤的血浓度升高还会造成多器官损害,当甲氨蝶呤浓度24h内>15 μmol/L、48h内>1.5 μmol/L或72h内>0.5 μmol/L时一般被认为中毒风险明显升高。高通量透析尽管可较快清除血清中甲氨蝶呤,但透后浓度将迅速回升。新药Glucarbidase因可将甲氨蝶呤和7-OH-甲氨蝶呤水解为无活性的形式而被用于解毒治疗。
贝伐单抗是抗血管内皮生长因子(VEGF)抗体,通过与VEGF的结合抑制肿瘤生长。正常情况下在肾小球,VEGF主要在足细胞生成,再作用于血管内皮细胞的VEGF受体发挥作用,进而维持滤过屏障的完整性。VEGF通过刺激血管内皮细胞生成一氧化氮和前列腺素发挥舒张小动静脉的作用,当VEGF被大量抗体阻断后,引起血管收缩并导致血压升高、蛋白尿或以TMA为表现的AKI等不良反应。研究还发现高血压(2.7%~36%)和蛋白尿(21%~63%)的发生率与药物剂量有关[14]。
舒尼替尼和索拉菲尼通过作用于受体酪氨酸激酶(如VEGF受体)抑制信号传导,并导致TMA、蛋白尿和高血压出现。有报道观察了5例接受舒尼替尼治疗后发生了AKI同时伴高血压和蛋白尿的患者,当药物撤除后肾功能可得到不同程度恢复[15]。但在临床上化疗后所出现血压升高常被看作药物发挥疗效的反映[16],医师也更倾向于通过降压药物对症治疗而非立即停药,但是对于肾功能损害较严重的患者仍应该权衡利弊做出最优选择[17],特别是当贝伐单抗和酪氨酸激酶抑制剂联用时。
吉西他滨也与TMA发生相关,并且发生率可能比预想的要高[18]。一项研究中吉西他滨治疗后出现TMA的29例患者均发生不同程度的AKI,其中26例属于新发高血压或原有病情加重,7例发生心力衰竭,且受试者尿检均合并血尿、蛋白尿[19]。有报道称药物剂量和既往丝裂霉素应用史可能与TMA发生有关[20]。最近的研究发现对于激素、利妥昔单抗或血浆置换治疗不敏感的吉西他滨所致TMA患者,应用依库丽单抗短期治疗达到了不错的效果,如纠正血小板异常和改善肾功能,且疗效独立于血液透析治疗[21]。
放疗相关的肾脏损伤
既往研究发现机体大量接受放射性照射后可能发生肾脏间质和血管的损害,临床表现为水肿、高血压、蛋白尿、镜下血尿、贫血和氮质血症等,故定义为放射性肾炎,依据发病时间又有急性和慢性之分。本病最常发生在对睾丸、卵巢、Wilm氏肿瘤、腹膜后淋巴瘤、成骨肉瘤、神经纤维肉瘤或腹腔内转移瘤的照射之后。但近年来随着放疗防护技术的改进,发生率已明显下降。临床上有时借助骨髓移植(BMT)治疗血液系统恶性肿瘤,患者在移植前常常要接受全身放射治疗(TBI)。当单次放射剂量达到10 Gy或3d累积剂量达到14 Gy常常引起放射性肾病的发生。Borg等[22]等对59例接受TBI的BMT长达2年的随访研究发现,当3d累积放射剂量限制在12 Gy时,仅1例患者出现放射性肾炎,发生率明显降低。
CKD合并恶性肿瘤患者的化疗
当患者的肾功能出现问题时化疗药物的使用必将受限,因为大多数化疗药物经过肾脏代谢,除了化疗药物本身的毒性外,还可能导致CKD患者感染或贫血加重。而就目前来说对于化疗药物的肾脏清除率和血液透析清除率相关研究资料还很不充分,并且CKD或ESRD患者的化疗药物剂量应该如何调整也只是基于一些小样本的研究和专家推荐。在IRMA-2研究中,4 267例合并实体恶性肿瘤的透析前CKD患者随访2年,结果显示GFR<60 ml/(min·1.73 m2)组死亡率较GFR>60 ml/(min·1.73 m2)明显升高,作者考虑可能与血管并发症或不合理的药物剂量调整有关。在CANDY研究中,178例继发恶性肿瘤的维持性血液透析(MHD)患者,大多数接受至少一种化疗药物,其中出现药物中毒者占44%。化疗药物在肾脏的排泄主要通过肾小球滤过和肾小管分泌,这主要取决于药物的分子量大小、蛋白结合率等,因此GFR可作为剂量调整的重要依据。而对于接受透析的患者,尽管肾脏毒性基本不作考虑,但清除不足所致的药物过量将引起其他的毒副作用,故依然值得重视。最近几项研究检测了酪氨酸激酶抑制剂(如舒尼替尼、索拉菲尼、埃托替尼)在MHD患者的药代动力学后发现,这些药物主要在肝脏经过CYP3A4途径代谢[23],且透析治疗对药物浓度影响较小,因此对于透析患者的给药时间并无过多的限制。本文对于目前主要化疗药物的选择及CKD患者应用时的剂量调整在表格1中进行了总结[20,24-25]。
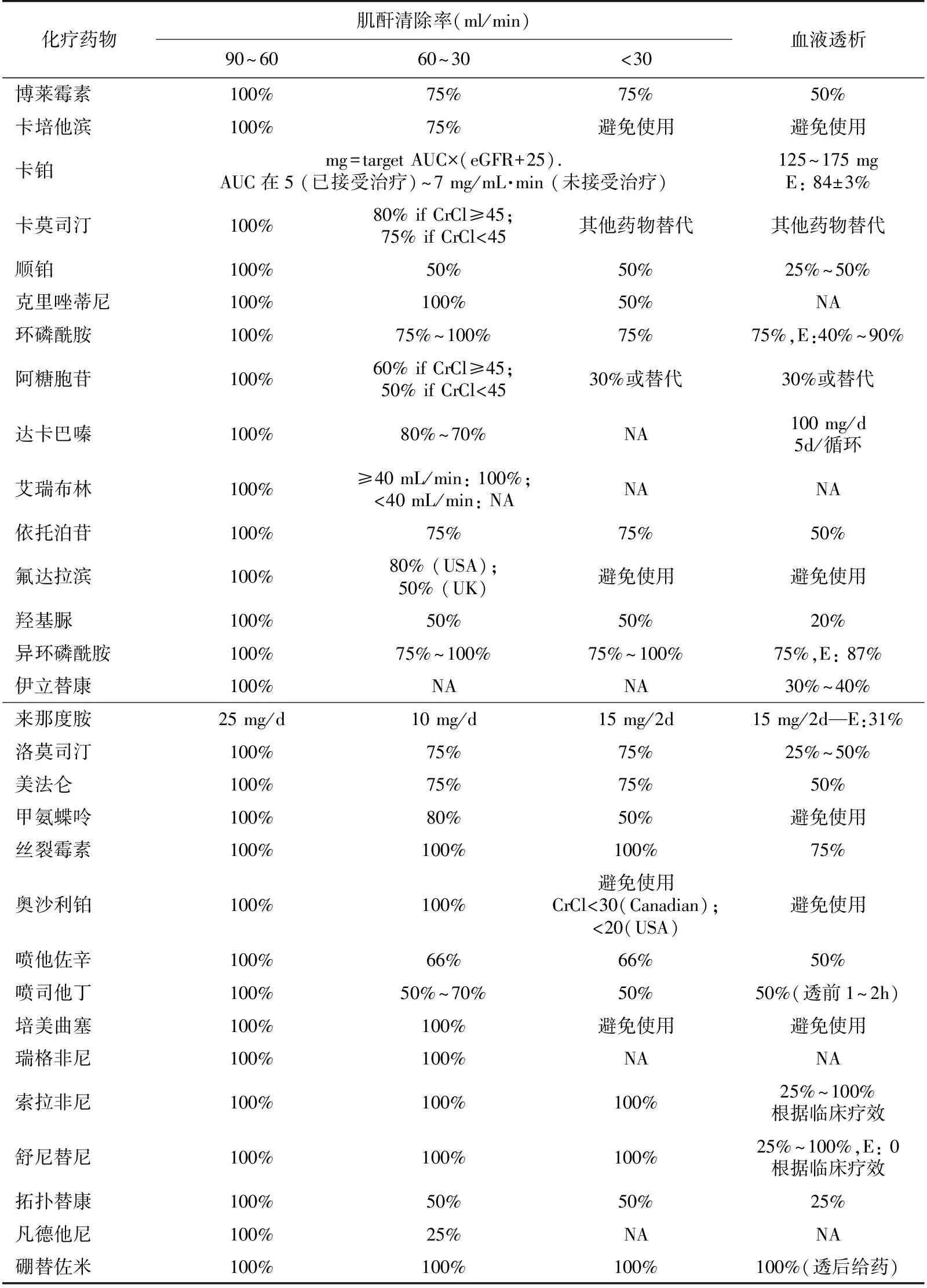
表1 不同分期慢性肾脏病患者应用主要化疗药物的剂量调整
AUC:浓度与时间曲线下面积[mg/(ml·min)];E:萃取系数(%),代表药物通过血液透析清除的比率,用来评估血 液透析药物的清除能力;NA:无相关研究
小结:化疗药物在抗肿瘤领域取得重大治疗突破的同时,其药物本身的毒副作用依然不容小觑,另外对于化疗过程中出现的肾脏功能损伤及CKD患者的药物剂量应该如何调整,都已成为限制药物推广应用和临床疗效发挥的重要课题。由于目前临床实验证据尚不充分,更需要肾脏科、肿瘤科及相关科室医师加强沟通合作,深入探讨化疗药物药代动力学及在肾功能不全患者中的代谢特点,制订合理、安全的给药方案,以期在肿瘤患者治疗中获得更优的临床疗效。因此,当前形势下培养高水平的肿瘤-肾脏病学专家并开展跨学科合作显得尤为迫切,相信经过医学工作者不懈努力必将对改善患者的预后产生积极的影响。
1 Christiansen CF,Johansen MB,Langeberg WJ,et al.Incidence of acute kidney injury in cancer patients:a Danish populationbased cohort study.Eur J Intern Med,2011,22(4):399-406.
2 Singh N,McNeely J,Parikh S, et al.Kidney complications of hematopoietic stem cell transplantation.AmJKidneyDis,2013,61(5):809-821.
3 Gupta D,Bachegowda L,Phadke G, et al.Role of plasmapheresis in the management of myeloma kidney:a systematic review.Hemodial Int,2010,14(4):355-363.
4 Hutchison CA,Heyne N,Airia P,et al.Immunoglobulin free light chain levels and recovery from myeloma kidney on treatment with chemotherapy and high cut-off haemodialysis.Nephrol Dial Transplant,2012,27 (10):3823-3828.
5 Grima DT,Airia P,Attard C,et al.Modelled cost-effectiveness of high cut-off haemodialysis compared to standard haemodialysis in the management of myeloma kidney.Curr Med Res Opin,2011,27(2):383-391.
6 Howard SC,Jones DP,Pui CH.The tumor lysis syndrome.N Engl J Med,2011,364(19):1844-1854.
7 Laskin BL,Goebel J,Davies SM,et al.Small vessels,big trouble in the kidneys and beyond:hematopoietic stem cell transplantation-associated thrombotic microangiopathy.Blood,2011,118(6):1452-1462.
8 Beck LH Jr,Bonegio RG,Lambeau G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy.N Engl J Med,2009,361(1):11-21.
9 Qin W,Beck LH Jr,Zeng C,et al.Anti-phospholipase A2 receptor antibody in membranous nephropathy.J Am Soc Nephrol,2011,22(6):1137-1143.
10 Grimbert P,Audard V,Remy P,Recent approaches to the pathogenesis of minimal-change nephrotic syndrome.Nephrol Dial Transplant,2003,18(2):245-248.
11 Audard V,Zhang SY,Copie-Bergman C,et al.Occurrence of minimal change nephrotic syndrome in classical Hodgkin lymphoma is closely related to the induction of c-mip in Hodgkin-Reed Sternberg cells and podocytes.Blood,2010,115(18):3756-3762.
12 Miller RP,Tadagavadi RK,Ramesh G,et al.Mechanisms of Cisplatin nephrotoxicity.Toxins (Basel),2010,2(11):2490-2518.
13 Yokoo K,Murakami R,Matsuzaki T,et al.Enhanced renal accumulation of cisplatin via renal organic cation transporter deteriorates acute kidney injury in hypomagnesemic rats.Clin Exp Nephrol,2009,13(6):578-584.
14 Zhu X,Wu S,Dahut WL,et al.Risks of proteinuria and hypertension with bevacizumab, an antibody against vascular endothelial growth factor:systematic review and meta-analysis.Am J Kidney Dis,2007,49(2):186-193.
15 Jhaveri KD,Flombaum CD,Kroog G,et al.Nephrotoxicities associated with the use of tyrosine kinase inhibitors:a single-center experience and review of the literature.Nephron Clin Pract,2011,117(4):c312-319.
16 De Stefano A,Carlomagno C,Pepe S,et al.Bevacizumab-related arterial hypertension as a predictive marker in metastatic colorectal cancer patients.Cancer Chemother Pharmacol,2011,68(5):1207-1213.
17 Li Y,Li S,Zhu Y,et al.Incidence and risk of sorafenib-induced hypertension:a systematic review and meta-analysis.J Clin Hypertens (Greenwich),2014,16(3):177-185.
18 Richmond J,Gilbar P,Abro E.Gemcitabine-induced thrombotic microangiopathy.Intern Med J,2013,43(11):1240-1242.
19 Glezerman I,Kris MG,Miller V,et al.Gemcitabine nephrotoxicity and hemolytic uremic syndrome:report of 29 cases from a single institution.Clin Nephrol,2009,71(2):130-139.
20 Perazella MA.Onco-nephrology:renal toxicities of chemotherapeutic agents.Clin J Am Soc Nephrol,2012,7(10):1713-1721.
21 Starck M,Wendtner CM.Use of eculizumab in refractory gemcitabine-induced thrombotic microangiopathy.Br J Haematol,2014,164(6):894-896.
22 Borg M,Hughes T,Horvath N,et al.Renal toxicity after total body irradiation.Int J Radiat Oncol Biol Phys,2002,54(4):1165-1173.
23 Masini C,Sabbatini R,Porta C,et al.Use of tyrosine kinase inhibitors in patients with metastatic kidney cancer receiving haemodialysis:a retrospective Italian survey.BJU Int,2012,110(5):692-698.
24 Yeung CK,Shen DD,Thummel KE,et al.Effects of chronic kidney disease and uremia on hepatic drug metabolism and transport.Kidney Int,2014,85(3):522-528.
25 Perazella MA,Parikh C.Pharmacology.Am J Kidney Dis,2005,46(6):1129-1139.
(本文编辑 心 平 清 如)
Onco-nephrology: a new field in nephrology
ZHANGWei,YUANWeijie
DepartmentofNephrology,ShanghaiFirstPeople’sHospital,ShanghaiJiaotongUniversity,Shanghai200080,China
Onco-nephrology is a new and evolving subspecialized area in nephrology that deals with kidney diseases in cancer patients. Not only is cancer often associated with abnormalities that affect the kidney, but cancer therapy often leads to both acute and chronic kidney diseases. If these problems are not solved,a lack of knowledge about this will reduces quality of life and expectation of life expectancy in tumor patients, meanwhile it will hinders the development and promotion of new anticancer drugs. This article will discuss the related problems of this field, the purpose of which is prompting recognition and treatment initiation for the patients who are with chronic kidney disease suffering from cancer,and improving outcomes in this population.
onconephrology cancer kidney disease chemotherapy drug
上海交通大学附属第一人民医院肾内科(上海,200080)
2015-05-07

