半乳糖凝集素3与慢性肾脏病风险评估
张志宏 综述 刘志红 审校
·基础医学·
半乳糖凝集素3与慢性肾脏病风险评估
张志宏 综述 刘志红 审校
慢性肾脏病(CKD)是世界性的公共卫生问题,我国CKD发生率逐年递增。除进展至终末期肾病(ESRD)外,CKD并发心血管疾病的风险显著升高。CKD的本质是肾组织慢性炎症和纤维化,涉及众多代谢产物和信号通路。半乳糖凝集素3(Gal-3)是体内一种重要的多功能蛋白质,具有广泛的病理生理意义。新近的多项研究发现Gal-3与心肾疾病的发生和进展关系紧密。本文就Gal-3在CKD心脏、肾脏事件风险评估中的认识进展作一综述。
慢性肾脏病 心血管疾病 半乳糖凝集素3
慢性肾脏病(CKD)已成为世界性的公共卫生问题[1-2],在我国CKD患者约1.19亿[3],其中引起成人终末期肾病(ESRD)的主要病因为:原发性肾小球肾炎(57.4%)、糖尿病肾病(16.4%)、高血压肾损害(10.5%)和囊性肾脏病(3.5%)。CKD令人瞩目的主要原因在两方面,一方面是引起CKD发生和进展的许多因素如高血压、糖尿病本身对于预后有着不良影响;更为重要的另一方面是CKD本身进展至ESRD后,必须依赖肾脏替代治疗以维持生命。随肾功能减退,约半数CKD患者未进展至ESRD即发生严重心血管事件,死亡风险显著增加。早期筛选出无症状的CKD患者进行心脏、肾脏事件潜在风险评估,采取有效措施减缓CKD进展无疑具有重要的临床意义。
现阶段CKD诊断及肾脏预后判断的主要指标仍是尿蛋白水平和肾小球滤过率(GFR)[4],两者皆为肾脏排泄或清除指标。由于影响因素众多,尿蛋白或GFR水平不能全面和及时反映肾脏早期的损伤和远期肾功能的变化。以糖尿病肾病为例,早期GFR往往不降反升,一旦出现大量蛋白尿,部分患者很快出现GFR下降,但也有仅表现GFR缓慢下降的。另一方面,CKD并发心脏事件风险的评估不能简单套用一般人群研究成果,如改善全球肾脏病预后组织(KDIGO)指出利用脑利钠肽(BNP)或N-末端脑利钠肽前体(NT-ProBNP)评估CKD患者容量状态或心力衰竭结论须慎重;同样,利用肌钙蛋白诊断CKD患者合并急性冠脉综合征必须结合其肾功能状态[4]。因此,寻找CKD诊断及预后判断的新型生物标记物已成为临床的客观需求和研究新热点。关于潜在的候选生物标记物,凝集素(Lectin)家族成员半乳糖凝集素3(Gal-3)即为其中之一。Lectin是一类从植物、无脊椎动物和高等动物中提纯的糖蛋白家族,由于具有凝集红细胞的作用,故名凝集素。Lectin最大的特点在于它们能识别生物膜中复杂的碳水化合物结构,一种Lectin能专一的识别并结合某种糖基。Gal-3是一种对含β半乳糖苷残基的糖化合物具有很高亲和力的凝集素。生物膜中均含有一定量的糖类,主要以糖蛋白和糖脂的形式存在,Gal-3通过与特殊配体的反应在多种生物学进程中发挥作用。本文就Gal-3在CKD风险评估中的研究进展进行综述。
Gal-3的分子结构与代谢
Gal-3又被称为碳水化合物结合蛋白35、Epsilon结合蛋白、HL-29、IgE结合蛋白和巨噬细胞溶酶体相关膜蛋白1。Gal家族成员具有三大共同特征:(1)特征性的氨基酸序列;(2)高度保守的由大约135个氨基酸组成的碳水化合物结合域(CRD);(3)对含β半乳糖苷残基化合物的亲和性。根据其分子的结合形式,又可将Gal划分为三种类型:(1)原型,即含有一个CRD单体,以单体(Gal-5,7,10)或二聚体(Gal-1,2,11,13,14)的形式存在;(2)串联重复型,即两个CRD串联融合而成(Gal-4,6,8,9,12);(3)嵌合体型,即由一个糖基与一个非糖基配体交联结合而成(Gal-3)。Gal-3是Galectin家族中唯一的嵌合体型,在配体存在时Gal-3形成五聚体以增加糖基结合位点。Gal-3的一级结构可划分为3个独特的结构域:(1)短的N-末端结构域,包括一个丝氨酸磷酸化位点;(2)包含氨基乙酸-酪氨酸-脯氨酸的重复序列;(3)包含CRD的C-末端结构(图1)。人类Gal-3分子量约35 kD,由位于14号染色体LGALS3基因编码。

图1 半乳糖凝集素3分子结构及与配体结合示意图[5-6]
生理环境下,Gal-3主要分布于成骨细胞、上皮细胞及肠组织等组织和细胞中,并在激活的巨噬细胞、嗜碱性粒细胞和肥大细胞等中高表达。Gal-3主要存在于细胞质中,但也在胞核、胞膜或细胞外表达。Gal-3的分泌不依赖内质网和高尔基器,通过一种类似细胞胞吐的非经典机制转移至细胞外,可溶性的Gal-3可进入全身循环。Gal-3的分子量低于白蛋白(60 kD),因此,可通过肾小球滤过屏障。
Gal-3与肾脏纤维化
Gal-3作为一种重要的多功能蛋白质,在细胞增殖和分化、细胞与细胞之间或细胞与间质之间的黏附、炎症反应、血管生成、细胞凋亡、免疫调节及肿瘤生长浸润等方面具有广泛的生理和病理意义[7-8]。
肾脏纤维化是CKD的特征性标志之一[9],最终结局是大量细胞外基质(ECM)的过度沉积。ECM主要包括胶原、非胶原糖蛋白、糖胺多糖和蛋白多糖等。肾脏纤维化以肾脏固有细胞的损伤为起点,激活相应的巨噬细胞,释放活性因子,活化静息状态的ECM产生细胞(主要为成纤维细胞),使之转化为肌成纤维细胞。肌成纤维细胞增殖并分泌细胞因子,通过旁分泌方式再作用于巨噬细胞,同时肌成纤维细胞合成大量ECM,导致ECM异常沉积。肾脏纤维化进程的中心调控者为活化的巨噬细胞。研究发现,慢性肾小球肾炎间质浸润的炎症细胞主要是巨噬细胞,且浸润的巨噬细胞数量与肾脏纤维化程度呈正比[10];敲除巨噬细胞基因可减轻肾脏纤维化[11];清除循环巨噬细胞也可降低大鼠免疫复合物相关性肾炎或单侧输尿管阻塞(UUO)性肾炎的间质纤维化程度[12-13]。基于细胞表面分子不同,可将巨噬细胞分为M1和M2两个表型。M1型通过经典途径活化,γ干扰素(IFN-γ)、脂多糖(LPS)、肿瘤坏死因子(TNF)和粒细胞巨噬细胞刺激因子(GM-CSF)能诱导其活化,是导致炎症和免疫损伤的主要成分;M2型通过替代途径活化,IL-4、IL-10、IL-13和免疫复合物诱导其活化,具有促进血管生成、细胞增殖和ECM重塑的重要作用。不同表型的巨噬细胞在炎症及纤维化中的作用不同,由M1型巨噬细胞介导的组织损伤和细胞凋亡可活化M2型巨噬细胞,后者吞噬细胞碎片、分泌生长因子、修复损伤,同时产生大量转化生长因子β(TGF-β)促进纤维化[14]。Gal-3在纤维化过程中的作用主要与巨噬细胞的替代途径活化(M2型)密切相关。首先,Gal-3作为趋化因子,通过浓度梯度信号趋化远隔部位(包括循环)的单核/巨噬细胞浸润[15];其次,Gal-3可选择性活化M2型巨噬细胞[16-17],后者一方面合成并分泌多种生长因子,包括TGF-β,另一方面进一步上调Gal-3的表达和释放,形成所谓Gal-3反馈环路;最后,Gal-3通过调控TGF-β促进成纤维细胞转型为肌成纤维细胞,并促进上皮细胞-间充质细胞转分化(EMT)(图2)[18-19]。另外,Gal-3也被认为是一种促有丝分裂原[20]。新近有实验发现,Gal-3还有独立于巨噬细胞外的致纤维化作用。该研究通过UUO制造大鼠肾脏纤维化模型,对比Gal-3基因敲除的大鼠与野生型大鼠肾脏纤维化严重程度,发现在巨噬细胞浸润程度相同的情况下,Gal-3基因敲除的大鼠肾脏纤维化程度较野生型大鼠有所减轻[21]。
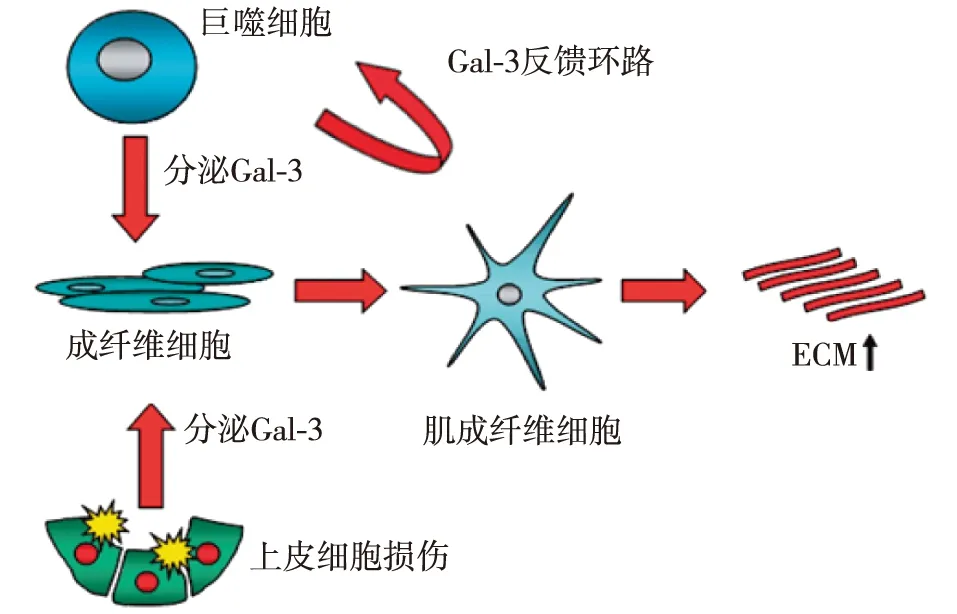
图2 Gal-3参与器官纤维化的过程 [19]Gal-3:半乳糖凝集素3;ECM:细胞外基质
Gal-3与心脏、肾脏功能关系的研究
健康者循环Gal-3水平极低。心力衰竭的相关研究显示,检测血清Gal-3浓度具有良好的应用价值,包括早期预测心力衰竭的风险[22-23]、对心[16,24]。由于心力衰竭患者容易出现肾功能不全,而CKD患者合并心力衰竭的风险也很高,循环Gal-3水平的变化能否反映心-肾间的这种交互作用值得期待。
一项小样本的观察性研究中,Gopal an>比较了4组不同心肾功能状态人群的血清Gal-3浓度。该4组人群分别为射血分数保留的心力衰竭组[简称HFpEF组,即左心室射血分数(LVEF)>50%的心力衰竭患者)34例;射血分数减低的心力衰竭组(简称HFrEF,即LVEF≤50%的心力衰竭患者)41例;无心力衰竭的CKD组12例;无心力衰竭和CKD的对照组32例。作者发现,与对照组相比,血清Gal-3浓度在HFpEF组与HFrEF组均有升高,且升高幅度接近,但血清Gal-3浓度最高水平出现在CKD组,差异较其他各组均有统计学意义。线性回归分析显示所有75例心力衰竭患者(HFpEF组+HFrEF组)和所有44例无心力衰竭患者(CKD组+对照组)的血清Gal-3浓度均与eGFR呈显著负相关,两组回归曲线拟合后较为接近。另一项纳入876例心力衰竭患者的横断面研究也发现,在校正年龄、性别、纽约心脏病学会(NYHA)心功能分级、LVEF和心力衰竭病因后,循环Gal-3水平与以CKD-EPI公式计算的eGFR水平或循环胱抑素C(CysC)水平均存在显著的负相关关系;如以eGFR水平将患者分为≥60 ml/(min·1.73m2)、30~59 ml/(min·1.73m2)和<30 ml/(min·1.73m2)三组,循环Gal-3水平随肾功能减退而升高的变化趋势独立于NYHA心功能分级和LVEF水平[25]。综合上述研究发现,提示心功能状态是循环Gal-3水平的影响因素之一,而肾功能状态(即GFR水平)却极有可能是其决定因素。
Gal-3评估CKD患者心脏、肾脏风险的研究
目前,有关循环Gal-3水平评估CKD患者心脏、肾脏风险的研究仍非常有限。一项纳入161例心力衰竭患者并随访1年的研究显示,循环Gal-3水平确与患者死亡风险显著相关,但该相关性对于eGFR≤60 ml/(min·1.73m2)的CKD患者在纳入NT-proBNP后消失[26]。迄今探讨循环Gal-3水平与CKD患者心脏、肾脏风险的大型前瞻性队列研究首推著名的Framingham心脏研究[27]。该研究共纳入3 353例参与者,其中纳入分析肾脏结局的有2 613例,最终有完善基线资料的为2 450例。女性占53%,平均年龄57岁。以1995年~1998年为基线,随访至2005年~2008年,平均随访10.1年。根据基线血清Gal-3水平进行四分位分组,分析各组间心脏结局(主要包括心力衰竭和全因死亡)和肾脏结局[主要包括肾功能快速减退,即年均eGFR下降率≥3 ml/(min·1.73m2)]或出现白蛋白尿[以尿白蛋白与尿肌酐比值评估(ACR),男性ACR≥17 mg/g,女性ACR≥25 mg/g]或确诊CKD[eGFR<60 ml/(min·1.73m2)]。结果随访期末,发生心力衰竭166例,死亡468例,肾功能快速减退241例,出现白蛋白尿194例,确诊CKD 277例。统计分析显示,调整年龄和性别因素后,循环Gal-3水平与增加的左心室质量指数(LVM)有非常显著的相关关系,COX回归分析显示,调整性别、年龄、糖尿病、高血压、血脂、尿蛋白及BNP等因素后,基线血清Gal-3浓度的对数值每增加1个标准差,患者10年后发生心力衰竭的风险增加23%,全因死亡的风险增加15%,肾功能快速减退的风险增加49%,发生CKD的风险增加47%,但出现白蛋白尿的风险无统计学意义。Framingham心脏研究的突出贡献是利用大样本的前瞻性队列,提出基线血清Gal-3水平对一般人群远期(10年后)发生CKD风险、肾功能快速减退、心力衰竭和全因死亡的预测价值,其预测价值独立于目前已知的风险因素如高血压、糖尿病、蛋白尿和BNP等。新近欧洲完成的路德维希港风险和心血管健康研究(Ludwigshafen Risk and C ̄a ̄r ̄d ̄i ̄o ̄v ̄a ̄s ̄c ̄u ̄l ̄a ̄r Health,简称LURIC研究)报道了Gal-3评估CKD患者心肾风险的新发现[28],研究于1997年~2000年共纳入3 316例接受冠脉成形术的患者,其中检测Gal-3水平的共2 578例,以eGFR水平将患者分为3组,即≥90 ml/(min·1.73m2)(36.6%)、60~89 ml/(min·1.73m2)(49.7%)和<60 ml/(min·1.73m2) (13.8%),平均随访10年,观察心脏和肾脏结局。结果发现,首先循环Gal-3水平随着肾功能减退持续升高,在各CKD分期间差异非常显著;其次,循环Gal-3水平与患者肾功能、年龄、炎症指标及心功能指标均存在显著的相关性,分别为GFR(r=-0.542),年龄(r=0.246),hsCRP(r=0.224),NT-proBNP(r=0.277);尤为引人关注的是该研究指出循环Gal-3水平与CKD 2期及以上患者[eGFR<90 ml/(min·1.73m2)]的全因死亡、心血管事件和感染相关死亡均独立相关(校正性别、年龄、吸烟、体质量指数、血压、血脂和糖尿病因素),与猝死、急性心肌梗死、心力衰竭死亡和中风发作均无相关性。需要指出的是,CKD患者并非Framingham心脏研究和LURIC研究主要的观察对象,前一研究纳入的皆是肾功能正常的一般人群,后一研究纳入的eGFR<60 ml/(min·1.73m2)的患者仅占13.8%,其中CKD 4期仅有39例,CKD 5期仅有10例。此外,LURIC研究进行心脏预后多因素分析时未能将反映心血管功能状态的重要指标NT-proBNP纳入令人费解。
小结:Gal-3是一种分布广泛的多功能蛋白质,在肾脏疾病发生和进展中具有重要的病理生理意义。CKD患者循环Gal-3浓度显著升高。目前的初步研究提示Gal-3在评估CKD发生风险、心脏预后和肾脏预后上均具有独特的预测价值,并且可望成为新的干预靶点。展望未来对CKD患者的风险评估,应整合现有研究成果,全面考量传统指标如eGFR、BNP、肌钙蛋白与新兴指标如Gal-3,以期更全面把握CKD患者心脏、肾脏潜在风险,改善总体预后。
1 Remuzzi G,Benigni A,Finkelstein FO, et al.Kidney failure: aims for the next 10 years and barriers to success.Lancet,2013,382(9889):353-362.
2 Liu ZH.Nephrology in China.Nat rev nephrol,2013,9(9):523-528.
3 Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional surrey.Lanect,2012,379(9818):815-822.
4 Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group.KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease.Kidney Int Suppl,2013,3:1-150.
5 Gao P,Simpson JL,Zhang J,et al.Galectin-3: its role in asthma and potential as an anti-inflammatory target.Respir Res,2013,14:136.
6 Argüeso P,Panjwani N.Focus on Molecules:Galectin-3.Exp Eye Res,2011,92(1):2-3.
7 Arad U,Madar-Balakirski N,Angel-Korman A,et al.Galectin-3 is a sensor-regulator of toll-like receptor pathways in synovial fibroblasts.Cytokine,2015,73(1):30-35.
8 Thijssen VL,Heusschen R,Caers J,et al.Galectin expression in cancer diagnosis and prognosis: A systematic review.Biochim Biophys Acta,2015,1855(2):235-247.
9 Rodríguez-Iturbe B,Johnson RJ,Herrera-Acosta J.Tubulointerstitial damage and progression of renal failure.Kidney Int Suppl,2005,(99):S82-S86.
10 Ferenbach D,Kluth DC,Hughes J.Inflammatory cells in renal injury and repair.Semin Nephrol,2007,27(3):250-259.
11 Persy VP,Verhulst A,Ysebaert DK,et al.Reduced postischemic macrophage infiltration and interstitial fibrosis in osteopontin knockout mice.Kidney Int,2003,63(2):543-553.
12 Guo S,Wietecha TA,Hudkins KL,et al.Macrophages are essential contributors to kidney injury in murine cryoglobulinemic membranoproliferative glomerulonephritis.Kidney Int,2011,80(9):946-958.
13 Lange-Sperandio B,Schimpgen K,Rodenbeck B,et al.Distinct roles of Mac-1 and its counter-receptors in neonatal obstructive nephropathy.Kidney Int,2006,69(1):81-88.
14 Anders HJ,Ryu M.Renal microenvironments and macrophage phenotypes determine progression or resolution of renal inflammation and fibrosis.Kidney Int,2011,80(9):915-925.
15 Sano H,Hsu DK,Yu L,et al.Human galectin-3 is a novel chemoattractant for monocytes and macrophages.J Immunol,2000,165(4):2156-2164.
16 Yu X,Sun Y,Zhao Y,et al.Prognostic value of plasma galectin-3 levels in patients with coronary heart disease and chronic heart failure.Int Heart J,2015,56(3):314-318.
17 Gopal DM,Kommineni M,Ayalon N,et al.Relationship of plasma galectin-3 to renal function in patients with heart failure: effects of clinical status,pathophysiology of heart failure,and presence or absence of heart failure.J Am Heart Assoc,2012,1(5):e000760.
18 Mackinnon AC,Gibbons MA,Farnworth SL,et al.Regulation of Transforming Growth Factor-β1-driven Lung Fibrosis by Galectin-3.Am J Respir Crit Care Med,2012,185(5):537-546.
19 Henderson NC,Mackinnon AC,Farnworth SL,et al.Galectin-3 expression and secretion links macrophages to the promotion of renal fibrosis.Am J Pathol,2008,172(2):288-298.
20 Li LC,Li J,Gao J.Functions of galectin-3 and its role in fibrotic diseases.J Pharmacol Exp Ther,2014,351(2):336-343.
21 Dang Z,MacKinnon A,Marson LP,et al.Tubular atrophy and interstitialfibrosis after renal transplantation is dependent on galectin-3.Transplantation,2012,93(5): 477-484.
22 Ho JE,Liu C,Lyass A,et al.Galectin-3,a marker of cardiac fibrosis,predicts incident heart failure in the community.J Am Coll Cardiol,2012,60(14):1249-1256.
23 Jagodzinski A,Havulinna AS,Appelbaum S,et al. Predictive value of galectin-3 for incident cardiovascular disease and heart failure in the population-based FINRISK 1997 cohort.Int J Cardiol,2015,192:33-39.
24 Felker GM,Fiuzat M,Shaw LK,et al.Galectin-3 in Ambulatory Patients With Heart Failure Results From the HF-ACTION Study.Circ Heart Fail,2012,5(1):72-78.
25 Zamora E,Lupón J,de Antonio M,et al.Renal function largely influences Galectin-3 prognostic value in heart failure.Int J Cardiol,2014,177(1):171-177.
26 Zhang R,Zhang Y,An T,et al.Prognostic value of sST2 and galectin-3 for death relative to renal function in patients hospitalized for heart failure.Biomark Med,2015,9(5):433-441.
27 O′Seaghdha CM,Hwang SJ,Ho JE,et al.Elevated galectin-3 precedes the development of CKD.J Am Soc Nephrol,2013,24(9):1470-1477.
28 Drechsler C,Delgado G,Wanner C,et al.Galectin-3,Renal Function,and Clinical Outcomes: Results from the LURIC and 4D Studies.J Am Soc Nephrol,2015,26(9):2213-2221.
(本文编辑 逸 沐)
Galectin-3 and chronic kidney disease
ZHANGZhihong,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
China has a high prevalence of chronic kidney disease (CKD). CKD imposes an enormous burden on public health resources for the reasons of development of end-stage renal disease (ESRD) and complications of cardiovascular diseases. Galectin-3 is a member of the multifunctional proteins comprising soluble β-galactoside-binding lectins that have regulatory roles in fibrogenesis, inflammation, tissue repair and cell proliferation. This review will focus on the relevant research progresses of Galectin-3 in CKD.
chronic kidney disease cardiovascular disease Galectin-3
南京军区南京总医院院管课题(2013038)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-05-11

