LC-MS/MS法测定Beagle犬血浆中布洛芬对映体的浓度
赵秀红,夏媛媛,黄玉荣,张爱杰,魏广力,司端运
(1.天津医科大学研究生院,天津 300070;2.天津药物研究院释药技术与药代动力学国家重点实验室,天津 300193)
LC-MS/MS法测定Beagle犬血浆中布洛芬对映体的浓度
赵秀红1,2,夏媛媛2,黄玉荣2,张爱杰2,魏广力2,司端运2
(1.天津医科大学研究生院,天津 300070;2.天津药物研究院释药技术与药代动力学国家重点实验室,天津 300193)
目的 建立简便、快速、灵敏的LC-MS/MS法测定Beagle犬血浆中手性药物布洛芬浓度的分析方法,进行系统的方法学验证,并用于布洛芬在Beagle犬体内的药代动力学研究。方法 以酮洛芬为内标,血浆样品经正己烷(含5%异丙醇)液萃取后,以甲醇: 1 mmol·L-1甲酸铵(含0.2%甲酸,10%甲醇)(82 ∶18,V/V)为流动相,采用Lux 5u Cellulose-3(250 mm·4.6 mm,5 μm)柱分离,流速为0.8 mL·min-1。通过电喷雾电离源以多反应监测(MRM)方式进行负离子检测,用于定量分析的离子对分别为m/z205.2/161.2(布洛芬)和m/z253.1/209.2(内标,酮洛芬)。方法验证包括基质效应、提取回收率、线性、定量下限、批内与批间精密度、稳定性、稀释效应等。结果 犬血浆中左/右旋布洛芬的线性范围为0.2~50 mg·L-1,最低定量限为0.2 mg·L-1,批内、批间精密度(RSD)介于1.01%~13.1%之间。Beagle犬单次口服给予右旋布洛芬后的主要药动学参数Cmax、T1/2、AUC(0-t)分别为:( 82.98±14.83 ) mg·L-1、( 3.217±0.7298) h、( 362.0±58.67 ) h·mg·L-1。单次口服给予消旋布洛芬后,其左/右旋布洛芬的主要药动学参数Cmax、T1/2、AUC(0-t)分别为:(70.62±14.81)/(74.48±20.08) mg·L-1、(1.520±0.9286)/(5.432±1.234) h、(177.8±34.18)/(649.6±200.2) h·mg·L-1。结论 该方法简便、快速、灵敏度高、重复性好,能够同时测量血浆中左/右旋布洛芬的药物浓度,可用于布洛芬在Beagle犬体内的药代动力学研究。
布洛芬;LC-MS/MS;血药浓度; Beagle犬;药代动力学;对映异构体
布洛芬为芳基丙酸类非甾体抗炎药(NSAIDs),是目前临床上应用广泛的抗炎镇痛药物[1],通过抑制前列腺素的合成而达到解热、镇痛、抗炎作用[2]。布洛芬化学结构中含有一个手性碳,因此有一对对映异构体,通常以外消旋体的形式存在,其中左旋体 (R构型) 与右旋体 (S构型) 的比例为1 ∶1[3]。右旋布洛芬( dexibuprofen ) 作为布洛芬优势异构体,在体外比左旋布洛芬 (低活性异构体) 表现出更好的药理活性,其活性比为160 (优势异构体/低活性异构体)[3-4]。其中,右旋布洛芬药理活性是临床常用外消旋体活性的1.6倍[5],制药企业正在开发单独的右旋口服和注射制剂。据文献报道[3,6-7],体内存在的异构化酶可将左旋布洛芬单向转化为右旋布洛芬,为了考察左/右旋布洛芬在体内的药代动力学特征,有必要建立能够同时测定左/右旋布洛芬的简便、快速、灵敏的方法。宫爱申等[1]建立了HPLC-UV法测定Beagle犬血浆中右旋布洛芬浓度的方法,但该方法并不能应用于消旋布洛芬两个对映体的同时测定,不能进一步研究左/右旋布洛芬在体内的转化。Sharma等[8]采用衍生化法测定了人血浆中的手性布洛芬,但是该方法操作复杂,对于批量生物样品的测定,分析周期长、效率低。本研究拟建立能够同时测定犬血浆中左/右旋布洛芬的定量分析方法,与文献报道的方法相比,该方法简便、灵敏、高效,并将其应用于Beagle犬单独给予右旋布洛芬和消旋布洛芬后体内的血药浓度的测定,可以为考察左/右旋布洛芬的单向转化及布洛芬在Beagle犬体内的药代动力学提供依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 药品:消旋布洛芬(纯度98.8%,批号100179-201105)、酮洛芬(纯度99.9%,批号100337-201104),均购于中国食品药品检定研究院;左旋布洛芬(纯度100%,批号5-JGC-193-1)、右旋布洛芬(纯度>98%,批号51146-56-6),均购于加拿大Toronto研究化学总公司;布洛芬片(0.2 g/片,批号130151),购于济南永宁制药股份有限公司;右旋布洛芬片(0.2 g/片,批号1305003),购于江西汇仁药业有限公司。
试剂:甲醇,色谱纯,Thermo Fisher公司;甲酸,色谱纯,天津市光复精细化工研究所;正己烷和异丙醇,均为色谱纯,天津市康科德科技有限公司;磷酸,优级纯,天津风船化学试剂科技有限公司。
1.1.2 仪器 日本Shimadzu公司Prominence 30A液相色谱仪,配有LC-30AD二元梯度泵,CTO-30A柱温箱,SIL-30AC自动进样器,DGU-20A5脱气机;美国Applied Biosystems公司Sciex TRIPLE QUADTM5500型三重四极杆串联质谱仪,配有电喷雾离子化源(ESI)及Analyst1.5.2数据处理软件;XS105型分析天平,瑞士METTER TOLEDO公司;Sorvall Legend Micro 17R台式高速冷冻离心机,Thermo Scientific公司;3K15型高速冷冻离心机,Sigma公司;TARGINTMVX-Ⅱ型多管涡旋振荡器,北京踏锦科技有限公司;Turbo Vap LV型样品浓缩仪,美国Caliper公司。
1.1.3 动物 Beagle犬6只,普通级,♀♂各半,体质量(10.12±0.5868) kg,北京玛斯生物技术有限公司提供,生产许可证:SCXK(京)2011-0003;质量合格证明:11400600000228。本研究在天津市新药安全评价研究中心动物实验设施内进行,动物实验已经获取天津市新药安全评价研究中心IACUC的批准,批准号:2014042104。
1.2 方法
1.2.1 色谱与质谱条件 色谱条件:色谱柱:Lux 5u Cellulose-3(250 mm×4.6 mm,5 μm),保护柱Guard Cartridge Kit,美国菲罗门公司;柱温:27°C;流动相:甲醇:1 mmol·L-1甲酸铵(含0.2%甲酸,10%甲醇)= 82:18;流速:0.8 mL·min-1;保留时间:左旋布洛芬8.68 min、右旋布洛芬9.66 min、内标酮洛芬8.56 min;仪器运行时间:15 min(7.5 min~11.0 min切换进入质谱)。
质谱条件:离子化源:电喷雾离子源,负离子检测;喷雾电压(IS):-4 500 V;源温度(TEM):550 ℃;扫描方式为多反应监测(MRM);定量检测:布洛芬m/z205.2/161.2,酮洛芬m/z253.1/209.2。
1.2.2 对照品溶液的配制 布洛芬对照品溶液的配制:精确称量消旋布洛芬标准品适量,用甲醇配制成含左/右旋布洛芬浓度各500/500 mg·L-1的标准储备液(消旋布洛芬浓度为1 g·L-1)。随后用甲醇梯度稀释成浓度为2/2、5/5、10/10、50/50、200/200、500/500 mg·L-1的左/右旋布洛芬系列标准工作液,于4 ℃保存,备用。
内标溶液的配制:精确称量酮洛芬标准品适量,加甲醇得酮洛芬浓度为1 g·L-1的储备液。取适量内标储备液,用50%甲醇水稀释为4 mg·L-1的内标工作溶液。
质控溶液的配制:精确称量布洛芬标准品适量,用甲醇配制成含左/右旋布洛芬浓度各500/500 mg·L-1的质控储备液(消旋布洛芬浓度为1 g·L-1)。随后用甲醇将质控储备液梯度稀释成浓度为5/5(LQC)、50/50(MQC)、400/400(HQC)mg·L-1的左/右旋布洛芬QC工作液。
1.2.3 样品处理方法 于玻璃试管中加入室温解冻后的血浆样品200 μL,内标溶液(4 mg·L-1)50 μL,甲醇20 μL和0.5%磷酸(pH = 1.5)200 μL,用3 mL正己烷(含5%异丙醇)萃取2 min后,4 ℃ 3000 r·min-1离心5 min,取上层有机相1 mL,40 ℃氮气吹干,残留物加500 μL复溶溶液(甲醇 ∶水=80 ∶20,V/V),涡旋2 min,复溶后转移于内插管中,4 ℃ 12 000 r·min-1离心5 min,取上清液进样6 μL。
1.2.4 给药设计 本试验采用双周期随机交叉试验设计。两周期时间间隔为7 d。受试Beagle犬6只,分为A、B两组,A组2♂1♀,B组2♀1♂。分别按每只0.2 g(1片)右旋布洛芬片和每只0.4 g(2片)消旋布洛芬片给药。于给药前、后0.083 3、0.25、0.5、0.75、1、2、3、5、7、10、12、15、24 h前肢静脉采血2 mL 左右于真空采血管中,4 000 r·min-1离心5 min,分离出血浆,于-20 ℃保存待测。
1.2.5 数据处理及统计学分析 使用Analyst 1.5.2数据处理软件,对待测物左/右旋布洛芬及内标酮洛芬进行积分,记录峰面积。以待测物浓度(X)为横坐标,待测物与内标物的峰面积比值(Y)为纵坐标,用加权最小二乘法(权重为1/X2)进行回归运算,求得的直线回归方程即为血浆校正曲线。各药代参数由WinNonlin 6.3(美国Pharsight公司)计算得出,参数经SPSS 17.0 进行统计学分析,定量资料采用t检验进行分析。
2 结果
2.1 方法特异性在本研究采用的LC-MS/MS条件下,分别取6个不同来源的犬空白血浆200 μL,除不加待测物及内标溶液(改加同体积甲醇和50%甲醇水溶液)外,其余按“血浆样品处理方法”项下操作,进行LC-MS/MS分析,获得空白血浆样品的色谱图见Fig 1A;以2.3方式配制的LLOQ样品进行分析的代表性色谱图见Fig 1B,待测物左旋布洛芬和右旋布洛芬及内标酮洛芬的色谱保留时间分别为8.67 min、9.64min、8.56 min;犬给药后血浆样品的代表性色谱图见Fig 1C。干扰组分的响应低于LLOQ响应的1/5及内标响应的1/20,表明犬血浆中的内源性物质不影响待测物和内标的定量分析。

Fig 1 MRM chromatograms for (R-)/(S+) ibuprofen in Beagle plasma
A: a blank plasma sample;B: a blank plasma sample spiked with (R-) ibuprofen(0.2 mg·L-1),(S+) ibuprofen(0.2 mg·L-1) and IS (4 mg·L-1);C: a plasma sample after 0.75 h intragastric given 0.4 g ibuprofen enantiomers to Beagle dogs
2.2 左/右旋布洛芬的相互干扰及相互转化
2.2.1 左/右旋布洛芬的相互干扰 配制含低浓度(0.5 mg·L-1)左旋布洛芬和高浓度(40 mg·L-1)右旋布洛芬的血浆样品以及含高浓度(40 mg·L-1)左旋布洛芬和低浓度(0.5 mg·L-1)右旋布洛芬的血浆样品,各3只试管。从每只试管中各取200 μL样品,按“1.2.3”项下处理后进样分析。结果显示,所有样品的RE在96.6%~112%,均在允许范围(±15%)以内,满足测定的要求,说明同时测定左/右旋布洛芬时,高浓度化合物不会对低浓度化合物产生影响。
2.2.2 左/右旋布洛芬的相互转化 分别配制含有低(0.5 mg·L-1)和高(40 mg·L-1)浓度的消旋布洛芬、左旋布洛芬以及右旋布洛芬的血浆样品,共6只试管。置37 ℃恒温水浴,分别于0、1、2 h 3个时间点取样,按“1.2.3”项下处理,每个浓度进行双样本分析。结果显示,所有2 h的样品与其相应0 h样品的比值在96.5%~105%之间,说明左/右旋布洛芬的浓度不随时间发生改变。此外,在含左旋布洛芬的血浆中测不到右旋布洛芬,含右旋布洛芬的血浆中测不到左旋布洛芬,说明左/右旋布洛芬在血浆中没有发生相互转化。在含消旋布洛芬的血浆中,低浓度和高浓度的左/右旋布洛芬的浓度比,从0~2 h均在99.0%~103%之间,说明左旋布洛芬和右旋布洛芬浓度一致,在不同浓度下不随时间发生改变,没有发生相互转化。

取左/右旋布洛芬(浓度0.2/0.2 mg·L-1)20 μL加入到200 μL空白血浆中,除不加甲醇外,根据“1.2.3”项下处理,进行6样本分析,连续进行3个批次的样本分析。结果显示,该浓度下左/右旋布洛芬的色谱峰信噪比(S/N)均>10,18个样本的相对误差(RE)分别为-1.81%和0.139%,批内精密度分别为4.19%和3.82%,批间精密度分别为4.82%和1.78%。结果表明本方法左/右旋布洛芬的定量下限(LLOQ)可以达到0.2 mg·L-1。
2.4 准确度和精密度取“1.2.2”项下配制的高、中、低浓度水平的质控样品20 μL,加入到200 μL空白血浆中,采用“1.2.3”项下的方法进行血浆样品处理,进行LC-MS/MS分析,记录左/右旋布洛芬及内标MRM检测的色谱图峰面积,每个浓度6样本,连续进行3个批次的样本分析。应用校正曲线计算各QC样品的测得浓度,考察分析方法的准确度和精密度,结果见Tab 1。左/右旋布洛芬各浓度水平QC样品的相对误差(RE)均介于-2.53%~-0.144%之间,批内精密度(RSD)均介于4.22%~6.29%之间,批间精密度(RSD)均介于1.01%~13.1%之间,符合有关生物样品分析方法验证的要求。
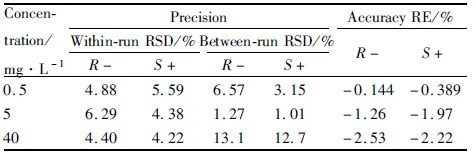
Tab 1 Precision and accuracy of (R-)/(S+) ibuprofen analysisin Beagle plasma by LC-MS/MS(n=6)
2.5 基质效应考察样品A: 取“1.2.2”项下配制的高、中、低浓度水平的质控样品20 μL和50 μL内标工作液,加入10 mL玻璃试管中,40 ℃下氮气吹干,加入1.5 mL溶液复溶后,进样6 μL进行LC-MS/MS分析,记录布洛芬和内标的色谱峰面积A。样品B: 向200 μL空白犬血浆中,不加对照品和内标(以溶剂代替),按“1.2.3”项下提取后经氮气吹干,用500 μL样品A复溶,进样6 μL进行LC-MS/MS分析记录左/右旋布洛芬和内标的色谱峰面积B。峰面积比B/A×100%即为左/右旋布洛芬和内标的基质效应,见Tab 2。结果表明左/右旋布洛芬在3个QC浓度水平上的基质效应介于97.0%~104%之间,RSD介于1.13%~8.54%之间;内标酮洛芬的基质效应为104%,平行测定的RSD为4.27%,基质效应不会对样品的分析产生明显影响。
2.6 提取回收率取“1.2.2”项下配制的高、中、低浓度水平的质控样品进行血浆中左/右旋布洛芬的提取回收率考察,每个浓度6样本。样品C:200 μL空白犬血浆加20 μL布洛芬质控工作液(0.5/0.5、5/5、40/40 mg·L-1),按“1.2.3”项下样品处理方法处理后进样6 μL,进行LC-MS/MS定量分析,记录布洛芬和内标酮洛芬的色谱峰面积C。峰面积C/B×100%测得的峰面积比即为左/右旋布洛芬和内标的提取回收率。结果见Tab 2, 表明左/右旋布洛芬在3个QC浓度水平上的提取回收率在105%~111%之间,RSD在4.35%~8.53%之间;内标酮洛芬的提取回收率为82.9%,RSD为7.72%。
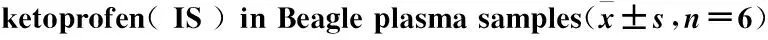
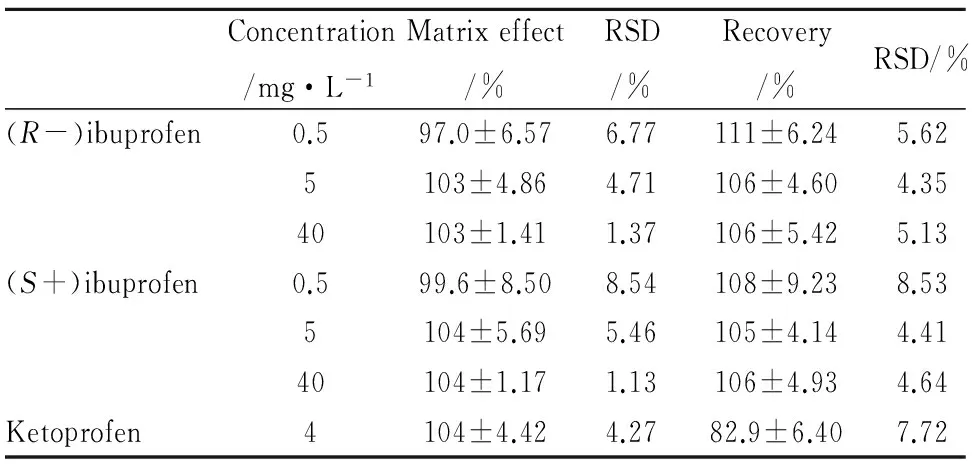
Concentration/mg·L-1Matrixeffect/%RSD/%Recovery/%RSD/%(R-)ibuprofen0.597.0±6.576.77111±6.245.625103±4.864.71106±4.604.3540103±1.411.37106±5.425.13(S+)ibuprofen0.599.6±8.508.54108±9.238.535104±5.695.46105±4.144.4140104±1.171.13106±4.934.64Ketoprofen4104±4.424.2782.9±6.407.72
2.7 稳定性稳定性考察了布洛芬血浆样品室温放置4 h、进样器放置24 h、-20 ℃室温冻融1次、3次循环、-20 ℃长期冻存稳定性。按“1.2.3”项下处理后分析,结果显示,血浆样品中左/右旋布洛芬RE均小于9.5%,表明布洛芬血浆样品在以上各条件下稳定。
2.8 稀释效应制备左/右旋布洛芬浓度为400 mg·L-1的标准血浆样品,用空白血浆稀释10倍后进行测定,考察稀释效应。结果显示,稀释10倍后测定结果乘以稀释倍数所得计算值,与标识浓度相比,左旋布洛芬的准确度(RE)为-2.04%,精密度(RSD)为2.82%;右旋布洛芬的准确度(RE)为-1.88%,精密度(RSD)为2.64%。表明对血浆样品进行稀释后分析,经校正计算后的结果能够准确反映超出曲线范围的药物浓度。
2.9 Beagle犬体内的药代动力学[9-10]Beagle犬给予右旋布洛芬片或消旋布洛芬片后,所测得的左/右旋布洛芬的平均血药浓度-时间曲线见Fig 2。以非房室模型计算所得的各个药代参数见Tab 3。动物在给药后,两组右旋AUC(0-∞)数值存在差异(P<0.01),给予消旋布洛芬之后,其右旋布洛芬的AUC(0-∞)(696.8±235.7) h·mg·L-1,明显高于单独给予右旋布洛芬(367.8±62.87) h·mg·L-1;给予消旋体后,其右旋布洛芬的AUC(0-∞)( 696.8±235.7) h·mg·L-1,明显高于左旋布洛芬的AUC(0-∞)( 181.1±32.13) h·mg·L-1(P<0.01)。给予消旋布洛芬后2 h,左右旋两对映体浓度之间呈现明显差异(P<0.05),右旋布洛芬的血药浓度明显大于左旋布洛芬;同时两组右旋数据也在给药后5 h呈现明显差异(P<0.05),给予消旋体之后,右旋布洛芬血药浓度明显大于单独给予右旋布洛芬。

Tab 3 Pharmacokinetic parameters of (S+) ibuprofenafter an i.g. dose of (S+)ibuprofen (0.2 g)and (S+)ibuprofen,(R-) ibuprofen after an i.g. dose ofibuprofen enantiomers (0.4 g)to Beagle ±s,n=6)
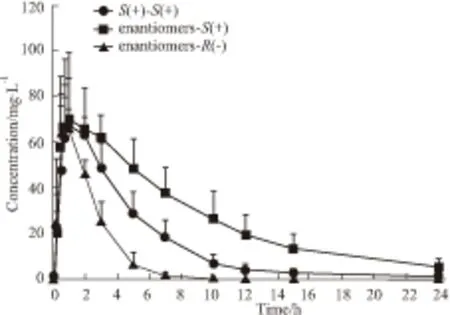
Fig 2 Plasma concentration-time curves of ibuprofen after an i.g. dose of (S+)ibuprofen (0.2 g)and ibuprofen enantiomers (0.4 g)to Beagle dogs (n=6)
3 讨论
根据国家食品药品监督管理总局2014版《药物非临床药代动力学研究技术指导原则》[10]规定,本研究建立了同时测定左/右旋布洛芬的定量分析方法。由于对映异构体具有几乎相同的物理性质(旋光性除外)和化学性质(在手性环境中除外),通常需要特殊的手性技术对它们进行分离和测定。本研究选用手性色谱柱(Lux 5u Cellulose-3)对左/右旋布洛芬实现了色谱分离,分离效果良好。宫爱申等[1]选择了20°C柱温测定右旋布洛芬,Cardoso等[11]选择25℃柱温对布洛芬对映体进行分离,分离效果良好。本研究选择27°C柱温并通过优化流动相组成和比例,分离效果更好,使两种待测物之间的分离度达到了1.69,能满足色谱分离和定量分析的要求。
由于对应异构体在体内具有不同的药代动力学行为,本研究在预实验中发现左/右旋布洛芬在犬体内的吸收、分布和消除有很大区别,相同时间点的血药浓度差异很大。基于以上,本研究考察了同时测定左/右旋布洛芬时,两种化合物的浓度差异是否会对测定造成影响结果显示所有样品均能够满足测定的要求,说明同时测定左/右旋布洛芬时,高浓度化合物不会对低浓度化合物产生影响。
根据文献报道[3,12-13],体内存在的异构化酶可将左旋布洛芬单向转化为右旋布洛芬,而这种转化是否会在血浆中发生,当前的测定方法能否准确分析血浆中两个对映异构体的浓度,基于以上,本研究考察了左/右旋布洛芬在血浆中的相互转化。结果显示,所有0、1、2 h的样品相比较,差别不大,说明孵育1 、2 h的血浆样品,其测得浓度相较0 h没有下降,左/右旋布洛芬在血浆中的浓度不随时间发生改变。单独含有左旋布洛芬的血浆中始终测不到右旋布洛芬,含有右旋布洛芬的血浆中也测不到左旋布洛芬,说明左/右旋布洛芬在血浆中没有发生相互转化。含低和高浓度消旋布洛芬的血浆里左/右旋布洛芬的浓度比值,从0~2 h均接近于100%,说明左/右旋布洛芬浓度一致,在不同浓度下不随时间发生改变,也没有发生相互转化。
目前检测血浆中布洛芬对映体的方法有紫外[14-15]、荧光[16]及质谱检测器[8,11]。采用质谱检测器相对紫外与荧光检测器,能够提高检测的灵敏度和选择性[11]。本研究建立了同时测定犬血浆中左/右旋布洛芬浓度的LC-MS/MS分析方法,定量范围均为0.2~50 mg·L-1,方法快速、简便、灵敏。并按照生物样品分析的相关规范,对该方法的基质效应、提取回收率、线性、准确度、精密度及稳定性等项目进行了验证考察,符合化学药物临床前药代动力学研究的技术要求,可为右旋布洛芬在Beagle犬体内的药代动力学的研究提供依据。
[1] 宫爱申,徐静华,张逸凡,等.右旋布洛芬缓释胶囊在比格犬体内的药物动力学[J].沈阳药科大学学报,2004,21(3):173-6.
[1] Gong A S, Xu J H, Zhang Y F, et al. Evaluation of the pharmacokinetics of dexibuprofen modified-release capsules in Beagle dog [J].JShenyangPharmUniv, 2004, 21(3): 173-6.
[2] 缪丽艳,张 华,王 中,等.脑脊液中右旋布洛芬含量及其药动学研究[J].苏州大学学报(医学版),2001,24(3):318-20.
[2] Miao L Y, Zhang H, Wang Z, et al. Determination of dexibuprofen concentration and pharmacokinetics in ventricle succus by HPLC-RP method [J].JSuzhouUniv(MeEdit), 2001, 24(3): 318-20.
[3] Caldwell J, Hutt A J, Fournel-Gigleux S.The metabolic chiral inversion and dispositional enantioselectivity of the 2-arylpropionic acids and their biological consequences [J].BiochemPharmacol, 1988, 37: 105-14.
[4] Adams S S, Bresloff P, Mason C G. Pharmacological differences between the optical isomers of ibuprofen, evidence for metabolic inversion of the (-)-isomer [J].JPharmPharmacol, 1976, 28(3): 256-7.
[5] 杨成雄,赵平华,罗 磊,等.右旋布洛芬缓释胶囊的含量及左旋体的高效液相色谱测定[J]. 中国医院药学杂志, 2008,28(14):1225-7.
[5] Yang C X, Zhao P H, Luo L, et al. Determination of content for dexibuprofen modified-release capsules and levorotatory by HPLC [J].ChinHospPharm, 2008, 28(14): 1225-7.
[6] Lee E J,Williams K,Day R,et al.Stereoselective disposition of ibuprofen enantiomers in man [J].BrJClinPharmacol, 2004, 58(7): S759-64.
[7] Evans A M, Nation R L, Sansom L N, et al.Stereoselective plasma protein binding of ibuprofen enantiomers [J].EurJClinPharmacol, 1989, 36: 283-90.
[8] Sharma P, Guttikar S, Solanki G, et al.Determination of (S)-(+)-and(R)-(-)-ibuprofen enantiomers in human plasma after chiral precolumn derivatization by reversed-phase LC-ESI-MS/MS[J].Bioanalysis, 2012, 4(24): 2909-27.
[9] 胡会青,王永利,绳晶伟,等. 盐酸双苯氟嗪在Beagle犬体内的药代动力学[J].中国药理学通报,2009,25(8):1107-10.
[9] Hu H Q, Wang Y L, Sheng J W,et al. Pharmacokinetics of diplfuzine hydrochloride in Beagle dogs after ingle intravenous dose [J].ChinPharmacolBull, 2009, 25(8), 107-10.
[10] 药物非临床药代动力学研究技术指导原则[S]. 国家食品药品监督管理局,2014.
[10] Drug non-clinical pharmacokinetic study technical guidelines[S]. State Food and Drug Administration, 2014.
[11] Cardoso J L,Lanchote V L, Pereira M P,et al.Analysis of ibuprofen enantiomers in rat plasma by liquid chromatography with tandem mass spectrometry [J].JSepSci, 2014, 37: 944-9.
[12] Kaiser D G, Van-Giessen, Reischer G J, et al.Isomeric inversion of ibuprofen (R)-enantiomer in humans [J].PharmSci, 1976, 65: 269-73.
[13] Lee E J, Williams K, Day R,et al.Stereoselective disposition of ibuprofen enantiomers in man [J].BrJClinPharmacol,1985, 19(5): 669-74.
[14] Peng W, Meiling Q, Lihe L, et al.Determination of ibuprofen in dog plasma by liquid chromatography and application in pharmacokinetic studies of an ibuprofen prodrug in dogs [J].JPharmBiomedAnalysis, 2005, 38: 714-19.
[15] Imran A, Iqbal H, Kishwar S, et al.Enantiomeric Resolution of Ibuprofen and Flurbiprofen in Human Plasma by SPE-Chiral HPLC Methods [J].CombChemHighThroughputScreen, 2012, 15: 509-514.
[16] Canaparo R, Muntoni E, Zara G P, et al.Determination of Ibuprofen in human plasma by high-performance liquid chromatography:validation and application in pharmacokinetic study [J].BiomedChromatogr, 2000, 14(4): 219-26.
Vailidation of a LC-MS/MS method for quantification of ibuprofen enantiomers in Beagle dog plasma
ZHAO Xiu-hong1,2,XIA Yuan-yuan2,HUANG Yu-rong2,ZHANG Ai-jie2,WEI Guang-li2,SI Duan-yun2
(1.GraduateSchool,TianjinMedicalUniversity,Tianjin300070,China;2.StateKeyLaboratoryofDrugDeliveryTechnologyandPharmacokinetics,TianjinInstituteofPharmaceuticalResearch,Tianjin300193,China)
Aim To develop a simple, rapid and accurate analysis method for determination of chiral ibuprofen in Beagle dog plasma.Method The plasma sample was submitted to liquid-liquid extraction using hexane/isopropanol (95 ∶5,V/V), with ketoprofen as the internal standard (IS). The separation was accomplished in a Lux 5u Cellulose-3 (250 mm·4.6 mm, 5 μm) column, and the mobile phase consisted of methanol and a mixture of 1 mmol·L-1ammonium acetate-methanol-formic acid (90 ∶10 ∶0.2,V/V/V) with the volume ratio of 82 ∶18 at a flow rate of 0.8 mL·min-1. The mass spectrometer consisted of an ESI interface operating at negative ionization mode and the detection was performed using multiple reaction monitoring at the transitions of m/z 205.2/161.2 for ibuprofen and m/z 253.1/209.2 for ketoprofen (IS) . Method validation included the evaluation of the matrix effect, extraction recovery, linearity, lower LOQ, within-run and between-run precision, stability and dilution effect. Results The calibration curve was linear across the concentration range of 0.2~50 mg·L-1for each ibuprofen enantiomer with a lower LOQ of 0.2 mg·L-1. The within-run and between-run precision (RSD%) was in the range 1.01%~13.1% for each ibuprofen. The pharmacokinetic parameters for orally single dose of (S+) and racemic ibuprofen in Beagle dogs were as follows:Cmax,T1/2, AUC(0-t)were (82.98±14.83 ) mg·L-1, ( 3.217±0.7298) h, (362.0±58.67) h·mg·L-1for (S+) ibuprofen and 70.62/74.48 mg·L-1, 1.520/5.432 h ,177.8/649.6 h·mg·L-1for (R-)/(S+) ibuprofen, respectively. Conclusions A simple, rapid, accurate, high sensitivity and repeatability method has been successfully developed, which can analyze the concentrations of (R-)/(S+) ibuprofen in Beagle dog plasma simultaneously. The method could be applied for the investigation of pharmacokinetics of ibuprofen enantiomers in Beagle dogs.
ibuprofen;LC-MS/MS;plasma concertration;Beagle dogs;pharmacokinetics; enantiomers
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.012.html
2014-12-06,
2015-01-04
国家科技部“重大新药创制”科技重大专项资助项目(No 2012ZX09304002);天津市自然科学基金资助项目(No 10SYSYJC28600)
赵秀红(1989- ),女,硕士生,研究方向:药代动力学,Tel:022-84845243,E-mail:zxh1278@163.com; 司端运(1965-),男,博士,研究员,研究方向:药代动力学, 通讯作者,Tel:022-84845261,E-mail:sidy@tjipr.com
10.3969/j.issn.1001-1978.2015.04.026
A
1001-1978(2015)04-0570-06
R-332;R969.1;R971.1

