大鼠脑微血管内皮细胞与周细胞、星形胶质细胞共培养建立体外血脑屏障模型
查雨锋,傅晓钟,张 顺,罗 敏,欧 瑜,董永喜,王爱民,王永林
(贵阳医学院 1.民族药与中药开发应用教育部工程研究中心、2.贵州省药物制剂重点实验室,贵州 贵阳 550004;3.贵阳市妇幼保健院药剂科,贵州 贵阳 550001)
◇实验方法学◇
大鼠脑微血管内皮细胞与周细胞、星形胶质细胞共培养建立体外血脑屏障模型
查雨锋1,傅晓钟1,张 顺1,罗 敏1,欧 瑜3,董永喜1,王爱民1,王永林2
(贵阳医学院 1.民族药与中药开发应用教育部工程研究中心、2.贵州省药物制剂重点实验室,贵州 贵阳 550004;3.贵阳市妇幼保健院药剂科,贵州 贵阳 550001)
目的 应用原代培养的大鼠脑微血管内皮细胞(brain-microvessel endothelial cells,BMECs)与脑微血管周细胞(brain-microvessel pericytes,BMPC)、星形胶质细胞(astrocytes,AS)共培养建立可模拟在体状态的体外血脑屏障(blood-brain barrier,BBB)模型。方法 原代分离、纯化和培养大鼠BMECs、BMPC和AS,通过细胞形态学和免疫细胞化学染色方法鉴定原代培养的细胞,应用Millicell细胞培养插(孔径0.4 μm)建立5种不同类型的体外BBB模型,经跨内皮电阻值 (transendothelial electrical resistance,TEER)、荧光素钠通透性(sodium fluorescent, Na-FLU)、碱性磷酸酶(AKP)和γ-谷氨酰转肽酶(γ-GT1)的表达测定以及阳性药在体内和体外BBB通透量的相似性,比较评价其屏障功能。结果 原代培养的BMECs呈典型的铺路卵石样结构,BMPC胞体较大且呈分枝状,AS有细长突触,胞质较浅;免疫细胞化学染色证实原代细胞为目标细胞;BMECs与BMPC、AS共培养后TEER值可达(478±25)Ω·cm2,Na-FLU的表观渗透系数为[(8.23±0.78)×10-6]cm·s-1,AKP和γ-GT1表达分别为(6.90±0.27)金氏单位·g-1Pro,(4.39±0.32)μg·g-1Pro;阳性药在体外BBB的表观渗透系数(apparent permeability coefficient,Papp)与在体数据具有较好的相关性(R2=0.92)。结论 原代培养的大鼠BMECs与BMPC、AS共培养建立的体外BBB模型在形态、结构及屏障功能方面具备BBB的基本特征,为研究BBB的生理学、病理学以及筛选化合物提供了一种有用工具。
原代培养;脑微血管内皮细胞;周细胞;星形胶质细胞;血脑屏障;形态学;免疫细胞化学
血脑屏障(blood-brain barrier,BBB)的体外培养模型在生理学、病理学及药理学等领域都具有巨大的研究价值[1],为人类对于中枢神经系统的认识提供了重大帮助。自从脑微血管内皮细胞(brain-microvessel endothelial cells,BMECs)首次在体外分离并培养成功以来[2],体外BBB模型得到不断发展和完善,目前已有多种体外模型的相关文献报道[3]。由于BMECs的屏障功能随着体外培养时间及传代次数的增加而逐渐降低,甚至消失[4],如跨内皮电阻值 (transendothelial electrical resistance,TEER)降低,通透性升高等,使得体外BBB的推广运用受到严重阻碍。研究发现,形成BBB并非BMECs的固有特性,中枢神经的内环境是形成BBB的必要条件[5],而星形胶质细胞(astrocytes,AS)是第一个被认为具有调节和诱导BMECs形成BBB的关键因素[6],鉴于此,BMECs与AS共培养模型是目前使用最为广泛的体外BBB模型。脑微血管周细胞(brain-microvessel pericytes,BMPC)是最靠近BMECs的一类细胞,其与BMECs共同拥有一个基底膜,但它对BBB的调节作用却很少被人们所关注[7-8]。文献报道,BMPC在心血管的生成及BBB的调节方面均具有极其重要的作用[9-10]。
本研究采用BMECs、BMPC及AS共培养建立一种新型的体外BBB模型,并对其进行屏障功能验证,为研究药物对BBB的影响及药物透过机制提供有力工具。
1 材料
1.1 动物2 d及10 d的 SD大鼠,♂♀均可,由贵阳医学院实验动物房提供,动物合格证号:SCXK黔2012-0001。
1.2 试剂DMEM高糖培养基(批号8114031)、胎牛血清(FBS,批号1227694)、胰蛋白酶(批号J130049)均购自Gibco公司;青霉素-链霉素(批号15140-122)购Hyclone公司;鼠尾胶原蛋白(批号C8062)、Trition X-100(批号T8200)、Percoll(批号305A046) 、苏木精(批号20130624)均购自Solarbio公司;胶原酶/分散酶(批号14093221)购自Roche公司;4%多聚甲醛(批号07K29C68)购自博士德生物公司;兔抗大鼠Ⅷ因子相关抗原单克隆抗体(批号bs-2974R)、兔抗大鼠α-SMA单克隆抗体(批号bs-0189R)均购自Bioss公司;兔抗大鼠GFAP单克隆抗体(批号ab33922)、兔抗大鼠NG2多克隆抗体(批号ab83178)购自Abcam公司;D-Hanks缓冲液(自配);SP免疫组化试剂盒(批号SP-9001)、DAB显色试剂盒(批号ZLI-9018)购自中杉金桥公司;Millicell insert(批号14070116);碱性磷酸酶(AKP)试剂盒(批号A059-1)购自南京建成生物工程研究所;γ-谷氨酰转肽酶(γ-GT1)ELISA试剂盒(批号ELA4289)购自R&D Systems公司。
1.3 仪器数显立式压力蒸汽灭菌器(上海博讯实业有限公司医疗仪器厂);超净工作台(北京东联哈尔仪器制造有限公司);CO2细胞培养箱(Thermo Scientific公司);Allegra 64R 冷冻高速离心机(美国Beckman);倒置显微镜(日本尼康公司);THZ-100型恒温培养摇床(上海一恒科学仪器有限公司); ERS-2电阻仪(美国密理博公司);Cary Eclipse荧光分光光度计(美国VARIAN公司); Modle 680酶标仪(Bio-rad公司);Acugity-TDQ型超高效液相色谱-串联质谱(Waters公司)。
2 方法
2.1 大鼠BMEC的原代培养根据本实验室先前报道的方法[11]获得大鼠BMECs,体外BBB模型的建立均采用第二代的BMECs。
2.2 大鼠BMPC的原代培养依照大鼠BMECs的提取方法分离获得较纯的脑微血管段,用含有10%FBS的高糖DMEM培养基悬浮后,接种于鼠尾胶包被的培养瓶中,置于37℃、5% CO2培养箱内培养24 h后换液,以弃除死细胞残渣,随后隔天换液1次。延长培养至d 10后,用0.125%的胰酶 (含0.01% EDTA)消化,并于倒置显微镜下观察,待上层的BMECs及胶质细胞开始脱落,但BMPC未完全消化时弃除胰酶,用含有10%FBS的高糖DMEM培养基轻轻吹打细胞表面,将未脱落的BMECs及胶质细胞吹落。弃除培养基,用PBS缓冲液清洗2遍后,添加0.125%的胰酶 (含0.01% EDTA)继续消化,于倒置显微镜下观察,当发现细胞变圆,间隙增大时,弃除胰酶,加入6 mL含10%FBS的培养液终止消化,轻轻吹打至细胞脱落,接种于未包被的细胞培养瓶中培养,待细胞铺满培养瓶后按1 ∶2的方式传代。体外BBB模型的建立采用3~10代的BMPC。
2.3 AS的原代培养取5只新生1~2 d的SD大鼠,无菌条件下取脑,分离并收集灰质于冷DMEM培养液中。将收集到的大脑灰质用D-Hanks液清洗3次后,剪成1 mm3左右大小,加入0.25% (含0.02% EDTA)的胰酶,37℃振荡消化15~20 min,加入含10%FBS的高糖DMEM终止消化,800×g离心5 min,弃上清液,将沉淀用含10%FBS的高糖DMEM培养液混匀,通过200目的滤网,将滤液接种于未包被的细胞培养瓶中培养(注:以上操作均在冰上进行)。50 min后吸出培养液,接种于事先涂有鼠尾胶的细胞培养瓶中。12 h后换培养液,以后每隔2~3 d换1次液。待细胞长成单层,将培养瓶置于恒温培养摇床中,200 r·min-1振荡15 h,吸出培养液,用PBS清洗2~3次,加入0.125%的胰酶(含0.01% EDTA)消化,在倒置显微镜下观察,当细胞变圆,间隙变大时,吸出胰酶,加入2~3 mL含10%FBS的高糖DMEM培养液,用滴管轻轻将细胞从瓶壁上吹打脱落,并吹成单个,按1 ∶2传代。体外BBB模型的建立采用3~10代的AS。
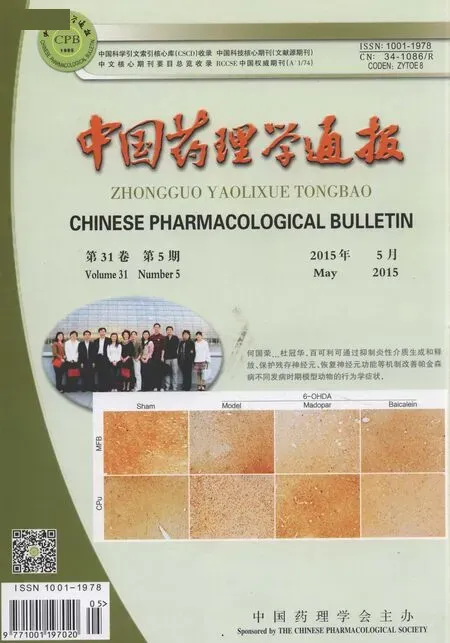
2.4 体外BBB模型的建立在模型建立之前,先用鼠尾胶原蛋白将24孔细胞培养板以及Millicell培养插的内侧和背侧包被并晾干。将BMPC及AS按每平方厘米1.5×104个细胞的密度分别接种于Millicell培养插的背侧和24孔细胞培养板中,于培养箱中培养6 h待BMPC及AS完全贴壁后,将Millicell培养插置于24孔细胞培养板中,将BMECs按每平方厘米2×104个细胞的密度接种于Millicell培养插的内侧,采用BMECs生长培养基培养。于37℃、5% CO2的细胞培养箱中培养,每2 d换液1次,直至d 7模型成功。另外,为了探索最佳体外BBB模型,本研究共建立了5种不同类型的体外模型,如Fig 1所示。
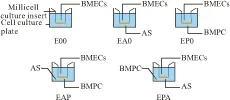
Fig 1 Diagram of five different types of in vitro BBB model
2.5 细胞形态学的观察将培养有BMECs、BMPC、AS的培养瓶置于倒置显微镜下观察细胞贴壁、生长状况及形态,并进行拍照。
2.6 免疫细胞组化染色将扩增培养的BMECs、BMPC、AS种于涂有鼠尾胶的6孔板中,当细胞铺满板底时吸出培养液,给予4%的多聚甲醛固定1 h,PBS冲洗3次(每次3 min),按照SP免疫组化试剂盒说明书依次操作。其中BMECs采用兔抗大鼠Ⅷ因子相关抗原多克隆抗体鉴定;BMPC采用兔抗大鼠α-SMA单克隆抗体以及NG2多克隆抗体鉴定;AS采用兔抗大鼠GFAP单克隆抗体鉴定。所有一抗均按1 ∶200稀释。DAB显色,苏木精复染,于倒置显微镜下观察,以胞质呈现棕色信号为阳性细胞,阴性对照用PBS代替一抗。
2.7 体外BBB模型屏障功能验证
2.7.1 TEER测定 采用Millicell-ERS系统于d 7检测5种不同类型体外BBB模型TEER值,同时测量无细胞的空白Millicell培养插的电阻值作为基准值减去后,乘以培养插面积即为TEER(Ω·cm2)。
2.7.2 Na-FLU通透量测定 待体外BBB模型培养至d 7后,用无血清的DMEM培养基清洗模型的内外侧2~3次,每孔内侧加入200 μL浓度为100 mg·L-1的Na-FLU无血清DMEM溶液,外侧加入1.2 mL无血清DMEM,60 min后从池外侧取出100 μL培养液用荧光分光光度计测定通过BBB模型的Na-FLU量,通过Artursson系数公式计算Na-FLU的通透性。
Papp=(dQ/dt)×1/(A·C0·60)
其中dQ/dt表示Na-FLU每分钟的通透量,A表示培养插的表面积,C0表示Na-FLU的初始浓度,60是将分钟换算成秒。
2.7.3 AKP的表达测定 模型采用6孔Millicell培养插建立,待模型培养至d 7后,弃除内外池培养液,用PBS缓冲液轻轻漂洗模型2~3次,加入1%Triton X-100细胞裂解液0.5 mL,用移液器轻轻吹打,将单层BMECs吹落,转移至1.5 mL的EP管中,4℃下裂解60 min后离心10 min(12 000×g,4℃),取上清液备用。按AKP检测试剂盒说明书方法检测。
2.7.4 γ-GT1的表达测定 样品制备方法与“2.7.3”项相同,按γ-GT1 ELISA试剂盒说明书方法检测。
2.7.5 体外BBB模型与在体的相似性评价 选用5个已知具有血脑屏障透过性的化合物作为阳性药进行体外BBB通透性测定,其体内数据如Tab 1所示。测定方法为:待“EPA”模型培养至d 7后,用无血清的DMEM轻轻漂洗模型2~3次,每孔加入200 μL浓度为200 μmol·L-1的阳性药无血清DMEM溶液,外侧加入1.2 mL无血清DMEM,60 min后从池外侧取出100 μL培养液用超高效液相色谱-串联质谱法(UPLC-MS/MS)测定阳性药通过BBB模型的量,通过Artursson系数公式计算其Papp,并与体内数据进行拟合,计算出相关系数。
Tab 1 List of drugs selected for transport study
aValues are calculated using a tissue distribution model in murine reported in Nakagawa (2009)[12].
2.8 色谱与质谱条件色谱柱:Waters BEH C18 (2.1 mm×50 mm, 1.7 μm)柱,保护柱:Waters Van Guard BEH C18 (2.1 mm×5 mm, 1.7 μm);流动相:A:0.1%甲酸乙腈(V/V),B:0.1%甲酸水(V/V),全梯度洗脱;流速:0.35 mL·min-1;柱温:45℃;进样体积:1 μL;质谱采用选择离子监测 (SIR) 扫描模式,以电喷雾离子源(ESI)在正离子电离模式下进行测定,以艾司唑仑为内标,用于定量的离子对分别为m/z 267.3(阿替洛尔)、m/z 455.6(维拉帕米)、m/z 189.2(安替比林)、m/z 195.2(咖啡因)、m/z 375.9 (羟嗪)、m/z 261.2(普萘洛尔)、m/z 295.2(艾司唑仑);锥孔电压分别为:40 V、50 V、40 V、40 V、45 V、40 V、45 V、40V。

3 结果
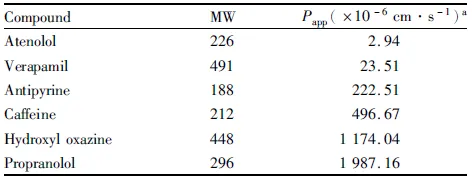
3.1 倒置显微镜观察细胞形态将原代培养的BMECs、BMPC、AS置于倒置显微镜下观察。BMECs呈典型的铺路卵石样结构,并呈漩涡状分布;BMPC胞体较大且呈分枝状;AS有细长突触,胞质较浅,如Fig 2所示。
3.2 免疫细胞组化染色DAB显色后,胞质显棕色则为阳性反应。如Fig 3所示,BMECs阳性表达Ⅷ因子相关抗原,AS阳性表达GFAP,BMPC阳性表达α-SMA和NG2,证明所分离细胞正确。
Fig 2 Cell morphology(×100)
A: BMECs; B: BMPC; C: AS

Fig 3 Characterization of primary cells by immunocytochemistry microscopy(×100)
(A),(C),(E)is the negative control of BMECs,BMPC and AS respectively. BMECs express factor-VIII relative antigen(B), while astrocytes are positive for GFAP(D). Pericytes give a positive immunostaining for α-SMA(F) and NG2(G).
3.3 TEER及Na-FLU通透量测定如Fig 4、Fig 5所示,培养至d 7后,BMECs单层模型(E00)的TEER值最低,Na-FLU通透量最高,二元(EA0/EP0)和三元(EAP/EPA)共培养模型的TEER值明显高于(P<0.01)且Na-FLU通透量明显低于(P<0.05)单层培养模型。其中以三元共培养模型EPA最优,其TEER值为(478±25)Ω·cm2,明显高于EAP组(P<0.01),其Na-FLU的Papp为[(8.23±0.78)×10-6]cm·s-1,明显低于EAP组(P<0.05)。
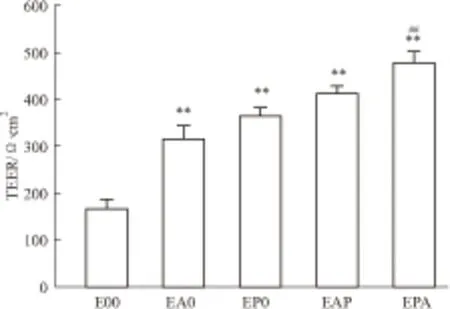
Fig 4 Transendothelial electrical resistance of the differentin vitro blood-brain barrier ±s,n=5)
**P<0.01vsE00 group;##P<0.01vsEAP group

Fig 5 Apparent permeability coefficient for sodium fluorescent of the different in vitro blood-brain barrier ±s,n=5)
*P<0.05,**P<0.01vsE00 group;#P<0.05vsEAP group
3.4 AKP及γ-GT1的表达测定培养至d 7后,BMECs单层模型(E00)的AKP及γ-GT1的表达均低最低,二元(EA0/EP0)和三元(EAP/EPA)共培养模型均可明显促进BMECs表达AKP(P<0.01)和γ-GT1(P<0.01),其中以三元共培养模型EPA的AKP和γ-GT1表达最高,均明显高于EAP组(P<0.01,P<0.05),见Fig 6、Fig 7。
3.5 体外BBB模型与在体的相似性评价如Fig 8所示,6个阳性药在体外BBB模型中的Papp与体内实验数据相比具有较好的相似性,r2=0.92。
4 讨论
从上世纪80年代以来,体外BBB模型的建立一直是人们研究的热点,但到目前为止,还未有一个统一的标准来对其进行规范,导致用于体外BBB建立所用的细胞种类、种属来源以及模型指标等均具有较大差别。尽管如此,本研究采用同种属的BMECs与BMPC、AS共培养建立一个稳定、可靠以及尽可能接近在体状态的体外BBB模型,并通过对一元模型(E00)、二元共培养模型(EA0/EP0)以及三元共培养模型(EAP/EPA)进行多个指标对比,以选出最优模型,为今后体外BBB模型的建立提供参考。

Fig 6 Expression of AKP of the different in vitroblood-brain barrier ±s,n=5)
**P<0.01vsE00 group;##P<0.01vsEAP group
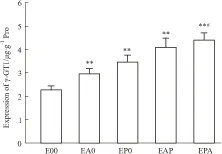
Fig 7 Expression of γ-GT1 of the different in vitroblood-brain barrier ±s,n=5)
**P<0.01vsE00 group;#P<0.05vsEAP group

Fig 8 Correlation between Papp of drugs tested at thein vitro blood-brain barrier model(in vitro Papp)and the Pappof the same drugs measured in animal models(in vivo Papp)
能否获得纯度较高的原代细胞是决定体外BBB模型质量的关键。本研究前期已建立了较为完善的BMECs分离及培养方法,而AS的分离较为简单,只需通过筛网过滤、差速贴壁及摇床振摇的方法即可纯化[13]。BMPC的贴壁能力较强,生长周期较长,对生长条件的需求相对于BMECs较低,因此,可通过培养条件选择以及延长培养的方法获得,并通过胰酶分步消化的方法去除贴壁能力较弱的BMECs、神经元细胞以及胶质细胞,最后接种于未经胶原包被的培养瓶中,使贴壁能力较弱的杂细胞不能贴壁生长而进一步纯化。
BMPC和AS均可诱导并维持BBB的功能特性,目前,BMECs与AS共培养模型被广大学者所采用,而BMECs与BMPC共培养模型也有文献报道[14],但BMPC与AS对BBB的诱导作用是否具有协同促进作用,未见相关文献报道。本研究不仅对5种模型的TEER及Na-FLU进行测定,还对其特异性酶AKP和γ-GT1进行了验证。所有指标均表明,二元共培养模型优于一元模型,并且BMPC对BBB的调节作用优于AS;三元共培养模型优于二元共培养模型,说明BMPC与AS对BBB的诱导调节具有协同促进作用。此外,EPA模型的各指标均为最优,并且其与在体状态的解剖结构最为接近,是体外BBB的最佳模型。为了更直观地反映体外BBB模型与在体状态的相似程度,本研究采用6个具有BBB透过性的化合物进行体外筛选,并与体内数据进行比对,其相关性达0.92,表明本研究所建立的体外BBB模型与在体具有较高的相关性。
综上所述,采用大鼠BMECs与BMPC、AS共培养可建立稳定、可靠、功能和结构与在体相似的体外BBB模型,为BBB的生理病理研究以及跨BBB药物筛选提供了良好工具,并为今后体外BBB模型的建立提供参考价值。
[1] Cecchelli R, Berezowski V, Lundquist S, et al. Modelling of the blood-brain barrier in drug discovery and development[J].NatRevDrugDiscov,2007,6(8):650-61.
[2] Panula P, Joo F, Rechardt L. Evidence for the presence of viable endothelial cells in cultures derived from dissociated rat brain[J].Experientia, 1978, 34(1):95-7.
[3] 李 珺,彭 亮,黄胜和,等.体外血脑屏障的建立和发展[J].广东医学,2009,30(4):647-8.
[3] LI J,Peng L,Huang S H,et al.Establishment and development of aninvitromodel of the blood-brain barrier[J].GuangdongMedJ,2009,30(4):647-8.
[4] Abbott N J, Ronnback L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier[J].NatRevNeurosci,2006,7(1):41-53.
[5] Neuwelt E, Abbott N J, Abrey L, et al. Strategies to advance translational research into brain barriers[J].LancetNeurol,2008,7(1):84-96.
[6] Haseloff R F, Blasig I E, Bauer H C, Bauer H. In search of the astrocytic factor(s) modulating blood-brain barrier functions in brain capillary endothelial cellsinvitro[J].CellMolNeurobiol,2005,25(1):25-39.
[7] Zozulya A, Weidenfeller C, Galla H J. Pericyte-endothelial cell interaction increases MMP-9 secretion at the blood-brain barrierinvitro[J].BrainRes,2008,89(16):1-11.
[8] Hill J, Rom S, Ramirez S H, Persidsky Y. Emerging roles of pericytes in the regulation of the neurovascular unit in health and disease[J].JNeuroimmunePharmacol, 2014,9(5):591-605.
[9] 秦伟伟,修瑞娟,史晓瑞.周细胞在血脑屏障中的作用[J].国际脑血管病杂志,2010,18(9):711-5.
[9] Qin W W,Xiu R J,Shi X R.Roles of pericytes in blood-brain barrier[J].IntJCerebrovascDis,2010,18(9):711-5.
[10] Thanabalasundaram G, Schneidewind J, Pieper C, Galla H J. The impact of pericytes on the blood-brain barrier integrity depends critically on the pericyte differentiation stage [J].IntJBiochemCellBiol,2011,43(9):1284-93.
[11]查雨锋,张 顺,苏 航,等.一种高纯度和高活力的大鼠脑微血管内皮细胞的提取及原代培养方法[J]. 中国药理学通报,2014,30(11),1616-9.
[11] Zha Y F,Zhang S,Su H,et al. A high purified and active extract and primitive culture method for rat microvascular endothelial cells[J].ChinPharmacolBull, 2014,30(11),1616-9.
[12] Nakagawa S,Deli M A,Kawaguchi H,et al.A new blood-brain barrier model using primary rat brain endothelial cells,pericytes and astrocytes[J].NeurochemInt,2009,54(3):253-63.
[13] 汤婷婷,官志忠,禹文峰.SD大鼠大脑皮层星形胶质细胞的体外原代培养[J]. 贵阳医学院学报,2014,39(2):158-61.
[13] Tang T T,Guan Z Z,Yu W F.Primary culture of cerebral cortical astrocytes from SD ratsinvitro[J].JGuiyangMedColl,2014,39(2):158-61.
[14] 鹿文葆,秦伟伟,张秋菊,等.脑微血管内皮细胞与周细胞共培养构建体外血脑屏障模型[J]. 国际脑血管病杂志,2012,5(20):338-42.
[14] Lu W B,Qin W W,Zhang Q J,et al. Establishment of aninvitroblood-brain barrier model by co-culturing brain microvascular endothelial cells and pericytes [J].IntJCerebrovascDis,2012,5(20):338-42.
Establishment of aninvitroblood-brain barrier model by co-culturing rat brain microvascular endothelial cells, pericytes and astrocytes
ZHA Yu-feng1, FU Xiao-zhong1, ZHANG Shun1, LUO Min1, OU Yu3, DONG Yong-xi1,WANG Ai-min1, WANG Yong-lin2
(1.EngineeringResearchCenterfortheDevelopmentandApplicationofEthnicMedicineandTCM,MinistryofEducation,SchoolofPharmacy,GuiyangMedicalUniversity,Guiyang550004,China; 2.GuizhouProvincialKeyLaboratoryofPharmaceutics,GuiyangMedicalUniversity,Guiyang550004,China; 3.DeptofPharmacy,GuiyangWomenandChildren’sHospitalandHealthInstitute,Guiyang550001,China)
Aim To establishinvitroblood-brain barrier (BBB) model with characteristics of simulation ofinvivoBBB by primitive co-culture of brain-microvessel endothelial cells (BMECs) with brain-microvessel pericytes (BMPC) and astrocytes (AS). Methods BMECs, BMPC and AS from SD rats were primitively isolated, purified and cultured, and then primitive culture cells were identified by cellular morphological and immunocytochemical staining methods. Five types ofinvitroBBB models were established by using Millicell culture insert (pore diameter 0.4 μm) and their barrier functions were evaluated by detection of transendothelial electrical resistance (TEER), permeability of sodium fluorescent (Na-FLU), expression of alkaline phosphatase (AKP) and γ-glutamyl transpeptidase(γ-GT1), and similarity of permeation amount for positive drugsinvitroandinvivoBBB conditions. Results Primitive culture of BMECs presented typical pebbles-like structure, BMPC presented larger soma with branching property, AS presented slender synapse and shallower cytoplasm. Moreover, immunocytochemical staining results identified primitive cells were targeted cells. TEER value for co-culture of BMECs, BMPC and AS reached (478±25)Ω·cm2, permeability coefficients (Papp) value of Na-FLU was [(8.23±0.78) ×10-6]cm·s-1, expression of AKP and γ-GT1 were (6.90±0.27) King unit· g-1Pro and (4.39±0.32) μg· g-1Pro respectively. Moreover, good correlation could be found inPappfor positive controlsinvitroandinvivoBBB models (R2=0.92). Conclusion The establishedinvitroBBB model by using primitive co-culture of BMECs with BMPC and AS possessesinvivoBBB properties in cell morphology, structures and barrier functions, and can be used as a powerful tool for studying physiology, pathology of BBB and screening candidate compounds.
primitive culture; brain microvascular endothelial cells; pericytes; astrocytes; blood-brain barrier; morphology; immunocytochemistry
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.027.html
2015-02-10,
2015-03-13
国家自然科学基金资助项目(No 81260473);贵州省中药现代化科技产业研究开发专项项目(黔科合中药字2012-3013号) ;贵州省优秀青年科技人才培养对象专项基金(2013-45号);贵州省中药现代化科技产业研究开发专项(黔科合重G字[2013] 4001)
查雨锋(1988-),男,硕士生,研究方向:药物化学及药理学,E-mail: 260901461@qq.com; 傅晓钟(1972-),男,博士,教授,硕士生导师,研究方向:药物化学,共同第一作者,Tel:0851-6908568,E-mail: xiaozhong_fu@sina.com
10.3969/j.issn.1001-1978.2015.05.027
A
1001-1978(2015)05-0730-06
R-332;R322.81;R329.2;R331.37