石榴皮多酚有效部位单次给药毒性及对无水乙醇致大鼠胃溃疡的保护作用
史李娜,王雪飞,马桂芝,康金森,高晓黎
(新疆医科大学 1.药学院、2.药理教研室、3.药物分析教研室,新疆 乌鲁木齐 830000)
石榴皮多酚有效部位单次给药毒性及对无水乙醇致大鼠胃溃疡的保护作用
史李娜1,王雪飞2,马桂芝3,康金森2,高晓黎1
(新疆医科大学 1.药学院、2.药理教研室、3.药物分析教研室,新疆 乌鲁木齐 830000)
目的 研究石榴皮多酚有效部位对小鼠单次给药毒性,评价其安全性,为新药研发和临床用药提供理论依据。观察石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡的保护作用。方法 选择健康昆明种小鼠50只,随机分为5组,每组10只,分别灌胃给予不同剂量的石榴皮多酚有效部位,连续观察14 d,每日记录各组小鼠一般情况、毒性反应及死亡情况,采用Bliss 法计算半数致死量。选择健康大鼠70只,随机分为:正常组、模型组(等体积生理盐水)、三九胃泰颗粒组(1 850 mg·kg-1)、枸橼酸铋钾组(33 mg·kg-1)和石榴皮多酚有效部位低、中、高剂量组(430、852、1 704 mg·kg-1),连续灌胃10 d;d 10,除正常组外,其余各组采用无水乙醇灌胃(每只1.5 mL)致大鼠胃溃疡;计算各组胃溃疡指数、溃疡抑制率、观察胃黏膜组织形态学改变、测定胃黏膜组织中PGE2、NO、SOD、MDA含量。结果 石榴皮多酚有效部位的半数致死量(LD50)为8 520.9 mg·kg-1,其95%的可信限范围为(7 291.2~9 914.4) mg·kg-1;病理学显示,给药剂量为16 000 mg·kg-1的小鼠脏器有不同程度的损伤。实验表明,与模型组比较,石榴皮多酚有效部位对胃黏膜损伤有明显修复作用,且明显升高胃溃疡大鼠胃黏膜NO含量、提高胃溃疡大鼠胃黏膜SOD活性及降低MDA含量、增加PGE2含量。结论 石榴皮多酚有效部位给药剂量为5 063 mg·kg-1未出现死亡,随着石榴皮多酚有效部位给药剂量的增加,给药剂量为16 000 mg·kg-1可造成小鼠的心、肝、肺、肾脏有不同程度的损伤,甚至导致死亡。石榴皮多酚有效部位的LD50为8 520.9 mg·kg-1,其95%的可信限范围为(7 291.2~9 914.4) mg·kg-1。石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡具有良好的保护作用,这种作用可能与促进胃溃疡上皮细胞合成、提高再生黏膜功能、增强抗氧化能力和诱导、促进NO合成有关。
石榴皮多酚有效部位;单次给药毒性;半数致死量;胃溃疡;PGE2;NO;SOD;MDA
消化性溃疡(PU)是发生在胃和十二指肠的慢性溃疡,是消化系统的常见病、多发病[1],目前以攻击因子[2](主要指胃酸、胃蛋白酶)与防御因子[3-7](主要包括胃黏膜血流量、碳酸氢盐和黏液的分泌、细胞膜完整性、细胞再生以及前列腺素生成等)失衡为主[8]。石榴(PunicagranatumL.)别名安石榴、甘石榴等,是石榴科石榴属的落叶灌木或小乔木[9]。我国引入栽培后,各省都有分布,其中,新疆石榴的栽培面积和产量均居全国第一,是新疆和田、喀什等产地特色果品。其果皮、籽、花均可入药,以石榴皮的药用最为显著。近年的药理学研究表明,石榴皮具有抗氧化[10]、抗炎、广谱抗菌、抗病毒[11]、抗癌[12]、降血糖[13]、降脂、预防动脉粥样硬化[14]、保护心血管系统[15]、保护消化性溃疡[16]、降低神经退化、免疫调节、改善肾功能[17]、抗腹泻等药理作用。研究证明,石榴皮提取物对多种原因引起的消化系统有保护作用,如石榴皮提取物对大鼠阿司匹林和酒精引发的胃溃疡有保护作用[18]。石榴皮多酚有效部位以安石榴苷、鞣花酸、没食子酸为主要成分。本实验以中试制备的石榴皮多酚有效部位为供试物,观察其对小鼠的单次给药毒性及对无水乙醇致大鼠胃溃疡的保护作用,为其进一步的临床开发应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 昆明种小鼠,SPF级,♀♂各半,体质量20~22 g,由新疆医科大学实验动物中心提供, 合格证号:SCXK(新)2003-0001。Wistar 大鼠,SPF级,♀♂各半,体质量180~220 g,由新疆医科大学实验动物中心提供,合格证号:SYXK(新)2011-0004。
1.1.2 药物与试剂 石榴皮(采集于新疆喀什市疏附县伯什克然木乡、阿瓦提乡);石榴皮多酚有效部位(新疆医科大学药剂教研室制备,批号:20121212);三九胃泰颗粒(华润三九制药有限公司,批号:1307014);枸橼酸铋钾颗粒(丽珠集团丽珠制药厂,批号:1308351);一氧化氮测试盒(南京建成生物工程研究所,批号:20140307);丙二醛测试盒(南京建成生物工程研究所,批号:20140310);SOD试剂盒(南京建成生物工程研究所,批号:20131129);PGE2试剂盒(上海原叶进口分装,批号:20140301A);考马斯亮兰试剂盒(南京建成生物工程研究所,批号:20140417)。
1.1.3 仪器 AL204-N电子天平(梅特勒-托利多仪器上海有限公司);TD5A-WS离心机、TDL-5M冷冻离心机(长沙湘仪离心机仪器有限公司);HH-S4数星恒温水浴锅(金坛市医疗仪器厂);680 酶标仪(日本);DHP-9082电热恒温培养箱(上海一恒科技有限公司);UV-2550紫外可见分光光度计(日本岛津);游标卡尺(上海九量五金工具有限公司)。
1.2 实验方法
1.2.1 石榴皮多酚有效部位中试工艺流程
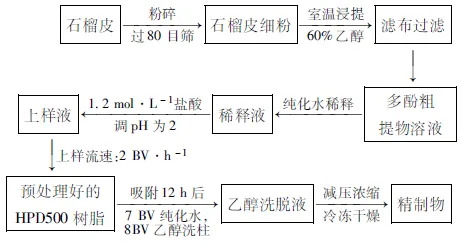
1.2.2 石榴皮多酚有效部位最大浓度的配制方法 精密称取中试产品石榴皮多酚有效部位粉末4.35 g,用3 mL生理盐水配成1 450 g·L-1混悬液。
1.2.3 石榴皮多酚有效部位对小鼠单次给药毒性试验
1.2.3.1 预试验 取昆明种小鼠10只,♀♂各半,每组5只,适应性喂养3 d后,随机分为2组:石榴皮多酚有效部位组和生理盐水对照组。实验前禁食不禁水12 h后,石榴皮多酚有效部位组给药量为29 000 mg·kg-1,按0.2 mL·10 g-1灌胃给药1次,对照组灌胃等体积的生理盐水,灌胃后连续观察3 d,结果小鼠全部死亡。根据小鼠的死亡情况对给药剂量作适当的调整,分别找出石榴皮多酚有效部位引起动物死亡的LD100值(100%死亡率)、LD0值(0%死亡率)和相应的剂量组间距r值,进行LD50值的测定。经预试验得出,石榴皮多酚有效部位的最小全致死量(Dm)为16 000 mg·kg-1,最大全不致死量(Dn)为5 000 mg·kg-1,正式试验设定5个剂量组,求出剂量比,确定r值为0.75。
1.2.3.2 石榴皮多酚有效部位半数致死量LD50的测定 昆明种小鼠50只,♀♂各半,体质量18~22 g,按性别和体重随机分为A、B、C、D、E 5个组,每组10只,各组剂量按1 ∶0.75的比例进行设置为16 000、12 000、9 000、6 750、5 063 mg·kg-1;各组动物禁食不禁水12 h后,分别以上述5个剂量的石榴皮多酚有效部位进行灌胃,灌胃体积为0.2 mL·10 g-1,灌胃1次,灌胃后观察每组小鼠给药后的反应并记录小鼠的精神状态、行为活动、饮食饮水、死亡情况等,连续观察14 d,对死亡小鼠及时解剖,肉眼观察主要脏器体积、颜色和质地的变化,对异常脏器进行组织病理学检查。
1.2.3.3 LD50计算 LD50采用Bliss几率单位法进行计算。
1.3 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡的保护作用
1.3.1 动物分组、造模与给药 Wistar 大鼠70只,♀♂各半,体质量180~220 g,按性别和体重随机分为正常组、模型组(给予生理盐水1 mL·100 g-1)、三九胃泰颗粒组(中药对照组,1 850 mg·kg-1)、枸橼酸铋钾颗粒组(西药对照组,33 mg·kg-1)、石榴皮多酚有效部位低、中、高剂量组(给药剂量根据LD50值的1/5、1/10、1/20计算为430、852、1 704 mg·kg-1),每组10只。各组大鼠按设定剂量灌胃给药,灌胃体积为1 mL·100 g-1,每天1次,连续灌胃给药10 d。d 9给药后禁食不禁水24 h[19],末次灌胃给药2 h后,除正常组外,其余各组均灌胃给予无水乙醇,每只1.5 mL,制备急性胃黏膜损伤模型。1 h后[20],处死大鼠,打开腹腔并结扎贲门和幽门,向胃腔内注入1%甲醛溶液2 mL,取出胃并浸入1%甲醛溶液中,30 min后沿胃大弯剪开胃壁,展平,用冰生理盐水冲洗胃内壁,用小棉球轻轻将胃黏液及血凝块擦掉,在10倍放大镜下观察胃黏膜损伤程度,胃黏膜的完整度、颜色,有无充血、水肿、糜烂、溃疡及瘢痕组织增生等。
1.3.2 观察指标
1.3.2.1 胃黏膜溃疡指数和溃疡抑制率的计算 参照Guth[21]标准,以局限于胃上皮的糜烂、溃疡、出血等的长度累计积分,正常为0分,斑点糜烂计1分,糜烂长度<1 mm计2分,1~2 mm计3分,3~4 mm计4分,>4 mm计5分,各分值相加为该动物的损伤指数总分。按下列公式计算溃疡抑制率:溃疡抑制率/%=(对照组溃疡指数-给药组溃疡指数) /对照组溃疡指数×100%。
1.3.2.2 胃黏膜组织形态学观察 从胃窦至胃体取一条状组织,用4%多聚甲醛固定,梯度乙醇脱水,常规石蜡包埋切片,HE染色,光镜下进行组织形态学观察。
1.3.2.3 胃黏膜PGE2、NO、SOD、MDA含量测定 将“1.3.2.2”项下取完条状组织后余下鼠胃,于冰浴上用滤纸吸干,迅速刮去胃黏膜,于-70℃冰箱贮藏,备用。称重,用冰生理盐水制成10%胃黏膜组织匀浆。4℃下2 500 r·min-1离心10 min,取上清液,检测步骤均严格按试剂盒说明书进行NO、MDA、SOD、PGE2的测定。

2 结果
2.1 单次给药毒性试验结果
2.1.1 石榴皮多酚有效部位对小鼠死亡率的影响及LD50的计算 各组小鼠的死亡多发生在灌胃后24~72 h内,小鼠的死亡率随剂量的增加而增高。小鼠灌胃给予石榴皮多酚有效部位的 LD50=8 520.9 mg·kg-1; LD5095%的可信限=(7 291.2~9 914.4) mg·kg-1。石榴皮多酚有效部位对小鼠死亡率的影响见Tab 1。
Tab 1 Effect of polyphenols’ effective parts from P.
2.1.2 石榴皮多酚有效部位对小鼠精神状态及行为活动的影响 低剂量组A中,小鼠未出现明显的毒性反应,且无1例死亡;剂量组B中,个别小鼠出现呼吸频率减慢,行动迟缓,严重者甚至死亡;高剂量组C、D、E中,小鼠灌胃72 h内出现不同程度的毒性反应,具体表现为呼吸频率减慢、精神萎靡、眼眯趴伏、自发活动减少、行动迟缓、蜷缩、对刺激性反应减弱等现象,严重者甚至死亡。随给药剂量增大,毒性反应症状越明显、严重,死亡数目增加。
2.1.3 石榴皮多酚有效部位最大剂量组对主要脏器毒性作用的病理学观察 大体解剖观察死亡小鼠的心、肝、脾、肺和肾脏,与对照组相比,均无明显变化。但从病理组织切片显示,最大给药剂量为16 000 mg·kg-1小鼠的脏器组织有不同程度的损伤:肝脏组织中有的发生不同程度的充血,少数细胞出现固缩、变性;心、肺、肾脏组织发生不同程度的充血,见Fig 1。
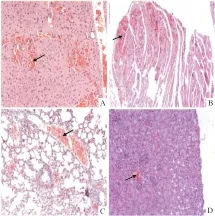
Fig 1 Effect of polyphenols’ effective parts from P. granatum in the maximal dose on the pathological morphology in the main organs of mice(HE×200)
2.2 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡保护作用的结果
2.2.1 胃黏膜溃疡指数与溃疡抑制率 与正常组比较,模型组胃溃疡指数明显升高,说明模型制备成功;与模型组比较,石榴皮多酚有效部位高、中剂量组大鼠胃溃疡指数明显降低(P<0.01),均能明显抑制大鼠乙醇型胃黏膜损伤,溃疡抑制率分别为98%、76%;且效果优于枸橼酸铋钾,见Tab 2。

Tab 2 Effect of effective parts of pomegranate peel polyphenols on UI of gastric ulcer in ethanol-induced ±s,n=10)
##P<0.01vsmodel control group
2.2.2 胃黏膜病理组织切片观察 HE染色后,光镜下观察可见,正常组大鼠胃窦皱壁均匀分布,上皮细胞排列规则,黏膜肌、腺体、黏膜下层及肌层结构正常。模型组大鼠,乙醇所致胃窦黏膜皱壁表面变性、崩解,部分黏膜上皮细胞呈嗜酸性坏死或融合成片状结构,腺体未见病变,黏膜肌下各层结构正常。石榴皮多酚有效部位低剂量组,大鼠胃窦部黏膜皱壁上皮排列整齐,无明显病变,但部分黏膜表层变性、脱落,固有层无明显炎细胞浸润,腺体结构正常。石榴皮多酚有效部位中剂量组,大鼠胃窦部分黏膜上皮完整,腺体结构正常,黏膜层厚度较低剂量组厚,但有部分黏膜变性、坏死,结构不清。石榴皮多酚有效部位高剂量组,大鼠大部分胃窦黏膜比较完整,上皮细胞有轻度变性,固有层未见明显炎细胞浸润,黏膜下层肌结构正常,见Fig 2、3。
2.2.3 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡PGE2含量影响 与模型组相比,枸橼酸铋钾组、石榴皮多酚有效部位中、高剂量组胃黏膜组织中PGE2含量明显增高(P<0.05),见Tab 3。
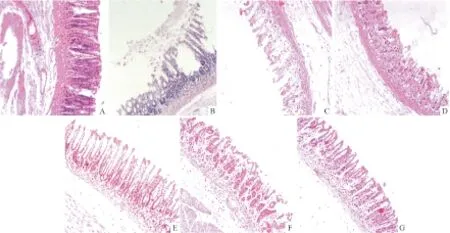
Fig 2 Effect of effective parts of pomegranate peel polyphenols on the pathological morphology in ethanol-induced rats(HE×200)
A:Normal control; B:Model control;C:Sanjiuweitai particles;D:Colloidal bismuth subcitrate;E:Low dose;F:Middle dose;G:High dose
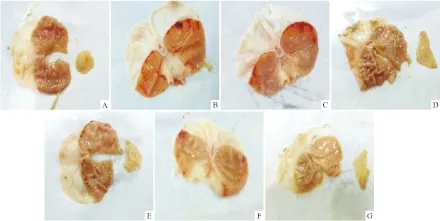
Fig 3 Effect of effective parts of pomegranate peel polyphenols on ethanol-induced rats
A:Normal control; B:Model control;C:Sanjiuweitai particles;D:Colloidal bismuth subcitrate;E:Low dose; F:Middle dose;G:High dose
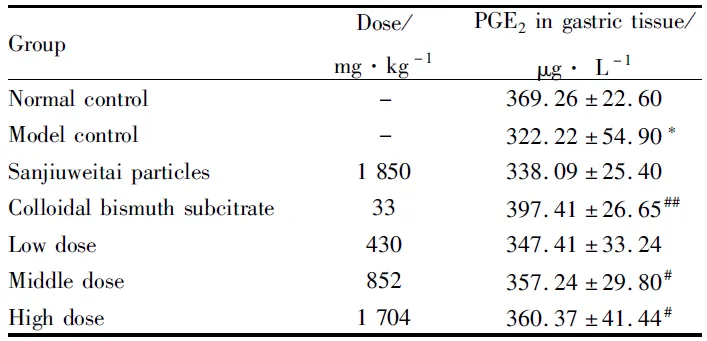
GroupDose/mg·kg-1PGE2ingastrictissue/μg·L-1Normalcontrol-369.26±22.60Modelcontrol-322.22±54.90*Sanjiuweitaiparticles1850338.09±25.40Colloidalbismuthsubci-trate33397.41±26.65##Lowdose430347.41±33.24Middledose852357.24±29.80#Highdose1704360.37±41.44#
*P<0.05vsnormal control group,#P<0.05,##P<0.01vsmodel control group
2.2.4 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡NO含量的影响 与模型组比较,枸橼酸铋钾组、石榴皮多酚有效部位高剂量组能明显提高无水乙醇损伤性胃黏膜组织内NO水平(P<0.05),见Tab 4。

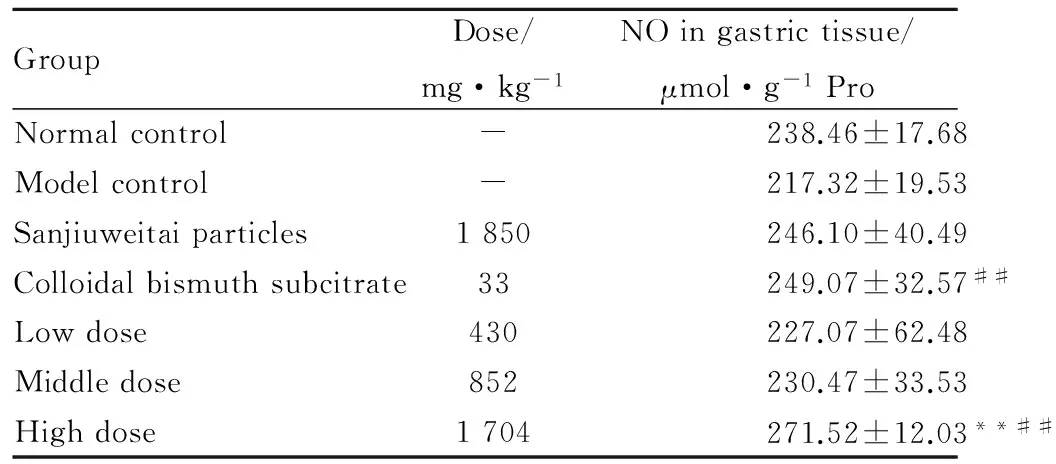
GroupDose/mg·kg-1NOingastrictissue/μmol·g-1ProNormalcontrol-238.46±17.68Modelcontrol-217.32±19.53Sanjiuweitaiparticles1850246.10±40.49Colloidalbismuthsubcitrate33249.07±32.57##Lowdose430227.07±62.48Middledose852230.47±33.53Highdose1704271.52±12.03**##
**P<0.01vsnormal control group;##P<0.01vsmodel control group
2.2.5 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡SOD活性的影响 与模型组比较,石榴皮多酚有效部位高剂量组能提高大鼠胃黏膜SOD活力(P<0.01),见Tab 5。
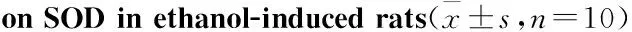
GroupDose/mg·kg-1SODingastrictissue/μmol·g-1ProNormalcontrol-200.97±36.50Modelcontrol-157.57±33.00**Sanjiuweitaiparticles1850153.95±23.53**Colloidalbismuthsubcitrate33175.54±31.21Lowdose430142.35±18.99**Middledose852155.04±15.92**Highdose1704187.01±19.47**#
**P<0.01vsnormal control group;#P<0.05vsmodel control group
2.2.6 石榴皮多酚有效部位对无水乙醇致大鼠胃溃疡MDA含量的影响 与正常组比较,模型组大鼠胃黏膜组织中MDA含量增加;与模型组比较,枸橼酸铋钾组、石榴皮多酚有效部位中、高剂量组可明显降低MDA含量(P<0.01),见Tab 6。
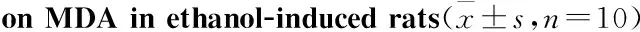

GroupDose/mg·kg-1MDAingastrictissue/μmol·g-1ProNormalcontrol-73.77±36.48Modelcontrol-97.87±51.59Sanjiuweitaiparticles185072.11±41.90Colloidalbismuthsubcitrate3365.32±31.98##Lowdose43087.16±18.01Middledose85254.35±17.71##Highdose170440.63±12.35*##
*P<0.05vsnormal control group;##P<0.01vsmodel control group
3 讨论
石榴皮多酚作为石榴皮中一种重要的生理活性成分,其主要成分为安石榴苷、鞣花酸、没食子酸。根据单次给药毒性试验结果,石榴皮多酚有效部位的LD50为8 520.9 mg·kg-1,其95%的可信限范围为(7 291.2~9 914.4) mg·kg-1,根据全球统一毒性分级系统标准,石榴皮多酚有效部位毒性未分类;根据欧盟毒性分级标准未分类,故石榴皮多酚有效部位在一定浓度范围内临床使用较安全。
胃溃疡发病的原因比较复杂,一般认为是多种原因引起胃黏膜损伤,导致对胃酸、胃蛋白酶的抵御能力降低,从而出现溃疡症状。溃疡病理模型可用化学性、物理性刺激以及通过应激状态诱发。乙醇诱导的胃溃疡模型较其它胃溃疡模型制备方法简单,溃疡发生率高,并且乙醇引起的胃黏膜急性损伤机制明确,有利于研究中药对溃疡预防和保护的机制。
本实验采用乙醇诱导的胃黏膜急性损伤模型,观察石榴皮多酚有效部位对大鼠急性胃溃疡的保护作用。实验结果表明,石榴皮多酚有效部位能明显降低急性胃溃疡大鼠的溃疡指数,并有促进溃疡愈合的作用。PGE2是由胃黏膜内花生四烯酸或亚油酸在环氧酶催化下合成的,具有促进胃黏膜上皮细胞分泌黏液与碳酸氢盐、维持黏膜完整性、抑制胃酸分泌和刺激组织修复来促进溃疡愈合的作用。石榴皮多酚有效部位中、高剂量组与模型组比较有明显差异,说明石榴皮多酚有效部位可促进胃溃疡大鼠上皮细胞合成分泌PGE2,增强胃黏膜防御功能,提高再生黏膜功能,这可能是其促进胃溃疡愈合的机制之一。
NO作为一种内源性血管舒张因子,能调节胃酸和胃黏液分泌及碳酸氢盐生成,在维持黏膜完整性和黏膜防御中直接发挥作用[22],从而与胃溃疡修复之间存在密切联系。研究表明,石榴皮多酚有效部位可以提高无水乙醇型大鼠胃溃疡模型胃黏膜组织中NO含量,说明该药物可能有增强胃黏膜屏障作用。
SOD是机体内一种重要的内源性氧自由基清除剂,具有修复细胞的功能,故机体内环境中SOD活性的高低间接性反映机体清除自由基的能力。MDA是脂质过氧化反应得到的终末产物,在体内的含量可反映脂质过氧化的程度,从而间接反映出细胞受损程度。本实验结果显示,石榴皮多酚有效部位可提高SOD活性及降低MDA含量,表明石榴皮多酚有效部位能增强胃溃疡大鼠的抗氧化能力,进而抑制溃疡的发生和发展。
综上所述,石榴皮多酚有效部位可提高无水乙醇致胃溃疡模型大鼠中PGE2、NO水平、SOD活性及降低MDA含量,对无水乙醇致大鼠胃溃疡模型具有胃黏膜保护作用,其机制可能与促进胃溃疡上皮细胞合成、增强胃黏膜防御功能,维持黏膜屏障的完整性,进而减少自由基生成、降低抗脂质过氧化反应酶的消耗和调控NO水平有关。
[1] 周龙平,韦玉琼.消化性溃疡的药物治疗及进展[J].中外健康文摘,2009,6(24):42-4.
[1] Zhou L P,Wei Y Q.Progress in pharmacotherapy of peptic ulcer[J].WorldHealthDigestMedPeriod,2009,6(24):42-4.
[2] 古学文,廖永州.疏肝健脾活血法对胃溃疡患者胃黏膜表皮生长因子及受体表达的影响[J].广州中医药大学学报,2010,27(2):113-5.
[2] Gu X W,Liao Y Z.Effect of therapy of soothing liver,strengthening spleen and activating blood on expression of epidermal growth factor and its receptor in patients with gastric ulcer[J].JGuangzhouUnivTraditChinMed,2010,27(2):113-5.
[3] Shay H,Komarov S A,Fels S S,et al.A simple method for the uniform production of gastric ulceration in the rat[J].Gastroenterol,1945,5(1):43-61.
[4] 张双霞,李光迪,于晓辉,张方信.根除幽门螺杆菌对慢性胃炎和胃溃疡组织中MIF蛋白表达的影响[J].西安交通大学学报:医学版,2009,30(6):724-8.
[4] Zhang S X,Li G D,Yu X H,Zhang F X.Effect of Helicobacter pylori infection on macrophage migration inhibitory factor protein expression in patients with chronic gastritis and gastric ulcer precancerous lesions[J].JXi’anJiaotongUniv(MedSci),2009,30(6):724-8.
[5] 梅武轩,曾常春,余 娜.健脾活血中药对胃溃疡大鼠H,K-ATP酶及壁细胞胃泌素受体作用的影响[J].时珍国医国药,2009,20(11):2778-80.
[5] Mei W X,Ceng C C,Yu N.Effects of jianpi huoxue recipe on the activities of H,K-ATPase and gastrin receptor in gastric parietal cells of gastric ulcer in rats[J].LishizhenMedMatMedRes, 2009,20(11):2778-80.
[6] Kim J J,Kim N,Lee B H,et al.Risk factors for development and recurrence of peptic ulcer disease[J].KoreanJGastroenterol,2010,56(4):220-8.
[7] 涂朝勇,田 徽,王 建,等.路边菊水煎液抗实验性胃溃疡的研究[J].时珍国医国药,2009,20(10):2595-6.
[7] Tu C Y,Tian H,Wang J,et al.Effect of water-decocted solution from Boltonia indica(L.)on experimental gastric ulcer[J].LishizhenMedMatMedRes,2009,20(10):2595-6.
[8] Okabe S,Pfeiffer C J.Chronicity of acetic acid ulcer in the rat stomach[J].AmJDigDis,1972,17(7):619- 29.
[9] 纪白慧,倪鑫炯,曹玉华.石榴皮抗氧化活性成分的提取及其组分的研究[J].天然产物研究与开发,2012,24(B12):17-22.
[9] Ji B H,Ni X J,Cao Y H.Research antioxidant pomegranate peel extract active ingredients and components[J].JNatProdResDevelopment,2012,24(B12):17-22.
[10] Boussetta T,Raad H,Letteron P,et al.Punicic acid a conjugated linolenic acid inhibits TNFα-induced neutrophil hyperactivation and protects from experimental colon inflammation in rats[J].PLoSOne,2009,4(7):e6458.
[11] Abdollahzadeh S H,Mashouf R,Mortazavi H,et al.Antibacterial and antifungal activities of punica granatum peel extracts against oral pathogens[J].DentistTehranNiversMedSci,2011,8(1):1-6.
[12] Jang A,Srinivasan P,Lee N Y,et al.Comparison of hypolipidemic activity of synthetic gallic acid-linoleic acid ester with mixture of gallic acid and linoleic acid, gallic acid, and linoleic acid on high-fat diet induced obesity in C57BL/6 Cr Slc mice[J].ChemBiolInteract,2008,174(2):109-17.
[13] Vroegrijk I O,van Diepen J A,van den Berg S, et al.Pomegranate seed oil, a rich source of punicic acid, prevents diet-induced obesity and insulin resistance in mice[J].FoodChemToxicol,2011,49(6):1426-30.
[14] Fuhrman B, Volkova N, Aviram M. Pomegranate juice inhibits oxidized LDL uptake and cholesterol biosynthesis in macrophages[J].NutrBiochem, 2005,16(9):570-6.
[15] Lewis S N,Brannan L,Guri A J,et al.Dietary α-eleostearic acid ameliorates experimental inflammatory bowel disease in mice by activating peroxisome proliferator-activated receptor-γ[J].PLoSOne,2011,6(8):e24031.
[16] 邱红梅,赖 舒,尚京川,周岐新.石榴皮提取物对大鼠幽门结扎所致胃损伤的保护作用研究[J].中国药房,2011,22 (7):594-6.
[16] Qiu H M, Lai S,Shang J S,Zhou Q X.Protective effect of the extracts of punica granatum on gastric damage induced by pylorus ligation in rats[J].ChinaPharm,2011,22 (7):594-6.
[17] Lansky E P,Newman R A.Punica granatum(pomegranate)and its potential for prevention and treatment of inflammation cancer[J].Ethnopharmacol,2007,109(2):177-206.
[18] Ajaikumar K B,Asheef M,Babu B H,Padikkala J. The inhibition of gastric mucosal injury by Punica granatum L.(pomegranate)methanolic extract[J].Ethnopharmacol,2005,96(1-2):171-6.
[19] 韦奇志,周 智,陈邦树,刘廷快.胃乐胶囊的抗溃疡作用实验研究[J].广东药学院学报,2000,16(4):300-2.
[19] Wei Q Z,Zhou Z,Chen B S,Liu T K.Experimental study of anti-ulcer effect Weile capsule[J].AcademJGuangdongCollPharm,2000,16(4):300-2.
[20] 赖 舒,周岐新,张 颖,等.石榴皮对实验性胃损伤及相关机制的研究[J].中药药理与临床,2009,25(3):49-51.
[20] Lai S,Zhou Q X,Zhang Y,et al. Effects and mechanisms of the acetone extract obtained from pomegranate bark on the experimental gastric damages[J].PharmacolClinChinMatMed,2009,25(3):49-51.
[21] Guth P H,Aures D,Paulsen G.Topical aspirin plus HCL gastric lesions in the rat[J].Gastroenterol,1979,76(1):88-93.
[22] 符 健,韩 丽,邢桂兰,等.秋茄提取物抗大鼠实验性胃溃疡作用研究.[J].中国药理学通报,2007,23(10):1379-83.
[22] Fu J,Han L,Xiang G L, et al.Study of gastric antiulcer effects on experimental rats of extracts of Kandelia candel[J].ChinPharmacolBull,2007,23(10):1379-83.
Single dose toxicity of polyphenols effective parts fromPunicagranatumand their protective effect on ethanol-induced gastric ulcer in rats
SHI Li-na1,WANG Xue-fei2, MA Gui-zhi3,KANG Jin-sen2, GAO Xiao-li1
(1.CollegeofPharmacy, 2.DeptofPharmacology,3.DeptofPharmaceuticalAnalysis,XingjiangMedicalUniversity,Urumqi830000,China)
Aims To study single dose toxicity of polyphenols effective parts fromPunicagranatum, to evaluate their safety, and thus to provide a theoretical basis for drug development and clinical use. To observe their protective effect on ethanol-induced gastric ulcer in rats. Methods 50 healthy Kunming mice were randomly divided into five groups and given different doses of polyphenols’ effective parts fromPunicagranatumvia intragastric administration.Toxicity and death in each group of mice were observed and recorded after administration for 14 d. The median lethal dose was calculated by Bliss method. 70 rats were randomly divided into normal group, model group(constant volume of normal saline),sanjiuweitai particles(1 850 mg·kg-1) group, colloidal bismuth subcitrate (33 mg·kg-1) group and polyphenols effective parts fromPunicagranatumlow-dose, medium-dose, high-dose(430,852,1 704 mg·kg-1)groups. On the 9th day of 10 days’ gavage, all except the normal group were fed ethanol (1.5 mL/only) to induce gastric mucosal injury in rats with acute gastric ulcer. Gastric ulcer index, the rate of ulcer inhibition were calculated for each group. The morphological changes of gastric mucosa were observed. The gastric mucosa levels of PGE2,NO,SOD and MDA were determined.Results The LD50and 95% confidence limit of the polyphenols’ effective parts fromPunicagranatumwere 8 520.9 mg·kg-1and 7 291.2~9 914.4 mg·kg-1,respectively. Pathology showed that the organs receiving dose of 16 000 mg·kg-1had different degrees of damage .Compared with the model group, the extract fromPunicagranatumsignificantly repaired the gastric mucosa, and significantly increased the gastric mucosa levels of NO and reduced MDA content, and improved SOD content and the levels of PGE2.Conclousion The dose of 5 063 mg·kg-1of polyphenols effective part fromPunicagranatumshowed no death. The dose of 16 000 mg·kg-1of polyphenols effective parts fromPunicagranatumcould cause varying degrees of damage in heart, liver, lung, kidney or the death of mice.The LD50and 95% confidence limit of the polyphenols effective parts fromPunicagranatumwere 8 520.9 mg·kg-1and 7 291.2~9 914.4 mg·kg-1,respectively.The extract fromPunicagranatumplays a protective role against gastric mucosa damage induced by absolute ethanol,and the mechanism may be related to promoting ulcer epithelial cells synthesis, enhancing mucosal regeneration function, regulating NO content and enhancing antioxidant capacity.
effective part of pomegranate peel polyphenols; single dose toxicity;LD50;gastric ulcer;PGE2;NO;SOD;MDA
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.020.html
2015-01-31,
2015-02-30
新疆维吾尔自治区科技支撑计划项目(No 201233135)
史李娜(1990-),女,硕士生,研究方向:新药研发,E-mail:1059129034@qq.com; 高晓黎(1962-),女,博士,教授,研究方向:新药研发,通讯作者,E-mail:xli_g@sina.com
10.3969/j.issn.1001-1978.2015.05.023
A
1001-1978(2015)05-0709-07
R-332;R284.1;R322.44;R573.110.531