耐力运动8周对大鼠骨骼肌收缩功能和线粒体生物合成的影响及机制
邱 霓,李 聪,方伟进,韦雪梅,何玉莲,熊 燕
(广州医科大学药学院,广州蛇毒研究所,广东 广州 510182)
耐力运动8周对大鼠骨骼肌收缩功能和线粒体生物合成的影响及机制
邱 霓,李 聪,方伟进,韦雪梅,何玉莲,熊 燕
(广州医科大学药学院,广州蛇毒研究所,广东 广州 510182)
目的 探讨8周耐力运动对不同类型骨骼肌收缩功能及线粒体能量代谢能力的影响及其机制。方法 分离经8周平台跑步训练的♂ SD大鼠的比目鱼肌和趾长伸肌,观测给予不同方式电刺激后两种类型骨骼肌收缩能力和抗疲劳能力的变化以及ATP含量和线粒体生物合成相关指标的改变。结果 耐力运动8周可一定程度提高比目鱼肌和趾长伸肌在单次电刺激和强直电刺激下的收缩力,明显改善比目鱼肌的抗疲劳能力。ATP含量在两类肌肉中均明显升高,但只有比目鱼肌线粒体DNA、PGC-1α、NRF基因的转录及PGC-1α蛋白明显上调,并伴随p-AMPK/AMPK蛋白比值明显增加。结论 耐力运动8周改善骨骼肌的收缩能力,但仅增加富含氧化型肌纤维的比目鱼肌的抗疲劳能力,这可能与耐力运动激活氧化型肌纤维的AMPK,上调PGC-1α转录和表达,增加线粒体生物合成有关。
耐力运动;比目鱼肌;趾长伸肌;骨骼肌收缩;线粒体生物合成;大鼠模型
骨骼肌占据了全身约45%的重量,在维持机体能量代谢平衡中起着重要的作用;肥胖、2型糖尿病等代谢性疾病常伴随骨骼肌细胞内线粒体功能异常[1-2]。研究表明,肥胖患者骨骼肌线粒体含量减少,呼吸链氧化酶活性降低,呼吸能力减弱;2型糖尿病患者在出现代谢相关基因和线粒体基因表达减少之前就已存在骨骼肌氧化磷酸化水平降低的表现[3]。长期耐力运动被证实可有效改善代谢紊乱,降低代谢性疾病所致的死亡率[4]。
骨骼肌是一类可塑性较高的组织,可根据运动强度、时间发生适应性的改变。有证据表明,短期运动主要促进骨骼肌对葡萄糖的摄取,增加肌肉蛋白质的合成,增强肌肉力量;而长期耐力运动则促使肌肉减少对于糖原和高能磷酸物的利用,能量代谢底物从葡萄糖转变为脂类,乳酸产生减少,从而延缓运动性疲劳的发生[5]。然而,骨骼肌并非由单一类型肌纤维组成,其包括富含线粒体、以有氧代谢为主要能量来源的氧化型纤维和线粒体含量少、以糖酵解方式获取能量的糖酵解纤维等。不同类型肌纤维中线粒体功能的改变对机体能量代谢状态的适应性存在差异。有证据表明,肥胖时以糖酵解型肌纤维为主的骨骼肌中线粒体数量升高,表现为线粒体DNA(mitochondrial DNA, mtDNA)、过氧化物酶体增殖活化受体γ辅助活化因子1α(peroxisome proliferator γ activated receptor coactivator 1α, PGC-1α)、核呼吸因子(nuclear respiratory factor 1/2, NRF 1/2)、线粒体转录因子A(mitochondrial transcription factor A, TFAM)等线粒体标志物的含量和表达水平上调;而以氧化型肌纤维为主的骨骼肌中这些指标无显著变化或下调[6-7]。
现今虽有研究证实运动可改善骨骼肌的线粒体功能,但运动诱发骨骼肌线粒体发生适应性改变的机制尚不明确。因此,本实验采用连续8周平台跑步耐力运动后大鼠模型小腿以其富含氧化型肌纤维的比目鱼肌(soleus, SOL)和富含糖酵解型肌纤维的趾长伸肌(extensor digitorum longus, EDL)为研究对象,探讨长期耐力运动对不同类型骨骼肌收缩和线粒体生物合成的影响及其调控机制,为预防和治疗代谢性疾病,维持机体能量代谢平衡提供实验依据。1 材料与方法
1.1 动物饲养与分组SPF级♂SD大鼠20只,体质量(200±15)g,购自于广东省实验动物中心,动物合格证号为SYXK(粤):2010-0104。所有动物适应性饲养1周后,随机分为对照组和耐力运动组,每组10只。运动采用平台耐力跑步训练法,即每天跑步1次,每周跑步5 d,休息2 d;运动量为每天先以15 m·min-1的速度跑15 min,再以20 m·min-1的速度跑60 min,最后以15 m·min-1的速度跑15 min,连续训练8周。
1.2 骨骼肌收缩功能测定腹腔注射10%水合氯醛(300 mg·kg-1)麻醉大鼠,迅速分离左侧比目鱼肌和趾长伸肌,置于预冷充氧的K-H缓冲液中;将骨骼肌条穿过电极刺激环的中央,固定于恒温37℃、持续充以95% O2和5% CO2混合气体的K-H缓冲液浴槽中平衡,随后分别给予单次刺激(10 V电压、100 ms波宽的脉冲电刺激肌条)、强直刺激[10 V电压、0.2 ms波宽、60 Hz(比目鱼肌)/90 Hz (趾长伸肌)频率的脉冲电刺激肌条2 s]、疲劳刺激[10 V电压,0.5 ms波宽,60 Hz(比目鱼肌)/90 Hz (趾长伸肌)频率的脉冲电刺激肌条,电刺激1 s,休息1 s,依次交替地进行,持续120 s],采用PowerLab八道电生理记录仪和Labchart7数据采集分析系统控制电刺激强度,并记录数据。
1.3 骨骼肌ATP含量检测采用荧光素酶法检测ATP含量,并通过蛋白含量进行最终标化。取20 mg组织加入200 μL裂解液,然后用机械匀浆器充分匀浆,裂解后4 ℃ 12 000×g离心5 min,取20 μL上清并依据试剂盒说明书进行后续实验。ATP含量和BCA蛋白测定试剂盒均购于广州碧云天生物技术有限公司。
1.4 线粒体DNA含量测定酚/氯仿法提取比目鱼肌和趾长伸肌的基因组DNA,取总DNA 100 ng为模板,加入到20 μL PCR反应体系中。PCR产物经1.5% 琼脂糖凝胶电泳后进行凝胶图像分析,以细胞色素C氧化酶亚基Ⅰ(COX Ⅰ)与β-actin的比值反映线粒体基因的合成情况。引物序列和反应条件如Tab 1所示。
1.5 RT-PCR检测PGC-1α、NRF 和UCP2基因转录TRIzol法提取比目鱼肌和趾长伸肌的RNA,取总RNA 500 ng为模板,用TaKaRa公司的逆转录试剂盒合成cDNA。取50 ng cDNA加入到20 μL PCR反应体系中。PCR 产物经1% 琼脂糖凝胶电泳后进行凝胶图像分析。引物序列和反应条件如Tab 1所示。

Tab 1 Sequences of forward and reverse primers for genes
1.6 Western blot检测PGC-1α、磷酸化AMPK和总AMPK蛋白的表达取50 mg 比目鱼肌和趾长伸肌样本,置于500μL预冷的RIPA裂解液中,冰上电动匀浆20s,于4 ℃以12 000×g离心15 min,留取上清,并取30 μg蛋白进行检测。通过ChemiDoxTMXRS+凝胶成像系统采集图像,使用Image J软件进行灰度扫描。其中PGC-1α抗体购自Abcam公司,p-AMPK(Thr172)、AMPK抗体购自Cell Signaling公司。
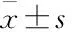
2.1 大鼠骨骼肌收缩功能的变化运动干预8周后,无论是比目鱼肌还是趾长伸肌,给予单次刺激和强直刺激,其收缩能力均呈增强趋势(见Fig 1A-B)。另外,与对照组相比,运动组的比目鱼肌抗疲劳能力增加,但趾长伸肌的抗疲劳能力无明显改善(见Fig 1C-D)。
2.2 大鼠骨骼肌ATP含量的改变与对照组相比,8周运动干预均可提高比目鱼肌和趾长伸肌内的ATP含量,其中比目鱼肌内ATP含量升高约2倍(P<0.05),而趾长伸肌内ATP含量增加达3倍左右(P<0.01),见Fig 2A-B。
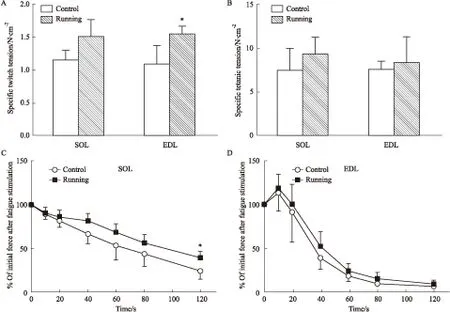
Fig 1 Endurance exercise for 8 weeks increased muscle contractility in SOL and ±s,n=4~5)
A: Twitch tension in SOL and EDL with or without exercise intervention for 8 weeks; B: Titanic tension in SOL and EDL with or without exercise intervention for 8 weeks; C: Percentage of initial force after fatigue stimulation for 120s in SOL; D: Percentage of initial force after fatigue stimulation for 120s in EDL.*P<0.05vscontrol group.

Fig 2 ATP contents increased in SOL(A) and EDL(B) after exercise intervention for 8 ±s,n=4~5)
*P<0.05,**P<0.01vscontrol group.
2.3 运动8周对大鼠骨骼肌线粒体DNA的影响采用COX I与细胞核内β-actin DNA比值以反映线粒体DNA含量。运动干预8周的比目鱼肌内COX I/β-actin的比值明显增加(P<0.05),而趾长伸肌内COX I/β-actin比值无变化(Fig 3A-B),这些结果提示8周耐力运动仅对比目鱼肌线粒体生物合成有促进作用。
2.4 骨骼肌PGC-1α及下游基因mRNA表达水平的改变8周耐力运动可明显上调比目鱼肌内PGC-1α及其下游NRF基因的mRNA水平(P<0.01),但对趾长伸肌中PGC-1α和NRF基因的转录无明显影响。另外,8周耐力运动可明显下调比目鱼肌和趾长伸肌中UCP2 mRNA水平(P<0.05),见Fig 4A-B。
2.5 骨骼肌PGC-1α蛋白表达水平的改变与对照组相比,8周耐力运动上调比目鱼肌中PGC-1α蛋白水平(P<0.05),但不影响趾长伸肌中PGC-1α蛋白表达(Fig 5A-B)。
2.6 骨骼肌AMPK的表达变化耐力运动组比目鱼肌中p-AMPK/AMPK比值较对照组明显升高(P<0.05),提示AMPK被激活(Fig 6A)。但p-AMPK/AMPK比值在趾长伸肌内未出现明显的改变(Fig 6B)。
3 讨论
本研究发现耐力运动8周增加比目鱼肌和趾长伸肌对单次刺激和强直刺激的反应性,提高比目鱼肌的抗疲劳能力,提示运动改善骨骼肌的收缩能力,在富含氧化型肌纤维的比目鱼肌中尤为显著。众所周知,骨骼肌收缩需要ATP提供能量,而线粒体是ATP产生的主要场所,因此线粒体功能的变化将直接影响骨骼肌的收缩能力。
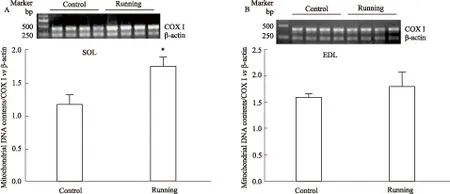
Fig 3 Effect of endurance exercise for 8 weeks on mithochondrial DNA contents in SOL(A) and EDL(B) of ±s,n=4)
*P<0.05vscontrol group.

Fig 4 Effect of endurance exercise for 8 weeks on mRNA expression of PGC-1α, NRF, UCP2 and
*P<0.05vscontrol group
Fig 5 Effect of endurance exercise for 8 weeks on PGC-1α
*P<0.05vscontrol group.
线粒体功能的变化包括ATP含量和/或线粒体生物合成的变化。PGC-1α,线粒体生物合成的关键调控因子,其主要分布于高氧化代谢的组织中,如肝脏、棕色脂肪、心脏、骨骼肌等,在骨骼肌中以氧化型肌纤维表达最高。PGC-1α可协调和辅助众多辅转录因子(如NRF1和2、PPAR、Tfam等),促进线粒体核基因转录,诱导线粒体DNA含量和线粒体复制增加[8-9]。有证据显示,过表达PGC-1α可诱导小鼠糖酵解型肌纤维向氧化型肌纤维转化,同时伴随着细胞色素C和细胞色素氧化酶Ⅰ、Ⅱ、Ⅳ及ATP合成酶表达增加;相反,PGC-1α基因敲除的小鼠骨骼肌内线粒体体积减小,线粒体呼吸链蛋白、ATP合成酶表达,ADP刺激呼吸能力下降[10-11]。PGC-1α的表达和活性主要受腺苷酸活化蛋白激酶(5’-AMP-activated protein kinasein,AMPK)调控。AMPK可直接磷酸化PGC-1α,从而增加PGC-1α mRNA和蛋白的表达,触发PGC-1α信号级联,诱导线粒体生物合成。AMPK被称为细胞能量调节器,在维持能量供需平衡中起着重要作用。在能量匮乏或对能量需求增加时,AMP/ATP比值增加,AMPK被激活,导致产生ATP的分解代谢途径启动,而消耗ATP的合成代谢途径被抑制。大量的研究提示,AMPK活化呈现运动时间依赖性和运动强度依赖性,长期运动不仅提高运动状态下骨骼肌的AMPK活性,也能提高骨骼肌安静状态下AMPK的活性[12-13]。无论是一次性急性运动、高强度间歇运动还是长期耐力运动均可提高骨骼肌PGC-1α mRNA和蛋白表达水平[14-16]。本研究结果显示,8周耐力运动增加比目鱼肌中线粒体基因COX Ⅰ与核基因β-actin拷贝数的比值、PGC-1α和NRF mRNA水平、PGC-1α蛋白水平,伴随p-AMPK/AMPK比值升高;然而,趾长伸肌内未观察到线粒体生物合成相关指标和p-AMPK/AMPK比值的改变,提示8周耐力干预仅对富含氧化型肌纤维的比目鱼肌内线粒体生物合成有促进作用,出现差异的原因可能与运动对小腿骨骼肌类型存在一定选择性有关。
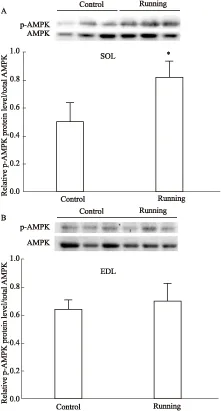
Fig 6 Effect of endurance exercise for 8 weeks on p-AMPK and total AMPK protein expression
*P<0.05vscontrol group.
ATP含量不仅与线粒体数量有关,还与线粒体的呼吸速率密不可分[17]。解偶联蛋白(uncoupling proteins,UCPS)作为线粒体内膜质子转运蛋白,当它被激活时,可产生质子渗漏,使氧化磷酸化解偶联,ATP合成降低,导致产能作用转化为产热作用。UCP2表达下调,导致质子漏和ATP合成之间进行快速转换,在不依赖于底物代谢和线粒体呼吸增加的情况下,提高线粒体呼吸速率,促使ATP得以快速大量产生[18-19]。本研究发现,8周耐力运动明显下调趾长伸肌内UCP2 mRNA的表达,增加ATP含量,但线粒体生物合成相关指标未发生变化,推测线粒体呼吸速率改善是趾长伸肌内ATP含量增加的一个主要原因。
综上所述,本研究表明耐力运动8周增加比目鱼肌的收缩能力和抗疲劳能力,这与氧化型肌纤维内AMPK被激活,上调PGC-1α,增加线粒体生物合成有关。但8周耐力运动仅一定程度增加趾长伸肌的收缩能力,这与线粒体氧化呼吸速率改善,导致ATP含量增加有关。
[1] Hojlund K, Mogensen M, Sahlin K, et al. Mitochondrial dysfunction in type 2 diabetes and obesity[J].EndocrinolMetabClinNorthAm, 2008, 37(3):713-31.
[2] Phielix E, Mensink M. Type 2 diabetes mellitus and skeletal muscle metabolic function[J].PhysiolBehav, 2008, 94(2):252-8.
[3] Ritov V B, Menshikova E V, Azuma K, et al. Deficiency of electron transport chain in human skeletal muscle mitochondria in type 2 diabetes mellitus and obesity[J].AmJPhysiolEndocrinolMetab, 2010, 298(1):E49-58.
[4] Joseph A M, Hood D A. Relationships between exercise, mitochondrial biogenesis and type 2 diabetes[J].MedSportSci, 2014, 60:48-61.
[5] Wisdom K M, Delp S L, Kuhl E. Use it or lose it: multiscale skeletal muscle adaptation to mechanical stimuli[J].BiomechModelMechanobiol, 2015,14(2):195-215.
[6] Holmstrom M H, Iglesias-Gutierrez E, Zierath J R, et al. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes[J].AmJPhysiolEndocrinolMetab, 2012, 302(6):E731-9.
[7] Gomez-Perez Y, Capllonch-Amer G, Gianotti M, et al. Long-term high-fat-diet feeding induces skeletal muscle mitochondrial biogenesis in rats in a sex-dependent and muscle-type specific manner[J].NutrMetab(Lond), 2012, 9:15.
[8] Chan M C, Arany Z. The many roles of PGC-1alpha in muscle——recent developments[J].Metabolism, 2014, 63(4):441-51.
[9] 郭 茜,郭家彬,李 梨,等. PGC-1α与线粒体生成调控在心血管疾病中的作用[J]. 中国药理学通报,2013,29(1):1-4.
[9] Guo Q,Guo J B,Li L,et al. Role of PGC-1α and mitochondrial biogenesis in cardiovascular diseases[J].ChinPharmacolBull, 2013,29(1):1-4.
[10] Arany Z, He H, Lin J, et al. Transcriptional coactivator PGC-1 alpha controls the energy state and contractile function of cardiac muscle[J].CellMetab, 2005, 1(4):259-71.
[11] Leone T C, Lehman J J, Finck B N, et al. PGC-1α deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight control and hepatic steatosis[J].PLoSBiol, 2005, 3(4):e101.
[12] Lantier L, Fentz J, Mounier R, et al. AMPK controls exercise endurance, mitochondrial oxidative capacity, and skeletal muscle integrity[J].FASEBJ, 2014, 28(7):3211-24.
[13] Jorgensen S B, Richter E A, Wojtaszewski J F. Role of AMPK in skeletal muscle metabolic regulation and adaptation in relation to exercise[J].JPhysiol, 2006, 574(Pt 1):17-31.
[14] Lin J, Wu H, Tarr P T, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres[J].Nature, 2002, 418(6899):797-801.
[15] Perez-Schindler J, Summermatter S, Santos G, et al. The transcriptional coactivator PGC-1alpha is dispensable for chronic overload-induced skeletal muscle hypertrophy and metabolic remodeling[J].ProcNatlAcadSciUSA, 2013, 110(50):20314-9.
[16] Popov D V, Bachinin A V, Lysenko E A, et al. Exercise-induced expression of peroxisome proliferator-activated receptor gamma coactivator-1alpha isoforms in skeletal muscle of endurance-trained males[J].JPhysiolSci, 2014, 64(5):317-23.
[17] Casas M, Buvinic S, Jaimovich E. ATP signaling in skeletal muscle: from fiber plasticity to regulation of metabolism[J].ExercSportSciRev, 2014, 42(3):110-6.
[18] Boss O, Hagen T, Lowell B B. Uncoupling proteins 2 and 3: potential regulators of mitochondrial energy metabolism[J].Diabetes, 2000, 49(2):143-56.
[19] Schlagowski A I, Singh F, Charles A L, et al. Mitochondrial uncoupling reduces exercise capacity despite several skeletal muscle metabolic adaptations[J].JApplPhysiol(1985), 2014, 116(4):364-75.
Effects and mechanisms of endurance exercise for 8 weeks on contractile function and mitochondrial biogenesis in rat skeletal muscles
QIU Ni, LI Cong, FANG Wei-jin, WEI Xue-mei, HE Yu-lian, XIONG Yan
(GuangzhouResearchInstituteofSnakeVenomandSchoolofPharmaceuticalSciences,GuangzhouMedicalUniversity,Guangzhou510182,China)
Aim This study was aimed to explore the influence and mechanism of the long-term exercise on skeletal muscle contraction and mitochondrial biosynthesis in different muscle fibers. Methods Soleus (SOL) and extensor digitorum longus (EDL) were isolated from SD male rats with platform running training for eight weeks. The changes of contractility under different electrical stimulation were observed, mitochondrial biosynthesis, including ATP content, mitochondrial DNA, the gene expression of PGC-1α and NRF were also detected. Results Long-term endurance exercise can improve twitch tension and titanic tension of SOL and EDL , but only enhanced the fatigue resistance in SOL. ATP contents were significantly increased in the two types of muscles, but mtDNA content, PGC-1α expression and NRF translation were only obviously enhanced in SOL, in accompanied with an increase in p-AMPK/AMPK protein ratio. Conclusion Long-term endurance exercise increased skeletal muscle contractility and improved the anti-fatigue ability in SOL, which may be associated with increase in mitochondrial biosynthesis via activated AMPK-PGC-1α axis.
endurance exercise; soleus; extensor digitorum longus; skeletal muscle contractility; mitochondrial biosynthesis; rat model
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.021.html
2015-02-21,
2015-03-24
国家自然科学基金资助项目(No 81170778);广东省科技计划(No 2013B21800098);广州市科技计划(No 2014J4100067)
邱 霓(1981-),女,博士后,讲师,研究方向:代谢性疾病,E-mail:qiuni1016@163.com; 熊 燕(1960-),女,博士,教授,研究方向:心血管和代谢性疾病,通讯作者,E-mail: xiongyan2001@yahoo.com
10.3969/j.issn.1001-1978.2015.05.020
A
1001-1978(2015)05-0691-07
R-332;R322.74;R329.24;R336;R337.2

