黄瓜中总黄酮提取方法的研究
陈悬悬,李荣超,卢玉曦,栾 锋,刘惠涛
(烟台大学化学化工学院,山东 烟台 264005)
黄瓜中总黄酮提取方法的研究
陈悬悬,李荣超,卢玉曦,栾 锋,刘惠涛
(烟台大学化学化工学院,山东 烟台 264005)
用乙醇提取法和索氏提取法分别提取华北型黄瓜和华南型黄瓜中总黄酮.采用紫外分光光度法,以芦丁为标准,亚硝酸钠-硝酸铝-氢氧化钠显色,在500 nm波长下检测总黄酮含量.芦丁的线性范围为20~100 μg·mL,回归方程:y=0.015 1x-0.456,R2=0.999 6, 用索氏提取法和乙醇提取法测得华北型黄瓜中总黄酮量分别为 35.04 mg/g和 40.32 mg/g, 平均回收率分别为 99.8%和 100.4%, RSD分别为1.30%和2.65%, 华南型黄瓜中总黄酮量分别为 24.44 mg/g和 37.66 mg/g, 平均回收率分别为 101.3%和 99.5%, RSD分别为1.93%和1.88%.结果表明,乙醇提取法能更好地提取黄瓜中的异黄酮,操作简便,结果准确.
黄瓜;总黄酮;索氏提取法;乙醇提取法;紫外分光光度法
黄酮类化合物(Flavonoids)是一类存在于自然界中具有2-苯基色原酮 (Favones) 结构的化合物,是植物由光合作用产生的一大类化合物,在植物体内有2种存在形式:一是与糖结合成苷类,一是游离态的苷元[1].黄酮类化合物具有广泛的生理活性,如抗衰老、抗癌、抗炎、 抗菌作用等[2].黄酮类化合物的药理作用,使得人们越来越多地关注日常食品中所含黄酮的量.
黄瓜营养丰富, 含有糖类、糖苷类、多种游离氨基酸[3],还是减肥和预防冠心病的最佳食品[4].如何提高和监控黄瓜的营养品质[5]日益受到重视.相比于黄瓜栽培而言,目前关于黄瓜营养成分的研究报道较少[6-8].关于黄瓜总黄酮含量的提取研究虽有报道,但主要研究的是黄瓜中黄酮的抗氧化性[9]以及遗传性对其的影响[10].苦瓜、木瓜等其他瓜类总黄酮的提取方法虽有报道[11-13],但黄瓜中总黄酮提取方法的研究未见报道.本研究分别采用乙醇提取法和索氏提取法提取华北型黄瓜和华南型黄瓜中的总黄酮,用正交实验设计优化了乙醇提取法,并针对索氏提取法提取时间长消耗溶剂多等缺点[14]做了对比研究,以寻求高效提取黄瓜中总黄酮的方法.
1 实验部分
1.1 仪器与试剂
UV-6000型紫外可见分光光度计(上海元析仪器有限公司);芦丁对照品,购自上海源聚生物科技有限公司;分析纯乙醇,购自天津市永大化学试剂有限公司;水为超纯水;华北型黄瓜和华南型黄瓜,均购自烟台当地超市.
1.2 对照品溶液制备
准确称取芦丁适量,加入70%乙醇溶解定容,配制成1 000μg/mL对照品溶液储备液.
1.3 供试品溶液的制备
2种鲜黄瓜分别切片烘干、粉碎,用石油醚超声除去其中的叶绿素,将黄瓜粉晾干备用.
乙醇提取法:称取华北型黄瓜粉和华南型黄瓜粉各2 g,分别用70% 乙醇以料液比1∶50在80 ℃下冷却回流提取3 h,冷却后取提取液用70%乙醇定容至100 mL.
索氏提取法:称取华北型黄瓜粉和华南型黄瓜粉各2 g,分别用150 mL乙醇在80 ℃下索氏提取8 h,冷却后取提取液用旋转蒸发仪蒸干后用 70%乙醇溶解,转移至100 mL容量瓶并定容.
1.4 检测波长确定
精密量取对照品储备液 25.0 mL至100.0 mL容量瓶中用70% 乙醇定容,配成250 μg/mL的标准品溶液.取该标准溶液 5 mL至25 mL容量瓶中,用70% 乙醇定容至10 mL, 加入 5% 的NaNO21.0 mL,摇匀,放置5 min 后加入10%的Al(NO3)31.0 mL,5 min后再加入4%的NaOH 10.0 mL,混匀,用70%乙醇定容至25 mL.摇匀后放置10 min.以试剂空白为参比,在300~800 nm波长范围内扫描.溶液在500 nm 处有最大吸收,因此,将500 nm 设定为检测波长.
1.5 单因素实验设计
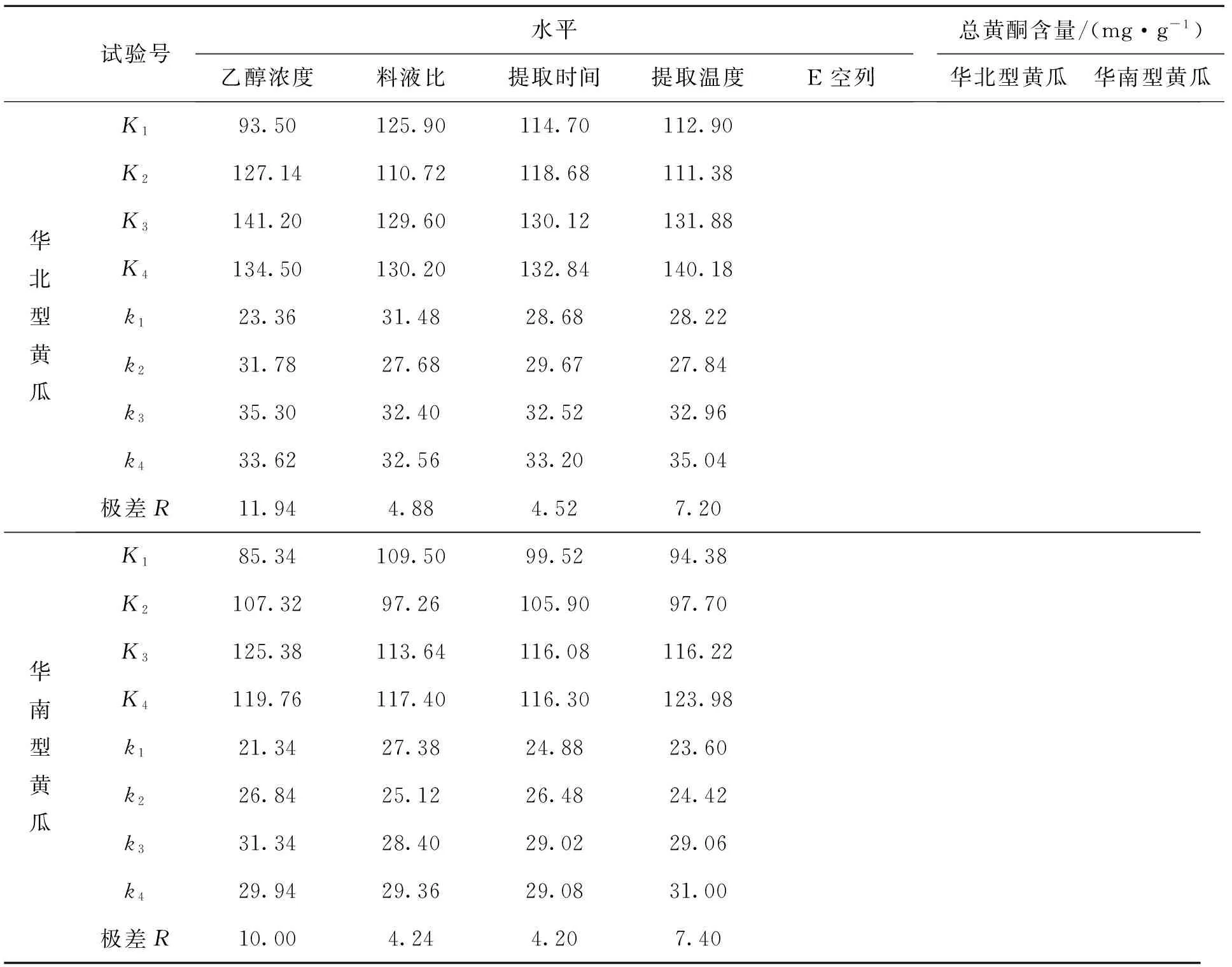
为了筛选出影响乙醇提取法提取总黄酮量的显著因素,对乙醇浓度、提取时间、料液比、提取温度4个影响因素进行了研究[15].采用4因素4水平的正交实验设计,实验次数为16.各因素名称、符号代码及实验水平见表1,2.

表1 因素水平表L16(44)
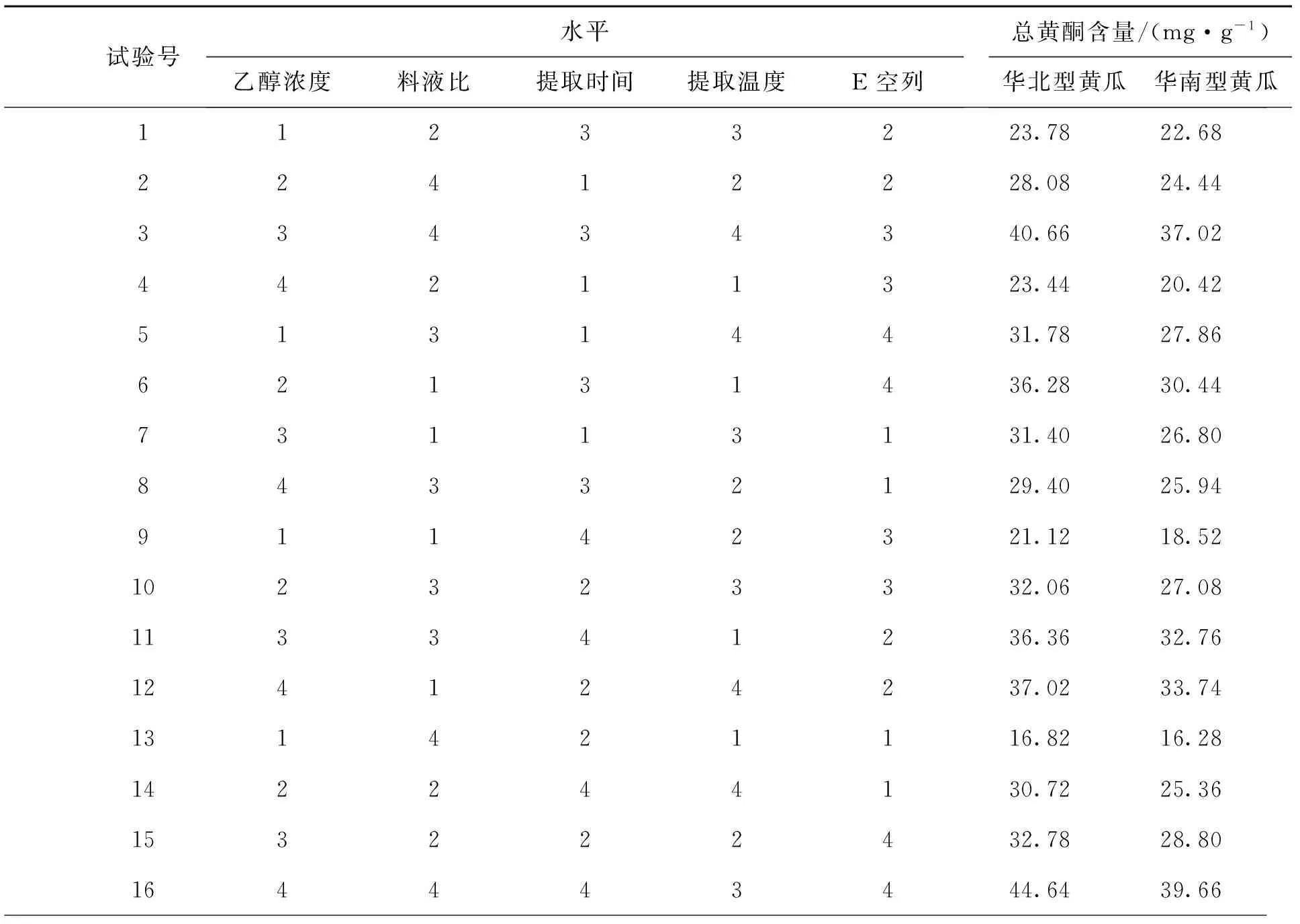
表2 正交实验结果
续表2
从表2中的极差R可以看出,4个因素对总黄酮提取量的影响程度为乙醇浓度>提取温度>料液比>提取时间.最佳提取工艺为乙醇浓度70%, 提取时间 3 h, 料液比1∶50, 提取温度 80 ℃.
2 结果与讨论
2.1 标准曲线的绘制
精确吸取对照品储备液 10.0、 20.0、 30.0、 40.0、 50.0 mL,置 100.0 mL 量瓶中,70% 乙醇定容.按 1.3项中的方法,取标准品溶液 5.0 mL 至25.0 mL容量瓶中,在 500 nm 测定吸光度.以浓度(x) 为横坐标, 吸光度 (y) 为纵坐标, 绘制标准曲线, 回归方程为:y=0.015 1x-0.456,R2=0.999 6.结果表明,芦丁在 20~100 μg/mL的浓度范围内与吸光度呈良好的线性关系.
2.2 方法精密度
精密吸取 250 μg/mL的标准品溶液 5.0 mL, 共 5份,按照1.3项中的方法测定,RSD 为 0.37%, 表明测定方法精密度良好.
2.3 稳定性
精密吸取供试品溶液(乙醇提取法提取华北型黄瓜)5.0 mL,按照1.3项中的方法测定,每隔5 min测定1次,RSD为 0.27%,结果表明显色在30 min中内稳定.
2.4 样品测定
按供试品制备方法分别制备华北型黄瓜和华南型黄瓜供试品各5份,编号为样品1~5,按照1.3项中的方法分别测定,结果见表3.结果显示,乙醇提取法提取的华北型黄瓜中总黄酮的平均含量为40.32 mg/g, RSD为1.32%,华南型黄瓜中总黄酮的平均含量为37.66 mg/g, RSD为1.12%;相对应的索氏提取法提取的华北型黄瓜中总黄酮的平均含量为 35.04 mg/g,RSD为1.22%,华南型黄瓜中总黄酮的平均含量为24.44 mg/g, RSD为0.87%.本实验乙醇提取2种黄瓜所得的总黄酮量与张克岩等[10]所列的黄瓜中总黄酮的范围吻合,但稍低于曹杰[11]用酸水解做前处理所测得的黄瓜中黄酮的量.这是由于酸水解法提取的是黄酮苷元而乙醇提取法是黄酮苷,2种方法的提取原理和提取的物质种类存在某些差异,导致结果稍有偏差.
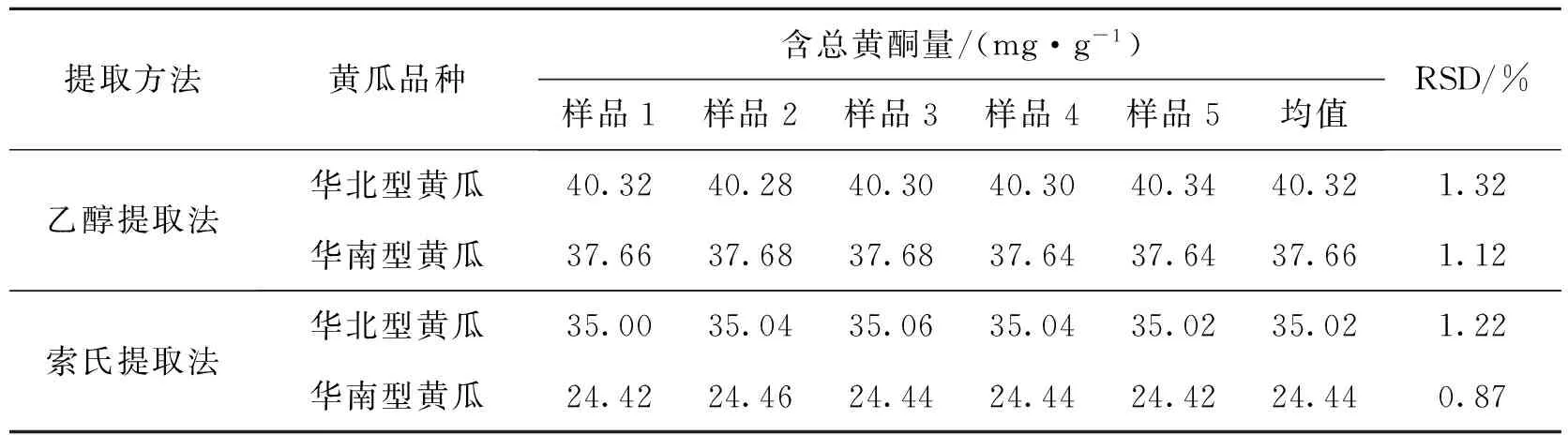
表3 提取方法比较(n=5)
2.5 加标回收试验
为了检测定量测定的准确性,采用加标回收法.加标样品与样品处理法相同,分别计算加标回收率,结果见表4.从表4中可以看出乙醇提取法的平均回收率在99%~100.5%之间,该提取方法简单且稳定性和准确性较好.索氏提取法的平均回收率在99%~101.5%之间,提取结果与上述方法相当,但此法耗时较长,操作过程繁杂.

表4 加标回收率实验结果 (n=3)
3 结 论
由实验结果得出,相对于传统索氏提取法,本实验采用的正交实验优化的乙醇提取法提取时间短、提取效率高.此外,本研究在前处理过程中用石油醚将华北型黄瓜和华南型黄瓜中的叶绿素除去,排除了紫外分光光度法测定过程中的干扰,提高了测定结果的准确性.
[1] 蔡健, 华景清, 王薇, 等. 黄酮提取工艺研究进展[J]. 淮阴工学院学报, 2003, 12 (5): 82-85.
[2] Rasulve B F, Abdullaev N D, Syrov V N, et al. A quantitative structure-activity relationship (QSAR) study of the antioxidant activity of flavonoids[J]. QSAR & Combinatorial Science, 2005, 24 (9): 1056-1065.
[3] 朱水根. 烹饪原料学[M].上海:上海交通大学出版社, 1999: 146-147.
[4] 张峻, 熊何健, 霍长俊, 等. 黄瓜汁饮料的生产工艺[J].饮料工业, 1998(13): 16-18.
[5] 乔宏宇, 朱芳, 栗长兰, 等. 黄瓜主要营养品质性状遗传分析[J]. 东北农业大学学报, 2005, 36(3): 290-293.
[6] 侯冬岩, 回瑞华, 李学成, 等. 水黄瓜营养成分的研究[J]. 鞍山师范学院学报, 2006, 8(2): 28-30.
[7] 何晓明, 林毓娥, 陈清华, 等. 不同类型黄瓜的营养成分分析及初步评价 [J]. 广东农业科学, 2002(4): 15-17.
[8] 金同铭, 刘玲, 唐晓伟. 非破坏评价黄瓜的营养成分[J]. 华北农学报, 1996, 11(1): 103-108.
[9] 施兴凤, 李琼, 李学辉,等. 黄瓜黄酮类化合物的抗氧化作用[J]. 食品研究与开发, 2010, 31(3): 85-86.
[10] 张克岩, 司龙亭, 李坤. 黄瓜(CucumissativusL.)总黄酮含量的遗传分析[J]. 沈阳农业大学学报, 2011, 42(5): 544-548.
[11] 徐青梅. 光皮木瓜中黄酮类物质提取工艺的研究[J]. 保鲜与加工, 2012, 12(5): 23-28.
[12] 蔡健, 王薇. 苦瓜资源开发与苦瓜籽黄酮提取技术[J]. 食品研究与开发, 2004, 25(3): 97-99.
[13] 周晓丽, 邵震, 李婷婷, 等. 木瓜黄酮的提取及抗氧化性研究[J]. 食品工业科技, 2007, 28(8): 170-172.
[14] Bimakr M, Rahman R A, Taip F S T, et al. Comparison of different extraction methods for the extraction of major bioactive flavonoid compounds from spearmint (MenthaspicataL.) leaves[J]. Food and Bioproducts Processing, 2011, 89 (1): 67-72.
[15] 王选东, 刘利林, 许宗运. 正交设计研究石榴皮总黄酮提取工艺[J].塔里木农垦大学学报, 2003, 15(2): 11-15.
[16] 曹杰. 蔬菜和水果中黄酮类化合物检测方法及应用研究[D]. 哈尔滨:哈尔滨医科大学, 2010.
(责任编辑 周雪莹)
Extraction of Total Flavonoids from Cucumber
CHEN Xuan-xuan, LI Rong-chao, LUAN Feng, LIU Hui-tao
(School of Chemistry and Chemical Engineering, Yantai University, Yantai 264005, China)
Total flavonoids in cucumber of north and south China are extracted by conventional soxhlet extraction (CSE) and ethanol extraction method, respectively. Color reaction is performed by mixing the extractions with NaNO2-Al (NO3)3-NaOH solution, total flavonoids are tested by UV spectrophotometry (500 nm) with authentic rutin as the standard sample. The linear regression equation of rutin isy=0.015 1x-0.456(R2=0.999 6) in the range of 20-100 μg/mL. The total flavonoids in north China cucumber extracted by CSE and ethanol extraction method are 35.04 mg/g and 40.32 mg/g, with the average recoveries of 99.8% and 100.4%, and RSD of 1.30% and 2.65%, respectively. The total flavonoids in south China cucumber extracted by CSE and ethanol extraction method are 24.44 mg/g and 37.66 mg/g, with the average recoveries of 101.3% and 99.5%, and RSD of 1.93% and 1.88%, respectively. It can be concluded that ethanol extraction method is more effective, easier and more accurate to extract total flavonoids from cucumber.
cucumber; total flavonoids; conventional soxhlet extraction (CSE); ethanol digestion method; UV spectrophotometry
1004-8820(2015)04-0260-06
10.13951/j.cnki.37-1213/n.2015.04.006
2014-10-13
山东省自然科学基金资助项目(ZR2012BM016).
陈悬悬(1988- ),女,山东济宁人,硕士研究生.
栾锋(fluan@sina.com), 副教授,研究方向为色谱和电泳分析.
O657
A

