猪瘟病毒Npro蛋白的原核表达与多抗制备
王 鑫,武专昌,魏建超,赵秋华,史子学,刘 珂,邵东华,李玉明,邱亚峰,马志永
(1. 临沂大学生命科学学院,临沂 276000;2. 中国农业科学院上海兽医研究所,上海 200241;3. 上海市闵行区动物疫病预防控制中心,上海201109;4. 上海市嘉定区农业委员会,上海 201800)
猪瘟病毒(Classical swine fever virus,CSFV)是一种黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus)的单股正链RNA病毒,可引起猪的急性、高度传染性和致死率的传染病,严重危害养殖业的发展[1,2]。CSFV基因组长约12.3 kb,包括5'非编码区(5'-NTR)、一个大开放阅读框和3'非编码区(3'-NTR)。在5'-NTR内含有内部核糖体进入位点序列,调控病毒蛋白进行非CAP依赖性的翻译。基因组的大开放阅读框编码约3898个氨基酸的多聚蛋白,经病毒自身酶和细胞蛋白酶作用下裂解为12个蛋白,依次为Npro-C-Erns-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B[2]。
瘟病毒属成员基因组编码的第一个非结构蛋白Npro是瘟病毒属特有的,同科的肝炎病毒属和黄病毒属成员没有Npro蛋白。Npro是一个半胱氨酸蛋白酶,能将自身从病毒多聚蛋白Cys168和Ser169间切割下来,形成了病毒衣壳蛋白C(多聚蛋白中Npro下游紧邻的结构蛋白)完整的N端[3]。Npro融合表达靶蛋白技术就是利用Npro自体蛋白酶活性切割开靶蛋白和非靶蛋白,从而保证Npro下游蛋白生成精确的N末端序列[4]。Npro没有跨膜活性,不能分泌到细胞外[5]。另外Npro具有抑制 I 型干扰素产生的功能,预示其在病毒拮抗宿主抗病毒反应中发挥重要作用[6-8]。最近研究发现Npro蛋白的核仁定位是独立于其切割活性和抑制干扰素产生功能的一种新功能,对猪瘟病毒复制周期晚期的有效复制是必需的[9]。Npro是CSFV复制非必需基因,但与CSFV毒力有关。Mayer等[10]将中等毒力毒株Alfort/187和强毒株Eystrup的Npro基因进行缺失,制备的基因缺失疫苗能有效保护猪的强毒攻击。
为进一步研究Npro的生物学功能及在疫苗开发中的应用,本研究利用原核表达系统表达纯化了Npro蛋白,并制备了特异性的兔源多克隆抗体,为今后研究工作的开展奠定了基础。
1 材料与方法
1.1 质粒、菌株、病毒 E.coli BL21(DE3)菌株、原核表达载体pCold I和猪瘟病毒石门强毒由中国农业科学院上海兽医研究所猪病研究室保存。
1.2 试剂 BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;质粒提取试剂盒购自美国Axygen公司;胶回收试剂盒购自Promega公司;蛋白预染Marker和ECL发光试剂盒购自美国Thermo scientific公司;镍离子亲和柱购自美国BIO-RAD生命医学产品有限公司;限制性内切酶EcoR I和Kpn I购自Fermentas公司;鼠源His单抗购自艾比玛特生物医药(上海)有限公司;E2单抗WH303(鼠源)引自英国VLA;HRP标记羊抗兔IgG购自美国Santa Cruz公司;弗氏佐剂购自美国Sigma-Aldrich公司;病毒RNA提取试剂盒和RNA反转录试剂盒购自大连宝生物有限公司。
1.3 Npro基因的扩增 提取CSFV感染PK细胞上清中的病毒R N A,用特异性引物(RP:5'-GCAACTGGTAACCCACAATGG-3')进行反转录,然后PCR扩增CSFV Npro基因。上游引物Npro-F:5'-CGGGGTACCATGGAGTTGAATCATT TTGAAC-3',下游引物Npro-R:5'-CCGGAATTCC TAGCAACTGGTAACCCACAATGG-3',扩增产物525 bp,斜体部分为引物5' 添加的酶切位点Kpn I、EcoR I与保护性碱基。
1.4 重组质粒pCold-Npro的构建 使用EcoR I和Kpn I限制性内切酶分别对载体pCold I和纯化的NproPCR产物进行酶切,产物进行回收纯化。将纯化的Npro和pCold I酶切产物用T4 DNA连接酶于16℃连接6 h,转化感受态细胞,并涂布于Amp+的LB培养皿中,37℃恒温培养过夜。d 2 随机挑选单克隆菌落,37℃振荡培养至菌体浑浊,抽提质粒酶切验证的阳性菌液送至上海桑尼生物科技有限公司进行测序,测序阳性质粒命名为pCold-Npro。
1.5 重组质粒pCold-Npro的诱导表达 将重组质粒pCold-Npro转化表达菌E.coli BL21(DE 3)中,37℃振荡培养至OD600值达到0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG诱导,18℃振荡过夜。收集菌体加入PBS进行超声裂解,高速离心后分别收集上清和沉淀,加入5×SDS buffer煮沸10 min后进行SDSPAGE电泳,对SDS-PAGE蛋白胶进行考马斯亮蓝染色,观察蛋白表达情况,同时设置空载体和未诱导表达组作为对照。
1.6 重组蛋白Npro的纯化和透析 将pCold-Npro转化表达菌按1:1000比例接种到4 mL含100 μg/mL Amp的LB培养基中,37℃、200 r/min振荡培养12 h。然后再按1:100将复苏的菌液接种于100 mL含100 μg/mL Amp的LB培养液中,37℃、200 r/min培养。至OD600达到0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG,18℃诱导12~16 h后,离心收集菌体。表达后的菌体进行超声破碎,差速离心后收集包涵体蛋白。采用镍离子亲和柱和自动液相层析系统对重组蛋白进行纯化,透析复性,去除蛋白溶液中的咪唑等有害物质,纯化的蛋白分装保存于-80℃,并用His单抗进行Western blot鉴定。
1.7 多克隆抗体的制备 将重组蛋白His-Npro与弗氏佐剂按1:1进行乳化,乳化完全后按0.6 mg/只对兔子进行背部皮下多点注射,每隔2周加强免疫1次。首免用弗氏完全佐剂,之后用弗氏不完全佐剂,免疫5次后,心脏采血,分离血清分装后,-80℃保存。
1.8 Western blot检测多抗的反应性 蛋白样品进行SDS-PAGE电泳后,转印PVDF膜,5%脱脂奶粉室温封闭2 h。用1:4000稀释的抗Npro多抗4℃孵育10 h,TBST洗膜3次后,20 min/次。加入1:10 000稀释的HRP标记的羊抗兔IgG,室温反应2 h,TBST洗膜后用ECL发光试剂盒显色,X光胶片暗室曝光。
1.9 间接免疫荧光(indirect immunofluorescence assay,IFA)检测多抗的反应性 CSFV感染细胞固定后,分别加入1:200稀释的WH303单抗或不同稀释度的抗Npro多抗孵育1 h;再加入FITC标记的羊抗鼠或羊抗兔二抗(1:200)孵育1 h,封片,观察荧光,具体操作步骤参照文献[11]。
2 结果
2.1 重组质粒pCold I-Npro的构建 PK细胞接种1MOI CSFV石门强毒株48 h后,收集细胞上清提取病毒RNA,进行RT-PCR,扩增Npro基因,得到的片段长525 bp(图1A),切胶回收目的片段。利用PCR引物5'端的酶切位点和保护性碱基,利用Kpn I和EcoR I酶切位点将Npro连接至原核表达载体pCold I,构建重组质粒pCold-Npro。Kpn I和EcoR I双酶切pCold -Npro,电泳结果显示,阳性质粒出现长约510 bp的Npro基因和4400 bp的载体片段,与预期相符(图1B)。对阳性克隆进行DNA测序,选取与参考序列完全一致的重组质粒用于后续表达。
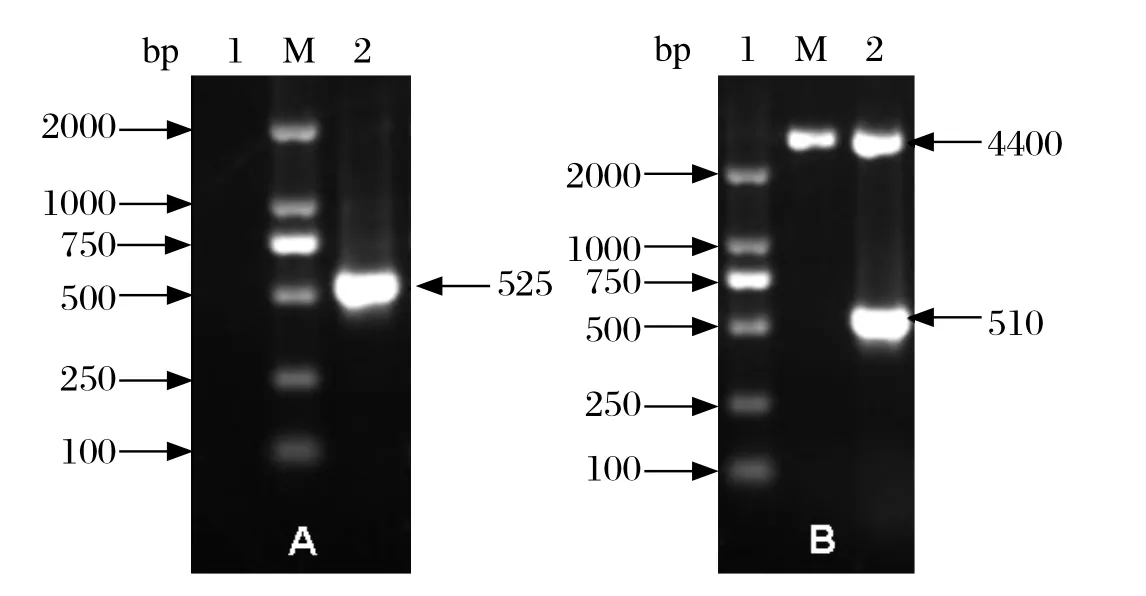
图1 Npro基因扩增和表达质粒pCold-Npro酶切鉴定Fig.1 Amplification of Npro gene and identification of recombination plasmid pCold-Npro by restriction enzymes digestion
2.2 重组质粒pCold-Npro的诱导表达与纯化 pCold-Npro和pCold I载体转化的表达菌E.coli BL21(DE3)经IPTG诱导后,收集菌体煮沸裂解进行SDSPAGE。结果显示pCold-Npro表达菌用IPTG诱导后出现了相对分子量约为24 kDa的目的条带,与重组蛋白His-Npro大小相符。His-Npro经Ni2+柱亲和层析纯化和蛋白透析复性后,电泳结果显示纯化后的目的蛋白条带纯度较高,符合后续试验要求。
2.3 重组蛋白His-Npro的Western blot鉴定 将IPTG诱导的pCold I和pCold-Npro转化表达菌及不同浓度纯化的重组蛋白His-Npro进行SDS-PAGE和Western blot检测,一抗为1:5000稀释的鼠源抗His标签单抗,二抗为1:10 000稀释的HRP标记羊抗鼠IgG。结果显示pCold-Npro转化表达菌诱导后出现约为24 kDa的目的条带,而pCold I对照组无此条带(图2)。上样量为20、100、250 ng的纯化重组蛋白His-Npro经Western blot 检测,在24 kDa左右均出现目的条带,且条带亮度存在蛋白上样量的依赖性,进一步说明成功表达和纯化出了重组蛋白His-Npro(图3)。
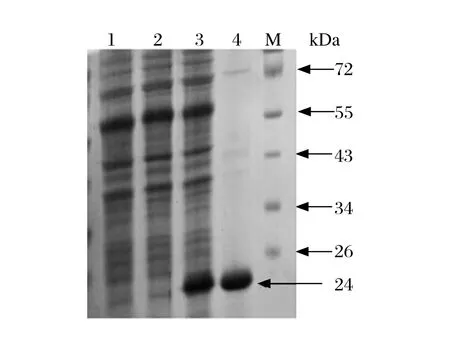
图2 His-Npro重组蛋白的诱导表达和纯化Fig.2 SDS-PAGE analysis of induced expression and purification of recombination protein His-Npro
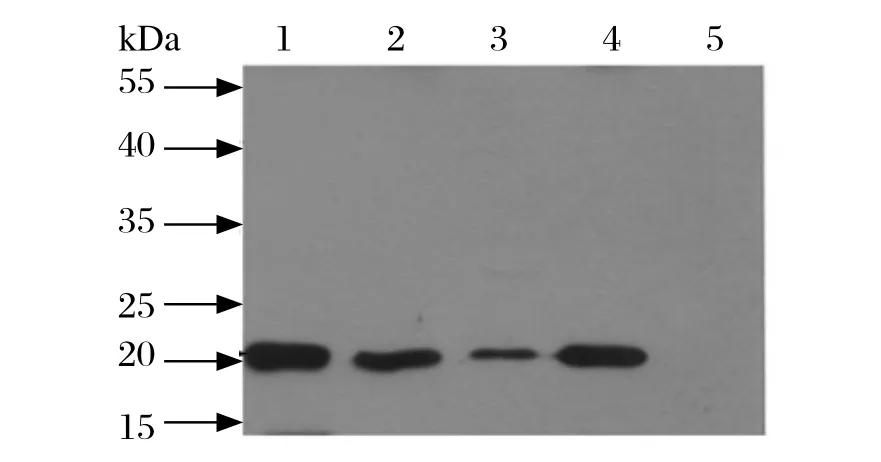
图3 重组蛋白His-Npro的Western blot鉴定Fig.3 Identification of recombinant protein His-Npro by Western blot
2.4 Npro兔源多抗的鉴定 1 MOI CSFV石门强毒感染PK细胞后24 h,收集细胞进行Western blot或固定细胞进行IFA,检测Npro蛋白的表达。将制备的兔源Npro多克隆抗体1:4000稀释后作为一抗,1:10 000稀释的HRP标记羊抗兔IgG作为二抗。Western blot 结果显示,CSFV感染细胞后表达Npro蛋白,而未感染PK细胞中未检测出Npro蛋白表达(图4)。IFA结果显示,E2单抗WH303能检测到CSFV感染,而不同稀释倍数(1:25、1:50、1:100)的Npro多抗均未能检测到CSFV的感染(图5)。说明本研究制备的Npro兔源多抗仅可用于CSFV Npro蛋白的Western blot检测,不适用于CSFV的IFA检测。
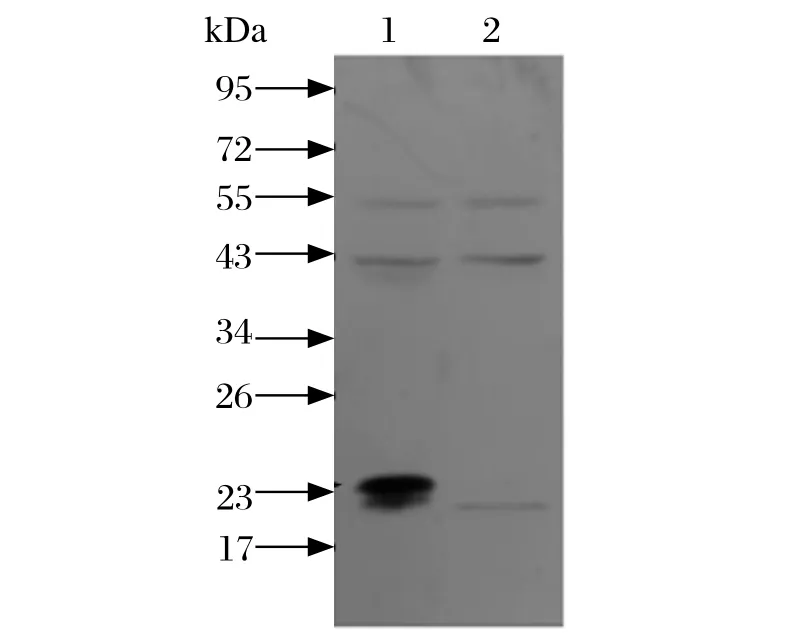
图4 Npro蛋白多抗的Western blot鉴定Fig.4 Western blot identification of anti-Npro serum
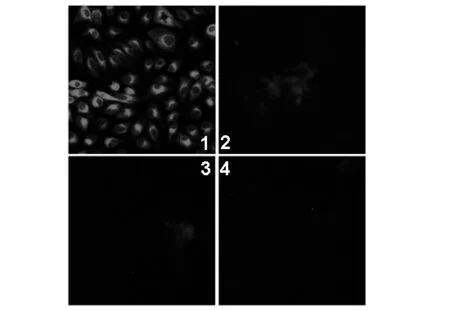
图5 Npro蛋白多抗的IFA鉴定Fig.5 IFA identification of anti-Npro serum
3 讨论
猪瘟是由黄病毒科、瘟病毒属的猪瘟病毒引起的一种急性、热性和高度接触性猪传染病,给养猪带来了重大经济损失[1]。Npro蛋白是CSFV编码的第一个非结构蛋白,具有自我切割酶活性、抑制I-IFN产生的作用和核仁穿梭功能[3,6,9]。Npro蛋白还能与dsRNA结合,抑制dsRNA诱导感染细胞的凋亡[12]。另外Npro也与CSFV毒力有关,将鼠的泛素分子替换猪瘟强毒株Alfort/187和Eystrup的部分Npro序列,构建的重组弱毒株能有效保护猪瘟亲本毒株Eystrup的攻击[10]。但Npro蛋白抑制干扰素产生的功能并不影响病毒毒力[13],预示Npro蛋白可能在影响病毒毒力方面有其他未知的功能。为了进一步阐释Npro蛋白的生物学功能及在新型疫苗中的应用尝试,需要建立Npro的检测工具。本研究利用大肠杆菌原核表达系统,表达纯化了Npro并免疫兔子,制备了CSFV Npro蛋白的多克隆抗体。
Western blot结果显示,1:4000稀释的多克隆抗体仍能很好的识别CSFV感染PK细胞后表达的Npro蛋白,但此多抗不能应用于IFA。免疫荧光检测中,抗体需要识别Npro蛋白的构象表位或功能性线性表位,而原核表达的Npro蛋白缺少翻译后修饰,即便复性也很难恢复Npro本身的天然构象,从而导致该多抗可能主要针对的是线性表位,Western blot中蛋白样品经煮沸变性后,Npro成为线性的蛋白形式,更易检测。
目前常用的弱毒疫苗(中国C株)能很好的保护猪群免受CSFV攻击,但该疫苗无法区分疫苗免疫与强毒感染,猪瘟标记疫苗的研制对猪瘟的防控具有重要意义[14,15]。猪感染猪瘟病毒后,体内并不能产生ELISA可检测到的Npro抗体量。Npro蛋白是病毒编码的第一个非结构蛋白,具有自我切割活性,可以利用Npro蛋白的功能特殊性,作为构建区分疫苗毒与野毒感染标记疫苗毒株的候选位点。例如,将猪瘟基因组Npro的拷贝数增加,使Npro蛋白表达量增加;或同时插入外源标记分子,组成Npro和外源分子的双标记;或添加信号肽,使Npro分泌至胞外,利于抗体产生。利用本研究原核表达纯化的Npro蛋白可建立针对猪血清中Npro蛋白抗体的ELISA检测方法,利于猪瘟病毒的防控与净化。
本研究应用大肠杆菌原核表达系统成功表达了CSFV Npro蛋白,并进行了纯化与复性,制备了特异性的多抗,为下一步研究该蛋白的功能及其在标记疫苗的研制提供了良好的生物材料。
[1]陈溥言. 兽医传染病学[M]. 5版. 北京: 中国农业出版社,2006: 210-215.
[2]Lindenbach B D, Thiel H J, Rice C M. Flaviviridae:The viruses and their replication[M]. 5thed. Lippincott Williams & Wilkins, Philadelphia, PA, 2007.
[3]Rümenapf T, Stark R, Heimann M, et al. N-terminal protease of pestiviruses: identification of putative catalytic residues by site-directed mutagenesis[J]. J Virol,1998, 72(3): 2544-2547.
[4]Cheng X, Lu W, Zhang S, et al. Expression and purification of antimicrobial peptide CM4 by Nprofusion technology in E. coli[J]. Amino Acids, 2010, 39(5):1545-1552.
[5]Tamura T, Sakoda Y, Yoshino F, et al. Selection of classical swine fever virus with enhanced pathogenicity reveals synergistic virulence determinants in E2 and NS4B[J]. J Virol, 2012, 86(16): 8602-8613.
[6]Bauhofer O, Summerfield A, McCullough K C, et al. Role of double-stranded RNA and Nproof classical swine fever virus in the activation of monocyte-derived dendritic cells[J]. Virology, 2005, 343(1): 93-105.
[7]Bauhofer O, Summerfield A, Sakoda Y, et al. Classical swine fever virus Nprointeracts with interferon regulatory factor 3 and induces its proteasomal degradation[J]. J Virol, 2007, 81(7): 3087-3096.
[8]La Rocca S A, Herbert R J, Crooke H, et al. Loss of interferon regulatory factor 3 in cells infected with classical swine fever virus involves the N-terminal protease, Npro[J]. J Virol, 2005, 79(11): 7239-7247.
[9]Li Y, Shen L, Li C, et al. Visualization of the Nproprotein in living cells using biarsenically labeling tetracysteinetagged classical swine fever virus [J]. Virus Res, 2014,189: 67-74
[10]Mayer D, Hofmann M A, Tratschin J D, et al. Attenuation of classical swine fever virus by deletion of the viral Nprogene [J]. Vaccine, 2004, 22(3-4): 317-328
[11]沈强, 魏建超, 史子学, 等. 日本脑炎病毒E III结构域蛋白的表达及多克隆抗体的制备与鉴定[J]. 中国动物传染病学报, 2013, 21(5): 7-12.
[12]Gil L H, Ansari I H, Vassilev V, et al. The aminoterminal domain of bovine viral diarrhea virus Nproprotein is necessary for alpha/beta interferon antagonism[J]. J Virol, 2006, 80(2): 900-911.
[13]Ruggli N, Summerfield A, Fiebach A R, et al. Classical swine fever virus can remain virulent after specific elimination of the interferon regulatory factor 3-degrading function of Npro[J]. J Virol, 2009, 83(2):817-829.
[14]仇华吉, 童光志, 沈荣显. 猪瘟兔化弱毒疫苗-半个世纪的回顾[J]. 中国农业科学, 2005, 38(8): 1675-1685.
[15]Graham S P, Everett H E, Haines F J, et al. Challenge of pigs with classical swine fever viruses after C-strain vaccination reveals remarkably rapid protection and insights into early immunity[J]. PLoS one, 2012, 7(1): e29310.

