广西省猪繁殖与呼吸综合征病毒GP2、GP3、GP4蛋白遗传进化分析
贺 微,韦 莹,黄加滨,洪绍锋,林思远,姚 静,陈 樱,黄伟坚,韦祖樟
(广西大学动物科学技术学院,南宁 530005)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的一种接触性、病毒性传染病,以妊娠母猪繁殖障碍和仔猪的呼吸道疾病为特征[1]。PRRS 自1987年首次报道以来,现已遍及世界许多国家和地区,成为危害养猪业最严重的传染病之一。
PRRSV为动脉炎病毒科、动脉炎病毒属的单股线状正链RNA病毒,基因组全长约15 kb,非编码区含有5'端“帽子”结构和3'端poly(A)尾巴;编码区含有9个开放阅读框(open reading frame,ORF):ORF1分为ORF1a和ORF1b,编码 RNA复制酶[2];ORF2~ORF5编码病毒的5种糖基化膜糖蛋白,分别为GP2a、GP2b、GP3、GP4和GP5;ORF6编码非糖基化的膜基质蛋白(M蛋白);ORF7编码核衣壳蛋白(N蛋白)[3,4]。根据遗传特性的差异,PRRSV可划分为欧洲Ⅰ型(Lelystad virus,LV)和美洲Ⅱ型(VR-2332)两个基因型(genotype),两者之间基因组差异约40%,同型病毒间的亚型基因组差异也可高达20%[5,6]。GP2a蛋白有两个保守的天门冬酰胺,形成两个糖基化位点,该位点对病毒感染是非必需的;GP2b蛋白有协助病毒复制的作用,对PRRSV粒子的脱壳、释放都起到一定作用,但无法装配病毒[7],同时GP2b蛋白具有离子通道,对病毒的感染是必需的[8]。Chen等[9]已经证实GP2的C端存在10个氨基酸的缺失,但目前GP2的缺失对病毒的致病性和毒力方面的影响尚未深入研究。GP3蛋白有7个N-糖基化位点,是PRRSV欧洲株和美洲株中突变性最高的蛋白之一[10]。最新研究表明,SH1211毒株在ORF3的203-208位点上缺失6个核苷酸或缺失67、68位点2个氨基酸[11]。另有研究发现,GP3 N端多聚糖有干扰机体产生中和抗体作用[12]。GP4含有4个糖基化位点,其N端和C端具有高度的疏水区,这些位点在美洲株和欧洲株之间都是保守的[13]。
目前,PRRSV遗传进化的研究主要还是集中在GP5、M和N蛋白,对GP2、GP3和GP4的研究并不多。研究表明次要蛋白GP2、GP3和GP4在与细胞受体CD163结合以及诱导机体产生中和抗体的过程起到重要的作用[14]。因此,本研究对11株广西省分离到的PRRSV进行ORF2、ORF3和ORF4基因的克隆、序列测定及遗传变异特征分析,有助于揭示PRRSV的遗传进化规律,为今后预防和控制PRRS提供理论依据。
1 实验材料与方法
1.1 病毒、菌种及质粒 11株PRRSV均为本实验室分离、保存;pMD18-T vector克隆载体购自TaKaRa公司;大肠杆菌DH5α购自康为世纪公司。
1.2 主要试剂 TrizolRNA 提取液购自上海生工生物工程有限公司;TaqMix、dNTP、RNase Inhibitor、M-MLV等购自大连宝生生物公司(TaKaRa)产品;DNA纯化回收试剂盒购自OMEGA公司。
1.3 引物设计与合成 将PRRSV ORF2、ORF3和ORF4基因分为两个片段扩增,参考美洲经典株VR-2332、中国标准株CH-1a和HP-PRRSV毒株JXA1相对应在ORF2、ORF3和ORF4基因的共同保守核苷酸序列片段来设计引物(表1)。引物在上海捷瑞生物工程有限公司合成。
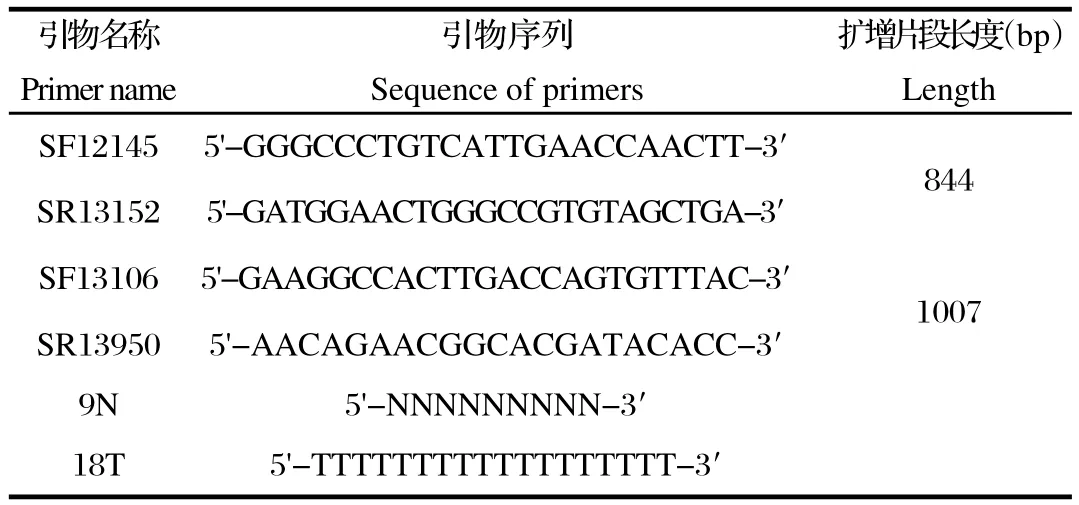
表1 本研究所用引物Table1 Primers used in this study
1.4 病毒RNA提取及 RT-PCR 选用本实验室保存的阳性细胞毒,采用Trziol 法抽提病毒总RNA。取RNA模板16.0μL,加入随机引物9N、18T各1.0μL,5×M-MLV Buffer 5.0μL,dNTP Mixture 2.0μL,RNasin Inhibitor 0.5μL,M-MLV Reverse Transcriptase 0.5μL,42℃ 1 h,即得到cDNA。PCR反应体系如下:TaqMix 12.5μL、ddH2O 8.5μL、上下游引物分别0.5μL、cDNA 3.0μL。PCR反应程序:94℃预变性 5min;95℃变性 1min,56℃退火 1min,72℃延伸 1.5min,30个循环;72℃再延伸6 min。
1.5 PCR产物回收、克隆及序列测定 将纯化产物与pMD18-T载体4℃连接过夜,转化DH5α感受态细胞中,挑取阳性克隆,扩大培养。菌液PCR鉴定:将菌液作为模板,以SF12145/SR13152、SF13106/SR13950引物验证目的基因片段。反应体系和程序同1.4。经鉴定的阳性菌液送上海杰李生物有限公司进行序列测定。
2 结果
2.1 RT-PCR扩增结果及菌液PCR鉴定 本研究将目的基因分为两个片段扩增,第一片段为1007 bp(图1),第二片段为844 bp,均与预期扩增长度一致(图2)。菌液PCR获得的基因片段与目的基因大小相符。
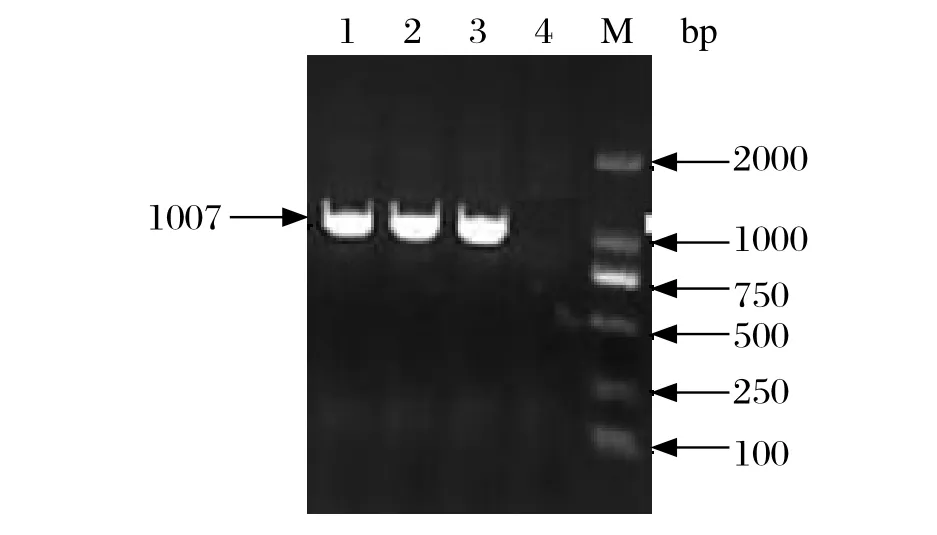
图1 第一片段目的基因扩增结果Fig.1 Amplification of the first gene fragment
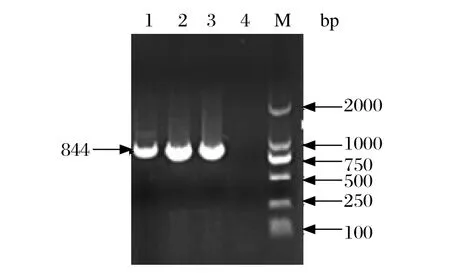
图2 第二片段目的基因扩增结果Fig.2 Amplification of the second gene fragment
2.2 序列分析及同源性比较 运用DNAStar软件分析测定序列,分别获得771、765、537 bp的ORF2、ORF3、ORF4的完整基因序列,将所得序列在NCBI BLAST网站进行比对,确认为PRRSV序列。同时运用DNAStar软件将11株PRRSV与GenBank发表的毒株进行氨基酸同源性比对,并用MEGA5.03软件对11株PRRSV构建系统遗传进化树。结果表明,11株PRRSV的GP2、GP3、GP4氨基酸序列同源性分别为94.6%~99.6%、95.3%~100%、93.9%~100%。与美洲型代表毒株VR-2332氨基酸同源性分别为91.4%~93.0%、85.1%~86.7%、89.4%~91.1%;与中国经典毒株CH-1a同源性为分别为94.2%~96.1%、91.8%~92.9%、95.0%~98.9%;与我国HP-PRRSV毒株JXA1、TJ、WUH4、HUN4同源性分别为96.1%~99.6%、95.3%~98.8%、95.0%~99.4%;与10-10GX-1毒株同源性为94.4%~99.2%;与欧洲代表毒株Lelystad virus序列同源性最低,仅为55.9%~72.6%。
将11株PRRSV GP2、GP3、GP4 氨基酸序列与美洲型代表毒株VR-2332和HP-PRRSV毒株JXA1、HUN4进行变异位点分析发现:PRRSV GP2与HP-PRRSV毒株在F9→S9、S24→F24、L32→S32、P42→Q42、T91→V91、S141→G141、M174→L174、V235→I235、I237→M237、T240→S240、S253→L253、Q257→W257出现相同的突变。除GXNN1310b的其余10株PRRSV均出现I118→V118,而在所有参考株中并未出现过该变异。10-10GX-1、GXNN1310b毒株出现N188→G188的一致变异(图3)。
PRRSV GP3与HP-PRRSV毒株存在多个相同的突变位点,如V2→A2、C13→R13、G27→N27、Y32→F32、T48→M48、P56→L56、L58→P58、T64→A64、Y67→L67、R71→K71、L73→F73、E83→S83、I95→V95、E147→V147、Q151→D151、N206→S206、R223→H223、K230→R230、I237→M237、V252→A252,其中213~216位从“LQIL”→“FRTS”。经典美洲型毒株的GP3蛋白中存在两个重要的B细胞表位即Y67EPGRSLW74和W74CRGHDRCGED85,11株PRRSV在这两个表位出现了5个氨基酸的突变且变异与HP-PRRSV毒株相同。此外,GP3蛋白的第83位氨基酸被推测与毒力相关,而11株PRRSV的83位点相应位置都被置换成S83,与我国HP-PRRSV毒株相同,通过此位点可推测11株PRRSV为强毒力毒株(图4)。
PRRSV GP4与HP-PRRSV毒株也存在V9→L9、L15→F15、L16→V16、A32→S32、A42→S42、R56→G56、A59→S59、E61→P61、A62→T62、V79→I79等多个相同位点的变异。GXNN1310b和10-10GX-1毒株均在3-5位点由“SSL”→“APF”,并出现A45→I45的相同变异(图5)。

图3 GP2氨基酸序列比对分析Fig.3 Alignment analysis of amino acids sequences of GP2
对11株PRRSV GP2、GP3、GP4氨基酸序列与VR-2332、RespPRRS MLV、Lelystad virus、CH-1a、JXA1、HUN4、10-10GX-1、GD3等代表毒株的相应序列构建遗传进化树发现,如图6、7、8所示,11株PRRSV GP2、GP3、GP4氨基酸序列全部分布在美洲型分支上,且与我国HP-PRRSV毒株JXA1、HUN4有较高亲缘性。三个进化树中GXNN1310b、10-10GX-1处于相同的亚分支下,两者亲缘关系最接近。
3 讨论
本研究以2013~2014年在广西省各地区分离的11株PRRSV的GP2、GP3、GP4蛋白为研究对象,对其遗传变异特征进行分析。分析表明,11株PRRSV GP2、GP3、GP4蛋白氨基酸同源性分别为94.6%~99.6%、95.3%~100%、93.9%~100%;与美洲经典毒株VR-2332 GP2、GP3、GP4氨基酸同源性分别为91.4%~93.0%、85.1%~86.7%、89.4%~91.1%;与我国HP-PRRSV 毒株对应氨基酸的同源性分别为96.1%~99.6%、95.3%~98.8%、95.0%~99.4%。
序列比对分析表明:11株PRRSV GP2、GP3和GP4氨基酸序列参考美洲经典毒株VR-2332和HPPRRSV毒株JXA1、HUN4,未出现缺失仅存在多处点突变。在GP2氨基酸序列比对中,除GXNN1310b毒株之外,其余10株PRRSV均在I118→V118出现变异,而在所有参考株中并未出现过该变异,该变异是否对病毒的毒力和致病性产生影响,仍需深入研究。在GP3氨基酸序列中,第83位点的G83被推测是与毒力相关的位点[15],11株PRRSV的该位点均与HP-PRRSV 毒株一致被置换为S83,而其弱毒疫苗株PespPRRS MLV该位点为E83,推测11株PRRSV为强毒力毒株。
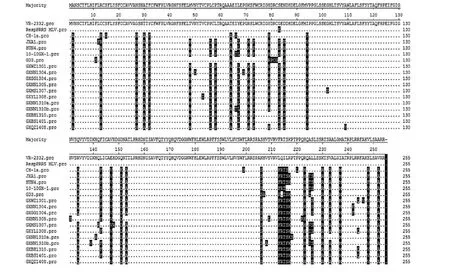
图4 GP3氨基酸序列比对分析Fig.4 Alignment analysis of amino acids sequences of GP3

图5 GP4氨基酸序列比对分析Fig.5 Alignment analysis of amino acids sequences of GP4
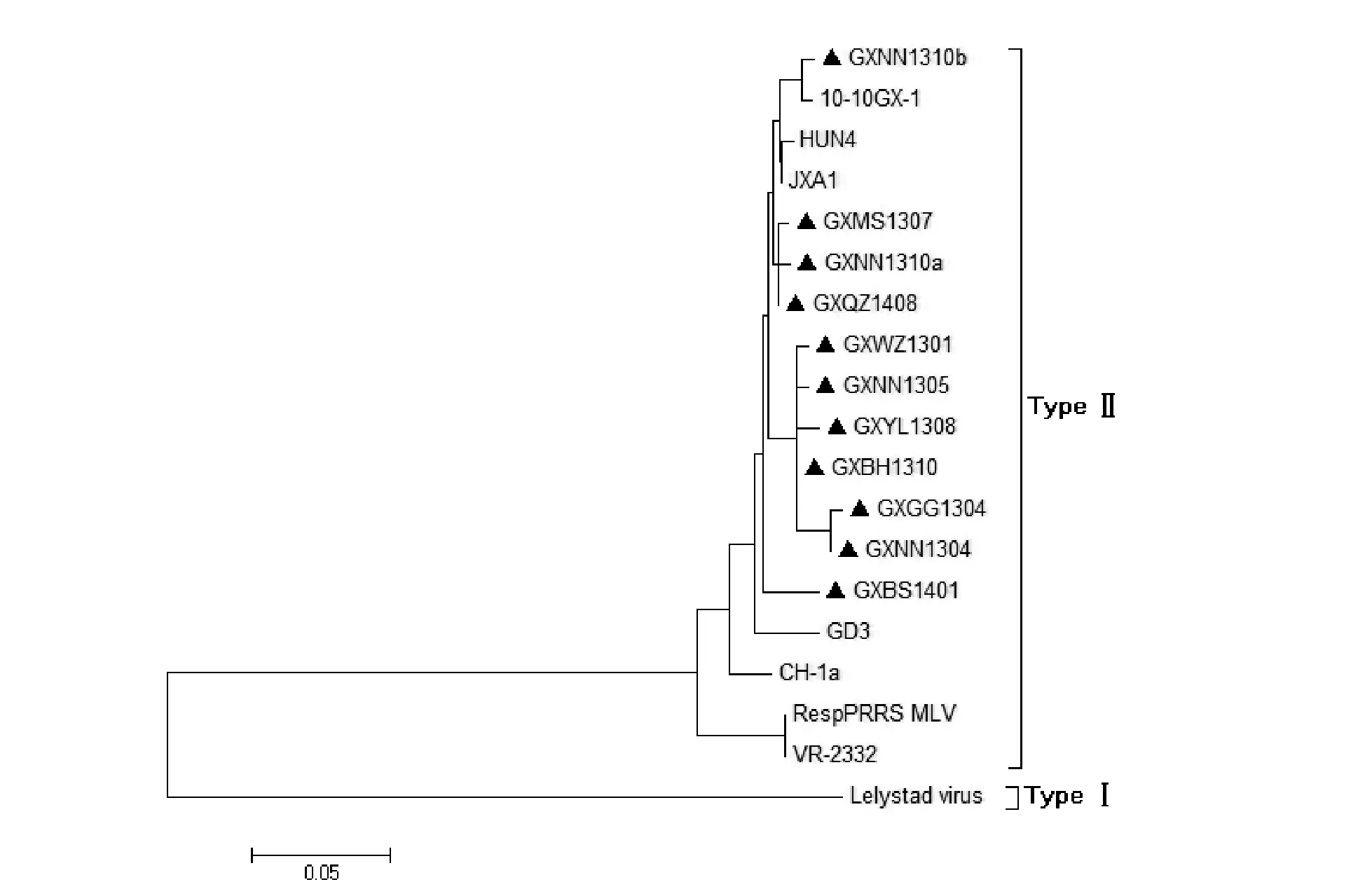
图6 PRRSV GP2氨基酸序列的进化树分析Fig. 6 Phylogenetic analysis based on the amino acid sequences of PRRSV GP2
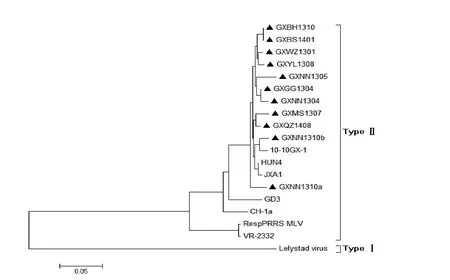
图7 PRRSV GP3氨基酸序列的进化树分析Fig. 7 Phylogenetic analysis based on the amino acid sequences of PRRSV GP3
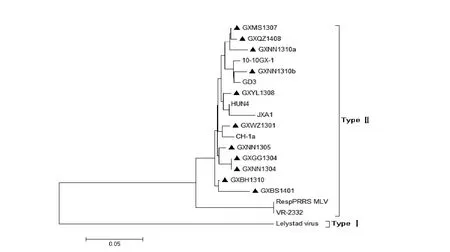
图8 PRRSV GP4氨基酸序列的进化树分析Fig. 8 Phylogenetic analysis based on the amino acid sequences of PRRSV GP4
遗传进化结果进一步表明,11株PRRSV均属于美洲型,且均为HP-PRRSV毒株。GXNN1310b和10-10GX-1毒株在遗传进化树中处于同一亚支,且二者同源性达98.3%以上,推测GXNN1310b可能是从10-10GX-1毒株发展而来。
本研究通过对广西省分离的11株PRRSV的GP2、GP3和GP4蛋白的遗传变异特征进行分析,证实了当前广西省以流行HP-PRRSV 毒株为主,且在自然环境和免疫压力作用下出现了多处氨基酸突变,但突变氨基酸有何生物学意义仍需进一步研究。因此,为有效控制PRRS,应加强对该区PRRS的分子流行病学调查、监控,深入研究病毒的致病机理及免疫机制,为研制更高效、更有针对性的疫苗提供一定科学依据。
[1]杨汉春. 猪繁殖与呼吸综合征综述[J]. 猪业科学, 2006,(5): 19-20.
[2]Allende R, Lewis T L, Lu Z, et al. North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions.[J].J Gen Virol, 1999, 80(Pt2): 307-315.
[3]王国强, 文利新, 袁志航, 等. 猪蓝耳病疫苗免疫及其免疫应激研究进展[J]. 养猪, 2007, (6): 41-44.
[4]张汉云, 赵彦宗, 贺东生. 猪高致病性蓝耳病免疫研究进展[C]//金宁一, 高宏伟, 罗廷荣. 中国畜牧兽医学会家畜传染病学分会第七届全国会员代表大会暨第十三次学术研讨会论文集. 上册, 广西南宁, 2009: 48-52.
[5]Wu W H, Fang Y, Rachel F, et al. A 10 kDa structural protein of porcine reproductive and respiratory syndrome virus encoded by ORF2b [J].Virology, 2011, 287(1):183-191.
[6]Meng X J. Heterogeneity of porcine reproductive and respiratorysyndrome virus: implications for curent vaccine efficacy and future vaccine development[J]. Vet Microbiol, 2000, 74(4): 309-329.
[7]李勇, 夏志平, 高英杰, 等. 猪繁殖与呼吸综合病毒结构蛋白2b研究进展[J]. 动物医学进展, 2010, 31(10):99-101.
[8]Wenming J, Ping J, Yufeng L, et al.Analysis of immunogenicity of minor envelope protein GP3 of porcine reproductive and respiratory syndrome virus in mice[J]. Virus Genes. 2007, 35: 695-704.
[9]Chen J Z, Peng J M, Bai Y, et al. Characterization of two novel porcine reproductive and respiratory syndrome virus isolates with deletions in the GP2 gene[J]. Vet Microbiol,2015, 176:344-351.
[10]刘丽霞, 庄天中, 潘树德, 等. PRRSV辽宁分离株ORF3基因的克隆与序列分析[J]. 沈阳农业大学学报, 2007,38(3): 353-356.
[11]Fan B, Wang H, Bai J, et al. A Novel Isolate with Deletion in GP3 Gene of Porcine Reproductive and Respiratory Syndrome Virus from Mid-Eastern China[J].Biomed Res Int, 2014, 2014(3): 63-68.
[12]Hl V, Kwon B, Yoon K J, et al. Immune evasion of porcine reproductive and respiratory syndrome virus through glycan shielding involves both glycoprotein 5 as well as glycoprotein 3.[J]. J Virol, 2011, 85(11): 5555-5564.
[13]赵琳, 王中明, 夏平安等. 猪繁殖与呼吸综合征病毒河南分离株GP4蛋白免疫活性研究[J]. 中国畜牧兽医, 2010,37(1): 57-61.
[14]马玉萍, 孔宁, 王向鹏,等. PRRSV细胞受体CD163 SRCR5-SRCR6多克隆抗体的制备[J]. 西北农林科技大学学报:自然科学版, 2014, 42(4): 1-6, 14.
[15]Allende R, Kutish G F, Laegreid W, et al. Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J]. Arch Virol, 2000, 145:1149-1161.

